IDS038 - La qualité au sein des laboratoires de biologie médicale selon l'ISO 15189 v2012.
DOI mémoire
https://doi.org/10.34746/gezj-8f21Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs

GOSSIN Georgie 
GUILLERM Maxime 
PING Jiayang
Contacts
Citation
A rappeler pour tout usage : G. GOSSIN, M. GUILLERM et J. PING, « La Qualité au sein des laboratoires de biologie médicale selon la norme ISO15189 v2012 », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de projet, janvier 2020, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids038 ; https://doi.org/10.34746/gezj-8f21
Article publié
Suite à ces travaux, un article a été publié : ID interne : 2020_09_idsap
Résumé
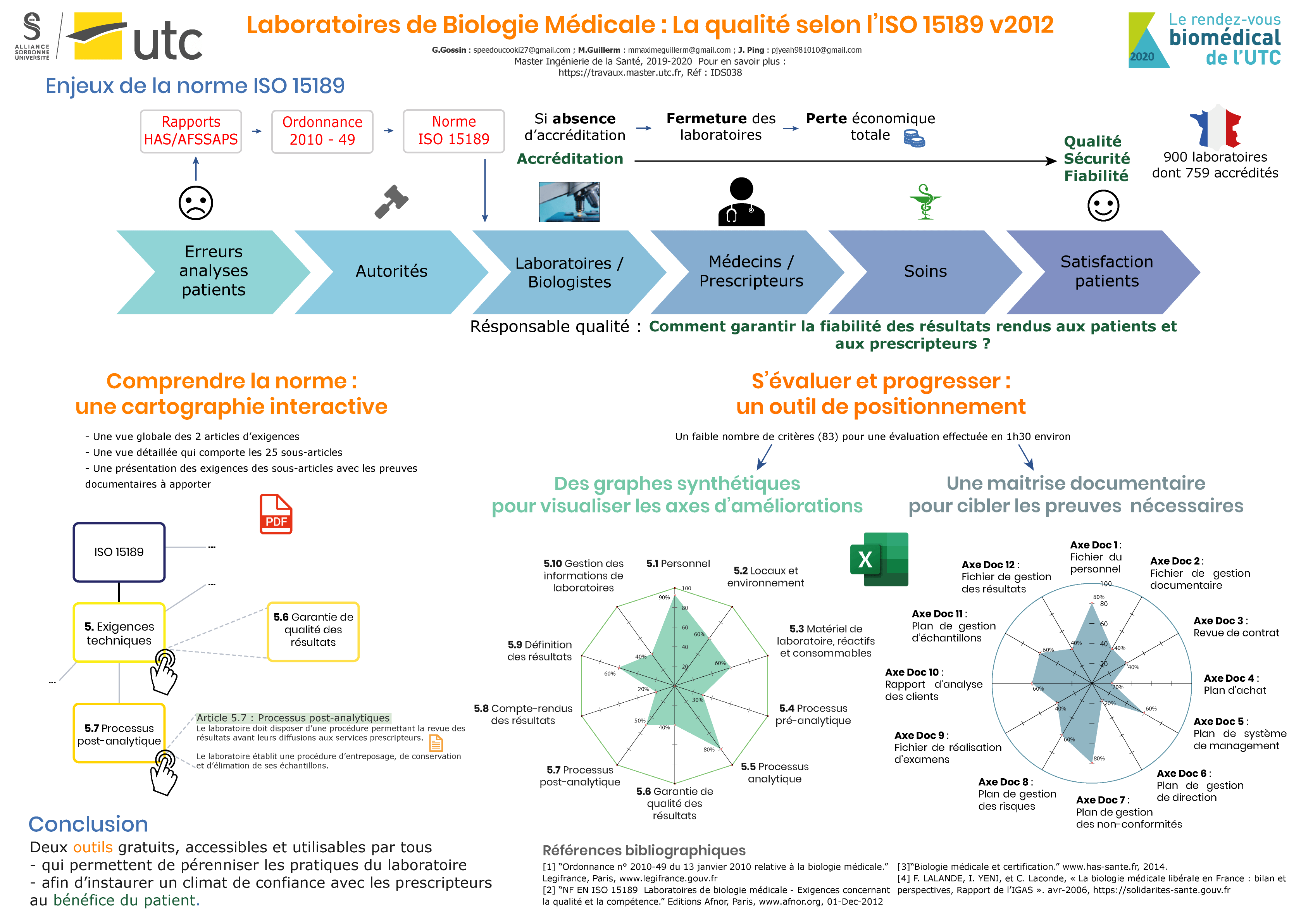
L’examen de biologie médicale a une place importante dans le parcours de soins du patient. Dans son intérêt, la loi dite “Ballereau” de 2013 ratifiée à l’ordonnance 2010-49 de janvier 2010 [1], impose aux laboratoires de biologie médicale de satisfaire aux exigences normatives selon l’ISO 15189 v2012. Cette reconnaissance de compétences est l’une des garanties dans la fiabilité du rendu de résultats aux patients et personnels de santé.
Ce mémoire a pour objectif de fournir des éléments clés aux laboratoires afin de maintenir leur accréditation.
Abstract
Medical biology exam is one of the most important milestones in the patient care. To improve the patient care, the 2013 “Ballereau” French law ratified to the 2010-49 ordinance from January 2010, tells that medical biology laboratory have to follow regulatory requirements from the ISO 15189 v2012 standard. Following those requirements ensures the laboratory to have the skills recognized and guarantees the reliability of results given to patients and caregivers.
The aim of this thesis is to provide few keys for laboratories to keep the ISO 15189 standard accreditation
Téléchargements
Poster : Les laboratoires de biologie médicale : La qualité selon l'ISO 15189

Mémoire d'Intelligence Méthodologique : La qualité au sein des laboratoires de biologie médicale selon la norme ISO15189 v2012

Cartographie d'aide à la compréhension de la norme ISO 15189 v2012 (format pdf)
Outil de positionnement selon l'ISO 15189 v2012 (fichier excel)
Mémoire complet
La qualité au sein des laboratoires de biologie médicale selon l'ISO 15189 v2012
Remerciements
Glossaire & Abréviations
- Certification : Assurance écrite (sous la forme d'un certificat) donnée par une tierce partie qu'un produit, service ou système est conforme à des exigences spécifiques.
- Accréditation : Reconnaissance formelle de la compétence d’une personne ou d’un organisme à réaliser des activités spécifiées d’évaluation de la conformité [2] .
- Certification : Assurance écrite (sous la forme d'un certificat) donnée par une tierce partie qu'un produit, service ou système est conforme à des exigences spécifiques.
- COFRAC : Comité Français d’Accréditation, unique organisme en France faisant autorité à délivrer l’accréditation
- EN : Norme Européenne.
- GBEA : Guide de Bonnes Exécutions des Analyses
- ISO : International Standard Organisation
- LBM : Laboratoire de Biologie Médicale
- NF : Norme française
- SMQ : Système management de la qualité
Introduction
L’examen de biologie médicale est défini selon le code de la santé public comme étant “un acte médical qui concourt à la prévention, au dépistage, au diagnostic ou à l’évaluation des risques de survenues d’états pathologiques, à la décision et à la prise en charge thérapeutique [...] [3].
Pour garantir la fiabilité des résultats rendus aux patients, l’ordonnance 2010-49 du 13 janvier 2010 relative à la biologie médicale [1] exige que l’ensemble des laboratoires de biologie médicale satisfassent aux exigences de la norme ISO 15189 Laboratoires de biologie médicale - Exigences concernant la qualité et la compétence [4].
Cette contrainte réglementaire est aujourd’hui en cours d’application dans 759 laboratoires (privés et publics) en France [5]
Ce mémoire d’intelligence méthodologique a pour but de fournir aux laboratoires des outils nécessaires à l’obtention ou au renouvellement de leur accréditation selon la dernière norme en vigueur, l’ISO 15189 v2012.
La première partie de ce mémoire consiste à définir le contexte ainsi que les enjeux associés à cette réglementation.
Dans un second temps, un outil de diagnostic en lien avec une cartographie interactive des processus est proposé en vue d’effectuer des audits internes pour se préparer au mieux à l’audit du Comité Français d’Accréditation (COFRAC).
I. Contexte et enjeux de la démarche qualité au sein des laboratoires de biologie médicale
a. Contexte de la démarche qualité
i. Le GBEA : Guide de bonnes exécutions des analyses
Suite à l’arrêté ministériel en 1994, l’entrée dans la démarche qualité des laboratoires a tout d’abord été instaurée par le Guide de Bonnes Exécutions des Analyses (GBEA) [6].
L’application de ce guide est obligatoire et surveillée par la Haute Autorité de Santé [3]. Or une enquête réalisée quinze ans après sa parution en ressort que seuls 31% des laboratoires sont conformes au GBEA [7].
Suite à des études réalisées depuis les années 2000 :
- un sondage réalisé par l’Agence Française de Sécurité Sanitaire des Produites de Santé (AFSSAPS) en 2003 montre que sur 4774 laboratoires sondés, 40% d’entre eux avaient 10% de leurs résultats non conformes [7].
- le rapport de l’Inspection Générale des Affaires Sociales (IGAS) en 2006 qui souligne la nécessité de réformer la biologie médicale [7].
- le rapport de 2008 établit par un ensemble de professionnels de la biologie ainsi qu’administratif pose les bases d’un projet de réforme de la biologie médicale [8].
Le besoin de fournir aux patients des résultats fiables, l’évolution de la biologie médicale dans le parcours de soin du patient, ainsi que la nécessité de traçabilité des examens rendus ont abouti à la réforme de la biologie médicale via la loi 2013-442 du 30 mai 2013, ratifiée à l’ordonnance 2010-49 du 13 janvier 2010 relative à la biologie médicale [1]
Ainsi, l’ensemble des laboratoires de biologie médicale doivent satisfaire aux exigences réglementaires selon la norme ISO 15189 selon un calendrier prévisionnel établie par le COFRAC [9].
ii. La norme ISO 15189
L’application de la norme NF EN ISO 15189 : Laboratoire de Biologie Médicale - Exigences concernant la qualité et la compétence [4] est rendue obligatoire pour l’ensemble des Laboratoires de biologie par l’ordonnance 2010-49 du 13 janvier 2010 [1].
Cette norme est internationale, rédigée par un ensemble d’organismes de normalisation (ISO). Elle est établi à partir de l’ISO 9001 Système de management de la qualité - Exigences [10] et à l’ISO 17025 Exigences générales concernant la compétence des laboratoires d’étalonnage et d’essais [11].
L’ISO 9001 délivre des lignes directives de gestion managériale et propose ainsi des outils permettant aux entreprises d’être en permanence dans le système d’amélioration continue. Deux versions de cette normes ont été revues, la troisième en vigueur, l’ISO 9001 v2015 offre des outils de management notamment par l’approche processus ainsi que la gestion des risques.
L’ISO 17025 s’applique à toutes organisations qui procèdent à des essais, étalonnages dans la réalisation de leur contrôle de qualité comme par exemple pour l’étalonnage d’un automate ou d’une pipette utilisée pour le dosage d’une analyse accréditée.
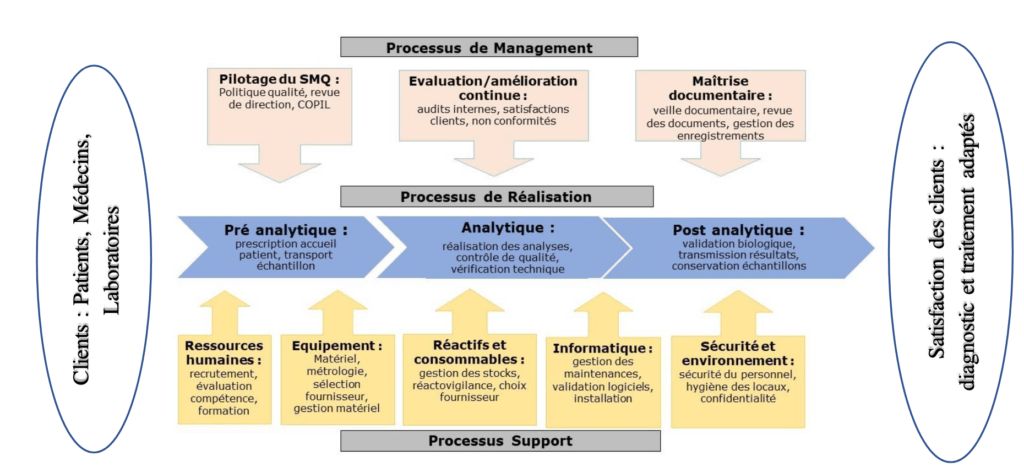
L’ISO 15189 comporte deux articles d'exigences :
Les exigences relatives au management de la qualité (chapitre 4), composé de 15 sous chapitres comme suit :
- Responsabilité en matière d’organisation et de management :
Les responsabilités/engagements du Directeur et du responsable qualité sont décrites. Une politique qualité est définie et le système de communication entre les acteurs est assuré.
- Système de management de la qualité :
Le manuel de qualité est rédigé et tenue à jour pour répondre à la politique qualité du laboratoire et permettre son amélioration
- Maîtrise des documents :
Le laboratoire doit mettre en œuvre un système documentaire requis par le système de management de la qualité. Sa veille est assuré afin de garantir l’absence de documentation obsolète.
- Contrats de prestations :
Les demandes d’examens acceptées par le laboratoire sont contractualisées. Ces contrats sont revue périodiquement.
- Examens transmis à des laboratoires sous-traitants :
Le laboratoire doit sélectionner et évaluer ses laboratoires sous traitants et consultants. Le laboratoire demandeur s’assure de la conformité de l’interprétation des résultats par ses consultants ainsi que de leurs comptes-rendus.
- Services externes et approvisionnement :
Le laboratoire assure la sélection et l’achat de services externes, de matériels, de réactifs, de consommables pour garantir la qualité de sa prestation.
- Prestation de conseils :
Le laboratoire établit les échanges avec les prestataires sur la pertinence de la demande d’examen, sur un cas clinique particulier, la logistique des prélèvements.
- Traitement des réclamations :
Le laboratoire met à disposition une procédure documentée pour toutes réclamations effectuées par les cliniciens, les patients ou le personnel.
- Identification et maîtrise des non-conformités :
L’identification et la gestion des non conformités liées au système de management de la qualité, au pré analytique, analytique, post analytique suivent une procédure documentée.
- Actions correctives :
Afin éliminer les causes des non conformités, le laboratoire met en place des actions correctives.
- Actions préventives :
Afin d’éviter la survenue de non conformités, le laboratoire met en place des actions préventives.
- Amélioration continue :
Le laboratoire améliore en continu l’efficacité de son système de management de la qualité ainsi que les exigences relatives à la technique au moyen de la revue de direction permettant d’établir des plans d’actions. Des audits sont réalisés afin d’évaluer la performance des actions apportées.
- Maîtrise des enregistrements :
Les enregistrements doivent inclure 22 critères pour satisfaire aux exigences. La vie de l’enregistrement doit être documentée afin de garantir la qualité du résultat rendu.
- Évaluation et audits :
Le laboratoire planifie des évaluations externes, des audits et une revue périodique de prescriptions. Il met en place un système de recueil des suggestions du personnel. Il détermine des indicateurs qualité pour surveiller et évaluer ses prestations.
- Revue de direction :
Pour garantir la pertinence de son système de management de la qualité, le laboratoire réalise une revue de direction périodiquement. Les éléments de cette revue y sont détaillés. Les résultats sont communiqués à l’ensemble du personnel.
Les exigences techniques (chapitre 5), composé de 10 sous chapitres comma suit :
- Personnel :
Le laboratoire s’assure de l’accueil, de la qualification, de la formation et du maintien des compétences du personnel. La définition des fonctions est décrite. La continuité des connaissances du personnel est assurée par la formation continue. Ces éléments font l’objet d’enregistrements et constituent le dossier personnel tenu à jour.
- Locaux et conditions environnementales :
Le laboratoire prévoit des locaux dédiés à chaque spécificité de la réalisation de l’analyse. (Bureaux, locaux de stockage, du personnel, de prélèvements et de réalisation des examens). Il s’assure de l’entretien et des conditions environnementales propres à chaque local.
- Matériel de laboratoire, réactifs et consommables :
Les équipements utilisés par le laboratoire sont répertoriés, étalonnés, contrôlés et leurs maintenances sont assurées. Le laboratoire s’assure avant installation de la conformité de la performance décrite par le fournisseur. Une gestion des réactifs et consommables comprenant la commande, la réception et le contrôle d’acceptation est décrite. Tout événement indésirable est tracé et signalé au fabricant.
- Processus pré analytiques :
Le laboratoire met à disposition des usagers les conditions de prescription, de prélèvement, de transport et de réception des échantillons.
- Processus analytiques :
Le laboratoire utilise des procédures de chaque examen validées pour leur utilisation prévue. Il détermine les intervalles de références biologiques ou de décision clinique de chaque examen ainsi que leurs incertitudes de mesure revues périodiquement. Des procédures analytiques pour la réalisation de l’examen sont écrites respectant 20 critères cités dans la norme.
- Garantie de qualité des résultats :
Le laboratoire garantie les résultats qu’il livre par la réalisation de contrôle de qualité. Il effectue des comparaisons inter laboratoires afin de garantir la continuité des soins du patient d’un établissement à un autre.
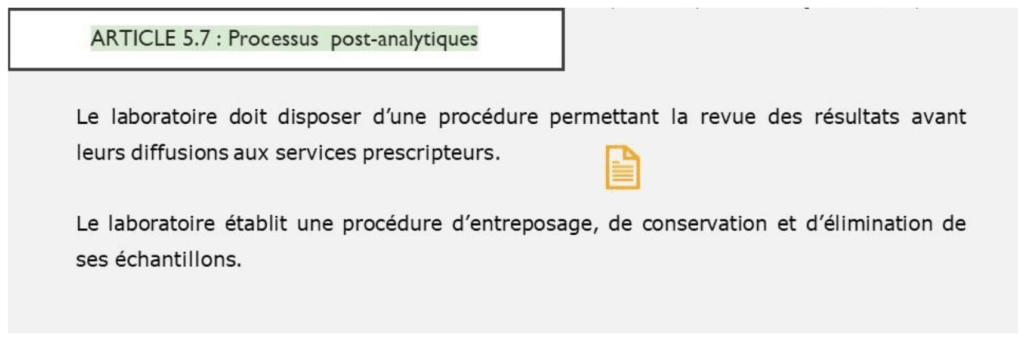
- Processus post-analytiques :
Le laboratoire dispose d’une procédure de validation des résultats par le personnel compétent avant la transmission aux prestataires. La conservation et l’élimination des échantillons est décrite.
- Compte rendu des résultats :
Le laboratoire détermine le mode de transmission de ses résultats et valide leur transcription. Les comptes rendus doivent comprendre 16 renseignements cités dans la norme.
- Diffusion des résultats :
Le laboratoire s’assure de la diffusion des comptes rendus aux services prestataires. Le laboratoire établi des instructions écrites lors de la révision d’un compte rendu après la diffusion des résultats.
- Gestion des informations de laboratoire :
Le laboratoire garantit la confidentialité des informations du patient. Les autorités et responsabilités liées à la gestion des informations sont définies. Les systèmes de recueil des informations sont contrôlés.
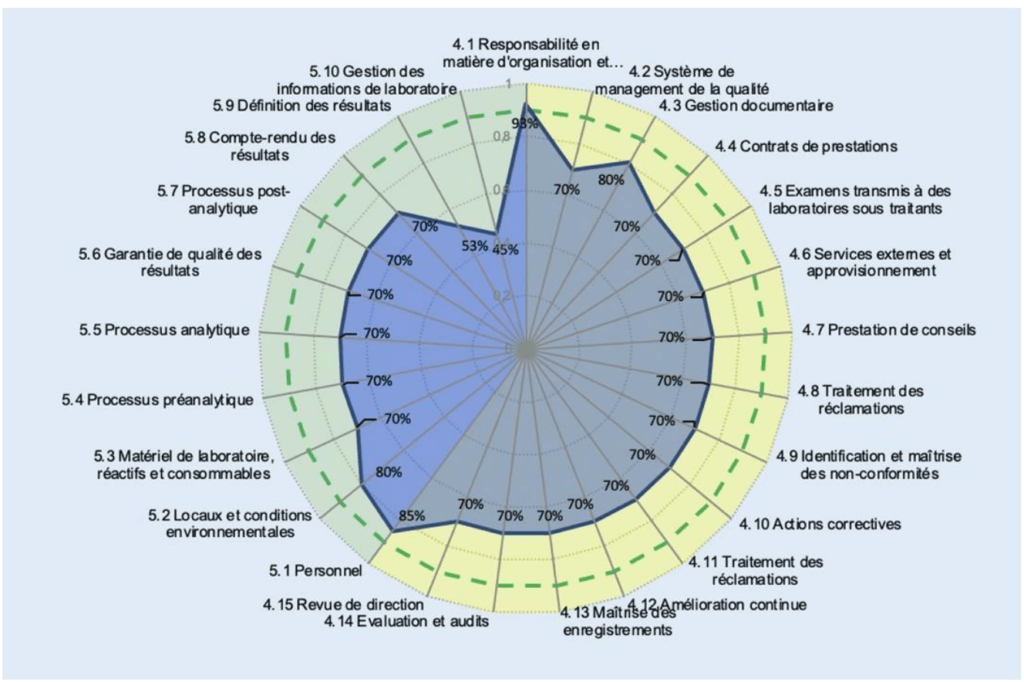
Pour faciliter la compréhension de la norme ISO 15189 et créer le lien entre les différents articles, la Figure 1 permet une vue d’ensemble des items des exigences normatives d’un laboratoire de biologie médical.
iii. Le COFRAC : Comité français d’accréditation
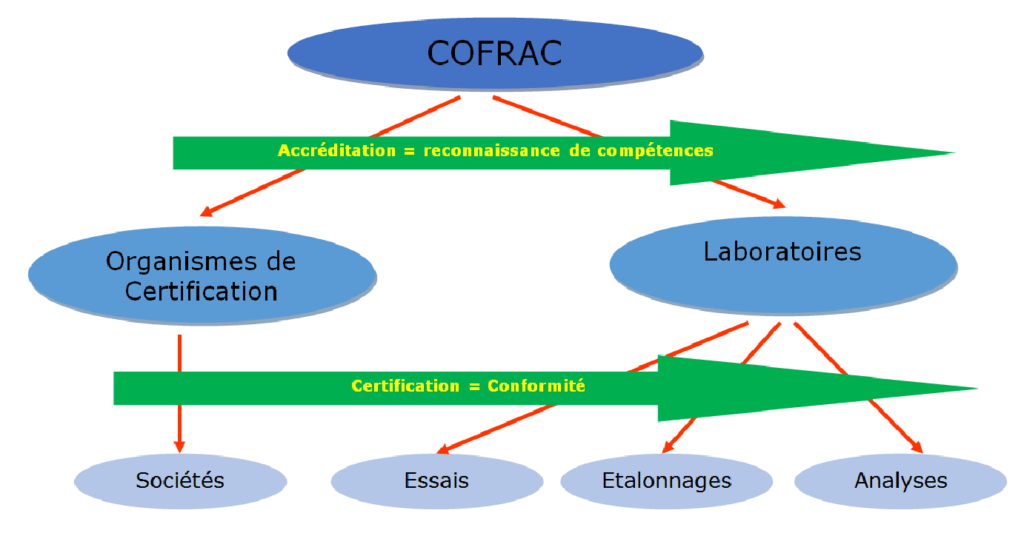
Le COFRAC est en France, l’unique organisme ayant autorité à délivrer une accréditation Figure 2.
Il se réfère à l’ISO 17021 Évaluation de la conformité — Exigences pour les organismes procédant à l'audit et à la certification des systèmes de management [12] et l’ISO 17040 Évaluation de la conformité — Exigences générales relatives à l'évaluation par des pairs des organismes d'évaluation de la conformité et des organismes d'accréditation [13]et délivre l’accréditation :
- Selon les ISO 15189, 17025, 22870 pour les laboratoires
- Selon les ISO 17021, 17024, 17040 pour les organismes de certification
Les laboratoires certifient leurs résultats. Les organismes de certification certifient les sociétés selon les ISO propres à chaque domaine reposant sur l’ISO 9001. Afin de comprendre au mieux les différentes interactions entre organismes et leurs responsabilités, voici un schéma récapitulatif :
Afin de situer les laboratoires dans leur démarche qualité, le COFRAC a établi un cycle d’accréditation.
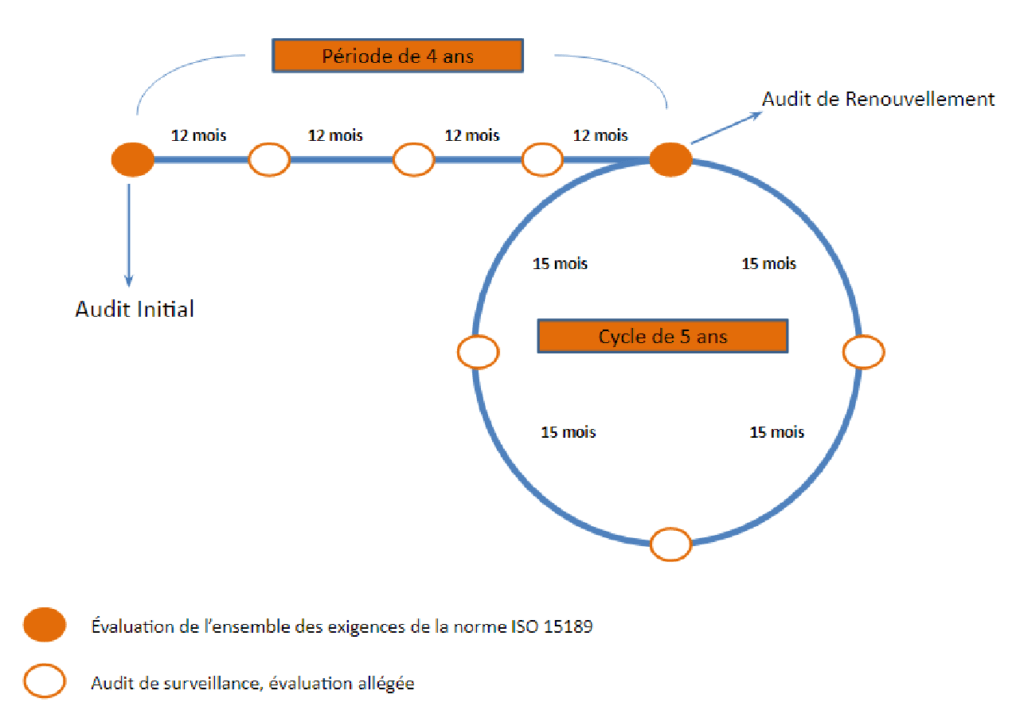
b. Les enjeux
i. Enjeux humains
Les patients :
L’obtention de l’accréditation est tout d’abord dans l’intérêt du patient, de part une fiabilité assurée dans le rendu et la traçabilité des résultats. C’est également la garantie pour le patient de faire des analyses identiques, avec la même reconnaissance d’acte, d’un établissement à un autre. En effet, de part les nouvelles technologies, l'autogestion du patient (lecteur à glycémie..), la place de la biologie dans le parcours de soins du patient évolue [14]. Cette norme a un impact sur la perception par les patients de la biologie médicale.
Les acteurs de terrain :
L’accréditation d’un laboratoire permet l’homogénéisation des pratiques au sein d’un service et donc un gain organisationnel du temps de travail.
Elle permet également une reconnaissance de compétences inter-laboratoires. En effet, avant l’application de cette norme, les techniciens de laboratoire médical n’avaient pas de reconnaissance réglementaire de leurs compétences acquises par l’expérience [15].
De plus, l’accréditation du laboratoire instaure un niveau de confiance entre la Direction Générale de l’établissement, les services de soins et également les fournisseurs et prestataires.
ii. Enjeux réglementaires
La loi Hôpitaux, Patients, Santé, Territoires du 21 Juillet 2009 [16] recommande aux LBM d’être accrédité ISO 15189. L’ordonnance 2010-49 de 2013 rend cette accréditation obligatoire [1]. Au terme de l’échéance imposée par le COFRAC, une absence d'accréditation totale de l’ensemble des examens de biologie d’un laboratoire entraîne sa cessation d’activités par sa fermeture administrative.
L’échéance initialement instaurée était 100% d’examens accrédités au premier novembre 2016. Après révision du calendrier, la date butoir est au premier Novembre 2020.
Les conséquences d’une fermeture de laboratoires sont :
- d’une part une dégradation du parcours de soins du patient et une perte de confiance dans l'établissement de soins
- d’autres part une perte financière importante, avec notamment un impact majeur sur l’effectif par un licenciement ou un reclassement.
La responsabilité de cette accréditation est donc portée par la direction de l’organisme.
iii. Enjeux de performance
L’accréditation selon l’ISO 15189 prouve la compétence des laboratoires à répondre à des exigences techniques et managériales. Ainsi, cette accréditation permet de définir un standard de qualité et donc de garantir les résultats issus du laboratoire. Cette confiance dans les résultats permet de préserver la réputation de l’établissement de santé. Cette norme permet également aux laboratoires de prouver l’efficacité de leurs méthodes et leur maîtrise des d’incertitudes de leurs mesures dans les processus d’analyse. D’après une étude réalisée au Luxembourg, 90% des établissements certifiés le fond pour garantir la fiabilité de leurs résultats [17]. Enfin, l’amélioration de l’efficience des laboratoires, portées par la norme ISO 15189 doit participer à la réduction du temps de séjour des patients et favoriser l’hospitalisation de jour [18], améliorant le confort du patient et réduisant les coûts hospitaliers.
La norme ISO 15189 exige le respect de la confidentialité des données, la conformité des analyses, la sécurité du personnel et défini un délai raisonnable d’obtention des résultats.
iv. Enjeux économiques
Accréditer l’ensemble des analyses d’un laboratoire a une répercussion économique. En effet, le nombre de laboratoires en France a diminué ces dernières années suite à la parution de la loi imposant l’accréditation.
Un regroupement des laboratoires d’analyses médicales a été observé, passant leur nombre de 1364 en 2013 à 864 en 2018 afin de diminuer les coûts engendrés par l’accréditation.
Un certain nombre de paramètres sont pris en compte pour déterminer le coût final, tels que le nombre de personne dans l’organisme, le nombre de jour de l’évaluation, s’il s’agit d’une évaluation initiale ou d’un suivi, toutes les modalités sont décrites dans les référentiels du COFRAC concernant les différents tarifs applicables [19].
Selon une estimation du groupe Labco, cette accréditation “entraînera un surcoût d'environ 3% du chiffre d’affaires au début puis 1.5% ensuite” [20]. Ainsi, les petites structures salariales ne pourraient pas assurer cette conséquence. Cependant, l’accréditation a pour objectif de modifier l’organisation des structures afin de réaliser des économies. Aussi, l’économie de 180 millions € annoncée par la sécurité sociale pour 2020 [21] ne pourra se faire uniquement que si les laboratoires sont plus efficients, notamment grâce à l’ISO 15189.
Afin de répondre aux différents enjeux, un outil de positionnement est élaboré. Pour garantir la fiabilité des résultats rendus aux patients, l’outil permet de cibler le non respect des exigences normatives qui peut conduire à des erreurs humaines. Cet outil est une aide au laboratoire dans leur démarche d’accréditation et peut être une présomption de conformité afin que les laboratoires puissent garder ou renouveler leur accréditation et donc éviter leur fermeture administrative. L’utilisation de graphique pour exploiter les résultats de l’évaluation permet de situer rapidement le laboratoire sur le respect et les pratiques des exigences réglementaires. De plus, suite à la mesure des critères par l’évaluation, des plans d’actions permettent d’agir dans le but d’une amélioration continue.
II. Élaboration d’outils d’aide à l’évaluation
a. Cartographie d’aide à la compréhension de la norme ISO 15189 v2012
Une cartographie détaillée sous format « pdf » est mise à disposition afin d’aider le lecteur à la compréhension de la norme. Cette cartographie est interactive et permet de naviguer entre les différents articles et sous articles de la norme de façon ludique et simple.
Elle est constituée d’une vue globale de la norme avec ses 2 articles (Figure 4a), puis d’une vue par paragraphes (Figure 4b) et enfin d’une vue avec les exigences attendues de chaque paragraphes (Figure 4c).
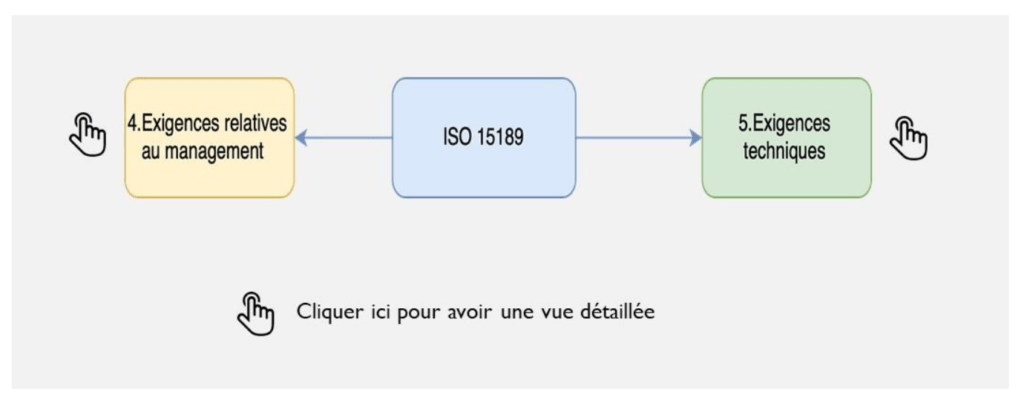
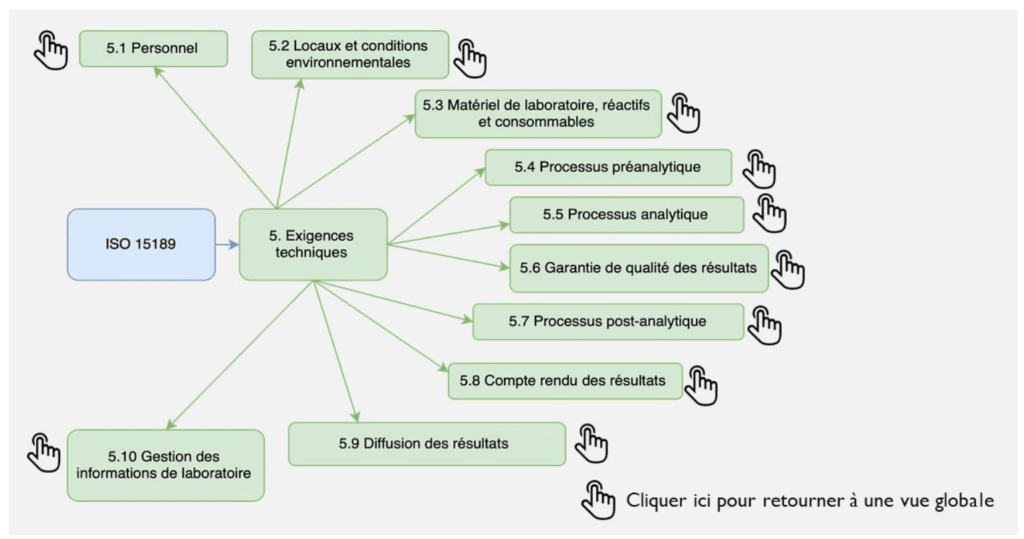
Cet outil cartographique est destiné tant à des personnes expertes que néophytes.
b. Outils de positionnement
Il existe différents « outils d’autodiagnostic » [22]–[25]pour aider au mieux les organismes à effectuer un état des lieux sur leurs pratiques. Un ca hier des charges groupant les critères nécessaires à l’élaboration d’un nouvel outil de positionnement efficient et efficace est élaboré à partir de la comparaison de quatre outils d’auto diagnostics existants (Tableau 1). Ces outils ont été choisis en fonction du lien qu’ils possèdent avec la norme ISO 15189.
Les outils suivants : « Outil d’auto évaluation du COFRAC [22]», « Accompagner les fabricants dans leur gestion des risques des dispositifs médicaux selon la norme NF EN ISO 14971 » [23], « Allier qualité et performance via l’ISO 9001 version 2015 » [24] ont comme structure commune la norme ISO 9001. L’outil « Qualité opérationnelle pour les laboratoires avec le « 5S Biologie » [25] est axé sur le management de la qualité.
Les critères sélectionnés pour l’élaboration du nouvel outil de positionnement sont les suivants :
- Mode d’emploi clair : Un mode d’emploi clairement explicite permet une prise en main simple de l’outil donc un gain de temps à l’utilisation de l’outil dans sa globalité. De plus, une bonne prise en main de l’outil augmente le taux de confiance dans les résultats présentés.
- Nombre de critères d’évaluation adéquat : Le nombre de critères dépend du nombre d’exigences portées par les différentes normes étudiées. De manière générale, les critères d’évaluation doivent être compréhensibles et compris par tous. Leur nombre doit permettre de couvrir l’ensemble des exigences de la norme de manière synthétique.
- Durée du diagnostic : La réalisation de l’évaluation avec l’outil ne doit pas excéder 1h.
- Résultats compréhensibles : Les résultats du test doivent être visuellement et rapidement compréhensibles.
- Évaluation de la maîtrise documentaire : Un bilan sur la gestion documentaire permet de cibler les documents obligatoires.
- Ergonomie de l’outil : L’outil doit être facile d’utilisation, avoir une lisibilité correcte et une physionomie adaptée (couleur utilisée, taille de la police..)
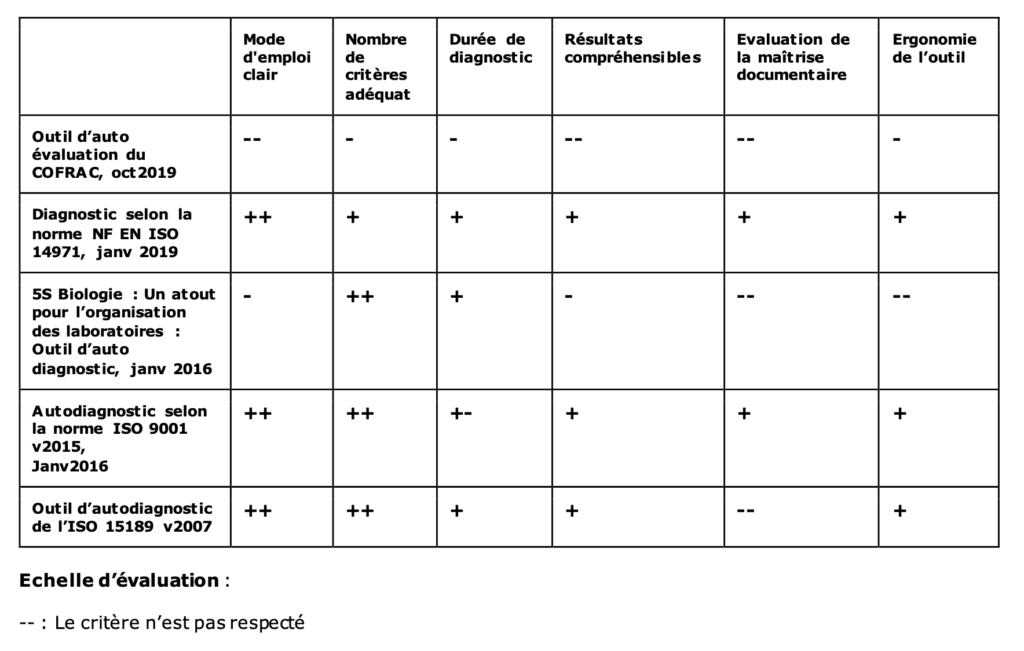
Échelle d’évaluation :
-- : Le critère n’est pas respecté
- : Le critère est partiellement respecté
+: Le critère est respecté
++: Le critère est respecté et amélioré
Le cahier des charges pour la réalisation d’un nouvel outil de positionnement est établi en prenant à minima le respect des critères cités dans le Tableau 1.
c. Proposition d’un nouvel outil de positionnement
Afin de répondre aux besoins des futurs utilisateurs de l’outil de positionnement, les critères ci évalués dans le tableau sont réutilisés de manière efficiente.
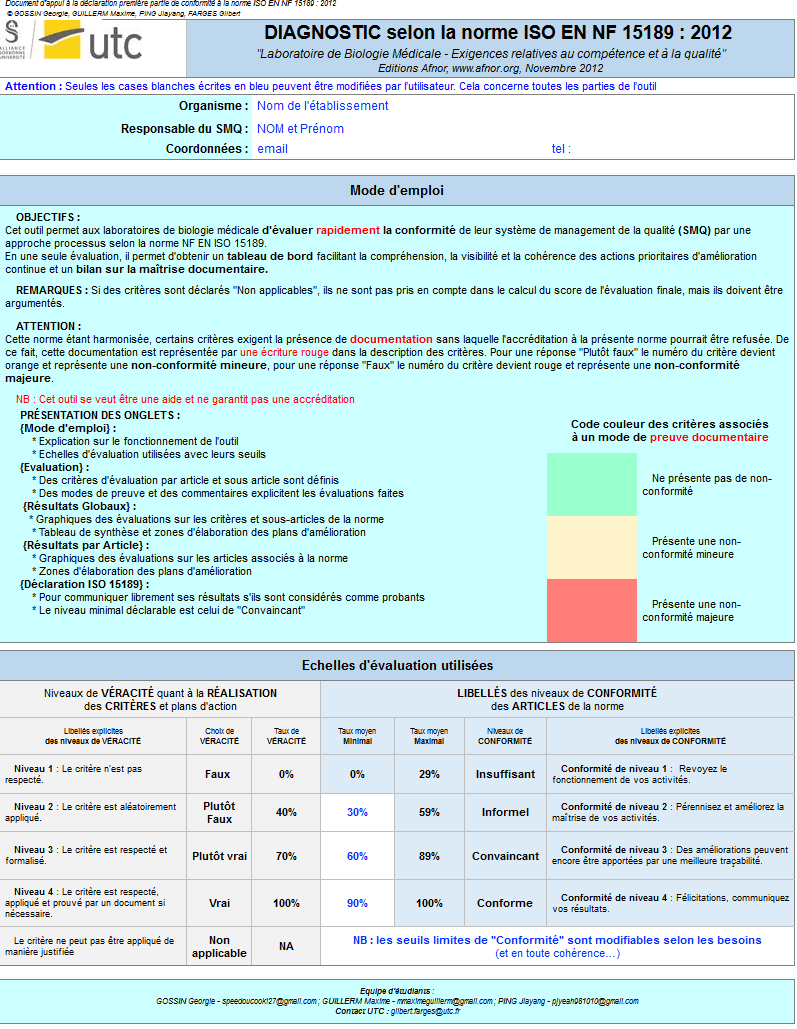
L’outil est proposé de manière gratuite et utilisable sur internet via le logiciel Excel©. Il a pour but de permettre au laboratoire de situer leur conformité relative à l’ISO 15189 v2012, de manière rapide (1h environ) et de déterminer un plan d’actions afin d’améliorer leurs pratiques.
Cet outil est composé de 6 {onglets} :
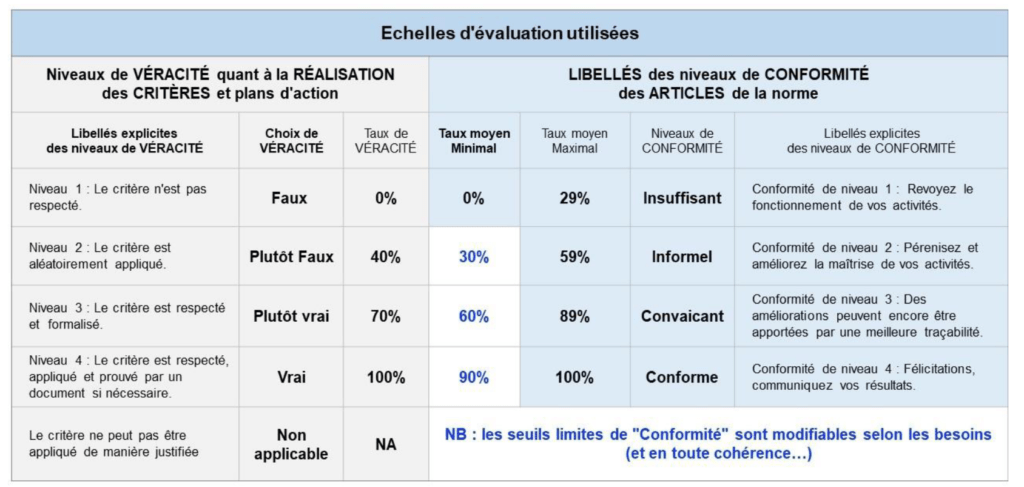
- L’onglet {Mode d’emploi} (Figure 7) explique l’utilisation des autres onglets ainsi que la méthodologie à suivre pour remplir l’outil. De plus, il détaille les différentes échelles de véracité (vrai, plutôt vrai, plutôt faux, faux, non-applicable) et de conformité (insuffisant, informel, convainquant, conforme et non-applicable) en fonction de leur de taux respectivement associés (0% à 100%)
- L’onglet {Évaluation} est composé de 43 critères pour le chapitre « Exigences relatives au management de la qualité » et de 39 critères pour le chapitre « Exigences techniques » de la norme ISO 15189. Ces critères ont été déterminés à l’aide de l’outil COFRAC. Cette évaluation est détaillée et englobe les exigences de preuves documentaires, repérées par la surbrillance rouge (Figure 8).

- Afin de cibler rapidement les améliorations à apporter, la visualisation de l’évaluation des critères est réalisée avec les onglets {Résultats globaux} et {Résultats par article}.
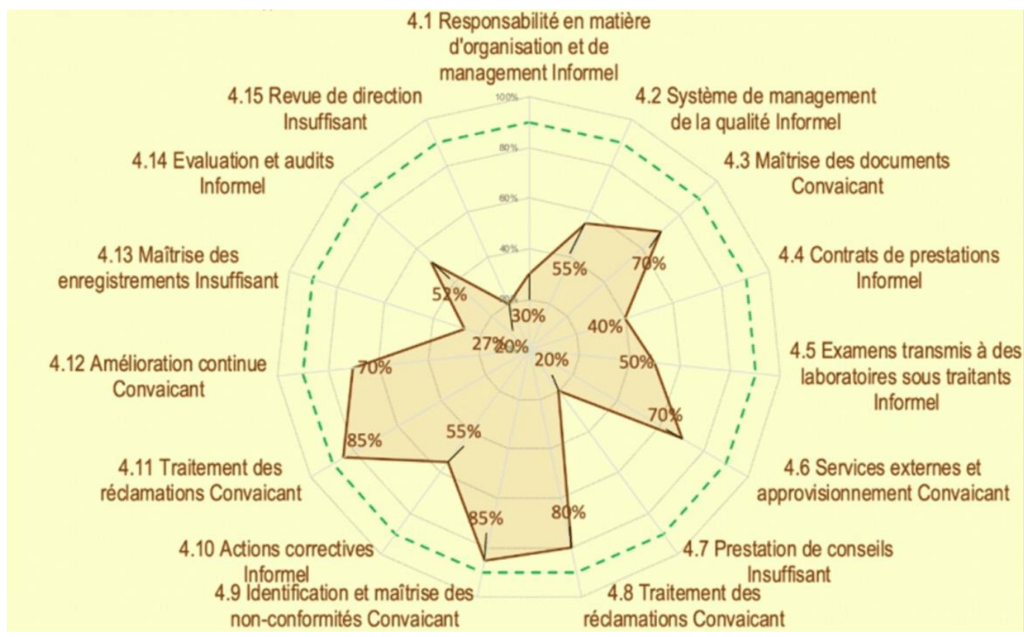
Deux histogrammes de répartition (Figure 9) sur les niveaux de véracité et de conformité sont disponibles. Un graphe radar présente les valeurs moyennes obtenues par article (Figure 10) puis sous article (Figure 11) permet d’identifier les axes à améliorer.

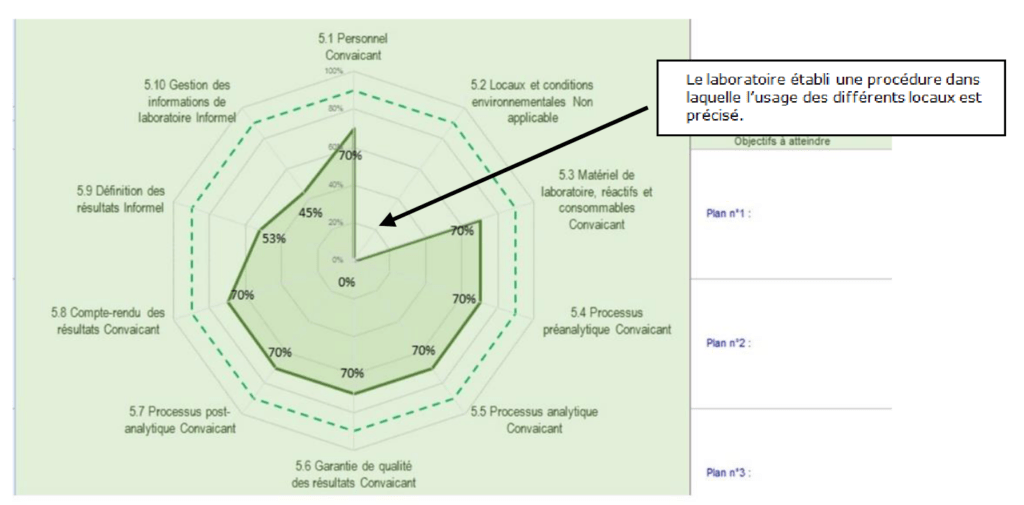
Par exemple, sur la (Figure 11), le pourcentage équivalent à 0% résulte de l’évaluation du sous article 5.2 de la norme, réalisée au préalable et signifie une non-conformité totale du sous article. C’est pourquoi, un espace dédié à des propositions de plan d’actions (comme indiqué en exemple sur la (Figure 11) est prévu ainsi que le suivi des actions mises en œuvres par le laboratoire.
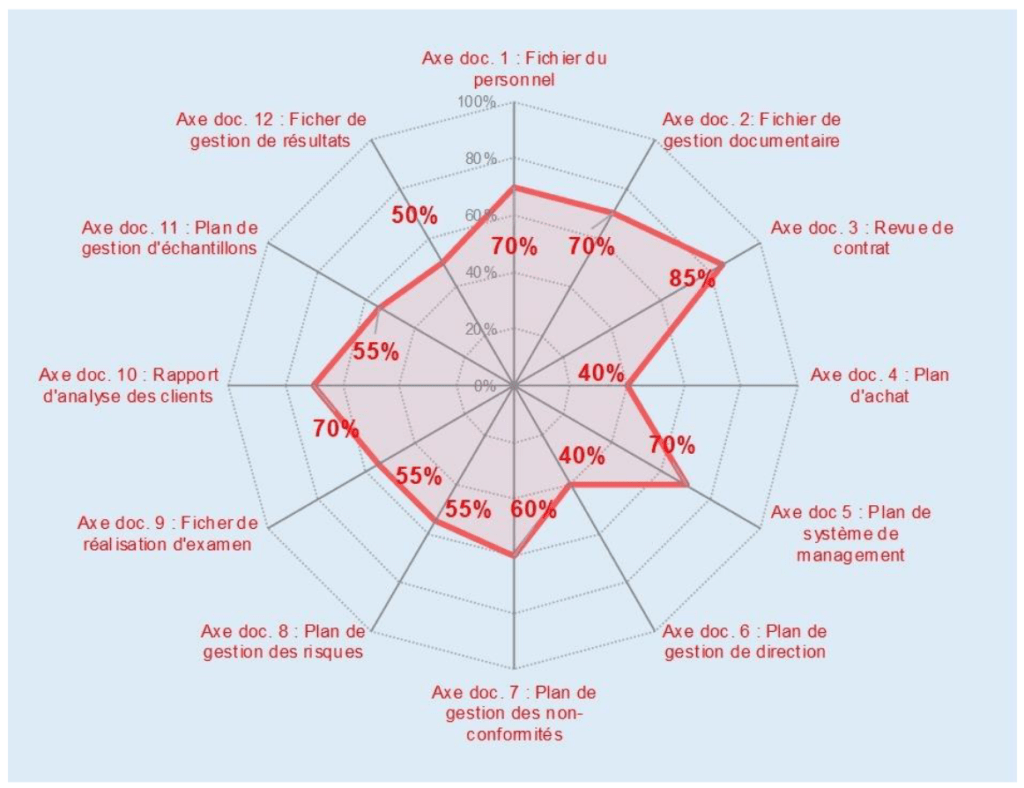
- L’onglet {Maîtrise documentaire} reprend les différents critères ayant pour éléments de preuve de réalisation un document. Une échelle de conformité de la maîtrise documentaire (absent, très incomplet, incomplet, presque complet, complet et diffusé) liée à graphe radar permet d’identifier les documents manquants ou incomplets. Les documents de preuve à fournir sont repérés dans l’onglet { Évaluation } en caractère rouge. Suivant le respect de l’exigence de l’apport de preuve documentaire, un pourcentage est calculé de manière automatique selon une échelle préalablement définie (Figure 13).

Par exemple, la (Figure 14) montre que le document 6 : Plan de gestion des non-conformités est incomplet puisque seulement 47% des exigences ont été respectées.
Pour les onglets {Résultats globaux}, {Résultats par article} et {Maîtrise documentaire}, une partie réservée aux commentaires des résultats, à la planification des actions à réaliser et au suivi des actions réalisées est libre d’écriture.

(source : auteurs)
- Pour finir, un onglet {Déclaration ISO 15189} peut être utilisé à titre de preuve de réalisation d’audit au sein du laboratoire. Cette déclaration sert de présomption de conformité lorsque le taux atteint un seuil suffisant qui est au préalablement défini.
Conclusion
L’ordonnance 2010-49 du 13 janvier 2010 [1] exige que tous les laboratoires de biologie médicale aient 100% de leurs examens accrédités d’ici le 1er novembre 2020 [9].
Cette exigence d’accréditation est née suite aux rapports relatant le besoin de réformer la biologie médicale dans l’intérêt du patient afin de diminuer le nombre de non-conformité sur les résultats qui leurs sont transmis [7], [8] pour leur garantir une qualité de soins.
L’outil de positionnement lié à une cartographie interactive permet de relancer une dynamique de l’amélioration continue et de rendre progressive les améliorations correctives à apporter aux laboratoires de biologie médicale. Cet outil peut être intégré au processus d’amélioration du laboratoire par son utilisation lors d’audits internes.
La performance de l’outil par son efficacité (respect des exigences selon la norme ISO 15189 v2012) et son efficience (<1h pour l’évaluation des critères) est un atout pour les utilisateurs.
Les deux outils ont été proposés pour tests et appréciations à un panel de responsable qualité de laboratoires.
Actuellement, le retour d’expérience souligne l’utilité de la cartographie d’aide à la compréhension de la norme et incite le groupe projet à réfléchir sur des suggestions pour l’outil de positionnement.
Références bibliographiques
[1] “Ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale.” Legifrance, Paris, www.legifrance.gouv.fr, Jan-2010
[2] “La certification ; c’est quoi?” [Online]. Available : https://www.iso.org/fr/certification.html. [Accessed : 11-Dec-2019].
[3] “Biologie médicale et certification.” Edition HAS, www.has-sante.fr, 2014.
[4] “NF EN ISO 15189 Laboratoires de biologie médicale - Exigences concernant la qualité et la compétence.” Editions Afnor, Paris, www.afnor.org, 01-Dec-2012.
[5] “Les laboratoires de biologie médicale poursuivent leur démarche d’accréditation !” Edition COFRAC, https://www.cofrac.fr, 01-Dec-2019. .
[6] “Arrêté du 26 avril 2002 modifiant l’arrêté du 26 novembre 1999 relatif à la bonne exécution des analyses de biologie médicale.” Editions Legifrance , Paris www.legifrance.gouv.fr, 26-Apr-2002.
[7] F. Lalande, I. Yeni, and C. Laconde, “La biologie médicale libérale en France : bilan et perspectives, Rapport de l’IGAS.” https://solidarites-sante.gouv.fr, Apr-2006. .
[8] M. Ballereau, “Rapport pour un projet de réforme de la biologie médicale,” Ministère de la Santé, de la Jeunesse, des Sports et de la Vie associative, https://solidarites-sante.gouv.fr, Sep. 2008.
[9] Ministère des Affaires sociales, de la Santé et des Droits des femmes, “L’accréditation de mon laboratoire de biologie médicale : les 3 dates-clés pour y arriver !” Oct-2014.
[10] “NF EN ISO 9001- Systèmes de management de la qualité- Exigences.” Editions Afnor, Paris, www.afnor.org, 15-Oct-2015.
[11] “Exigences pour l’accréditation des laboratoires selon la norme NF EN ISO/IEC 17025:2017, Révision 13.” Editions Afnor, Paris, www.afnor.org, 01-Nov-2019.
[12] “Norme ISO/IEC 17021:2011 : Évaluation de la conformité — Exigences pour les organismes procédant à l’audit et à la certification des systèmes de management.” Editions ISO, Genève, Feb-2011.
[13] “ISO/IEC 17040:2005 : Évaluation de la conformité — Exigences générales relatives à l’évaluation par des pairs des organismes d’évaluation de la conformité et des organismes d’accréditation.” Editions ISO, Genève, Jan-2005.
[14] V. Devillaine, “La biologie médicale face aux enjeux des nouveaux parcours des patients - Fédération Hospitalière de France (FHF).” www.edp-biologie .fr, 07-Dec-2017.
[15] D. Prudent, “L’AFTLM à l’heure du Développement Professionnel Continu (DPC),” Techlabo.com, pp. 04–05, Sep-2016.
[16] LOI n° 2009-879 du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires, vol. Article 69-alinéa 2. 2009.
[17] M. Jacoby, “Analyse de l’impact de l’accréditation au Luxembourg,” ILNAS-Institut Luxembourgeois de la Normalisation, de l’Accréditation, de la Sécurité et qualité des produits et services, Luxembourg, Etudes, Mar. 2014.
[18] M. Dahan, A. Gallot, and M. Ballereau, “La biologie médicale, coeur de métier hospitalier Enjeux de la réforme,” Réforme de la biologie médicale et accréditation, no. 531, pp. 8–11, Dec. 2009.
[19] “Combien l’accréditation va t elle me coûter?” Editions COFRAC, Paris www.cofrac.fr/.
[20] M. Perez, “Accréditer les labos d’analyse pour améliorer la qualité,” 29-Jan-2013. [Online]. Available : http://sante.lefigaro.fr/. [Accessed : 12-Dec-2019].
[21] D. Rosenweg, “Budget de la sécurité sociale : les pistes d’économie pour 2020,” leparisien.fr, 28-Jun-2019. [Online]. Available : http://www.leparisien.fr/. [Accessed : 12-Nov-2019].
[22] “Outil d’auto-évaluation.” Edition COFRAC, https://www.cofrac.fr, 10-Oct-2019. [23] E. Ayne, V. Bayeux, D. Wannepain, and G. Farges, “Accompagner les fabricants dans leur gestion des risques des dispositifs médicaux selon la norme NF EN ISO 14971:2013,” IRBM News, vol. 40, no. 2, pp. 69–73, Apr. 2019.
[24] Z. Barry et al., “Allier qualité et performance via l’ISO 9001 version 2015,” IRBM News, vol. 37, no. 2, pp. 68–71, Apr. 2016.
[25] N. Drillaud et al., “Qualité opérationnelle pour les laboratoires avec le « 5S Biologie »,” IRBM News, vol. 38, no. 1, pp. 82–86, Feb. 2017.
[26] F. De Frondat, V. Delahaye, P.-J. Gomez, C. Podlunsek, G. Farges, and J.-P. Caliste, “Laboratoires d’analyses de biologie médicale : un outil d’autodiagnostic basé sur la norme NF EN ISO 15189,” IRBM News, vol. 31, no. 3, pp. 3–6, Jul.2010,doi:10.1016/j.irbmnw.2010.05.002 .