IDS083 - Plan d'action pour la conception d’un dispositif médical dans l’urgence
Catégories
Mots-clés
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs

GIORGI Marie 
EL OUAGHMARI Nour 
DE GROUT DE BEAUFORT Eloise 
MACEDO Carolina
Contacts
- eloisedebeaufort@gmail.com
- nourelouaghmari@hotmail.com
- mariegiorgi@outlook.fr
- eng.carolinamcd@gmail.com
Citation
A rappeler pour tout usage : E. de Beaufort, N. El Ouaghmari, M. Giorgi et C. Macedo, "Plan d'action pour la conception d'un dispositif médical dans l'urgence", Université de Technologie de Compiègne (France), Master Ingénierie de la santé parcours Technologies Biomédicales et Territoires de Santé, Mémoire de projet, Décembre 2020, disponible sur : https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids083/
Résumé
Face à la crise sanitaire et au vu du flux de patients croissant dans les hôpitaux, certains établissements furent en manque de dispositifs médicaux durant la période mars-avril 2020. De nombreux projets indépendants ont vu le jour, composés d’équipes d’experts qui ont uni leurs compétences pour fabriquer des respirateurs artificiels d’urgence. C’est ainsi que les Minimal Universal Respirator sont apparus. Ainsi, de nombreuses organisations ou universités ont été contactés pour participer à certaines étapes du cycle de vie du dispositif médical et s’investir dans les différents projets ou initiatives en cours. Face à cette demande, certaines institutions ont été en incapacité de répondre à cet appel par manque de connaissances des ressources disponibles et de la démarche à suivre.
Dans ce mémoire, il s’agit principalement de présenter toutes les étapes à suivre pour aboutir à une innovation biomédicale, et de fournir pour chacune d’elles, les ressources matérielles et humaines disponibles dans l’établissement concerné (ici l’Université de Technologie de Compiègne). L’objectif étant de se rendre compte de ses capacités et incapacités afin de pouvoir mettre en place les actions nécessaires pour répondre de maniè re opérationnelle à une demande de conception d’une innovation biomédicale de rupture.
Pour ce faire, l’utilisateur a à sa disposition un outil qui lui permet de recenser toutes ces ressources en fonction des différentes étapes au cours desquelles il peut intervenir. Finalement, le but de cet outil est de permettre à tout porteur de projet d’innovation biomédicale d’être opérationnel dans l’urgence et de suivre un plan d’action défini et concret. Le but ultime sera de valider le dispositif fabriqué, afin de pouvoir le diffuser et l’utiliser pour veiller au bien être des patients.
Abstract
Facing the sanitary crisis and the increasing flow of patients in hospitals, some institutions were in shortage of medical devices in March and April 2020. Some independent projects were set up, with teams of experts who combined their skills to manufacture emergency artificial respirators. This is how the Minimal Universal Respirator appeared. As a result, many organizations or universities have been contacted to participate in certain stages of the medical device live cycle. They were asked to get involve in various projects or initiatives underway. Faced with this demand, some institutions have been unable to respond due to an acknowledge of the available resources and the process to follow.
Here, the aim is to present all the steps to follow in order to achieve a biomedical innovation, and to provide for each of them, all the material resources and human resources available in the concerned establishment (here the Université de Technologie de Compiègne). The objective is to be aware of one’s capacities and disabilities in order to put in place the necessary actions to respond in an operational manner to a demand for the design of a breakthrough biomedical innovation.
The user has now a tool that allows him to identify all those resources according to the different stages during which he can intervene. The global aim of these tools is to enable any biomedical innovation project leader to be operational in an emergency. He will be able to follow a defined and concrete action plan. Finally, the ultimate goal is to validate and spread the manufactured device and use it with patients.
Téléchargements


Introduction
L’objectif principal de ce document est de fournir un guide complet, regroupant de nombreuses informations pratiques ; destinées à accompagner toute personne souhaitant innover, fabriquer, valider, lancer ou commercialiser un dispositif médical dans l’urgence.
Afin que ce guide soit le plus efficace possible, il est important de se mettre à la place de toute personne souhaitant initier un projet d’innovation biomédicale. Ainsi, le guide est conçu de manière claire afin d’être facilement compréhensible et exploitable par l’utilisateur. Ce dernier est également adapté au contexte de chaque projet. Pour cela, il faut veiller à ce que les informations figurant dans le guide puissent être utiles pour un large panel de dispositifs médicaux et pour chacune des étapes de leur cycle de vie. En ce sens, l’auteur du guide est invité à se baser sur un exemple concret afin de lui faciliter les démarches de création d’un guide général, recouvrant tout type de dispositif médical.
Le point de départ de la réflexion concerne la conception d’un MUR (Minimal Universal Respirator) UTC dans le cadre de la crise sanitaire du COVID19. Dans un premier temps seront exposés les informations techniques nécessaires à la conception d’un MUR et dans un second temps les informations réglementaires à prendre en compte à toutes les étapes de son cycle de vie.
Une seconde partie, plus générale, traitera de la démarche à suivre pour mettre en place une innovation biomédicale. Pour cela, il est nécessaire de commencer par un rappel des étapes principales du cycle de vie d’un dispositif médical ainsi que des actions à mettre en œuvre pour chacune d’entre elles. L’objectif étant de permettre au porteur de projet de suivre son avancement et de s’autoévaluer. Il s’agit ici de se concentrer sur les étapes qui précèdent la commercialisation du dispositif et son utilisation dans les établissements de santé. Un processus est alors détaillé en quatre phases principales afin de guider le porteur de projet dans la conception de son dispositif médical en accord avec les réglementations en vigueur. Enfin, il est essentiel de réaliser un recensement des ressources humaines et matérielles pouvant aider le porteur de projet dans la réalisation de ses missions. Il sera ici présenté les ressources disponibles à l’UTC et dans son environnement proche, mais les outils proposés seront adaptables à toute organisation.
Chapitre 1 – Contexte de l’étude : La crise sanitaire en France
1. Contexte, enjeux et cibles du projet
En Mars 2020, la France a fait face à un manque certain de ventilateurs artificiels pour soigner les patients atteint de SDRA (Syndrome de Détresse Respiratoire Aigu) comme la maladie Covid-19. Le gouvernement a donc lancé un appel d’aide à toutes les personnes en capacité de répondre rapidement à ce manque.
Instantanément, les premiers répondant à cet appel furent les industriels. Par exemple, l’entreprise française, Air Liquide Medical Systems, a proposé de s’associer avec PSA, Valeo et Schneider Electric pour produire des ventilateurs en grande quantité. En 3 mois, 10 000 respirateurs ont été produit et mis sur le marché. Deux modèles ont été fabriqués :
- Le Monnal T60 : un ventilateur d’urgence et de transport, adaptable dans les services de réanimation
- L’Osiris 3 : un ventilateur plus léger et compact, également utilisé en transport
De ces deux modèles, c’est l’Osiris 3 qui a été produit en grande quantité, car facilement reproductible et peu onéreux. [1]
En outre, les industriels n’ont pas été les seuls à répondre à l’appel du gouvernement. De nombreux autres projets indépendants, initiatives et concours ont vu le jour partout dans le monde pour fabriquer des ventilateurs. Les ingénieurs, étudiants, autoentrepreneurs, start-up, universités, ont déployé leurs capacités techniques et matérielles pour répondre à la pénurie de ventilateurs. [2]
Cependant, pour répondre rapidement dans un contexte urgent à une telle demande et pouvoir fabriquer un dispositif médical conforme, il faut un cahier des charges opérationnel qui réunit toutes les ressources nécessaires pour répondre à cette demande.
Demain, un(e) jeune ingénieur(e) ou une université en capacité de fabriquer un dispositif médical, doit pouvoir réunir toutes les ressources matérielles et humaines nécessaires à son projet afin de répondre rapidement et proposer son dispositif aux autorités compétentes.
A titre d’exemple, l’Université de Technologie de Compiègne a été sollicitée par le Centre Hospitalier de Compiègne-Noyon pour produire des ventilateurs. Face à cette situation les chercheurs et ingénieurs manquaient d’un plan d’action concret qui leur permette de connaitre toutes les étapes à suivre, les personnes à contacter et les ressources matérielles à réunir pour mettre en place un tel projet. C’est ainsi, qu’un guide des actions à effectuer est nécessaire dans le cas où l’UTC serait contactée pour produire des dispositifs médicaux ou autres innovations technologiques dans un tel contexte.
2. Etude de cas : MUR (Minimal Universal Respirator)
Le réel intérêt de fabriquer un tel respirateur est de permettre un gain de temps pour traiter les patients en détresse respiratoire. En effet, face à l’encombrement des hôpitaux de patients covid, les médecins ont dû trouver des alternatives pour ventiler les patients. C’est donc avec des BAVU (Ballon autoremplisseur à valve unidirectionnelle) que les praticiens apportaient l’oxygène nécessaire à leurs patients. Cela a donc provoqué une perte de temps et une diminution de la disponibilité du personnel soignant, qui devait être en continu au chevet du malade. [3]
C’est ainsi que l’on trouve tout l’intérêt du M.U.R, qui permet de ventiler simplement et de manière automatisée ces patients.
Pendant la crise de la covid19, tous les Minimal Universal Respirator ont été conçus grâce à un mouvement de solidarité basé sur le partage de connaissances. L’objectif était de pallier la pénurie des respirateurs dans le monde entier. De nouveaux fabricants naissent de start-up, d’universités et de reconversion de société se regroupant ainsi autour d’une problématique : fabriquer rapidement un dispositif peu onéreux avec les fonctionnalités minimales exigées d’un respirateur et applicable pour des patients souffrant de lésions pulmonaires liées à la covid-19.
Beaucoup d’entre eux, afin d’obtenir une certaine reconnaissance pour le travail et l’efficacité qu’ils ont fournis, participent à des concours de création. Ces challenges ont pour but d’inciter, toutes les personnes ou organismes ayant les capacités humaines et matérielles nécessaires, de concevoir un respirateur en un temps record.
Les 2 principaux concours sont le CoVent-19 Challenge et le Défi Respirateur Code Vie.
- Le CoVent-19 Challenge [4] organisé par le département d’anesthésie du Massachusetts General Hospital a débuté le 1er avril dernier pour 8 semaines de compétition. Un appel à projet a été lancé en invitant de nombreuses personnes à participer au concours. Lors de ce dernier, des ingénieurs, designers, innovateurs et fabricants ont pu proposer des modèles de respirateurs artificiels.
Figure 1 : Images publicitaires de l’appel à projet pour le CoVent-19 Challenge. Source : d’après [5]

Le challenge s’est déroulé en ligne, sur la plateforme GrabCAD Challenges [5] qui fait partie des plateformes de création et d’échange les plus connues, avec plus de 7 millions d’utilisateurs. GrabCAD Challenge regroupe plus de 4 millions de fichiers gratuits téléchargeables dont des tutoriels, des challenges et des modèles de conception assistée par ordinateur (CAO) compatibles avec l’impression 3D. Le grand gagnant du CoVent-19 Challenge est le respirateur SmithVent, fabriqué par une équipe d’anciens élèves du Smith College au Massachusetts.
- Le Défi Respirateur Code Vie [6] organisé par l’hôpital général de Montréal et l’Institut de recherche du Centre universitaire de santé McGill a débuté le 19 mars dernier pour une compétition de 2 semaines.
Le challenge a été organisé sur la plateforme en ligne Agorize, une plateforme française spécialisée dans l’organisation d’hackathons ou d’innovations ouvertes. Après le tri de 2600 inscriptions provenant de 94 pays différents, le jury composé de médecins et ingénieurs, a choisi les trois finalistes suivants : Haply (Canada), IFPR (Brésil) et Lung Carburetor (Canada).
En plus de des plateformes GrabCAD Challenges et Agorize, de nouvelles ont vu le jour pour des appels à projet listés ci-dessous [2] :
- Groupe Facebook Open Source COVID19 Medical Supplies
- Open Source Ventilator (Irlande/sous-groupe du groupe Facebook)
- Covid19 Global Hackathon (appel à projet lance par l’OMS)
- OpenCovid 19 (Just One Giant Lab)
- Helpful Engineering
- Open Air
- Tikkum Olam Makers (TOM)
- Help with Covid
Toutes ces plateformes regroupent des idées, des astuces, des conseils, des exigences à suivre et des fichiers CAO de respirateur. Tout ceci permet aux fabricants de pouvoir s’entraider et échanger afin de réaliser le meilleur Minimal Universal Respirator.
Etude d’autres projets : concurrence
Aujourd’hui, la plupart des projets présentés précédemment, proposent un site web avec des documents « open source » pour que chaque personne ayant la capacité, puisse reproduire le travail et ainsi diffuser un maximum de respirateurs dans le monde entier.
Pour le projet MIT Emergency Ventilator (figure 2), c’est une équipe d’ingénieurs, de cliniciens et d’experts qui se sont réunis pour mettre en commun leurs compétences diverses. Ils mettent à la disposition de tous différents documents sur leur site internet :
- Les fonctionnalités minimales d’un ventilateur basé sur un guide clinique
- La conception du matériel de références en accord avec les exigences cliniques
- Les différentes stratégies de contrôle de référence et conceptions électroniques
- Les résultats de leurs essais cliniques sur des animaux
Figure 2 : Photo de l’Emergency Ventilator. Source : d’après [4]

Dans le même principe, on retrouve le projet Makair(figure 3), également guidé par un groupe d’experts universitaires, ingénieurs et médecins. Ils proposent de suivre l’avancée de leurs travaux et tests via leur site internet, en mettant en libre accès tous les documents qui permettent de fabriquer un tel dispositif. Ils expliquent que leur ventilateur est pensé « pour respecter 100% des règles garantissant la sécurité des patients en conformité avec la réglementation européenne sur les dispositifs médicaux ». Ils présentent également toutes les étapes et tous les matériaux nécessaires à la conception de leur machine mais sans réellement expliquer le processus de mise sur le marché ni les étapes avant et après conception. [7]
Figure 3 : Photo du respirateur MakAIr. Source : d’après [8]

On peut également s’inspirer du projet M.U.R (figure 4), lancé par un collectif de médecins, responsables associatifs, personnel humanitaire et scientifique, réunis dans le laboratoire « le Club sandwich Studio » pour fabriquer un respirateur low-cost et low-tech. En revanche, lorsque l’on consulte leur site web (https://mur-project.org/), il est indiqué « site web en construction ». Ce dernier est peu intuitif et difficilement navigable. Tous les documents sont mis en source accessible à tous, mais sont compliqués à déchiffrer et ne peuvent pas être compris par le plus grand nombre. [8]
Figure 4 : Photo du respirateur MUR. Source : d’après [9]

Un autre respirateur existant, l’OxyGEN [9], est un dispositif d’automatisation du processus de ventilation manuelle, fabriqué par la société Protofy.xyz avec le soutien de l’hôpital Clínic, de l'Hôpital Germans Trias i Pujol et de l'UB de Barcelone. Il consiste à presser mécaniquement et régulièrement un insufflateur manuel ou un BAVU. Il est donc possible de configurer une respiration assistée comprise entre 12 et 20 tours à la minute. Dans leur dernier prototype, il est possible de configurer différents rythmes respiratoires selon les patients. Ils ont créé 2 versions de respirateurs, la version fabricant "OxyGEN-M" et la version industrielle "OxyGEN-IP".
- OxyGEN-M a été conçu pour les fabricants et peut être développé à partir d’outils courants et sans materiel ou machine particulières.
- OxyGEN-IP a été conçu pour de la production à grande échelle (échelle industrielle). Pour ce respirateur, des machines de formatage des métaux et des connaissances en ingénierie sont essentielles pour la bonne réalisation de ce dispositif.
Figure 5 : Photos des 2 projets conçus par Protofy. Source : d’après [10]

Sur les premiers prototypes, ce mécanisme de pression pour réguler la ventilation a été fabriqué avec un moteur d’essuie-glace initialement récupéré sur une vieille Peugeot 504 Ambulance alimenté par une alimentation d’ordinateur. L’OxyGEN-IP a reçu l'approbation de l'AEMPS (Agence espagnole des médicaments et des produits de santé) pour être diffusé à l’hôpital et ainsi commencer l’étude clinique sur des patients qui souhaitent y participer. Des professionnels de santé ont déjà pu valider le système et offrir un précieux retour d’informations.
Le respirateur SmithVent (figure 6) [10] est le gagnant du CoVent-19 Challenge. Ce dispositif permet d’apporter de l’air au patient de manière douce tout en pouvant contrôler le volume et la pression. La plupart des composants sont disponibles sur le marché ; il ne nécessite pas un temps de fabrication élevé. Le système physique comprend des électrovalves, un réservoir mélangeur de gaz, des capteurs de pression et de débit. De plus, l’équipe du Smith College a travaillé avec des cliniciens pour développer un produit intuitif, compréhensible, rapide d’utilisation et qui répond aux attentes et qui répond aux attentes des utilisateurs. Grâce à cela, les cliniciens peuvent reconnaitre facilement et rapidement des anomalies et ainsi agir au plus vite. Des alarmes visuelles et sonores ont également été appliquées. Les développeurs ont également pensé au design de leur produit pour qu’il soit convivial et facile à nettoyer.
Figure 6 : Modélisation du respirateur SmithVent. Source : d’après [11]

La société canadienne Haply Robotics [11] a développé le respirateur Rideau Mk II (figure 7), finaliste du Défi Respirateur Code Vie. Il respecte certaines fonctionnalités comme les modes de contrôle de pression réglable jusqu’à 1000mL et de volume réglable jusqu’à 50 cm d’eau. De plus, le nombre de respirations pour l’inspiration et l’expiration est variable entre 5 et 40 respirations par minute. Le respirateur est capable de détecter une pression redondante et le taux d’oxygène tout en permettant le contrôle de l’humidification de l’air. Ce dispositif d’assistance respiratoire polyvalente et performante est destiné à répondre aux besoins de la crise tout en étant fabriqué, déployé et utilisé rapidement dans les endroits où ils en ont le plus besoin.
Figure 7 : Photo du respirateur Rideau Mk II. Source : d’après [12]

L’Institut Fédéral de Paraná (IFPR-Brésil) [12] a conçu un respirateur qui a été élu un des 3 finalistes du Défi Respirateur Code Vie (figure 8). Ce dispositif fonctionne avec une valve de débit électromagnétique pour mesurer et contrôler le débit d’air vers le patient. L’appareil possède également une dalle tactile pour régler les paramètres du respirateur et afficher les graphiques utiles pour les médecins afin qu’ils puissent les analyser.
Figure 8 : Photo du respirateur de l’IFPR. Source : d’après [13]

Le dernier finaliste du Défi Respirateur Code Vie est le ventilateur d’urgence Lung Carburetor (figure 9) [13]. Il a été développé par une équipe de concepteurs de Montréal et de Charlevoix spécialisée sur les dispositifs médicaux et encadrée par des professionnels de santé. Ce dispositif à l’avantage d’être petit, portable, pratique et doté d’un beau design. Il s’agit d’un dispositif invasif contrôlé par pression qui génère son propre flux d’air grâce à une pompe médicale. Cette pompe peut fonctionner en autonomie sur batterie pendant environ 3 heures. Il est composé d’un écran tactile et son contrôle est possible à distance via un navigateur web par un téléphone portable ou un ordinateur. Les composants de ce dispositif sont faciles à trouver ou faciles à fabriquer à l’aide d’une imprimante 3D.
Figure 9 : Photo du respirateur Lung Carburetor. Source : d’après [14]

Pour terminer sur la présentation des respirateurs, d’autres dispositifs comme l’ApolloBVM (figure 10) [14] développé par l’Université de Rice (Texas) sont moins développés que les dispositifs présentés précédemment car ils ne possèdent pas d’écran tactile ni n’affichage de courbes qui reste une aide considérable pour les médecins. Ce dispositif sert simplement à presser un BAVU pour ventiler une personne et donc décharger un personnel soignant. Il existe deux « paddles » qui entourent le sac afin de le comprimer à un certain rythme. Un petit écran se situe au-dessus du respirateur et sert simplement à afficher le volume courant, le rythme respiratoire et le ratio inspiration/expiration. De plus, il existe trois boutons également visibles : le premier sert à allumer le respirateur, le second permet de régler tous les paramètres et le dernier est utilisé en cas d’arrêt d’urgence. Les composants sont très basiques, trouvables partout (servomoteurs, des cartes arduinos) et la compression se fait grâce à un rail d’engrenages qui avance et recule.
Figure 10 : Photo du respirateur ApolloBVM. Source : d’après [15]

Tous ces projets ont des composants différents mais répondent à des fonctionnalités communes (voir tableau ci-dessous).
Tableau 1 : Listes de composants répondant à certaines fonctionnalités d'un respirateur
| Fonctionnalités du respirateur | Composants réalisant la fonction |
| Filtrer l’air | Filtre d’air d’entrée (machine) et filtre d’air de sortie (patient) |
| Humidifier l’air | Capteur + humidificateur |
| Mélange des gaz | Réservoir mélangeur de gaz et mélangeur de gaz |
| Insuffler de l’air | Pompe à air médicale ou insufflateur manuel (bavu) avec un mécanisme de compression (exemple de l’Appollo BVM avec 2 paddles sur rails d’engrenage qui avances et recule) |
| Mesurer et contrôler le débit | Capteur ou valve de débit électromagnétique |
| Mesurer la pression | Capteur ou valve de pression (soupape de pression) |
| Réguler les paramètres et les afficher | Dalle tactile, écran LCD microcontrôleur ou affichage sur ordinateur |
| Contrôler le respirateur | Carte mère et microcontrôleur |
| Autres composants : Pneumatique : Connecteurs pneumatiques (entrée et sortie), Connecteur capteur de débit et Grille d’entrée d’air passif Électronique : Moteur (exemple de l’OxyGEN avec un moteur d’essuie-glace), Carte PCB, Tuyau du capteur de pression, Batteries, Convertisseur, Carte d’alimentation, Câble d’alimentation, Système de refroidissement, Boutons de configurations, Disjoncteur et Câbles électroniques |
Pour la plupart des projets, on retrouve tous les documents « open source » sur les plateformes citées précédemment ou sur le site internet Github. [15] Github est un site qui permet de lancer des projets de logiciels pour les développeurs, et permet également de déposer des fichiers ou archives de documents. C’est ainsi que l’on retrouve tous les documents « open source » des groupes de projet de ventilateurs. En effet, c’est un outil qui semble efficace pour partager des projets en cours ou se lancer en imitant les projets des autres. Cependant, le site ne recense pas uniquement les projets biomédicaux mais est également une plateforme ouverte à tous les entrepreneurs et développeurs du monde, dans tous les domaines. C’est pour cette raison qu’il est compliqué de cibler précisément l’innovation biomédicale que l’on recherche.
Finalement, après avoir étudié plus de 10 projets comme ceux-ci, on se rend compte que dans l’urgence de la situation, la première intention de ces collectifs ingénieurs était de proposer un moyen de fabriquer la machine rapidement et avec peu de moyens. En effet, on retrouve à chaque fois toute la documentation qui contient le matériel, les méthodes d’impression 3D, les méthodes d’assemblage etc. Cependant, il manque réellement aujourd’hui, un outil qui permet à un jeune ingénieur ou fabricant néophyte dans le domaine, de connaître les étapes à suivre et les moyens nécessaires pour concevoir et commercialiser un dispositif médical.
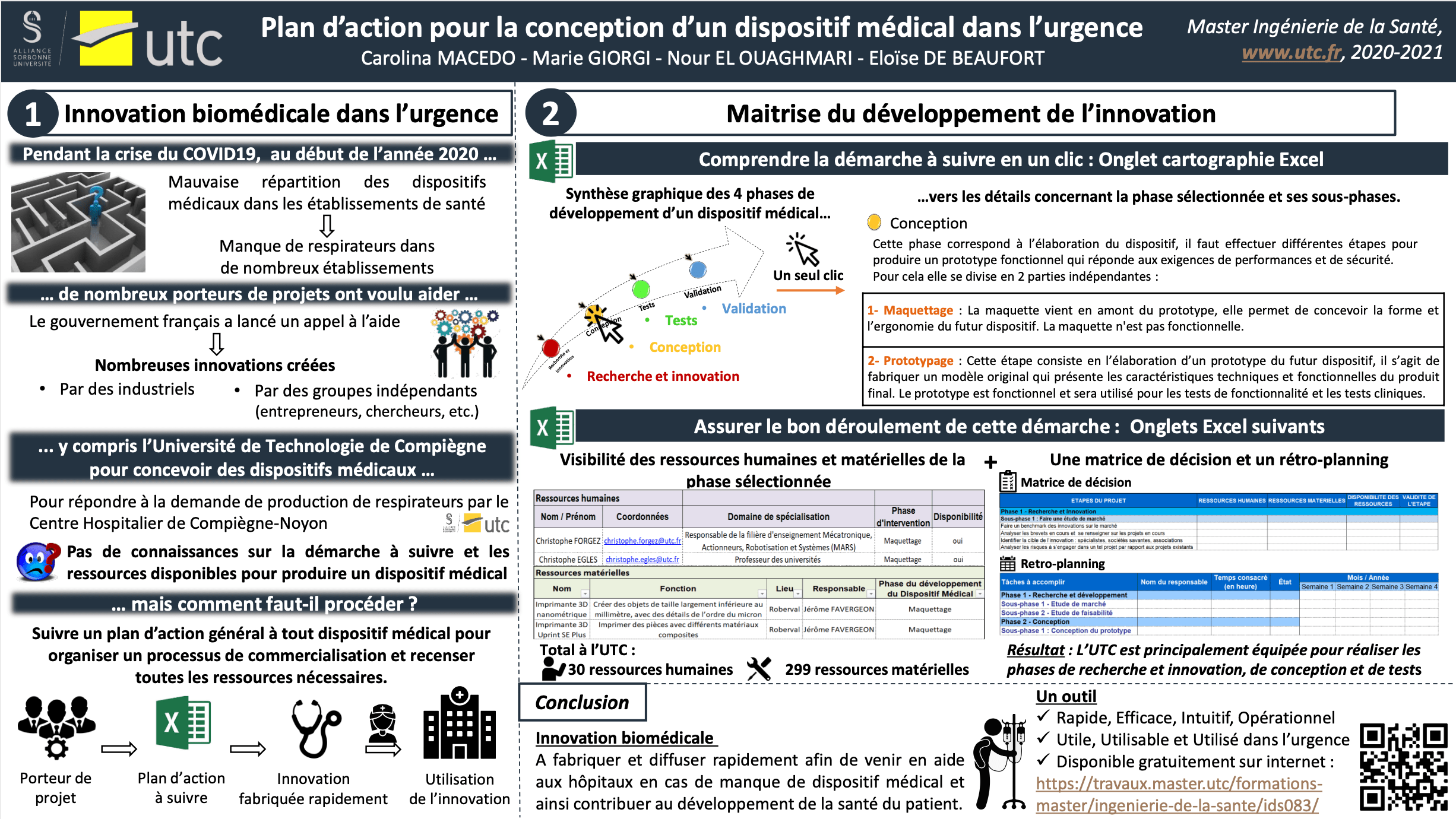
2.1. Un rappel de la physiologie respiratoire : Le cycle respiratoire
La respiration a un rôle très important et sa principale fonction est la réalisation des échanges gazeux entre l’alvéole et le sang (apporte d’oxygène et élimination de dioxyde de carbone). Pour ce faire, la respiration est faite en cycles, répartis en deux phases : l’inspiration et l’expiration, comme montré sur la figure 11.
L’inspiration est un phénomène actif où le volume thoracique augmente. Par conséquent, les pressions dans les poumons diminuent et le gradient de pression entre l’extérieur et l’intérieur des poumons est créé. L’augmentation de ce volume est dû à la contraction des muscles inspiratoires qui augmentent les dimensions de la cage thoracique [16].
L’expiration, quant à elle, est un mécanisme passif, causé par la relaxation des muscles inspiratoires et du retour à la forme initiale des poumons grâce à la compliance. On note, lors de l’expiration, une diminution du volume et donc une augmentation de la pression interne des poumons entraînant la sortie d’air. De plus, il existe l’expiration forcée : phénomène actif qui utilise les muscles abdominaux pour augmenter la pression de la cage thoracique et diminuer davantage le volume [16].
Figure 11 : Les phases du cycle respiratoire. Source : d’après [17]
2.2. Les principes de la Ventilation
La ventilation a pour but principal de décharger les muscles respiratoires de l’effort supplémentaire, celui-ci étant causé par l’essai de maintenir un cycle respiratoire normal. Les patients atteints de maladies respiratoires détiennent des muscles généralement fatigués et sont incapables de réaliser les mouvements respiratoires de façon efficace [17].
Ainsi, les ventilateurs (ou respirateurs) sont des dispositifs utilisés afin de prendre en charge le travail respiratoire du patient. Ils permettent de forcer l’entrée d’air riche en oxygène (O2) pour la réalisation des échanges gazeux et diminuent par ce biais les efforts des muscles respiratoires. Pour ce faire, les ventilateurs imposent des pressions au patient afin de réaliser le processus de la respiration.
Lorsqu’un outil pénètre le corps du patient pour créer une voie aérienne artificielle, tel qu’un tube endotrachéal ou une canule de trachéostomie, la ventilation est dite « invasive » [18]. Généralement, la ventilation invasive a lieu dans les cas d’insuffisances respiratoires aigües ou lors d’interventions chirurgicales ne pouvant pas utiliser de ventilation non invasive [19].
Au fil des années, les efforts pour diminuer la morbidité associée à l’intubation trachéale et à la ventilation ont permis à la ventilation non invasive (VNI) de voir le jour [20]. Le patient, dans ce type de ventilation, ne souffre pas de trachéotomie et ne nécessite pas de sondes d’intubation pour l’assistance respiratoire. En effet, la VNI utilise un masque à fuite ou un embout buccal. La ventilation non invasive est plus avantageuse car elle apporte plusieurs bénéfices au traitement du patient et peut être utilisée pour des cas chroniques ou aigües.
2.3. Les modes ventilatoires conventionnels
Les deux modalités basiques de ventilation délivrent une assistance respiratoire en mode barométrique ou en mode volumétrique. Le choix entre les modes est fait par le médecin et dépend de l’état de maladie du patient. Néanmoins, ils ont aussi des limitations qui sont dues à la complexité de l’interaction patient-ventilateur et ils doivent être surveillés pour éviter les barotraumatismes, par exemple [17], [20].
Le mode volumétrique d’un ventilateur consiste à délivrer au patient un volume courant à une fréquence donnée et à une période d’inspiration définie, dit temps inspiratoire (Ti). Ce mode doit assurer un volume courant (Vt) et une ventilation minute (Vt x fréquence). Toutefois, il présente des pressions de pointe plus élevées, un risque de distension gastrique ainsi que des fuites non intentionnelles en VNI [21].
Le mode spontané partiel le plus utilisé pour un volume contrôlé, est la ventilation assistée contrôlée intermittente (VACI). Ce mode assure une ventilation minute minimale pour permettre au patient de respirer spontanément. Ce mécanisme fonctionne en délivrant des cycles respiratoires obligatoires, et entre ces cycles, le patient est libre de respirer par lui-même [22].
Le mode barométrique, quant à lui, permet le réglage de la pression d’insufflation qui sera délivrée aux voies aériennes durant une période définie. Il présente comme avantage la limitation de la pression, ce qui peut éviter le barotraumatisme. En revanche, le volume courant et la ventilation minute ne peuvent pas être totalement contrôlés.
Une configuration barométrique, appelé Aide Respiratoire (AI), est très utilisée de nos jours. En utilisant ce paramétrage, le patient est capable d’imposer son propre temps inspiratoire. Plus concrètement, lorsque le débit passe à un seuil prédéfini dans la machine, l’envoi de gaz est arrêté et l’expiration peut commencer. L’AI permet de conserver, durant toutes les phases respiratoires, un degré de respiration spontanée et une meilleure synchronisation entre le patient et le ventilateur [20]. Pour la sécurité du patient, les ventilateurs actuels détiennent également un système lié à la configuration AI. En effet, lorsqu’une apnée est détectée, le ventilateur passe à un mode sécurisé avec un mode de ventilation minimal [17].
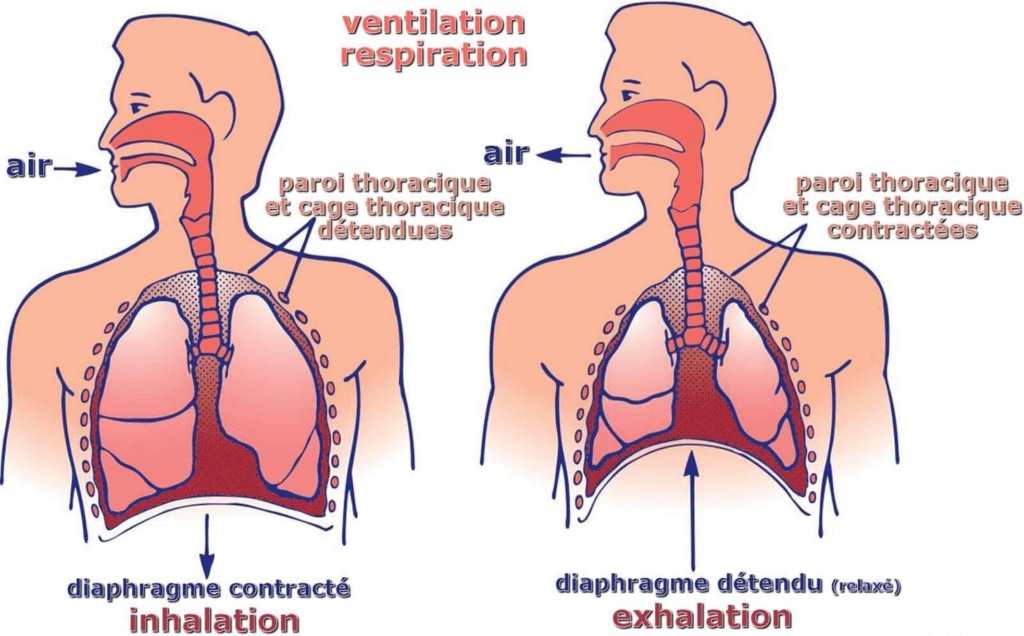
2.4. Le fonctionnement d'un ventilateur
Les ventilateurs ont pour but de prendre en charge le travail respiratoire du patient, tel qu’énoncé précédemment. Cet appareil envoie de l'air dans les poumons pour permettre l'échange de gaz. Il effectue également l'expiration en agissant comme un poumon artificiel grâce à la suppression de pression.
Plus concrètement, ce dispositif médical travail en quatre phases, comme détaillé sur la figure 12. Tout d’abord, le ventilateur surmonte les propriétés élastiques et la résistance du système respiratoire du patient pour gonfler ses poumons avec une pression ou un volume d'air approprié, selon les réglages. Puis, en arrivant à la valeur réglée de volume, de pression, de temps inspiratoire ou de volume minute, la phase inspiratoire est interrompue pour démarrer la phase expiratoire. Les poumons sont ensuite vidés progressivement. Enfin, la valve expiratoire se ferme et la valve inspiratoire s’ouvre. Le déclenchement peut être programmé par intervalle de temps, pression ou changement de débit [16].
Figure 12 : Schéma du flux d'air depuis le ventilateur jusqu'au patient. Source : auteures
2.5. Les fonctionnalités minimales d’un ventilateur
Afin de faire face à la crise sanitaire actuelle et de pallier le manque de respirateurs, quelques fonctionnalités minimales ont été établies de façon à assurer une bonne prise en charge des patients en détresse respiratoire. Ainsi, l’Organisation Mondiale de la Santé (OMS) a publié un ensemble de recommandations destinées aux pays européens pour les guider dans la gestion de la pandémie du COVID-19. Le Service National de Santé au Royaume Unie (NHS-UK) et le CONSIP S.p.A en Italie, ont également diffusé des recommandations techniques pour les ventilateurs utilisés dans les services d’urgence [23].
Tout d’abord, la ventilation doit être réalisée de façon continue et doit au minimum contenir le mode de ventilation à volume contrôlé (VC). Plus concrètement, la ventilation à volume contrôlé nécessite un volume courant et une fréquence respiratoire prédéfinie. Le volume courant est délivré pendant la période respiratoire. Ce mode est acceptable uniquement si des commandes de limitation de pression supplémentaires sont disponibles. L'utilisateur doit être en mesure de régler la limite de pression inspiratoire des voies aériennes dans la plage d'au moins 15 à 40 cmH2O, ou souhaitablement de 0 à 40 cmH2O, par incréments. Toutefois, les modes de ventilation à pression contrôlé (PC) ou de volume contrôlé à régulation de pression (VCPR) sont souhaitables [23]–[25].
De plus, la présence d’un mode d’assistance à la respiration spontanée est recommandé. Nous pouvons citer la ventilation intermittente à double niveau de pression positive (BIPAP) ou encore la ventilation en pression assistée contrôlée (P-VACI). Lorsque ce mode est fourni et que le patient arrête de respirer, le ventilateur doit basculer automatiquement en sécurité sur la ventilation obligatoire (modes VCPR, PC ou VC) [25].
Pour la pression inspiratoire des voies aériennes, il est recommandé que la pression de plateau soit ajustable et limitée à 35cmH2O. Par exception, il est possible d’ajouter une option pour augmenter la pression à une valeur de 70 cmH2O. Aussi, il est conseillé que la pression de pointe ne dépasse pas 2 cmH2O au-dessus de la pression de plateau. De façon à protéger le patient, une valve mécanique doit être intégrée et en capacité de s’ouvrir lorsque la pression monte à 80 cmH2O [25].
Au cours de l’expiration, la pression expiratoire positive (PEEP) doit être maintenue selon une valeur choisie, comprise entre 0 et 20 cmH2O. Le ventilateur, pour chaque cycle respiratoire, doit fournir un rapport inspiration : expiration (I:E) ajustable, compris entre 1:1 et 1:3 [23]–[25]. De plus, il doit fournir une plage de fréquence respiratoire de 10 à 60 cycles de respiration/minute dépendant des réglages des utilisateurs [23], [24].
Selon l’OMS, le volume de gaz s'écoulant dans les poumons pendant un cycle inspiratoire, dit volume courant (Vt), doit être réglé entre 20 et 2000 mL [24]. Toutefois, le NHS-UK exige qu’au moins un réglage de 400 ml soit disponible sur le ventilateur mais en étant possible la présence d’une plage de 250 à 800 ml [25].
Tableau 2 : Synthèse des principales fonctionnalités minimales. Source : d’après [23]–[25]
| Modes opératoires | VC : Ventilation à volume contrôlé PC : Ventilation à pression contrôlée VCPR : volume contrôlé à régulation de pression |
| Pression de plateau | Ajustable et limitée à 35cmH2O |
| Pression inspiratoire | Minimum : 15 à 40 cmH2O Souhaité : 0 à 40 cmH2O |
| PEEP | De 0 à 20 cmH2O |
| I:E | Compris entre 1:1 -1:3 |
| Fréquence respiratoire | De 10 à 60 cycles de respiration/minute |
| Vt | 20 à 2000 ml (selon l’OMS) |
2.6. Les réglementations pour les ventilateurs
Selon le règlement européen 2017/745, un dispositif médical est défini comme « tout instrument, appareil, équipement, logiciel, implant, matière ou autre article, destiné par le fabricant à être utilisé seul ou en association à l'exception des produits d'origine humaine, ou autre article utilisé seul ou en association, chez l'homme à des fins médicales précises et dont l'action principale voulue n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de tels moyens. [26].
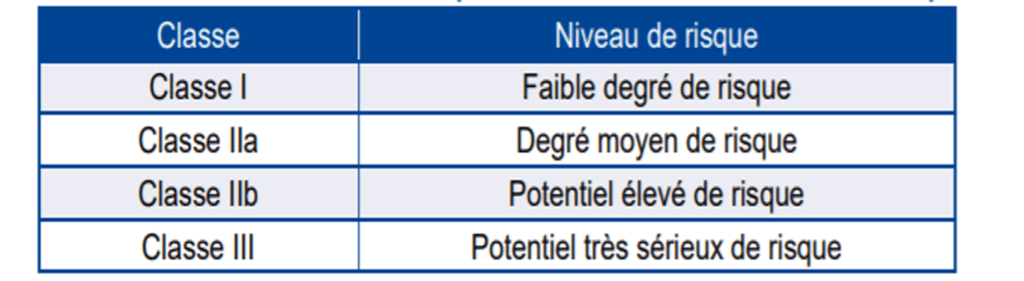
Ces dispositifs médicaux ne présentent pas le même niveau de criticité. Ainsi, la directive européenne 93/42/CE relative aux dispositifs médicaux, les divise en quatre classes (figure 13).
Point d'attention : ces classes de risques sont valables uniquement jusqu'en mai 2021, les dispositifs médicaux avec une classe de risque conforme à cette directive devront être retirés du marché en 2024.
Figure 13 : Classification des dispositifs médicaux en fonction du risque. Source : d’après [28]
Les respirateurs font partis de la classe IIb et doivent se conformer à un certain nombre d’exigences pour obtenir le marquage CE. Etant donné que nous sommes dans une situation d’urgence sanitaire, il existe une procédure pour commercialiser les DM plus rapidement. En effet, l’ANSM a mis en place un guide destiné aux professionnels de santé et aux fabricants de DM. Ce guide leur fournit les critères et informations requises pour faire une demande de dérogation et pour que celle-ci soit traitée favorablement. Cette dérogation mettra sur le marché des respirateurs non marqués CE, exceptionnellement pour répondre à la crise actuelle du COVID 19 [27].
Qui fait la demande ?
La demande de dérogation doit être effectuée par le fabricant qui met sur le marché́ le dispositif non marqué CE (ou par l’intermédiaire du distributeur), et doit être motivée par un professionnel de santé qui souhaite mettre en service le dispositif.
A qui adresser la demande ?
La demande doit être adressée à l’ANSM par courrier ou e-mail, à la direction suivante :
« Direction des dispositifs médicaux de diagnostics, des cosmétiques et des dispositifs médicaux de diagnostic in vitro »
- Adresse e-mail : dmcdiv@ansm.sante.fr
- Tél : 01.55.87.37.21
- Fax : 01.55.87.42.90
Quels dispositifs sont concernés ?
- Les Equipements de Protection Individuelle (« EPI »), qui relèvent du règlement (UE) 2016/425, tels que masques, gants, combinaisons de protection ou lunettes de protection,
- Les Dispositifs Médicaux, qui relèvent de la directive 93/42/CEE (DDM) et, à compter de sa date d’application au 26 mai 2020, du règlement (UE) 2017/745 (RDM), tels que masques chirurgicaux, gants d’examen et certaines blouses (DM de classe I).
« Pour les dispositifs médicaux, la Commission rappelle que l’article 11 § 13 de la DDM, comme l’article 59 du RDM, permet aux autorités compétentes (sur demande dûment justifiée) de déroger aux procédures d’évaluation de la conformité, même lorsque l’intervention d’un organisme notifié n’est pas requise. Traduisez : elles peuvent autoriser exceptionnellement la mise sur le marché de DM qui ne sont pas encore marqués CE, à condition d’en informer immédiatement la Commission. »
Quelles sont les conditions à remplir ?
Voici les conditions à remplir pour mettre sur le marché un DM disruptif :
- Demande clairement initiée par un professionnel de santé, nominative. Un cahier des charges écrit sera fourni et détaillé le contexte clinique
- Contexte d’urgence (le contexte de pandémie du covid-19 en est un)
- Pas d’alternative connue par le professionnel de santé ni par le fabricant
- Le rapport bénéfice/risque doit être établi
- Les différences ou similarités avec les dispositifs comparables conformes aux directives 93/42/CEE, 90/385/CEE ou 98/79/CE doivent être décrites
- On peut envisager d’utiliser des dispositifs déjà certifiés (en changeant leur destination) et des fabricants certifiés dans la catégorie de dispositifs existants
Quel est le contenu de la demande de dérogation ?
Tableau 2 : Eléments à fournir pour la dérogation. Source : Auteures d'après [27]
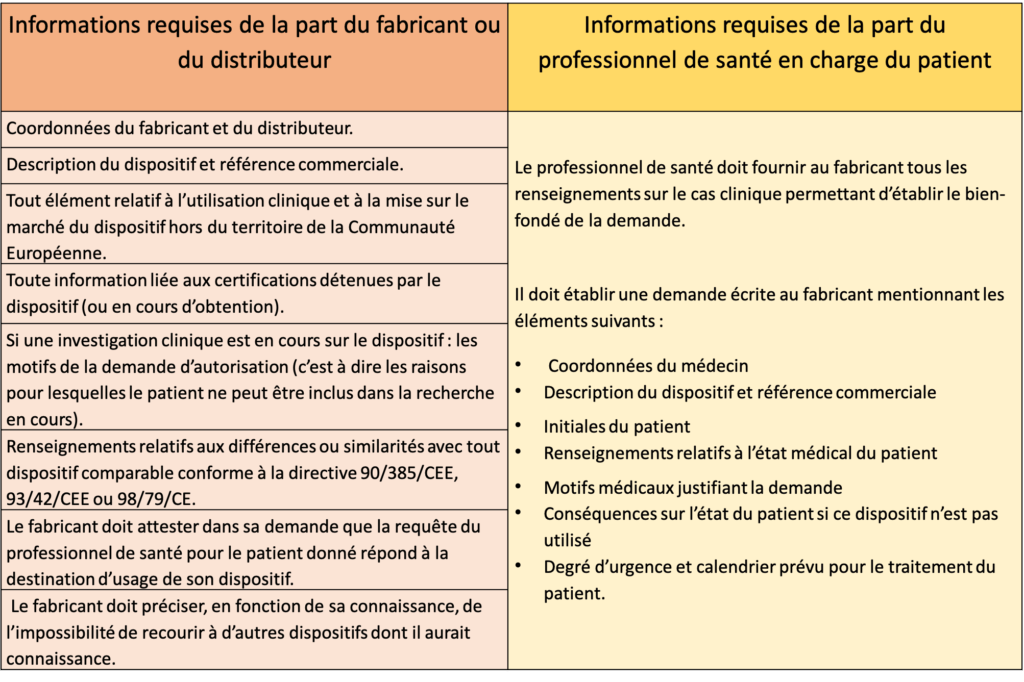
Que faire lorsque la dérogation est obtenue ?
Une fois la dérogation obtenue, le fabricant devra tenir compte des mesures complémentaires à prendre (par exemple, une limitation de la durée de dérogation) et des procédures de matériovigilance et de suivi post-commercialisation.
La procédure précise en effet que tout incident lié à l’utilisation du dispositif concerné doit faire l’objet d’un signalement auprès de l’ANSM.
En clair : les procédures de signalement de matériovigilance et de suivi post-commercialisation sont applicables pour un dispositif médical ayant fait l’objet d’une dérogation.
Parmi les normes spécifiques aux appareils électromédicaux et plus spécifiquement aux respirateurs, nous pouvons citer : la norme ISO 80601-2-12, la norme IEC 60601-1, l’IEC 60601-1-8 et l’IEC 62304.
La norme ISO 80601-2-12 s’applique à la sécurité de base et aux performances essentielles d'un ventilateur, accompagnée de ses accessoires. Elle concerne plus particulièrement les ventilateurs en environnement de soins intensifs et en établissement de soins professionnels. Il est à noter que les ventilateurs utilisés dans les soins intensifs et destinés aux transports ne sont pas considérés comme des ventilateurs utilisables dans des services d’urgence. Ils ne sont également pas considérés comme utilisant un système physiologique de commande en boucle fermé, sauf si les paramètres de ventilations sont ajustés par rapport à une variable physiologique du patient. Pour ce qui est des accessoires, ces derniers sont pris en compte lorsque leurs caractéristiques sont susceptibles d’entraver la sécurité du patient et les performances du ventilateur [28].
La norme IEC 60601-1 quant à elle, vient compléter l’ISO 80601 en exposant les exigences de base et les performances essentielles des appareils électromédicaux. Cette dernière est rédigée à trois niveaux : international, européen et français. Toutefois, les exigences énoncées demeurent identiques et ont toutes pour but ultime de réduire les risques. Cette norme exige que le fabricant définisse les performances de base et la durée de vie de l’appareil. De plus, elle encourage ces derniers à utiliser davantage de normes en lien avec la gestion du risque. L’IEC 60601-1 spécifie également qu’en cas de défaut, le dispositif doit rester sécurisé et que ces composants les plus critiques doivent être conformes à des normes particulières. La revue du dossier de gestion des risques va permettre de vérifier le respect de ces exigences [29].
La norme IEC 60601-1-8 a vu le jour suite à un rapport de l’ANSM concernant les problèmes liés aux alarmes des dispositifs médicaux. Malgré que ces dernières servent à gérer les risques liés aux DM, elles demeurent mal reconnues, perçues et utilisées. Ceci entraine des incidents sur le terrain qui pourraient largement être évités en apprenant à les utiliser et à les reconnaitre. Cette norme couvre des exigences essentielles de la directive 93/42/CEE relative aux DM. Le fabricant doit en cas de risque prendre ses précautions et intégrer un système d’alarme si nécessaire, notamment lorsque la sécurité du patient dépend de la source d’alimentation externe du DM. Les dispositifs conçus de manière à surveiller plusieurs paramètres physiologiques du patient, tel que les respirateurs, ont l’obligation d’être équipés de systèmes d’alarmes [30].
Les respirateurs détiennent des logiciels embarqués qui sont soumis à des exigences. L’IEC 62304 est une norme de sécurité fonctionnelle qui est destinée au développement et à la maintenance de tout logiciel considéré comme DM ou faisant parti d’un DM. Cette dernière énonce les exigences à respecter par les développeurs. Tout d’abord, ils doivent mettre en place un système de management de la qualité selon l’ISO 13485, puis appliquer un processus de gestion des risques suivant l’ISO 14971 et enfin attribuer une classe de sécurité à leur logiciel (classe A, B ou C) [31].
3. Le fil directeur à suivre pour un porteur de projet d’innovation biomédicale
3.1 Le processus global
Les étapes à suivre pour la commercialisation d’un DM ou d’une innovation de rupture sont nombreuses et doivent être suivies méticuleusement par le porteur de projet. Le processus complet se divise en plusieurs phases et sous-phases à suivre dans l’ordre chronologique indiqué.
Voici sur la figue 14, le processus global à suivre pour l’utilisateur, qui reprend le cycle de vie d’un dispositif médical :
Figure 14 : Processus global à suivre pour la commercialisation d'une innovation de rupture. Source : auteures
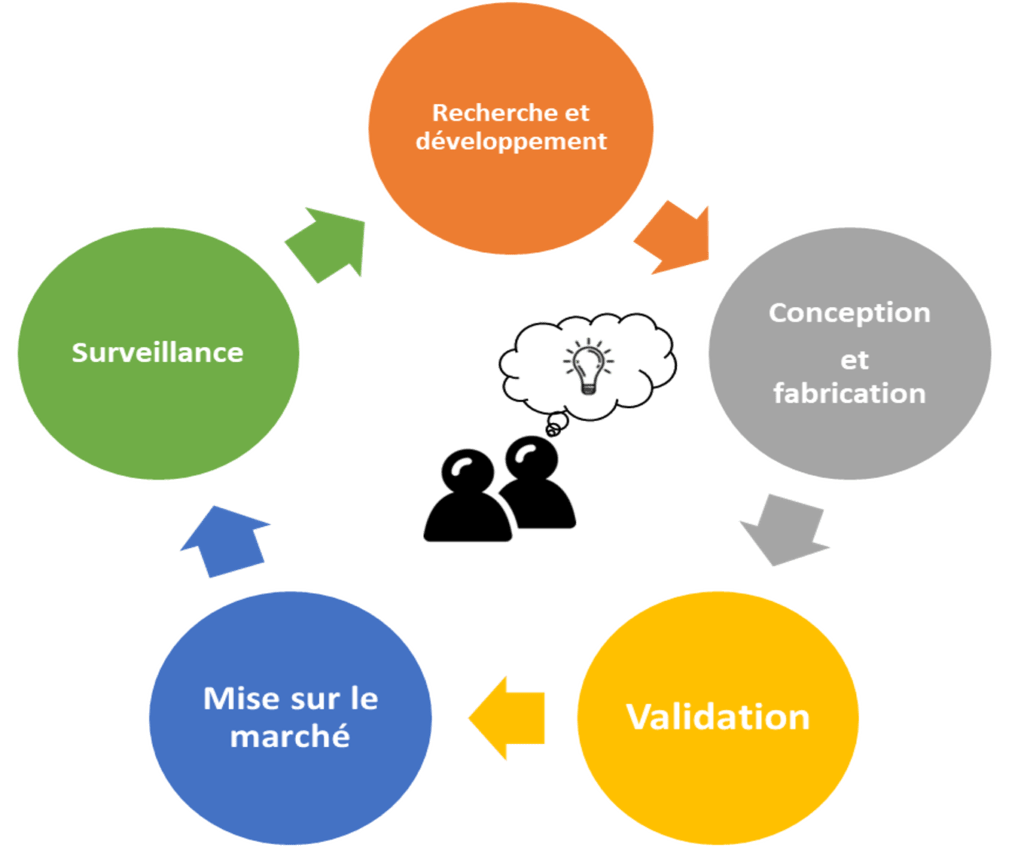
Une fois le processus global bien compris et intégré, l’utilisateur doit diviser chaque sous-phase de son projet en étapes. Voici les étapes détaillées à suivre pour tout porteur de projet, en fonction du schéma de la figure 14 :
| Phase 1 – Recherche et développement |
| Sous-phase 1 - Etude de marché |
| Benchmark |
| Analyser des brevets en cours à l’INPI |
| Identifier les associations d’usagers concernées par ce DM et les corporations médicales concernées |
| Analyse des risques par rapport à l’existant |
| Sous-phase 2 - Etude de faisabilité |
| S’assurer que l’idée d’innovation est un DM au sens de la réglementation (EPI ou autre) |
| Orienter le domaine d'application du DM |
| Cibler les pathologies |
| Définir la classe du DM : annexe du règlement européen 2017/745 pour un DM |
| Identifier la stratégie de certification et ses dérogations possibles. |
| Choisir la procédure de marquage CE à mettre en place pour le futur DM |
| Organisme notifié désigné et surveillé par l'ANSM |
| Identifier les exigences spécifiques (risques, bénéfices, en fonction de la classe définie) au DM et les normes applicables au futur DM |
| Phase 2 – Conception |
| Sous-phase 1 - Conception du prototype |
| Développer un prototype (cf dossier de fabrication) |
| Analyse des risques (14971 v.2019) |
| Analyse bénéfices/risques (XP S 99-223) du nouveau procédé pour commencer les recherches et finaliser le prototype |
| Sous-phase 2 - Etude de préindustrialisation et lancement d'une présérie |
| Identifier les prestataires fabricants |
| Dossier de fabrication : composants, étapes pour construire et fabriquer le DM |
| Phase 3 – Validation |
| Sous-phase 1 – Tests |
| Essais de fonctionnalité pour validité |
| Développer une série de DM pour les Tests : validation du prototype |
| Tests cliniques pour s’assurer qu’il réponde aux attentes médicales : recherche |
| Réaliser les essais techniques sur le DM : veiller au respect des exigences de l’ISO 60601-1 |
| Sous-phase 2 - Evaluation clinique de la présérie |
| Obtenir l’autorisation pour effectuer les essais pré-cliniques avec DM tel qu’il serait vendu |
| Dossier avec les résultats des essais pré-cliniques, compléter le rapport de conformité aux normes |
| Obtenir l’autorisation de l’ANSM pour faire des essais cliniques |
| Réaliser les essais cliniques : déterminer les Contre-indications, effets secondaires, effets physiologiques non manifestes pour la DT |
| Phase 4 – Mise sur le marché |
| Sous-phase 1 - Lancement de l'industrialisation |
| Produire les DM |
| Préparer les commandes |
| Faire un stock |
| Obtention de l'IUD |
| Enregistrer le dispositif et le fabricant dans Eudamed |
| Sous-phase 1bis - Le marquage CE |
| Rédiger la documentation technique |
| Contacter l’organisme notifié |
| Faire un audit du SMQ 13485 |
| DM disruptif en attendant le marquage CE : dérogation ANSM |
| Sous-phase 2 - Remboursement |
| Remboursement LPPR |
| Phase 4 - Surveillance |
| Sous-phase 1 - Suivis et audits |
| Surveillance par l’ANSM LNE-gmed en france |
| Suivi clinique après commercialisation (SCAC) du DM dans l’établissement de santé /contrôles qualité |
| SAC : suivi après commercialisation |
| Audits inopinés : marquage CE |
| Audits de suivi |
| Sous-phase 2 - Finalité du projet |
| Maintien du marquage pendant 5 ans |
| Réforme à la fin du cycle de vie du DM |
| Retour d'expérience |
3.2 Le processus à suivre avant la commercialisation
Pour ce projet, il s’agit de se focaliser sur les phases intervenant dans la conception du dispositif avec les ressources humaines et matérielles nécessaires. Ainsi, 4 grandes phases ont été identifiées pour faciliter les étapes de conception afin que le porteur de projet puisse anticiper l’industrialisation et la commercialisation.
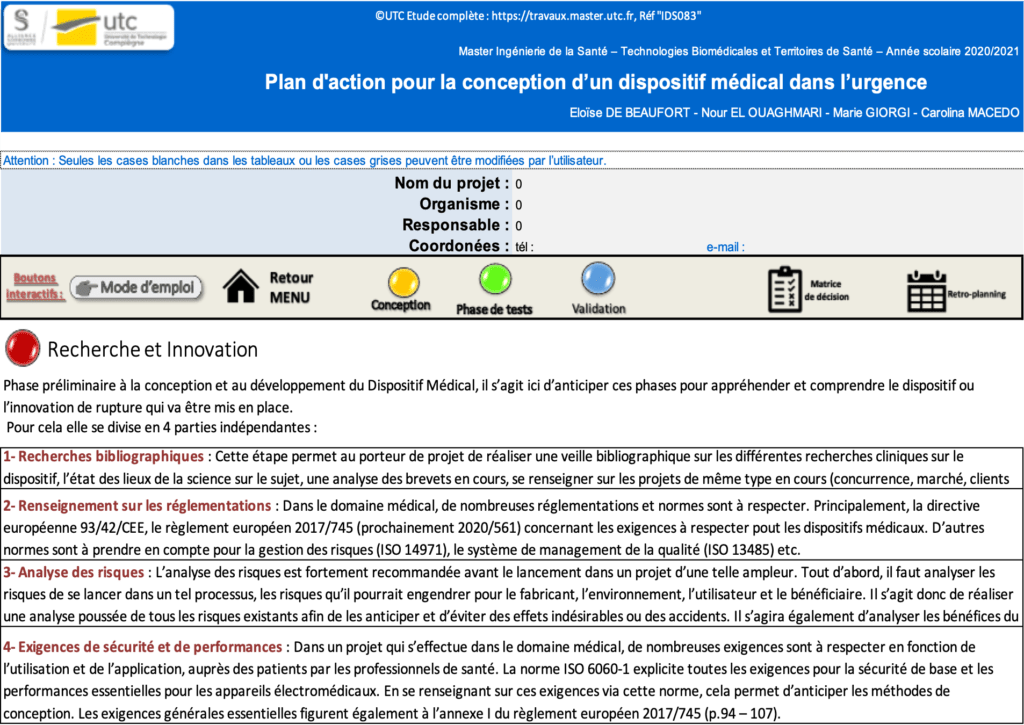
Phase 1 : Recherche et innovation => Cette phase permet au porteur de projet d’effectuer toutes les recherches bibliographiques nécessaires sur son dispositif, de recenser toutes les normes et réglementations qu’il doit respecter, de se renseigner sur les exigences que son produit doit respecter et faire une analyse des risques avant de se lancer. C’est donc une étape préliminaire à la conception de l’innovation, qui permet d’appréhender le projet, de se l’approprier et d’être informé sur les aspects des réglementations et des exigences qu’il devra respecter.
Phase 2 : Conception => Cette phase est dédiée à la conception d’une première maquette et/ou d’un prototype. Il s’agit alors de réunir les ressources matérielles électroniques et mécaniques disponibles qui pourront servir à fabriquer un premier prototype de l’innovation ou du dispositif médical. L’utilisateur devra donc à cette étape être capable de fabriquer les premiers prototypes fonctionnels pour effectuer des tests.
Phase 3 : Tests => Cette phase regroupe tous les tests à effectuer sur les prototypes fabriqués à l’étape précédente. Il s’agit donc d’effectuer des bancs de tests pour s’assurer que le produit conçu est fonctionnel en fonction de l’utilisation prévue, qu’il répond aux exigences de sécurité et de performances et qu’il est conforme aux attentes médicales. Il s’agit également ici, d’effectuer des essais pré-cliniques et cliniques pour son utilisation auprès des patients par des professionnels de santé.
Phase 4 : Validation des procédés => Cette phase permet de valider tous les essais effectués au préalable. Cette validation peut s’opérer dans les établissements de santé volontaires pour participer aux essais par les professionnels sur leurs patients. Il s’agit donc ici de s’assurer que l’établissement est prêt à effectuer ses tests en conditions réelles. Si les tests sont concluants, il s’agira ensuite de lancer une présérie, initiatrice d’une industrialisation et d’une diffusion.
En effet, en respectant ces étapes et en réunissant toutes les données nécessaires à son projet, le fabricant ou l’institution pourra lancer une plus grande série de dispositif et viser l’industrialisation. L’utilisateur se situe à la fin de l’étape « Validation » du cycle présenté à la figure 14, la prochaine étape concerne la mise sur le marché de son produit rendant possible son utilisation à des fins médicales dans l’établissement demandeur. Pour la suite du processus, il devra faire appel à des prestataires afin d’assurer la production de ce dispositif en grande quantité.
Chapitre 2 – Démarche à suivre pour la mise en place d’une innovation biomédicale
1. La démarche pour comprendre l’outil
Pour prendre en main l’outil proposé, le porteur de projet doit bien avoir en tête son idée d’innovation et la démarche qu’il va entreprendre pour la commercialiser. L’idée est qu’il puisse avoir un appui opérationnel de toutes les étapes à suivre validées, et faire un suivi personnalisé de son projet. Cet outil permet alors une auto-évaluation de l’utilisateur dans son processus de conception d’une innovation de rupture. Ce dernier est adaptable à chaque personne, quelles que soient ses qualifications ou son rôle dans le projet. L’idée est de pouvoir partager à tous les participants l’état d’avancement du projet, les étapes qu’il reste à valider et les délais à respecter.
Une fois que l’utilisateur s’est approprié l’outil, ce dernier sera capable de réunir toutes les ressources dont il dispose et dont il a besoin aux différentes étapes de son processus de conception d’une innovation de rupture. Il pourra compléter le tableau d’état d’avancée de son processus pour avoir une vision globale des étapes validées, en cours ou à faire. Ce classeur Excel lui permet de recenser toutes les ressources disponibles pour l’aider dans son processus, que ce soit des ressources humaines et/ou matérielles, et également faire un bilan à chaque phase pour se repérer dans le processus.
L’utilisateur a à disposition un format de retro-planning vierge dans le classeur Excel, qui lui permet de remplir toutes les étapes à réaliser et de les placer dans le temps qui lui est imparti. Cela lui permet de planifier au moment de se lancer dans le projet des dates limites à respecter et d’avoir une vision globale de sa progression tout au long des étapes du cahier des charges.
2. Comment fonctionne l’outil ?
L’outil est composé de 8 onglets sous format de classeur Excel.
Sur la première page se trouve un mode d’emploi des 4 onglets suivants avec un descriptif des tableaux et des échelles d’évaluation à prendre en compte dans son projet. L’utilisateur peut cliquer sur l’intitulé qu’il souhaite pour y arriver directement ou cliquer sur les onglets du classeur.
Pour tous les onglets, l’utilisateur doit rentrer les métadonnées qui correspondent à son projet : nom, coordonnées, dates. Une fois que le nom du projet est écrit sur la première page, il est automatiquement enregistré sur les autres pages du document.
L’utilisateur dispose également à chaque onglet d’un menu interactif avec des boutons qui mènent directement à la page souhaitée, sans avoir à passer par les onglets Excel.
Le mode d’emploi est accessible en cliquant sur le bouton :

La matrice de décision et le retro-planning sont accessibles en cliquant sur ces boutons :


Voici sur la figure 15, un aperçu du mode d’emploi qui réexplique toutes les parties du classeur, leurs fonctions ainsi que les échelles d’évaluation de la matrice de décision et du rétroplanning.
Figure 15 : Aperçu du mode d'emploi de l'outil. Source : auteures

2.1 La cartographie
Le premier onglet de l’outil présente une cartographie interactive. C’est ici que sont présentées les 4 phases principales de développement d’un dispositif médical. L’interaction de ce menu permet à l’utilisateur de se rendre sur les différentes phases et d’avoir un descriptif du rôle de la phase et des ressources disponibles pour l’effectuer.
Sur le menu de la cartographie, se présentent les 4 phases identifiées précédemment sous forme de bouton. A chacune de ces phases, correspond les étapes du processus que l’utilisateur doit valider. Cette partie de l’outil a pour vocation d’être utilisée comme résumé de tout le plan d’action du porteur de projet. Il présente les phases du cycle de vie du dispositif médical sur lesquelles l’utilisateur peut intervenir et les étapes qu’il doit valider au fil de son processus.
Sur la figure 16, l’utilisateur peut cliquer sur n’importe quelle phase à tout moment de son processus s’il a besoin des renseignements qui lui sont associés.
Cette cartographie est adaptable pour tous. Elle présente un aspect générique du processus à suivre pour le porteur de projet et le mène à des tableaux qui présentent les ressources humaines et matérielles identifiées qui répondent aux attentes de la phases. Les ressources humaines sont des personnes avec des connaissances et une expertise suffisante pour assurer le bon déroulement d’un projet d’innovation biomédicale. Les ressources matérielles sont des logiciels ou machines qui peuvent intervenir dans la conception d’un dispositif médical, au stade de maquette ou de prototype.
Figure 16 : Aperçu de la cartographie interactive de l'outil. Source : auteures
2.2 La matrice de décision
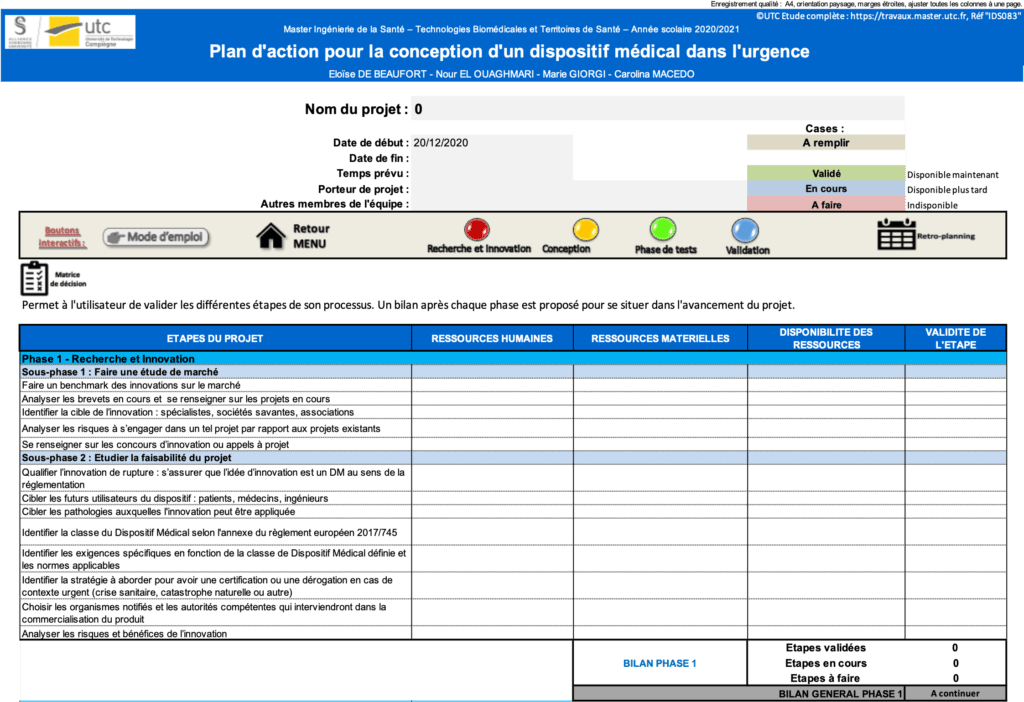
Le 7ème onglet est constitué d’une matrice de décision (figure 17) qui permet à l’utilisateur d’avoir toutes les étapes détaillées (figure 14) dans un tableau avec les ressources matérielles et humaines nécessaires pour la validation de l’étape correspondante. L’utilisateur peut également évaluer la disponibilité des ressources nécessaires, ce qui permettra de valider ou non l’étape en cours. A la fin de chaque phase, l’utilisateur doit faire un bilan pour valider ou non le passage à l’étape suivante. Le bilan de la phase indique le nombre d’étapes validées, en cours ou à faire, ce qui permet à l’utilisateur de se situer dans sa phase. Le bilan général quant à lui, donne une information à l’utilisateur pour savoir s’il peut avancer dans son processus ou si des actions à mener dans sa phase sont encore à valider.
Figure 17 : Aperçu de l'utilisation de la matrice de décision. Source : auteures
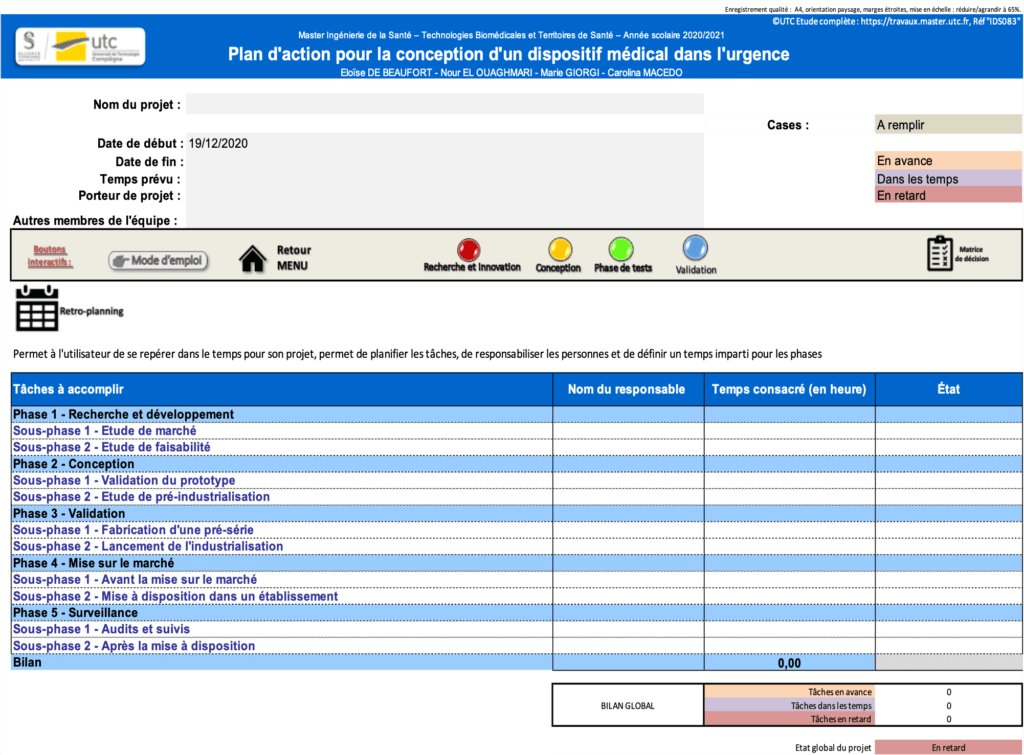
2.3 Le retro-planning
Le dernier onglet est constitué d’un retro-planning (figure 18). En premier lieu, l’utilisateur doit remplir les métadonnées requises, et principalement les dates pendant lesquelles il souhaite réaliser son projet. Le tableau à remplir permet au porteur de projet de responsabiliser les différents membres de son équipe ou les participants au projet sur les différentes étapes de son processus. Chaque étape doit donc avoir un responsable, un nombre d’heures correspondant et donnera lieu à un état d’avancement (en avance, dans les temps ou en retard). Le nombre de phases en avance, dans les temps ou en retard est calculé automatiquement en bas du retro-planning. Ceci permet à l’utilisateur de se situer dans le temps et d’adapter ses prochaines étapes en fonction de ce facteur temps. Ce retro-planning permet d’avancer un projet semaine par semaine sur plusieurs mois. Ainsi, l’utilisateur peut alors remplir au fur et à mesure les semaines qui passent pour se repérer correctement dans son calendrier.
Figure 18 : Aperçu du retro-planning. Source : auteures
3. Méthodologie de recensement des ressources
De façon à recenser les ressources humaines et matérielles, dans le cadre du développement d’une innovation biomédicale de rupture au sein de l’Université de Technologie de Compiègne (UTC), quelques actions ont été réalisées. Ces actions peuvent servir d’exemple de recensement pour tout porteur de projet qui ne connait pas la totalité des ressources dont il dispose.
3.1 Les ressources humaines
La première d’entre elles a été de réunir, sous forme de tableau Excel, les données présentes dans les annuaires des laboratoires au sein de l’UTC et qui sont disponibles sur le site internet (www.utc.fr). Pour certaines ressources humaines, des recherches google ont été réalisées en utilisant la structure « NOM, Prénom + nom du laboratoire + UTC », afin de pallier aux informations manquantes.
Toutefois, ce premier recensement n’assure pas que toutes les personnes personnes soient prêtes à s’engager dans ce projet d'innovation de rupture. Ainsi, il est nécessaire de mettre en place d’autres actions. En premier lieu, il s’agit d’un questionnaire en ligne qui a été créé et envoyé aux ressources humaines recueillies (figure 19). Ce formulaire est composé d’une présentation du projet, de deux questions concernant les coordonnées et de onze questions faisant référence à l’implication et au rôle de la personne dans le développement d’une innovation biomédicale de rupture. Parmi ces dernières nous pouvons citer :
Figure 19 : Aperçu du questionnaire de recensement des ressources. Source : auteures
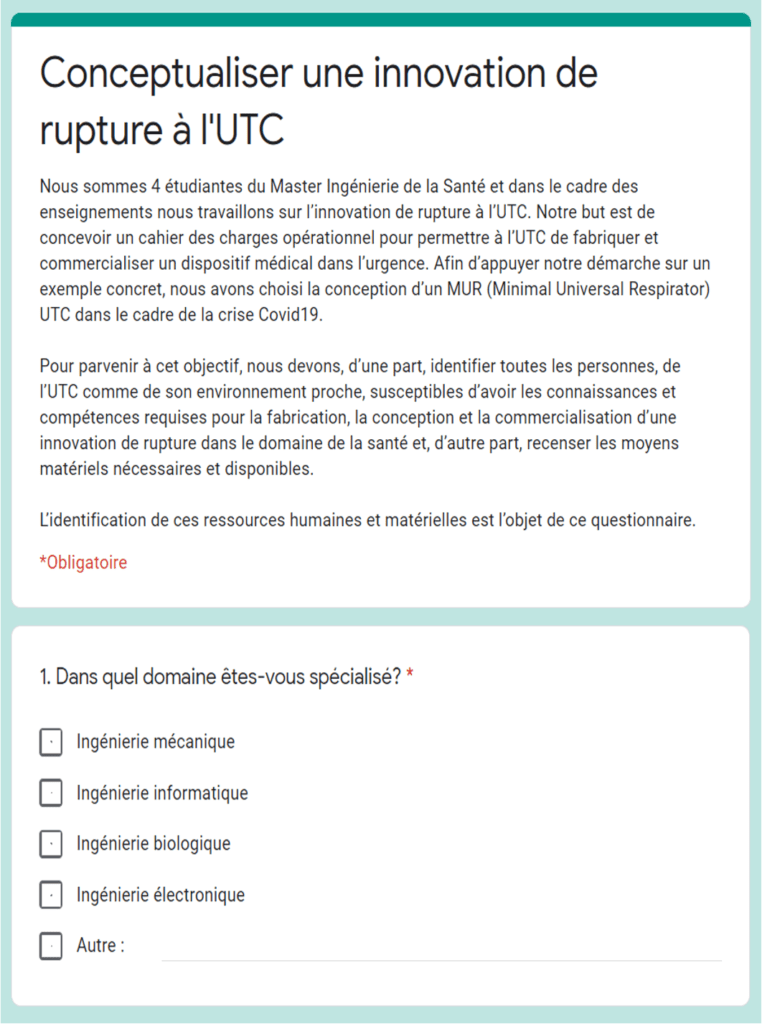
- Dans quel domaine êtes-vous spécialisé ?
- Avez-vous des ressources matérielles mécaniques qui permettraient de fabriquer une innovation technologique ?
- Avez-vous des ressources matérielles électroniques qui permettraient de fabriquer une innovation technologique ?
- Etes-vous déjà intervenu dans la conception d'un dispositif ? Si oui, à quelle étape ?
- Etes-vous déjà intervenu dans la conception d'un dispositif médical en particulier ? Si oui lequel ?
- Pourriez-vous avoir un rôle dans la conception ou la commercialisation d'un DM ?
- Etes-vous spécialisé dans un DM en particulier ?
- Avez-vous des compétences utiles pour intervenir sur d'autres DM ? Si oui, quel(s) DM et quel(s) domaine(s) d'intervention ?
- Si vous n’êtes pas en lien avec les DM, pensez-vous dans le cadre de votre activité pouvoir fournir de l’aide pour ce projet ? (étude de marché, sourcing, logistique, lancement de projet, distribution, main d’œuvre etc.).
- Si oui, en quoi pourriez-vous nous aider ?
- Seriez-vous intéressé de participer à ce projet ?
Face à un taux de réponse de 11,6% (7 réponses sur 60 questionnaires envoyés), d’autres questionnaires plus personnalisés ont été envoyés à des personnes ayant directement les fonctions recherchées. Cette méthode s’est avérée plus efficace avec un taux de réponse de 58,8% (10 réponses sur 17 questionnaires envoyés). On en conclut donc qu’un questionnaire plus spécialisé en fonction de la profession de la personne est plus efficace. En effet, la personne se sent directement concernée par les questions posées et répond plus facilement. D’autre part, les questions sont mieux ciblées et permettent ainsi de mieux s’adapter au projet et de renseigner des informations plus précises.
Voici sur la figure 20, un exemple de questionnaire à personnaliser et à envoyer :
Figure 20 : Exemple de questionnaire à envoyer. Source : auteures
![Zone de Texte: Bonjour Monsieur/Madame [NOM],
Je suis [Prénom/NOM], [situation professionnelle] et je me permets de vous contacter sur les conseils de [Prénom/NOM].
Je fais partie [explications du projet]. Notre but est de [explications de l’objectif du projet].
Pour parvenir à cet objectif, [Explications en quoi cet interlocuteur peut intervenir dans le projet, pourquoi son aide est importante].
Ainsi, je vous contacte aujourd’hui pour savoir si vous seriez susceptible d’intervenir et de m’aider dans ce projet. Je vous serais reconnaissante si vous pouviez répondre aux questions ci-dessous
• Seriez-vous prêt.e à participer à un tel projet s’il venait à se concrétiser ?
• A quelle étape du cycle de vie pourriez-vous intervenir (se référer à la liste ci-dessous) ?
1/ Recherche et innovation (sourcing, bibliographie, règlementation, évaluations précliniques)
2/ Conception/Fabrication (maquettage, prototypage/électronique/mécanique, tests techniques, tests de sécurité, règlementation, essais cliniques)
3/ Tests (utilisation de bancs de test, mesure de la performance/incertitudes)
4/ Validation (tests cliniques, règlementaire)
• Avez-vous des ressources (matérielles, organisationnelles, documentaires, etc.) à mettre à disposition ?
En vous remerciant par avance de votre aide.
Bien cordialement,
[Prénom NOM]](https://travaux.master.utc.fr/wp-content/uploads/sites/16/2020/12/ids083-figure20-1024x705.png)
Ainsi, toutes les ressources obtenues par le biais de ces questionnaires et entretiens, ont été recensées dans des tableaux en fonction de plusieurs critères.
Les ressources humaines sont classées selon :
- Le nom et prénom
- Les coordonnées (adresse mail)
- La fonction (profession, statut)
- La phase du projet dans laquelle elle peut intervenir
- La disponibilité : Oui si la réponse est positive, NR (Non renseigné) si la réponse n’est pas claire ou que la personne n’est pas convaincue par la faisabilité de ce projet.
3.1 Les ressources matérielles
Néanmoins, le premier questionnaire avait aussi pour objectif de réunir des informations sur les ressources matérielles dont l’UTC dispose. Les questions 2 et 3 traitent de ce sujet.
Une quatrième action a été menée pour rassembler les ressources matérielles à l’UTC. Un entretien avec Nicolas Piton : ingénieur d’innovation responsable du FabLab (Laboratoire de Fabrication et Association de l’UTC) ; et Benjamin Fidelaine : ingénieur au service électronique de l’UTC. Au cours de cet entretien, plusieurs points sur le développement des dispositifs médicaux au sein de l’UTC ont été soulevés. De plus, les matériaux dont ces deux services disposent ont été recensés. Un deuxième entretien a eu lieu avec Jérôme Favergeon, le responsable du laboratoire Roberval, afin d’obtenir un inventaire de toutes les machines dont il dispose dans son laboratoire afin de les classer par rapport aux différentes phases de la cartographie. Cette méthode d’entretien s’avère être très efficace car elle permet d’avoir directement les informations recherchées grâce à des partages de documents.
Ainsi, toutes les ressources obtenues par ces deux méthodes sont recensées dans un tableau, situé sous le tableau des ressources humaines de la phase correspondante. Elles sont classées selon 5 critères :
- Le nom (de la machine, du site internet ou du logiciel)
- La fonction (l’utilité de la machine)
- Le lieu (où trouver la machine, ici à l’UTC)
- Le responsable (pour savoir qui contacter en cas de besoin)
- La phase de développement du dispositif médical dans laquelle elle peut intervenir
De manière à bien classer le matériel recensé, il faut s’assurer de la fonction qu’il opère afin de le positionner dans la bonne phase et de s’assurer qu’il apporte une réelle plus-value dans un projet de conception d’un dispositif médical.
Il est également primordial de s’assurer de la disponibilité de la ressource lors de l’élaboration du projet, et de s’assurer de la capacité à l’utiliser. Dans le cas où le porteur de projet ne connait pas la machine, il faudra impérativement que le responsable ou une personne habilitée à son utilisation puisse superviser l’étape.
Chapitre 3 – Une cartographie Excel qui présente les résultats de l’étude
1. Les ressources humaines et matérielles
Pour présenter les résultats de l’étude, une cartographie interactive sous format Excel est à disposition de l’utilisateur. Elle se présente en quatre parties distinctes en fonction des phases de conception du projet. Chaque phase a été divisée en sous phase qui correspond à une étape à valider pour mener à bien le projet d’innovation biomédicale. Ainsi, à chaque sous-phase il est proposé deux tableaux qui recensent les ressources humaines et matérielles qui correspondent à cette étape. Les ressources utilisées et présentées dans la cartographie interactive sont celles de l’UTC, un format vierge de tout le classeur Excel est également disponible pour que chaque personne puisse l’adapter à son projet.
Par exemple, en cliquant sur le premier bouton « Recherche et innovation » l’utilisateur est mené vers un deuxième onglet qui présente les étapes correspondantes à valider. Sur la figure 21, on observe que 4 sous-phases sont à effectuer pour cette première étape de « Recherche et innovation ». Ce sont des étapes préliminaires qui permettent au porteur de projet et à son équipe de se renseigner sur les autres projets en cours, sur le marché, les règlementations et les risques qu’ils encourent à se lancer dans un tel projet.
Figure 21 : Aperçu de la présentation de la phase Recherche et Innovation
Directement sous les explications des étapes, l’utilisateur dispose des deux tableaux qui présentent les ressources humaines (figure 22) et matérielles (figure23) correspondant à l’étape. C’est donc à l’utilisateur de s’approprier les ressources identifiées, ici sont présentées les ressources de l’UTC. Cependant, ces tableaux sont adaptables à toutes les organisations qui disposent de telles ressources.
NB : NR = non renseigné
Figure 22 : Aperçu du tableau des ressources humaines de la phase Recherche et innovation, source : auteures

Figure 23 : Aperçu du tableau des ressources matérielles pour la phase Recherche et Innovation, source : auteures
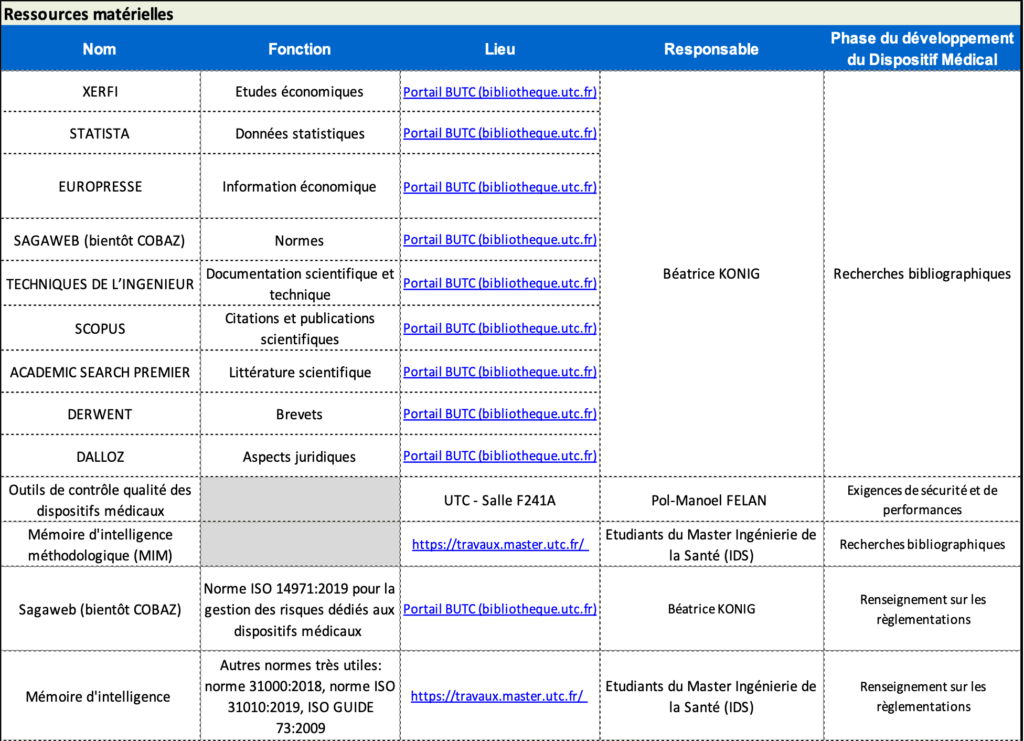
De cette manière, les tableaux présentent les résultats des ressources humaines recensées par l’utilisateur en deux parties : les ressources humaines (personnes à contacter) et les ressources matérielles. Ainsi, l’utilisateur peut avoir un accès direct aux informations essentielles pour son projet et donc être opérationnel dans l’urgence.
2. Les résultats attendus de l’utilisation
La cartographie Excel permet de répondre à plusieurs attentes. Tout d’abord, son principal atout est le gain de temps et son intuitivité. C’est un outil facile à prendre en main avec un mode d’emploi qui explique son fonctionnement, intuitif grâce à son code couleur employé pour différencier les phases et ses boutons précisément explicités. C’est également un outil qui nécessite peu de temps de lecture, comportant uniquement 4 pages et ciblant les informations clés.
Il est important de comprendre que les outils proposés ont été réalisés dans le cadre d’une étude faite à l’UTC. En effet, les personnes recensées travaillent à l’UTC ou dans son environnement proche et les machines mentionnées sont celles des différentes plateformes ou laboratoires de l’UTC. Les coordonnées des personnes ne peuvent être utilisés uniquement si l’UTC donne l’autorisation de rendre public les documents. Pour le matériel, étant dans les locaux de l’université, ils pourront être utilisés uniquement si le responsable donne son autorisation. Le réel objectif de l’outil est interne à l’UTC, de manière à avoir un recensement de tout ce qu’il se trouve dans 6 laboratoires existants :
- Le laboratoire BMBI (Biomécanique et Bioingénierie)
- Le service d’analyses physico-chimiques (SAPC)
- Le Fablab
- Le laboratoire d’électromécanique
- Le service électronique
- Le laboratoire Costech
- Le laboratoire Roberval
Les personnes recensées sont des enseignants, chercheurs ou ingénieurs qui travaillent à l’UTC et qui se rendent disponibles pour un projet en interne. En effet, l’objectif principal de cette étude est donc de pouvoir rendre opérationnel la conception d’un dispositif médical « UTC » ou toute autre innovation du domaine biomédical, au même titre qu’un M.U.R aurait pu être fabriqué lors de la demande en mars 2020. L’UTC est à présent prêt à recevoir une telle demande, et pourra réunir rapidement toutes les ressources nécessaires pour fabriquer et faire valider un tel dispositif. Actuellement, l’UTC dispose de 29 personnes capables et prêtes à s’engager dans un tel projet et 289 ressources matérielles identifiées et localisées. L’accès à ces données est à présent unique, un seul fichier est nécessaire pour accéder à toutes les ressources. Cela évite alors au porteur de projet de multiplier les fichiers et lui permet de tout rassembler à un seul endroit.
Concernant les résultats de l’étude, il semble évident que l’UTC est en capacité d’intervenir dans les étapes de recherche, innovation, conception et certaines phases de tests pour le cycle de vie d’un dispositif médical.En revanche, il manque des ressources internes pour la réalisation des essais cliniques ainsi que pour le regroupement et la validation des données dans le dossier technique. Pour cela, il faudrait envisager des partenariats extérieurs avec des experts possédant les ressources et des établissements certifiés pour réaliser ce type de tests.
Par ailleurs, cet outil est entièrement adaptable à toutes les organisations. Il est alors disponible en format vierge et modifiable afin que toutes les personnes en capacité de réunir des ressources dans le domaine du biomédical puissent le faire de façon opérationnelle. L’outil Excel est un outil générique et pérenne, qui peut être modifiable à tout moment par le porteur de projet et son équipe. La matrice de décision ou le retro-planning sont des outils utilisés dans tout projet donc cela permettra un gain de temps considérable pour l’organisation qui conçoit le dispositif.
La cartographie est également disponible vierge, elle permet à l’utilisateur d’avoir le fil directeur de son processus et de remplir directement les tableaux correspondant aux ressources. Il pourra ainsi transmettre rapidement et efficacement les informations sur son projet aux membres de son équipe ou ses partenaires dans le projet.
Finalement, quelle que soit l’utilisation visée de cet outil, il permet un gain de temps considérable dans un projet d’innovation biomédicale, une opérabilité directe et une transmission d’information claire entre les acteur du projet. C’est donc pour ces raisons que chacun peut s’approprier les outils proposés et les adaptés à son équipe et son projet.
3. Les risques anticipés et les alternatives envisagées
2.1 Les risques anticipés
Dans un processus de fabrication et de mise sur le marché d’une innovation de rupture ou d’un dispositif médical de nombreux risques sont à prendre en compte et à anticiper. Il faut donc veiller au suivi méticuleux de toutes les étapes pour ne rien manquer et avoir un projet viable et concret.
Le risque principal à éviter est l’oubli ou le manque de rigueur. Dans un tel projet, il parait indispensable d’être méticuleux dans les tâches à effectuer pour ne rien omettre et rendre un projet concret et valorisable. Pour pallier ces éventuels oublis, le retro-planning permet de fixer les dates limites et de se rendre compte de l’avancée du projet. Pour les oublis en termes de ressources, l’utilisateur remplit le tableau « matrice de décision » qui lui permet d’avoir un récapitulatif de toutes les étapes du processus et de leur donner un état d’avancement. Ces outils seront efficaces si chaque membre du projet les utilise consciencieusement et régulièrement. Il est donc nécessaire au début et à la fin de chaque étape de mettre à jour le document pour que le suivi des tâches soit efficace.
Un deuxième risque important à anticiper dans un tel projet est le manque de ressources. Malgré le recensement de toutes les ressources humaines et matérielles, il est possible de s’apercevoir pendant l’élaboration du projet que certaines ressources manquent ou ne répondent pas correctement aux critères recherchés en première intention. Pour anticiper ce risque, il est fortement conseillé au porteur de projet et à son équipe d’évaluer la fiabilité de la ressource et de doubler les ressources qui semblent les moins fiables. Dans un projet d’innovation dans un contexte urgent, il est primordial de s’assurer que toutes les ressources nécessaires seront disponibles au moment du lancement du projet, de manière à ne pas perdre de temps.
Un troisième risque à anticiper est la nécessité d’être conforme aux exigences réglementaires imposées par les autorités compétentes et correspondant à l’innovation de rupture en cours de conception. Pour s’assurer que l’innovation respecte toutes les exigences réglementaires, le porteur de projet et son équipe doivent effectuer des tests techniques et cliniques. Le risque est de ne pas être spécialisé dans l’analyse normative des documents et donc de ne pas comprendre les différents articles des normes. Pour pallier cela, il existe de nombreux outils d’autodiagnostic de normes qui permettent d’assurer la conformité de l’innovation ou du dispositif aux normes associées. L’équipe du projet peut également faire appel à des experts en qualité ou des responsables d’affaires réglementaires pour les guider sur ces aspects compliqués et laborieux.
Le dernier risque important à prendre en compte est la mauvaise appropriation de l’outil proposé. En effet, l’outil se présente sous-forme de tableaux Excel vierges à remplir par l’utilisateur. Un guide d’utilisation et un mode d’emploi sont à sa disposition pour que cet outil soit le plus bénéfique possible et lui permette un gain de temps dans son projet. En revanche, si l’utilisateur n’utilise pas ces tableaux il risque de ne pas être dans les temps impartis, de manquer des étapes ou de manquer de ressources. Pour pallier cela, l’outil peut prendre un format pdf imprimable à remplir à la main par l’utilisateur. Il pourrait également suivre une petite formation en ligne pour s’approprier l’outil et l’utiliser efficacement.
Grâce au logigramme ARA (Actions, Risques, Alternatives) de la figure 24 il est possible d’anticiper certains risques qui découlent des actions essentielles au projet. En voici un exemple, adaptable pour tous les risques et tous les projets d’innovation.
Figure 24 : Logigramme ARA pour anticiper les risques. Source : auteures
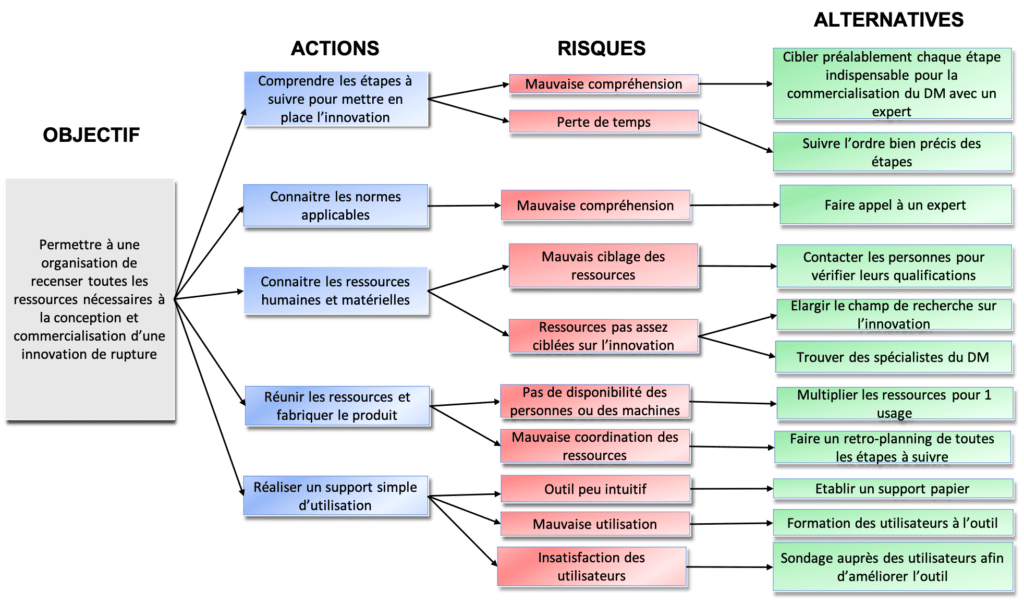
2.2 Les perspectives
Le principal intérêt de cet outil est sa pérennité dans le temps. En effet, ce dernier est adaptable à tous les projets et peut être utilisé à tout moment et autant de fois que nécessaire. Cependant, certaines mises à jour devront être faites concernant les normes renseignées dans la cartographie, par exemple le règlement européen 2017/745 qui changera en mai 2021 et deviendra 2020/561.
Par ailleurs, de manière à ce que ces outils soient le plus efficaces possible, il faudrait pouvoir renseigner un très grand nombre de ressources pour avoir plusieurs issues possibles si des ressources se rendent indisponibles au moment de lancer le projet. Il serait alors très intéressant de pouvoir mettre ces outils sous format de logiciel, ce qui rendrait l’entrée ou la suppression de ressource plus rapide. L’outil Excel serait alors remplacé par un système de remplissage automatique, comme lors d’une inscription. Ainsi, une nouvelle ressource pourrait être intégrée plus facilement dans l’outil. De plus, l’élaboration de ce logiciel permettrait d’avoir un menu interactif qui adapterait les données en fonction du projet en cours, en renseignant certaines informations relatives au dispositif en développement. Il serait par ailleurs intéressant de pouvoir automatiser le remplissage de la cartographie au fur et à mesure que l’utilisateur entre ses ressources dans l’outil Excel. De cette manière, l’utilisateur n’aurait qu’un seul outil pour travailler et avancer dans son projet.
Conclusion
Pour conclure, l’UTC ou toute organisation possédant des ressources pour concevoir un dispositif médical ou une innovation biomédicale, dispose désormais d’un outil qui permet de les rassembler et de les placer en fonction des phases de développement du dispositif.
En effet, la conception d’un dispositif médical est une démarche fortement réglementée à travers les exigences des lois, règlements et directives. Ainsi, le fabricant doit s’assurer que le dispositif qu’il conçoit puisse réellement être utilisé à des fins médicales. Face aux longues procédures et aux nombreuses étapes, le fabricant peut à présent s’appuyer sur des outils qui l’accompagnent et le guident dans son processus.
Le porteur d’un projet biomédical peut, grâce aux outils proposés, planifier son projet en fonction de dates précises et suivre son avancement au fur et à mesure. Ce dernier peut également valider les différentes étapes du cycle de vie de son dispositif afin d’éviter d’oublier certaines étapes clés. Dans un tel projet, il est primordial d’être méticuleux dans son travail. Un tel appui est donc nécessaire pour assurer l’avancée et l’aboutissement du processus de conception et de diffusion d’un dispositif. D’autre part, l’utilisateur peut désormais facilement recenser toutes les ressources dont il aura besoin et les solliciter au moment prévu grâce à l’inventaire qu’il aura réalisé préalablement dans l’outil Excel ou dans la cartographie.
On peut déduire de cette étude que l’UTC est capable de fabriquer un prototype de dispositif médical et d’effectuer tous les tests pré-cliniques nécessaires. Le prototype pourrait être conforme aux exigences de la réglementation européenne et se voir utiliser dans les établissements de santé. Cependant, il persiste un manque certain de ressources pour procéder à la validation du prototype conçu. En effet, il faudrait qu’il puisse être utilisé en conditions réelles, dans un hôpital auprès des patients. C’est pourquoi, un partenariat doit être envisagé entre l’équipe biomédicale du Centre Hospitalier de Compiègne-Noyon. Ainsi, certains tests supplémentaires pourront être effectués et le prototype pourra être validé par les autorités compétentes (ANSM). Après la mise en place de cette collaboration, une présérie du dispositif pourra être lancée auprès de prestataires fabricants et ainsi être industrialisé et produit en plus grande quantité.
A l’avenir, de nombreuses institutions universitaires dans le domaine biomédical pourraient mettre en place de telles collaborations afin d’envisager des tests sur des dispositifs conçus par des enseignants chercheurs ou des ingénieurs. Ainsi, ces démarches poussent à l’innovation et au progrès dans le domaine des dispositifs médicaux.