IDS088 - Mise en œuvre de nouvelles cartographies de processus et accompagnement des pilotes dans l'analyse des risques processus
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteur

Contact
Mohamed Aziz Ayadi : ayadimedaziz@gmail.com
Citation
A rappeler pour tout usage : Mohamed Aziz AYADI "Mise en œuvre de nouvelles cartographies de processus et accompagnement des pilotes dans l'analyse des risques processus", Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de stage, juillet 2021, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids088/
Résumé
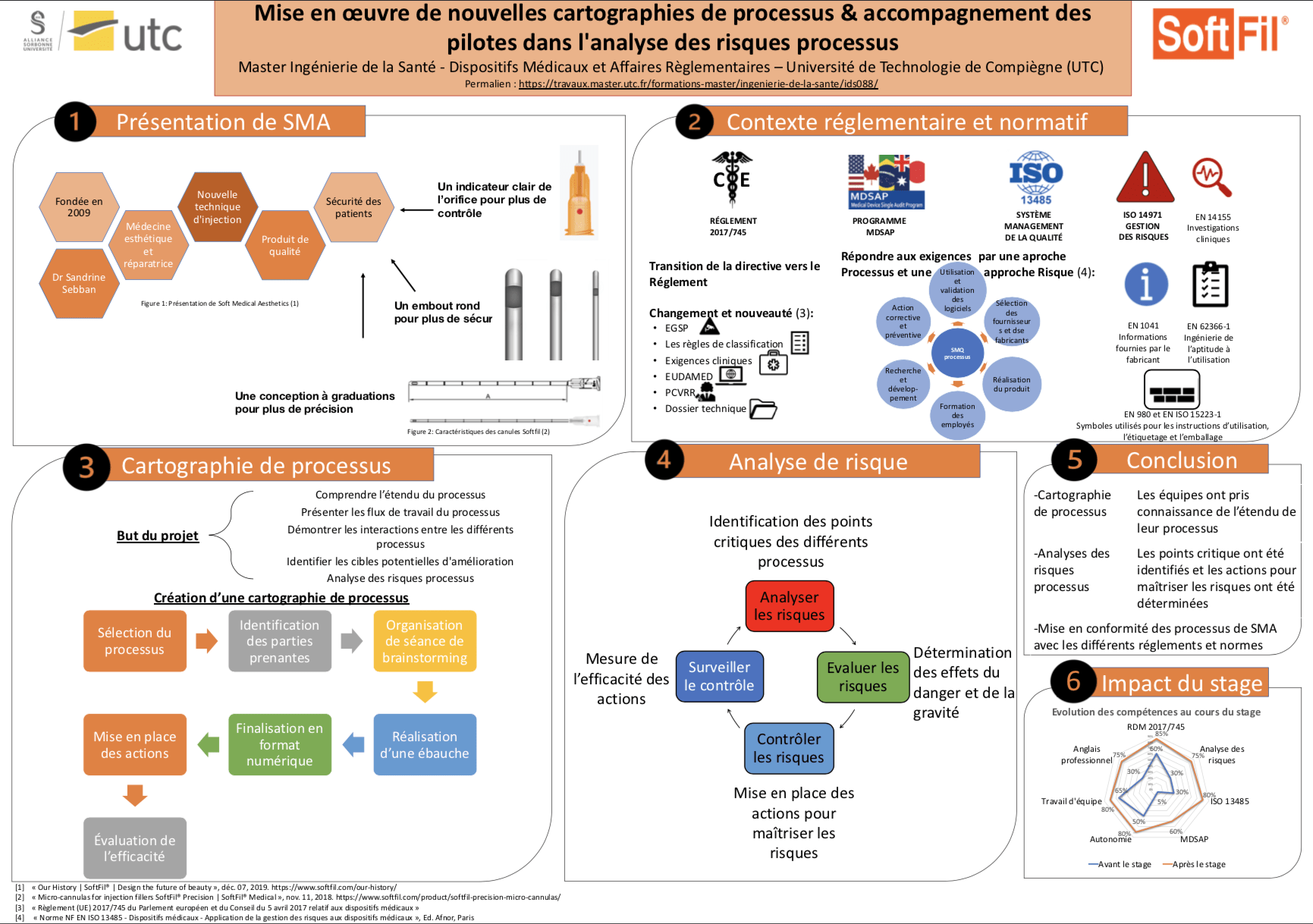
Le fabricant de dispositifs médicaux est l'un des principaux acteurs du secteur de la santé, il a un rôle très important, car il doit à la fois assurer la délivrance d'un produit conforme et performant mais surtout il doit garantir la sécurité du patient et de l'utilisateurs.
Tous comme le secteur pharmaceutique, le secteur des DM est très réglementé, les fabricants doivent s'appuyer sur les différentes normes disponibles et faire en sorte de respecter les exigences des différentes réglementations des pays dans lesquelles ils souhaitent commercialiser leurs produits.
Ainsi, Soft Medical Aesthetics met tout en œuvre pour répondre aux exigences du nouveau règlement 2017/745 pour mettre sur le marché Européen ses produits, mais aussi pour la prise en compte des exigences des règlements d'autres pays comme le programme MDSAP, pour élargir ses parts de marché.
C'est dans ce sens que tout au long du stage, les tâches et projets réalisés notamment, la mise en place des cartographies de processus ou l'analyse des risques ont été accomplis pour répondre aux exigences réglementaires
Mots-clés : Règlement 2017/745, Cartographie des processus, Analyse des risques, Système Management de la Qualité, Dispositifs Médicaux
Abstract
The manufacturer of medical devices is one of the main actors in the health sector and has a very important role to play, as he must not only ensure the delivery of a compliant and efficient product, but also guarantee the safety of the patient and the user.
Just like the pharmaceutical sector, the DM sector is highly regulated, and manufacturers must rely on the various standards available and ensure that they comply with the requirements of the various regulations of the countries in which they wish to market their products.
Thus, Soft Medical Aesthetics is doing its utmost to meet the requirements of the new regulation 2017/745 to put its products on the European market, and to take into account the requirements of other countries' regulations such as the MDSAP program, to expand its market share.
In this sense, throughout the course, tasks and projects such as the implementation of process mapping or risk analysis were carried out to meet the regulatory requirements
Keywords : Regulation 2017/745, Process mapping, Risk analysis, Quality Management System, Medical Devices
Téléchargements