IDS145 - Etude exploratoire sur le développement de produits dédiés ou compatibmes avec la radiothérapie
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteur

Contact
Adebola FATOKE : fatokeadebola@gmail.com
Citation
A rappeler pour tout usage : Adebola FATOKE, "ÉTUDE EXPLORATOIRE SUR LE DÉVELOPPEMENT DE PRODUITS DÉDIÉS OU COMPATIBLES AVEC LA RADIOTHÉRAPIE" Université technologique de Compiègne (France), Master Ingénierie de la santé, Rapport de stage, https//travaux.master.utc.fr/, réf n° IDS145, juillet 2022, url directe : https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids145
Résumé
La recherche d’une meilleure efficacité du traitement des tumeurs et l’utilisation accrue de l’imagerie pendant la prise en charge des patients ont permis la conception de machines associant l’accélérateur linéaire de particules avec l’IRM. Dans ce contexte, l’entreprise OLEA-MEDICAL aimerait étudier les possibles opportunités liées à cette nouvelle approche de traitement.
Ainsi, pour explorer cette possibilité, la compréhension des différentes tumeurs cérébrales, les différentes techniques et technologies utilisées, les compétences nécessaires, le parcours patient en radiothérapie neuro-oncologie et l’environnement macro-économique sont des éléments indispensables.
J'ai donc mis en pratique des outils de gestion de projet comme le QQOQCP pour mieux cadrer la problématique, le Gantt pour avoir une vision claire des tâches et la durée d’exécution, les diagrammes de cause à effet et en arbre pour anticiper au mieux les risques, puis j'ai fait une veille technologique et documentaire, et enfin, j'ai discuté avec les acteurs de la radiothérapie neuro-oncologie.
Cette étude a confirmé la place importante qu’occupe l’imagerie (CT et IRM) de la phase diagnostic jusqu’au suivi post traitement, et m’a permis l’amélioration de mes compétences techniques, stratégiques, humaines et linguistiques.
Abstract
The search for greater efficiency in tumor treatment and the increased use of imaging during patient management have led to the design of machines that combine the linear accelerator (LINAC) with MRI. To this end, OLEA-MEDICAL would like to study the possible opportunities related to this new treatment approach.
To explore this possibility, the understanding of the different brain tumors, the different techniques and technologies used, the necessary skills, the patient pathway in neuro-oncology radiotherapy and the macro-business environment are essential elements.
I therefore used project management tools such as the QQOQCP to better define the problem, the Gantt to have a clear vision of the tasks and the duration of execution, cause and effect diagrams and tree diagrams to better anticipate the risks, then I did a technological and documentary monitoring, and finally, I discussed with the actors of the neuro-oncology radiotherapy. This study confirmed the important place of imaging (CT and MRI) from the diagnostic phase to the post-treatment follow-up, and allowed me to improve my technical, strategic, human, and linguistic skills.
Téléchargements

Mémoire complet : Étude exploratoire sur le développement de produits dédiés ou compatibles avec la radiothérapie
Remerciements
Je tiens tout abord à remercier M. Fayçal Djeridane président d’Olea Medical pour m’avoir donné l’opportunité d’intégrer OLE-MEDICAL.
Je remercie ma tutrice de stage Mme Margarita ARANGO-LIEVANO pour tous les enseignements, le partage d’expérience et la confiance qu’elle m’a accordée pendant mon stage.
Je souhaite remercier l’équipe solution clinique, en particulier M. Mael FLOCH, M. Franck GIRARD et Mme Nathalie KIEUSSEYAN pour leur aide et leur coopération dans la réalisation du présent document.
Je tiens à remercier l’équipe enseignante de l’UTC, notamment Mme Isabelle Claudeet M.Jean-Matthieu Prot pour leurs conseils et disponibilité.
Liste des sigles/acronymes
- SNC : Système Nerveux Central
- INCR : Institut des Neurosciences Clinques de Rennes
- LINAC : Accélérateurs Linéaires de Particules
- AVCI : Année de Vie Corrigée de l'Incapacité
- Gy : GRAY
- KV : Kilovolt
- MV : Mégavolt
- PFS : Progression-free survival
- OS : Overall survival
- TMZ : Temozolomide
- PCV : procarbazine lomustine vincristine
- CBCT : Cone Beam Computed Tomography
- PSMA : Prostate-Specific Membrane Antigen
- ADC : Apparent Diffusion Coefficient
- DSC : Dynamic Susceptibility Contrast-enhanced
- DCE : Dynamic Contrast-Enhanced
- FLAIR : Fluid-Attenuated Inversion Recovery
- DICOM : Digital Imaging and Communications in Medical
Introduction
L’augmentation de l’espérance de vie de la population a contribué à l’accroissement du nombre de personnes vivant avec des maladies du système nerveux central (SNC) : maladie de Parkinson, sclérose en plaques, maladie d’Alzheimer, tumeurs cérébrales, accident vasculaire cérébral, dépression, etc. La tumeur cérébrale correspond à une anomalie de la croissance cellulaire qui peut être de nature bénigne ou maligne. Les tumeurs du système nerveux central peuvent se développer dans la région intracrânienne ou dans la région du canal rachidien. Elles recouvrent plus d’une vingtaine de tumeurs distinctes. Leurs pronostics et leur prise en charge sont très différents selon le type de tumeur et l’âge[1].
Les tumeurs du système nerveux central peuvent être traitées par chirurgie, la radiothérapie et la chimiothérapie, ou le plus souvent, une combinaison de ces traitements. La radiothérapie intervient dans la prise en charge d’environ 70% des patients atteints de tumeurs cérébrales[2]. Il existe deux différents types de radiothérapie : la radiothérapie externe et interne. La radiothérapie externe utilise les accélérateurs linéaires de particules (LINAC) pour traiter le patient, tandis que la radiothérapie interne utilise des substances radioactives dans le corps[3] [4].
Face à cette utilisation croissante de la radiothérapie dans la prise en charge des tumeurs cérébrale, OLEA MEDICAL, entreprise spécialisée dans la conception et la commercialisation d’application d’imagerie (IRM et CT) du groupe CANON MEDICAL SYSTEMS, a décidé de proposer une solution intégrable et intégrée.
Ainsi, ce rapport présentera la place de l’imagerie en radiothérapie neuro-oncologie. Ceci sera fait en ayant comme fil conducteur : la présentation l’entreprise de stage, les tumeurs cérébrales, l’état de l’art de la radiothérapie neuro-oncologie et l’apport du stage.
Chapitre 1 : OLEA-MEDICAL et son environnement
1.1 Présentation de l’entreprise, Historique
Olea Médical est une société anonyme (SA) spécialisée dans le post-traitement d’images pour le diagnostic médical. La mission de l’entreprise, ‘Improved Diagnosis for Life’ (Figure 1) est de fournir une solution pour améliorer le processus de diagnostic et suivi des maladies. Sur le plan technique et scientifique, Olea Medical® développe des solutions avancées de post-traitement d’images IRM et de scanner multi-constructeurs, multi-applications.
Olea Medical® a été fondée en 2008, mais son histoire commence bien avant, en 1998, créant un logiciel de recherche clinique, basé sur des algorithmes mathématiques, pour le post-traitement d’images de patients ayant subi un AVC.
Dix ans plus tard, M. Fayçal DJERIDANE crée Olea Medical® avec l’aide de Mme Anca Mitulescu, M.Cyril Di Grandi et M. Benoît Gy, avec pour mission : Improved Diagnosis for Life (un meilleur diagnostic pour préserver la vie).
En 2015, Olea Medical® rejoint le groupe Toshiba Medical Systems Corporations, 3ème leader mondial dans le domaine de l’imagerie médicale maintenant connue tant que Canon Inc. Ce rachat, d’enjeux à la fois économiques et technologique a pour mission première d’accélérer l’innovation dans le développement des systèmes d’IRM.
Figure 1 : Symbole de Olea Medical

Source : OLEA-MEDICAL
1.2 Organigramme et organisation du travail
OLEA-MEDICAL est constitué de 133 employés répartis suivant sept (7) pôles. J’ai effectué mon stage dans le pôle Stratégie et Innovation, plus précisément dans le département solutions cliniques (Figure 2) en tant que chef de projets. L’équipe est composée de cinq (5) personnes dont ma tutrice de stage Mme Margarita ARANGO-LIEVANO, responsable solutions cliniques chargée des solutions dédiées à la neuroimagerie.
Figure 2 : Organigramme OLEA-MEDICAL
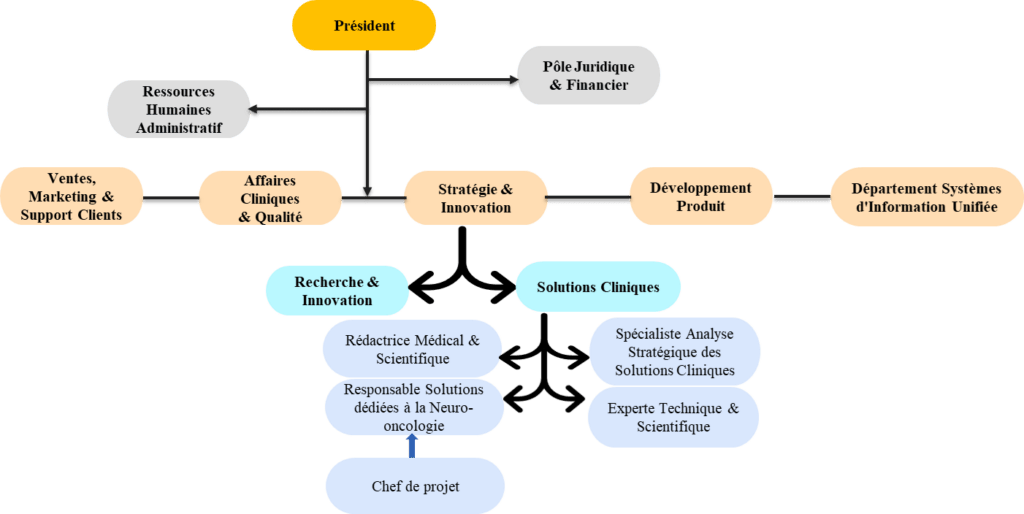
Source : OLEA-MEDICAL
Créé en 2021, le département solution clinique (Figure 2) à un rôle de veille stratégique et technologique. En relation avec le département Recherche et Innovation (R&I), il a pour mission principale de déterminer la stratégie des produits et la faisabilité des nouveaux projets. Il doit déterminer si l’entreprise a un intérêt à réaliser un nouveau produit, s’il y a un marché et où, quel est le produit minimum viable (MVP en anglais) et enfin voir si l’entreprise a les bases de l’algorithme nécessaire à son développement.
Une grande partie des opérations chez Olea Medical ® se fait en mode projet piloté par un chef de projet au sein du pôle programme, qui coordonne les activités des collaborateurs du pôle développement, validation, affaires cliniques et réglementaires afin de mettre des nouveaux produits sur le marché ou améliorer les produits existants.
Dans ce but, l’organisation du travail est axée sur une structure dite coopérative. Et de ce point de vue, l’entreprise fournit de grands efforts pour maintenir une ambiance familiale. Cet esprit se traduit par un management le plus transversal possible, hiérarchisé dans une moindre mesure, avec les créateurs de la société et directeurs des services qui participent quotidiennement au développement des produits, en plus du management des équipes.
1.3 Présentation de l’offre logiciels
Olea Medical® développe des outils d’aide au diagnostic permettant aux professionnels de santé une analyse plus précise et plus rapide des images de résonance magnétique (IRM) et scanner (CT pour computed tommography).
En 2008, Olea Medical® conçut la première génération de logiciels permettant d’améliorer de façon significative la prise en charge des accidents vasculaires cérébraux. Elle permet à la suite d’un examen IRM ou CT, de produire un diagnostic en moins d’une minute contre 25 à 30 minutes avec les outils existants à ce moment-là et de faciliter l’utilisation de l’imagerie de perfusion en routine clinique. Par la suite, les logiciels PerfScape™ et NeuroScape™ ont aussi servi à l’analyse des tumeurs cérébrales.
En avril 2012, Olea Medical® élargit son champ de vision et agrandit sa gamme de logiciels tout en proposant à ses clients l’Olea Sphere® (Figure 3).
OleaSphere® comporte différentes applications innovantes d’imagerie médicale, telles que :
| Neurologie ORL (oto-rhino-laryngologie) Sénologie Prostate Pelvis féminin | Rectum Oncologie en général Cardiologie Ostéo-articulaire Sein |
Les différents modules disponibles sont :
| Diffusion Perfusion (perfusion T2) Perméabilité (perfusion T1) Suivi des fibres Diffusion multi-b-DTI fMRI-DTI | CEST Marquage de spin (Arterial Spin Labelling : ASL) Analyse Suivi |
En évolution permanente, le module Clinique breastscape est déjà disponible dans la dernière version Olea Sphere®, en revanche chemical exchange saturation transfer (CEST) est en phase la recherche.
Figure 3 – Olea Sphere ®

Source : OLEA-MEDICAL
Il existe deux versions différentes sur le marché mondial : la version 2.3 et la version 3.0 qui est plus récente. Olea dispose des autorisations de mise sur le marché (AMM) en Europe (marquage CE) et aux Etats-Unis (FDA). Olea Sphere® est un ensemble de modules permettant le post traitement et l’archivage d’images médicales pour le corps entier. Son interface intuitive et ses applications automatisées permettent la standardisation du post-traitement, de l’analyse et de l’affichage d’images IRM dynamique, d’IRM fonctionnelle et de scanner, ainsi que le suivi optimal entre différentes dates, modalités, séries.
Actuellement, se développe un nouveau produit pour remplacer Olea Sphere (Figure 3). Il s’agira d’une plateforme qui intègre plusieurs applications, permettant aux cliniciens d’accéder à plusieurs options dans un seul produit. Par conséquent, l'objectif du produit peut apporter de grands avantages à tout domaine dans lequel l'imagerie est impliquée, et est donc intéressé par la recherche de solutions compatibles ou dédiées avec la radiothérapie.
Chapitre 2 : Tumeurs cérébrales
Le sujet d’intérêt porte essentiellement sur la neuro-oncologie, discipline médicale qui prend en charge les cancers du système nerveux. Dans ce chapitre, ma mission était de faire la veille documentaire nécessaire pour faciliter en premier lieu la compréhension du système nerveux sur le plan physiologie et fonctionnel, ensuite sur l’apparition et développement de ces maladies et enfin identifier les différents types de traitements disponibles.
2.1 Structures et fonction du cerveau
Le système nerveux central (SNC) est composé de l’encéphale (contenant le cerveau, le tronc cérébral et le cervelet) et de la moelle épinière. Le cerveau est constitué de deux types de tissus cérébraux (Figure 4) : la substance blanche composée majoritairement des axones de neurones et la substance grise où se trouvent leurs corps. L’axone assure une bonne circulation de l'information dans le système nerveux et connecte les différentes régions du cerveau. Le corps cellulaire ou le cortex a pour rôle de recevoir les messages, d'examiner les informations et de préparer les réponses.
Le cortex (Figure 5) est divisé en quatre lobes [5] :
- Lobe frontal : impliqué dans les tâches cognitives supérieures comme la résolution de problèmes, la pensée, la planification et les émotions.
- Lobe pariétal : qui intervient dans les processus sensoriels, l'attention et le langage.
- Lobe occipital : à l'arrière du cerveau qui participe à l'information visuelle y compris dans la reconnaissance des formes et des couleurs.
- Lobe temporal : qui joue un rôle important dans l'encodage des informations auditives et dans l'intégration des informations provenant des autres modalités sensorielles.
Figure 4 : Types de tissus cérébraux
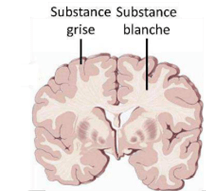
Source : https://tel.archives-ouvertes.fr/tel-01740330
Figure 5 : le cortex cérébral
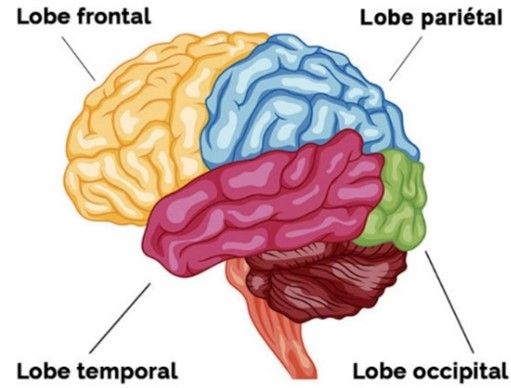
Source : lobes-cerveau.jpg
La population cellulaire du cerveau est divisée en deux grandes parties (Figure 6): les cellules neuronales (en bleu), spécialisées dans la réception, le traitement et la transmission de l’influx nerveux ; et les cellules gliales comprenant les astrocytes (vert), les oligodendrocytes (en orange) et les cellules microgliales qui assurent le bon fonctionnement des neurones[5].
Figure 6 : Population cellulaire cérébrale
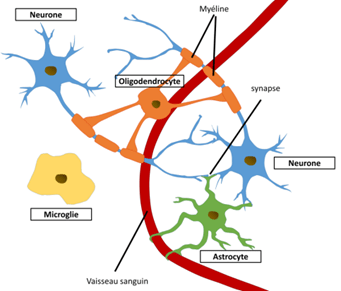
Source : https://tel.archives-ouvertes.fr/tel-01740330
2.2 Physiologie des tumeurs cérébrales
La tumeur cérébrale ou tumeur du système nerveux central (SNC) est une masse formée d’un amas de cellules qui se sont multipliées de façon anarchique dans une zone du cerveau. Selon leur nature, elle peut être bénigne (non cancéreuse) ou maligne (cancéreuse).
Du fait de leur provenance et localisation, la tumeur est soit primaire ou primitive quand elle nait directement à l’intérieur du crâne, et secondaire ou métastase cérébrale quand elle se développe au niveau de l’encéphale en provenance d’une cellule cancéreuse situé dans une autre partie du corps : le sein, les poumons, etc.
La catégorisation histologique était principalement fonction du tissu cérébral dans lequel la tumeur se développe. Ainsi les cellules astrocytaires donnent naissance aux astrocytomes, les oligodendrocytes aux oligodendrogliomes, les cellules épendymaires aux épendymomes, les cellules des nerfs périphériques aux neurinomes. Le gliome regroupe d’une façon générale l’ensemble des tumeurs issues des cellules gliales et les méningiomes à partir des méninges.
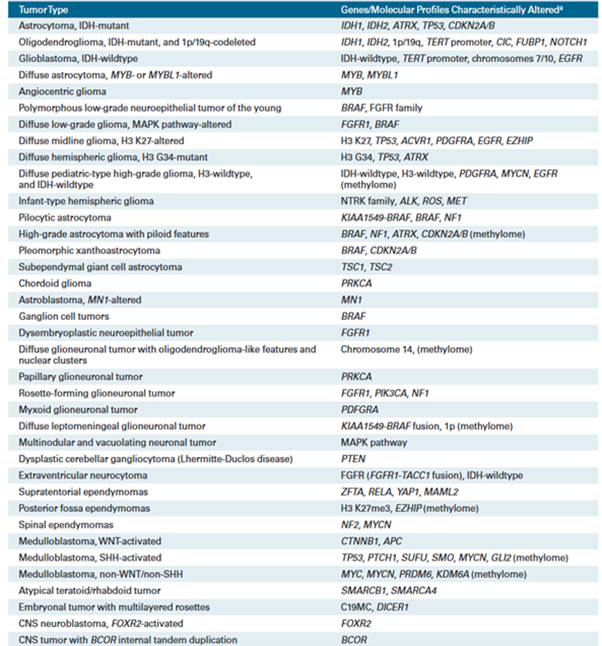
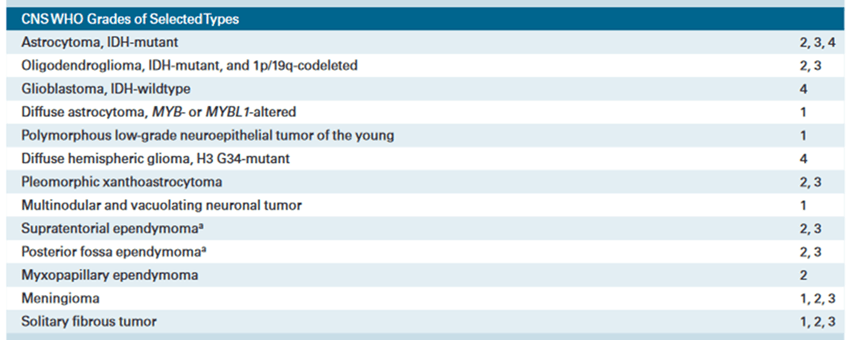
Plus récemment, l’OMS a inclus de nouvelles informations moléculaires dans sa nouvelle classification 2021, une version qui vient remplacer celle de 2016 et dont la première version date de 1979. Cette catégorisation, intégrant chaque fois l’état de la recherche, a pour but d’améliorer l'objectivité, la précision du diagnostic en pratique clinique, et de déterminer avec plus de précision le pronostic et la réponse au traitement (Tableau 1) (Tableau 2) [6].
Tableau 1 : Classification histologique et moléculaire

Tableau 2 : Classification histologique et grade

Source : classification OMS 2021
2.3 Epidémiologie des tumeurs cérébrales
Rappel 1 :
Incidence : l’incidence du cancer est le nombre de nouveaux cas de cancer survenant dans une population spécifiée sur une période donnée (généralement 1 an). Il peut être exprimé en nombre absolu de cas dans l’ensemble de la population par an ou en taux pour 100 000 personnes par an. Le taux d’incidence du cancer fournit une approximation du risque moyen de développer un cancer. Les données sur l’incidence sont systématiquement recueillies par les registres nationaux ou infra-nationaux du cancer fondées sur la population [17].
Mortalité : la mortalité par cancer est le nombre de décès dus au cancer survenant dans une population spécifiée sur une période donnée (généralement 1 an). Il peut être exprimé en nombre absolu de décès dans l’ensemble de la population par an ou en un taux pour 100 000 personnes par an. Les données sur la mortalité par cause sont systématiquement collectées par les systèmes nationaux d’enregistrement de l’état-civil [17].
Prévalence : la prévalence d’un cancer donné est le nombre de personnes au sein d’une population définie qui a reçu un diagnostic de ce cancer et qui sont encore en vie à un moment donné (les survivants). La prévalence complète est le nombre de personnes vivantes, à un moment donné, qui ont reçu un diagnostic de maladie d’intérêt, peu importe le temps écoulé depuis le diagnostic ou si la personne est toujours sous traitement ou est considérée comme guérie. La prévalence partielle limite le nombre de patients à ceux qui ont reçu un diagnostic au cours d’une période définie dans le passé, et il s’agit d’une mesure particulièrement utile du fardeau du cancer [17].
Année de Vie Corrigée de l’Incapacité (AVCI) ou disability-adjusted life year (DALY) : une AVCI représente la perte de l'équivalent d'une année de pleine santé. Les AVCI pour une maladie ou un problème de santé sont la somme des années de vie perdues en raison de la mortalité prématurée (AVP) et des années vécues avec un handicap (AVH) en raison des cas prévalents de la maladie ou du problème de santé dans une population [18].
Taux normalisé selon l’âge (TSA) Age-Standardized Rate (ASR) : un taux normalisé selon l’âge (TSA) est une mesure sommaire du taux qui aurait été observé si la population avait une structure d’âge standard. La normalisation est nécessaire lors de la comparaison de plusieurs populations qui diffèrent selon l’âge, car l’âge a une forte influence sur le risque de cancer. Un ASR est une moyenne pondérée des taux par âge ; la pondération est basée sur la répartition de la population d’une population standard. La population standard la plus fréquemment utilisée est la population standard mondiale (W). L’incidence calculée ou le taux de mortalité est alors appelée incidence normalisée par âge ou taux de mortalité (W), et est exprimée par 100 000 années-personnes [17].
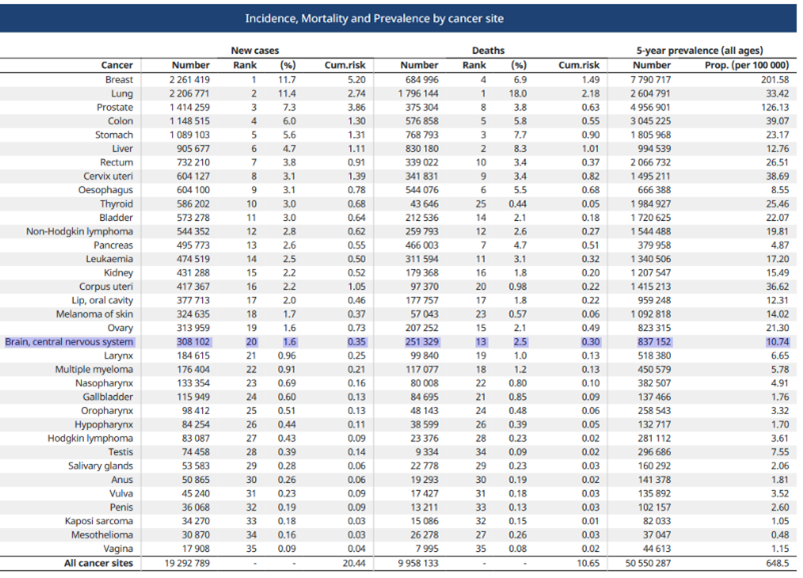
Les tumeurs du système nerveux central (SNC) sont des tumeurs rares et leurs causes sont mal connues. En 2020, GLOBAL CANCER OBSERVATORY a publié une étude effectuée dans 185 pays pour 36 types de cancer par sexe et groupe d’âge. Le nombre estimé de nouveaux cas de tumeur cérébrale dans le monde est 308 102, soit 1,6 pour 100 000 personnes et le nombre de décès est 251 329, soit 2,5 pour 100 000 personnes (Tableau 3) [7].
Tableau 3 : Epidémiologie mondiale

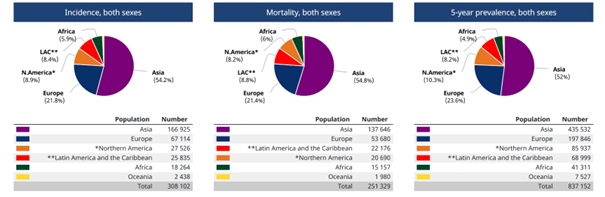
Cette étude inclut aussi la part de chaque continent dans le taux mondial d’incidence et de mortalité, par exemple, l’Europe prend une part de 21,8% dans la totalité des incidences et 21,4% dans la totalité des mortalités (Figure 7)[8].
Figure 7 : Epidémiologie continentale

Source : GLOBAL CANCER OBSERVATORY
Cependant, le taux mondial de mortalité évoqué précédemment n’informe pas sur l’année de vie corrigée de l'incapacité (AVCI) des patients afin de montrer l’impact des tumeurs du système nerveux central sur la santé comparativement aux autres maladies du cerveau. L’AVCI est un indicateur très important pour évaluer le fardeau des différentes maladies du corps. Il est obtenu par la somme des années de vie perdues en raison de la mortalité prématurée (AVP) et des années vécues avec un handicap (AVH) en raison des cas prévalents de la maladie ou du problème de santé. Ainsi, en comparant les deux études publiées par Global Burden of Disease (GBD) en 2019 sur les tumeurs du système nerveux central et l'AVC (Figure 8). Nous avons constaté que le taux d'AVP (YLL en anglais) du groupe d'âge <40 ans, est plus élevé pour les tumeurs du SNC comparativement à l'AVC, tandis que l’inverse se produit par rapport au taux d’AVH (YLD en anglais) pour le groupe >40 ans. Ce qui permet d’affirmer que les tumeurs du SNC sont plus mortelles tandis que les patients atteints de l’AVC vivent avec des handicaps tout au long de la vie[9] [10].
Figure 8 : Comparaison du taux mondial selon l'âge de l'AVC et tumeurs du SNC
| Figure 8 (A) : Taux mondial selon l’âge d'AVH et d'AVP de l'AVC | Figure 8 (B) : Taux mondial selon l’âge d'AVH et d'AVP des tumeurs du système nerveux central |
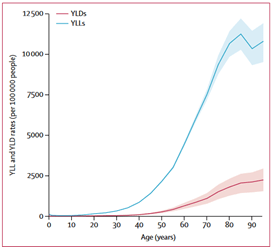 | 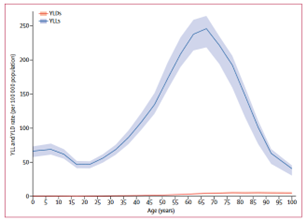 |
Source : Global Burden of Disease (GBD)
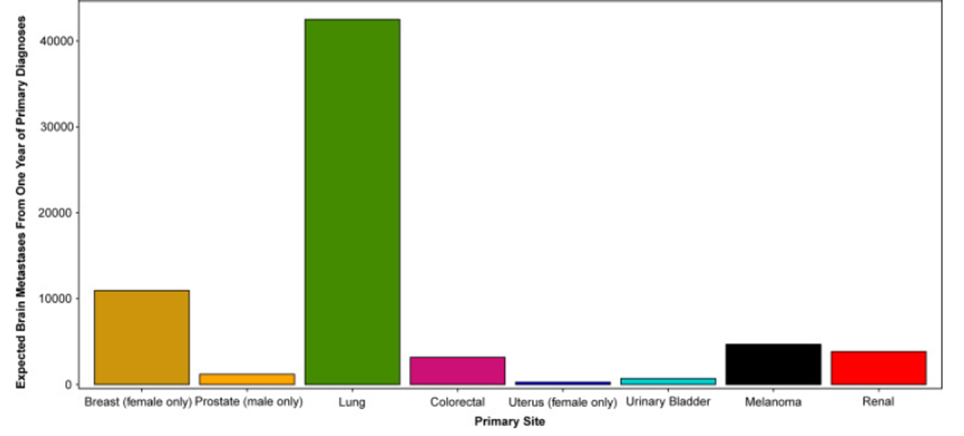
Selon l’étude publiée en 2016 par le journal Américain Neuro-Oncology, les métastases cérébrales de tumeurs malignes systémiques constituent la majorité des cancers intracrâniens, avec une incidence estimée entre 8,3 et 11,0 pour 100 000 contre 6,6 pour 100 000 pour toutes les tumeurs malignes primaires du système nerveux central[11]. En 2021 Neuro-Oncology Advances et CLINICAL PRACTICE GUIDELINES IN ONCOLOGY révèlent que 8,5 à 9,6 % des patients cancéreux développent une métastase cérébrale, tandis qu'environ 25 % des personnes décédées d'un cancer avaient développé une maladie métastatique au cerveau [12][13]. Les métastases proviennent souvent de tumeurs primitives extra-crâniennes telles que : le cancer du poumon avec une incidence autour de 40 %, suivi du sein pour environ 11%, mélanome et rein autour de 7%, et colorectal près de 2% (Figure 9)[11][14][15]. Elles sont localisées à la jonction matière grise - matière blanche, à l’espace sous-arachnoïdien et aux interfaces des principaux territoires vasculaires artériels. Dans le parenchyme cérébral, la plupart des métastases cérébrales (jusqu’à 80 %) se produisent dans les hémisphères cérébraux, tandis que 17 % se produisent dans le cervelet et 3 % dans les ganglions basaux. Dans le cerveau, les métastases ont tendance à se produire plus souvent dans les lobes frontaux et pariétaux que dans les lobes temporaux et occipitaux[16].
Figure 9 : métastases cérébrales par cancer primaire

Source : Brain metastases : epidemiology
2.4 Traitement des tumeurs cérébrales
Actuellement, trois types de traitements associés les uns aux autres sont proposés au cours de la prise en charge des tumeurs du système nerveux central : une intervention chirurgicale, la chimiothérapie et la radiothérapie.
- Intervention chirurgicale
Ce traitement, sauf chez les personnes trop âgées ou trop faibles pour le supporter, est quasi systématique lorsqu’un diagnostic incertain de lésion du SNC est posé, ou une métastase est associée à un œdème cérébral étendu ou la métastase dominante est dans une région éloquente [17]. Elle consiste à retirer la plus grande partie possible de la tumeur en limitant les conséquences fonctionnelles [18]. Dans le cas d’une métastase cérébrale, l’intervention chirurgicale permet de récupérer les tissus pour le diagnostic, la réduction de l’effet de masse et l’amélioration de l’œdème[12].
- Chimiothérapie
La chimiothérapie utilise des médicaments anticancéreux administrés avant ou après la chirurgie selon les cas par voie orale et/ou intraveineuse. Lorsque par exemple l'évérolimus, un inhibiteur de mTOR, est utilisé avant la chirurgie, il permet la réduction d'au moins 50 % du volume tumoral pour faciliter la résection chirurgicale et une survie sans progression (PFS en anglais) à 6 mois de 86 % après le traitement[12].
La chimiothérapie utilise aussi des médicaments comme le TMZ ou PCV pendant ou après la radiothérapie pour améliorer significativement la PFS et la survie globale (OS en anglais), éliminer d’éventuelles cellules cancéreuses restantes et réduire le risque de récidive. Par exemple, dépendamment de l’âge et le type de tumeur du patient, l’utilisation de PCV après la radiothérapie permet d’améliorer le taux de survie à 10 ans d’environ 60% contre 100% [12]. Outre les médicaments de chimiothérapie, il existe d’autres traitements médicamenteux d’accompagnement comme des corticoïdes pour diminuer l’œdème du cerveau provoqué par la tumeur ou les traitements ; des diurétiques pour faciliter l’élimination de l’excès de liquide à l’intérieur du cerveau ; des antiépileptiques pour prévenir les crises d’épilepsie ; des antalgiques pour soulager la douleur, en particulier les maux de tête ; ou encore des anticoagulants pour éviter une phlébite ou une embolie pulmonaire[18].
Dans le cadre d’une métastase cérébrale, un traitement systémique est recommandé lorsque la tumeur primaire est sensible à la chimiothérapie, ou les options thérapeutiques ont été épuisées et il existe un médicament raisonnable disponible[17].
- Radiothérapie
En complément des traitements précédemment évoqués, environ 70% des patients atteints du cancer bénéficieront d’une radiothérapie au cours de leur maladie [18] [2]. Elle permet un contrôle local total de la tumeur primaire et/ou de la métastase. Ce dernier type de traitement fera l’objet de la suite du document.
Chapitre 3 : Radiothérapie
Dans le présent chapitre, après la compréhension superficielle du système nerveux central, ma mission était de comprendre le parcours patient et le rôle des différents acteurs (cliniques et industriels) intervenants dans la radiothérapie afin d’identifier les besoins cliniques et industriels. Ainsi, j’ai fait l’état de l’art de la radiothérapie en procédant par une veille documentaire et en soumettant un questionnaire au cours des entretiens avec les différents acteurs du domaine.
3.1 Définition
La radiothérapie est un traitement locorégional des cancers. Son principe est basé sur l’utilisation de rayonnements ionisants à haute énergie afin de détruire ou endommager les cellules cancéreuses empêchant ainsi leur multiplication. Pour cela, une équipe pluridisciplinaire travaille sur la prise en charge du patient et utilise de nombreux outils spécifiques et de haute précision, qu’ils soient logiciels ou matériels. Dans l’application thérapeutique, ces rayonnements sont dirigés vers différents volumes prédéfinis comme suit :
Volume tumoral ou gross tumor volume (GTV) : correspond à la tumeur et aux tissus envahis macroscopiquement par du tissu cancéreux ; ils sont visibles grâce aux techniques d’imagerie.
Volume clinique ou clinical target volume (CTV) : correspond au volume tumoral ou lit d’exérèse (tissus adjacents à la tumeur suite à son extraction), additionné des tissus à forte probabilité d’envahissement infra clinique. Ces volumes peuvent être continus (tissus de proximité) ou discontinus (territoire ganglionnaire).
Volume planifié ou planning target volume (PVT) : correspond au volume clinique augmenté d’une marge dite de sécurité. Le principe de la marge de sécurité est d’intégrer la difficulté à positionner, de manière précise et reproductible, le volume cible dans le faisceau. Pendre en compte les imprécisions liées à l’installation du patient. C’est aussi le volume qui doit recevoir, de la manière la plus uniforme possible, la dose prescrite.
Volume traité ou treated volume (TV) : correspond au volume de tissus recevant une dose dont la valeur est au moins égale à la dose minimale du volume planifié.
Volume irradié ou irradiated volume (IV) : correspond au volume recevant une certaine proportion de la dose prescrite (par exemple 50%), suffisante pour être prise en compte par rapport à la tolérance des tissus traversés[19].
Malheureusement, malgré la définition de ces régions, la radiothérapie affecte les cellules saines qui se trouvent autour du volume cible[20] [2].
3.2 Radiation ionisante en radiothérapie
3.2.1 Différents rayonnements
La radiothérapie utilise deux types de rayonnements à savoir :
- Rayonnement de particules : il s’agit des électrons et protons possédant de masse et charge, issus des accélérateurs de particules.
- Rayonnement des ondes électromagnétiques : constitué de photon (rayon X et rayon gamma) de haute énergie sans masse ni charge.
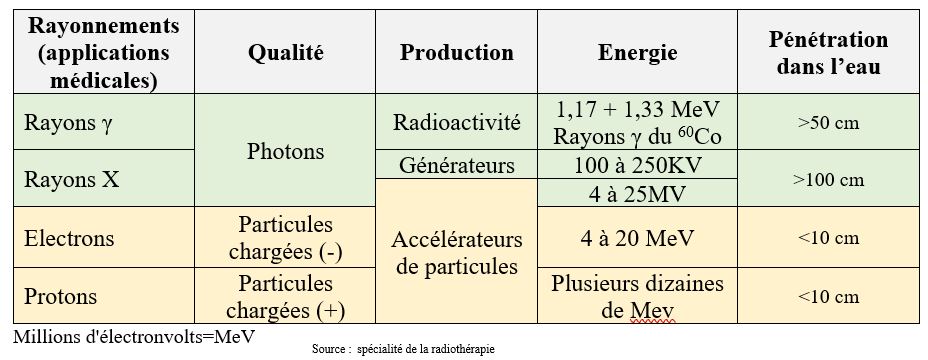
Le tableau 4 ci-dessous permet de classer les rayonnements selon leur qualité et leur production[21].
Tableau 4 : classification des rayonnements en radiothérapie

3.2.2 Objectifs des rayonnements
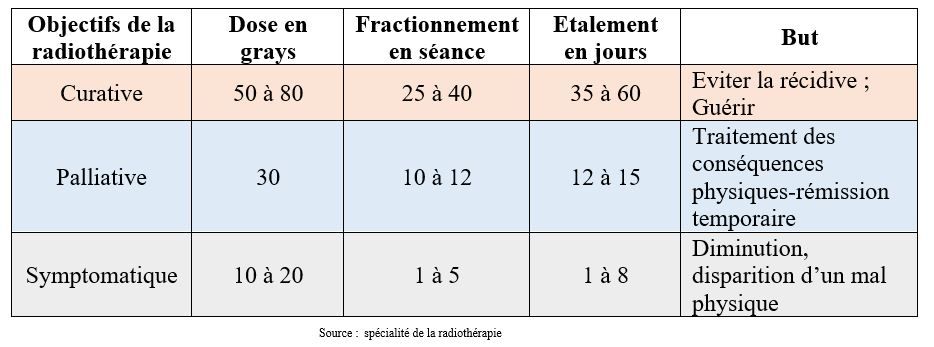
Associée ou non à la chirurgie ou la chimiothérapie, la radiothérapie a pour objectif de participer au contrôle de la maladie. Quand elle permet de guérir le patient, on parle de radiothérapie curative ; elle est palliative lorsqu’elle est utilisée dans le but de freiner la progression de la maladie et d’assurer au patient une rémission clinique dans les situations de dissémination métastatique ; et elle est dite symptomatique lorsqu’elle soulage le patient d’un symptôme gênant comme la douleur. Le tableau 5 ci-dessous présente la prescription selon les modalités adaptées au contexte de la maladie[21].
Tableau 5 : Prescription des doses en radiothérapie anti-cancéreuse

Rappel : GRAY : Unité du système international (SI) de dose absorbée lors d'une irradiation par des rayonnements ionisants. « Source : dictionnaire Larousse »
3.2.3 Types de radiothérapie
La radio-oncologie utilise deux différents types de radiothérapie, la radiothérapie externe et interne :
- Radiothérapie externe
La source de rayonnement est placée en dehors du patient. Le rayonnement peut être produit par une source radioactive comme le cobalt ou par un générateur ou un accélérateur de particules.
- Radiothérapie interne « cas de Curiethérapie »
À l’opposé du précédent, la source radioactive est placée à l’intérieur de l’organisme du malade sous forme scellée comme le césium, l’iridium ou l’iode. La curiethérapie est endocavitaire (endoluminale) quand la radioactivité est placée dans une cavité et endo-curiethérapie (interstitielle) lorsqu’elle est placée directement dans un organe[21].
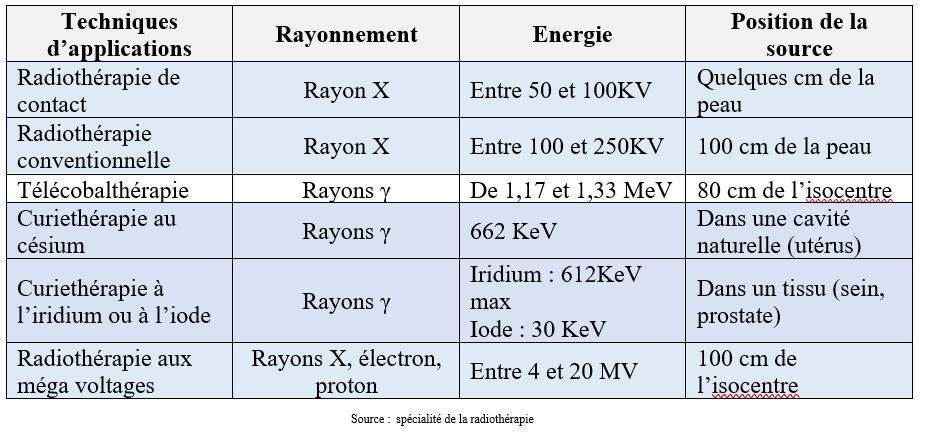
Le récapitulatif des techniques d’application des radiations ionisantes est présent dans le tableau 6.
Tableau 6 : Techniques d’application des radiations ionisantes

3.3 L’irradiation en radiothérapie
3.3.1 Pathologies cérébrales
Le traitement des pathologies en radiothérapie varie selon que la tumeur cérébrale est primaire (maligne ou bénigne) ou secondaire (métastase) :
- Tumeurs cérébrales malignes
La majorité des tumeurs primaires malignes du cerveau est des gliomes. C’est une catégorie de tumeurs qui se développent à partir des cellules gliales. Ils vont des astrocytomes pilocytiques, qui sont très rares et non invasifs, aux glioblastomes, la tumeur cérébrale maligne la plus fréquente chez les adultes, très invasifs et pratiquement incurables[12].
La nouvelle classification de l'Organisation mondiale de la santé basée sur les similitudes biologiques au sein des types de tumeurs plutôt que sur le comportement clinique approximatif, a opté pour la définition de grade des tumeurs en chiffre arabe “1,2,3,4” (Tableau 2) au profit de l’ancienne numération romaine (I, II, III, IV) afin de réduire les erreurs cliniques liées à la numérotation et aussi pour se conformer à la classification de l’OMS pour les autres tumeurs du corps[6]. Les gliomes de bas grade (1 & 2) représentent environ 5 % à 10 % de toutes les tumeurs du SNC et sont généralement guérissables par la chirurgie [12]. Lorsque la radiothérapie est associée à la chirurgie, le traitement est administré à dose faible (45-54 Gy) avec des marges restreintes, recommandée par National Comprehensive Cancer Network (NCCN). Cependant, les gliomes de hauts grades (3 & 4) sont souvent traités par chirurgie suivie de la radiothérapie à 60 Gy sur 6 semaines[12]. Malheureusement, presque tous les gliomes de hauts grades récidivent. Des doses de radiation suffisantes sont nécessaires pour maximiser ce bénéfice de survie[22].
- Tumeurs cérébrales bénignes
Les méningiomes sont les tumeurs cérébrales bénignes les plus fréquentes, suivis de schwannomes vestibulaires, les adénomes hypophysaires, les craniopharyngiomes et les paragangliomes. Dépendamment du grade et de l’histologie de la tumeur, la dose recommandée varie de 45 à 60 Gy à 1,8 ou 2 Gy par fraction[23].
- Métastase cérébrale
Les métastases cérébrales sont le plus souvent diagnostiquées chez les patients atteints de tumeurs malignes primaires déjà décelées. Toutefois, elles sont également présentes jusqu'à 30 % des patients lorsque la tumeur primaire est diagnostiquée[24]. Le choix du traitement par radiothérapie dépend du scénario clinique, y compris le nombre et le volume de métastases, la dose et le fractionnement de la radiothérapie planifiée, les options de traitement systémique, et les avantages prévus de la résection chirurgicale. Ainsi, la dose standard est de 30 Gy délivrées en 10 fractions ou 20 Gy en 5 fractions[25].
3.3.2 Techniques d’irradiation
- Radiothérapie externe
La radiothérapie externe est la forme la plus courante de traitement en radio-oncologie. Les différents types de radiothérapie externe sont présentés ci-dessous :
Radiothérapie conformationnelle 3D (RTC-3D)
La radiothérapie conformationnelle 3D permet de faire correspond le plus précisément possible le volume sur lequel vont être dirigés les rayons, au volume de la tumeur. Elle utilise les images en 3D de la tumeur et des organes avoisinants obtenus par imagerie (CT, IRM, PET). Les rayons sont dirigés vers la tumeur avec des caches en métal ou lames, fixés à l’appareil de radiothérapie, pour sculpter la dose de rayon autour de la tumeur tout en protégeant les zones saines. La limite de cette technique est que l’efficacité dépend de la position de l’organe à risque (OAR) par rapport au PVT (Tableau 7)[26].
Radiothérapie conformationnelle avec modulation d’intensité (RCMI, IMRT en anglais)
La radiothérapie avec modulation d'intensité représente la principale évolution de la RTC-3D, car elle permet une meilleure distribution de la dose dans le volume cible et la délivrance d'une irradiation hautement conforme à des volumes concaves et de forme irrégulière. Contrairement à la RTC-3D, l'intensité des faisceaux d'irradiation est délivrée sous la forme d'une séquence de nombreux petits faisceaux modulés par un collimateur multi-lames (MLC) de manière dynamique par balayage (fenêtre glissante) ou par paliers, en utilisant une planification informatisée sophistiquée par optimisation (planification inverse). La technique RCMI peut être utilisée pour délivrer différentes doses de rayonnement à différents volumes cibles en une seule phase, sous forme de boost intégré simultané. En revanche, cette technique est reconnue pour délivrer des doses intégrales aux tissus sains environnants, ce qui peut engendrer un risque élevé de tumeur secondaire au patient ayant une longue expérience de vie. L'incidence estimée du risque de cancer secondaire en utilisant la RCMI pour le traitement des tumeurs cérébrales est d'environ 130/10 000 personnes/an[27]. Il existe deux modes d’irradiation avec la RCMI :
RCMI statique (step and shoot en anglais) : les lames du collimateur multi-lames sont statiques pendant l’irradiation et se déplacent entre deux irradiations ;
RCMI dynamique (IMAT en anglais) : la modulation d’intensité est obtenue par le déplacement continu des lames durant l’irradiation[2].
Le tableau 7 ci-dessous est une comparaison de RTC-3D et IRMT dans le cas de traitement de gliomes [26]:
Tableau 7 : Comparaison de RTC-3D et IRMT

Source : https://doi.org/10.1016/j.radonc.2009.10.002.
Arcthérapie à modulation volumétrique (VMAT en anglais)
Une évolution de la technique RCMI dynamique est représentée par la VMAT, dans laquelle la dose de rayonnement est délivrée en continu pendant que le portique de l'accélérateur linéaire tourne autour du patient en décrivant un ou plusieurs arcs. La VMAT permet d'obtenir une distribution de dose très conforme à la tumeur, en modulant l'intensité du faisceau de rayonnement, le débit de dose et la vitesse de rotation du portique, tout en raccourcissant la durée du traitement et en réduisant le nombre d'unités moniteur délivré, par rapport à la RCMI classique[27]. Les patients traités par cette technique présentent une toxicité minime, se limitant généralement à une légère alopécie ou maux de tête[28].
Tomothérapie hélicoïdale
Grâce à la combinaison d’un système d’imagerie par scanner et d’un appareil de radiothérapie, la tomothérapie associe la technique de RCMI et le mode hélicoïdal pour obtenir la conformité de la dose à la tumeur en modulant l'intensité d'un faisceau en éventail rotatif à l'aide du collimateur multi-lames[27].
Radiothérapie du cerveau entier (WBRT en anglais)
La radiothérapie du cerveau entier utilise la technique traditionnelle de la radiothérapie pour traiter les patients atteints de métastases cérébrales, en particulier de métastases cérébrales multiples. La planification du traitement pour la WBRT, ne nécessite généralement aucune fusion d’image, car les frontières anatomiques du cerveau détermineront les frontières des champs de traitement. C’est une technique associée à un bon contrôle local, mais la survie globale est faible et les toxicités aiguës telles que l'alopécie, les maux de tête et les nausées, les effets tardifs des radiations comme le déclin neurocognitif a été identifié chez les patients traités par WBRT[28] [16].
Radiochirurgie Stéréotaxie (SRS en anglais)
L'irradiation stéréotaxique représente un raffinement supplémentaire de la RTC, avec l'avantage d'une meilleure immobilisation du patient grâce à l'utilisation d'un système stéréotaxique avec ou sans cadre, ce qui permet de repositionner le patient avec une précision submillimétrique. La SRS est fréquemment utilisée pour traiter les tumeurs cérébrales malignes ou bénignes, et est adoptée comme alternative à la WBRT pour les patients atteints de métastases cérébrales limités (≤ 4 lésions de diamètre < 3 cm) [27]. La planification du traitement par SRS nécessite la coregistration des séquences IRM et CT pour définir un GTV, avec une expansion de 0-2 mm par rapport au PTV[16]. Cette technique est favorable au control local de la tumeur et à la survie globale du patient. Néanmoins, elle présente souvent un risque de toxicité tardive liée à l'apparition d'une nécrose chez les patients, des déficits neurologiques notamment des crises d'épilepsie et des déficits moteurs et cognitifs[28].
Radiothérapie guidée par l'image (IGRT en anglais)
La radiothérapie guidée par l'image (IGRT) implique l'utilisation d'une imagerie fréquente du patient dans la salle de traitement par radiothérapie, dans le but d'améliorer la précision de l'administration du rayonnement tout au long d'un processus d'acquisition d'images, de comparaison avec les images de référence et de corrections de configuration[27]. Les différents systèmes utilisant l’IRGT sont :
- Le détecteur d'imagerie portale électronique (EPID en anglais), permet l'utilisation directe du faisceau de traitement et la possibilité d'obtenir des images pendant le traitement. L’EPID est basé sur un système à détection indirecte composé de 3 couches. La couche supérieure est une plaque métallique qui convertit les photons incidents en électrons et absorbe la diffusion à faible énergie. La couche intermédiaire est un phosphore scintillant qui convertit les électrons en photons visibles, et la troisième est le réseau de détecteurs. Le réseau de détecteurs est une matrice de paires de photodiodes et de transistors en couches minces, dont chacune forme un pixel ;
- L’imagerie CT à faisceau conique kV et MV (CBCT kV et MV), un système composé d'un tube à rayons X conventionnel rétractable et de détecteurs de rayons X en silicium amorphe montés soit orthogonalement à l'axe du faisceau de traitement, soit le long de l'axe du faisceau de traitement. Cette modalité fournit rapidement des ensembles de données volumétriques et est compatible avec une grande variété de sites anatomiques, de positions du patient et de dispositifs de positionnement ;
- L’imagerie IRM, un système composé de résonance magnétique à bas champ permettant l’amélioration du contraste des tissus mou par rapport au CBCT au cours du traitement. Cette modalité contribue donc à la diminution des marges du volume cible de planification, ce qui facilite l'augmentation de la dose et l'hypo-fractionnement[29].
Radiothérapie interne « Curiethérapie »
La curiethérapie, c'est-à-dire l'implantation chirurgicale d'isotopes radioactifs (125Iode ou 131Césium) soit au contact de la tumeur « insertion dans un applicateur qui a été placé contre la tumeur », soit dans la tumeur elle-même « introduction par de fins cathéters qui sont implantés à l’intérieur des tissus et de la tumeur ». C’est une technique d'irradiation conformationnelle qui permet de délivrer de fortes doses de rayonnement à des tumeurs cérébrales bien définies mesurant moins de 5 à 6 cm de diamètre. Elle peut être utilisée comme traitement primaire, comme traitement adjuvant ou comme traitement de la récidive de certaines tumeurs cérébrales et métastases. La curiethérapie pour les tumeurs cérébrales peut être divisée en trois grandes catégories : faible débit de dose (5 à 60 Gy/heure), haut débit de dose (100 à 200 Gy/min) et intra cavitaire, utilisée pour traiter les tumeurs kystiques[4] [3].
3.3.3 Technologies utilisées
Actuellement en radiothérapie il y a trois catégories d'équipements, dont chacun utilise une instrumentation et des sources de rayonnement différentes :
Le Gamma Knife, utilise 192 ou 201 faisceaux de rayons gamma au cobalt-60 disposé en hémisphère à l'intérieur d'une structure fortement blindée. Un collimateur primaire dirige le rayonnement émis par ces sources vers un point focal commun. Un deuxième casque collimateur externe, qui s'insère dans le collimateur primaire, comporte un ensemble de collimateurs amovibles en tungstène (un par source) avec des ouvertures circulaires d'une taille de 4 à 18 mm. La meilleure conformation de la tumeur est obtenue par une combinaison différente du nombre, de la taille et de la position des collimateurs (Figure 10).
Le Gamma Knife est principalement utilisé pour traiter les lésions intracrâniennes de taille petite à moyenne, en appliquant la technique de radiochirurgie stéréotaxique (SRS). Le traitement se fait en une seule séance, mais ne convient généralement pas aux cibles de plus de trois ou quatre centimètres[30] [27]. Le fabricant leader de cette technologie est ELEKTA.
Figure 10 : Exemple de machine Gamma knife
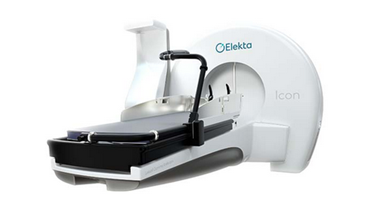
Source : www.elekta.com
L'accélérateur linéaire médical (LINAC en anglais), utilise la technologie des micro-ondes (semblable à celle utilisée pour les radars) pour accélérer les électrons dans une partie de l'accélérateur appelée "guide d'ondes", puis permet à ces électrons d'entrer en collision avec une cible en métal lourd pour produire des rayons X à haute énergie. Ces rayons X à haute énergie sont modelés à la sortie de la machine pour épouser la forme de la tumeur du patient et le faisceau personnalisé est dirigé vers la tumeur du patient. Le faisceau est généralement façonné par un collimateur à feuilles multiples intégré à la tête de la machine. Le patient est allongé sur une table de traitement mobile et des lasers sont utilisés pour s'assurer que le patient est dans la bonne position. La table de traitement peut se déplacer dans de nombreuses directions, notamment vers le haut, le bas, la droite, la gauche, l'intérieur et l'extérieur. Le faisceau sort d'une partie de l'accélérateur appelé "portique", qui peut tourner autour du patient. Le rayonnement peut être délivré à la tumeur sous de nombreux angles en faisant tourner le portique et en déplaçant la table de traitement (Figure 11).
LINAC est l'appareil le plus couramment utilisé pour les traitements des tumeurs de grande taille en une seule séance ou en plusieurs séances. Il est utilisé pour traiter tous les sites du corps, en utilisant les techniques conventionnelles, la radiothérapie à modulation d'intensité (IMRT), l'arc thérapeutique à modulation volumétrique (VMAT), la radiothérapie guidée par l'image (IGRT), la radiochirurgie stéréotaxique (SRS) et la radiothérapie stéréotaxique du corps (SBRT)[31]. Les principaux constructeurs de cette technologie sont : varian medical system, ELEKTA et Accuray.
Figure 11 : Exemple de machine LINAC
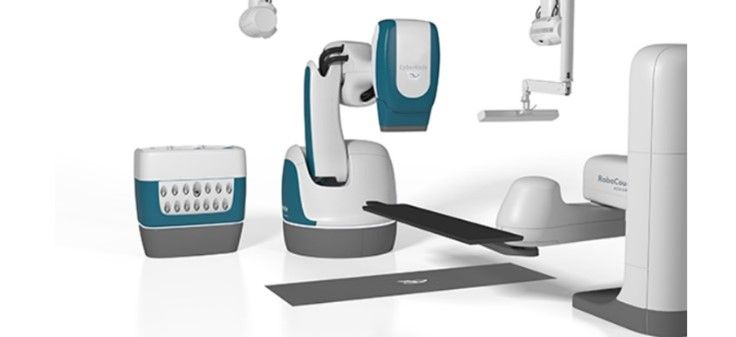 | 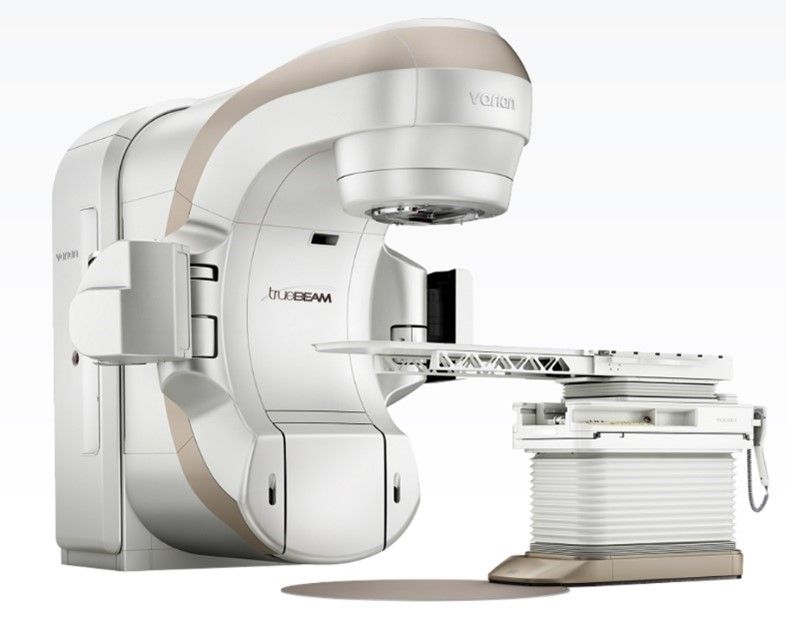 |
Source : www.accuray.com Source : www.varian.com
La radiochirurgie à faisceau de protons ou à particules lourdes, utilise des machines spéciales à base de proton tel que le cyclotron et le synchrotron pour générer et accélérer des protons à des vitesses pouvant atteindre 60 % de la vitesse de la lumière et des énergies allant jusqu'à 250 millions d'électron-volts. Ces protons à haute énergie sont dirigés par des aimants vers la salle de traitement, puis vers la partie spécifique du corps à traiter. Dans certains anciens appareils à protons, des équipements supplémentaires sont nécessaires pour modifier la portée des protons et la forme du faisceau. Les installations plus récentes procèdent à des ajustements similaires en réglant avec précision l'énergie du faisceau et les champs magnétiques qui guident sa trajectoire ("balayage du faisceau par crayon" ou "balayage du faisceau"). Ces modifications permettent de guider le faisceau de protons vers des endroits précis du corps où ils délivrent l'énergie nécessaire à la destruction des cellules tumorales (Figure 12).
Cette technologie est en particulier pour les tumeurs de petite taille, la dose de rayonnement peut se conformer beaucoup plus étroitement à la tumeur et il peut y avoir moins de dommages aux tissus sains. Actuellement, les doses de prescription pour les tumeurs et les contraintes OAR sont basées sur une efficacité biologique relative (EBR) générique et constante de 1,1 pour normaliser la dose physique à un équivalent photon. Il a été choisi de manière conservatrice pour assurer la couverture de la cible avec des prescriptions basées sur l'expérience des photons[32]. Le médecin peut donc administrer une dose encore plus importante à la tumeur tout en minimisant les effets secondaires indésirables. Ceci est particulièrement important pour le traitement des enfants, car les protons permettent de réduire les radiations sur les tissus en croissance et en développement[1]. Les principaux constructeurs de cette technologie sont : varian medical systems et Ion Beam Applications (IBA).
Figure 12 : Exemple de machine protonthérapie
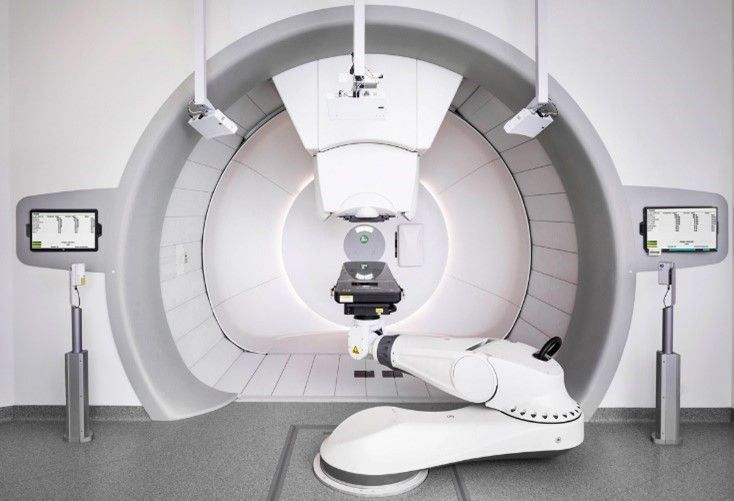 | 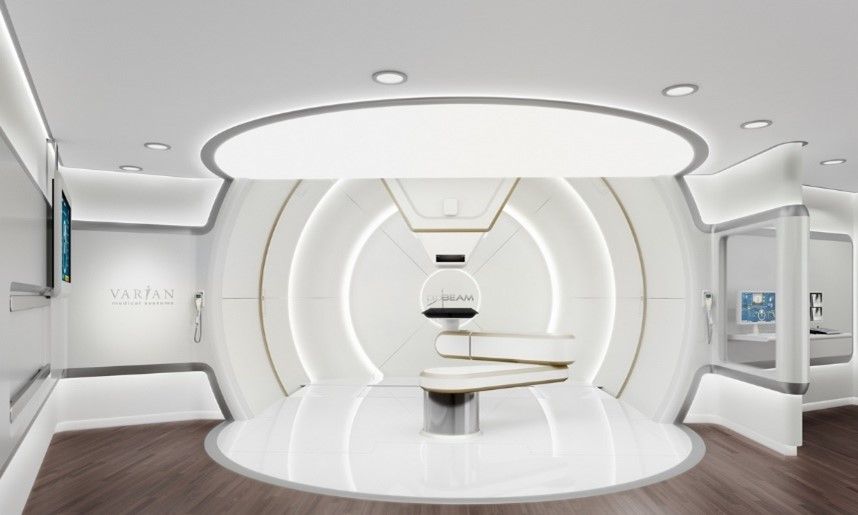 |
Source : iba-worldwide.com Source : www.varian.com
3.4 Place de l’imagerie en radiothérapie neuro-oncologie
3.4.1 Compétences indispensables
- SECRETAIRE MEDICALE : C’est une personne qui organise les rendez-vous de consultation et s’occupe de l’ensemble du dossier patient. Elle transmet au médecin les informations du patient.
- MANIPULATEUR/TRICE EN ELECTRORADIOLOGIE MEDICALE : C’est un spécialiste des scanners, des radios et des échographies. Il participe en radiothérapie aux diagnostics et traitements des maladies comme le cancer.
- MEDECIN RADIOTHERAPEUTE : C’est un médecin spécialiste dans le traitement du cancer par rayons. Il pose l’indication, prépare et réalise le traitement, détermine la zone à traiter, choisit la dose à prescrire, et fixe la manière dont les organes voisins seront protégés. Il recevra généralement le patient en consultation chaque semaine pour surveiller l’efficacité du traitement et sa tolérance.
- PHYSICIEN MEDICAL : le radiophysicien définit la balistique selon les prescriptions du médecin et s’assure du contrôle qualité des machines. Il propose le meilleur plan de traitement afin d’éviter les effets secondaires à court et long terme.
- DOSIMETRISTE : il appartient à l’unité de physique comme le physicien. Son rôle est de préparer le traitement en faisant un plan de traitement afin d’optimiser la dose dans la tumeur tout en protégeant les organes sains autour.
- INFIRMIERE : cette personne est souvent présente lors des consultations. Elle administre les soins et réalise les prises de sang éventuelles. Elle assiste parfois le médecin lorsqu’il examine le patient et est aussi à l’écoute du patient.
- AIDE-SOIGNANTE : elle aide le patient à s’habiller, déshabiller, monter sur la table d’examen. Elle peut aider aussi le médecin lors des consultations.
- NEURORADIOLOGUE : c’est un spécialiste des examens d'imagerie du crâne (dont l'imagerie cérébrale) et du rachis cervical, dorsal et lombaire. Il aide au diagnostic.
- NEURO-ONCOLOGUE : c’est un médecin spécialisé dans les cancers touchant le système nerveux comme le cerveau, la moelle épinière et les nerfs périphériques. Il participe à la prise en charge et suivi du patient.
- NEURO-CHIRURGIEN : encore appelé « chirurgien neurologue », il s’occupe des interventions chirurgicales liées au système nerveux.
3.4.2 Biomarqueurs des tumeurs cérébrales
Un biomarqueur est une caractéristique mesurable avec précision, utilisée comme indicateur d'une fonction du corps, d'une maladie ou de l'action d'un médicament[33]. En neuro-oncologie, l’imagerie IRM permet d’extraire des biomarqueurs d’imagerie incontournable dans le diagnostic et le suivi des tumeurs cérébrales. Par exemple pour les gliomes, les séquences standards sont : T1, T1-G, T2 et T2 Flair. T1 est une séquence anatomique hyposignal dont les tissus apparaissent plus sombres sur l’image permettant la mise en évidence de la tumeur tandis que T1-G est un T1 injecté de gadolinium, un produit de contraste permettant un rehaussement pondéré en T1. T2 est une séquence hypersignal dont les tissus apparaissent plus blancs sur l’image traduisant l’étendue de la tumeur, un œdème ou une inflammation et T2-Flair est un T2 avec le liquide céphalorachidien (CSF en anglais) en hyposignal[34].
Les techniques d'IRM avancées telles que : la diffusion (DWI), la perfusion (PWI) et spectroscopie par résonance magnétique (SRM) sont plus sensibles et/ou spécifiques aux processus biophysiques, cellulaires et micro-structurels. De plus, dans une enquête récente sur l’utilisation des techniques de l’IRM quantitative dans la pratique neuroradiologique clinique en Europe, l’IRM de diffusion (ADC) est utilisé à hauteur de 80% des répondeurs, l’IRM de perfusion (DCS, DCE) à 70% et la spectroscopie par résonance magnétique (N-acétyl aspartate, la choline, le lactate, les lipides et la créatine) à 65%[35]. Ces biomarqueurs d'imagerie sont couramment utilisés pour le pronostic et le suivi des approches thérapeutiques des tumeurs cérébrales.
3.4.3 Parcours patient en radiothérapie neuro-oncologie
- Consultation prétraitements
Le patient est généralement référé au centre de la radiothérapie par les différentes spécialités médicales (oncologue, chirurgien). Ensuite, son dossier passe en réunion de concertation pluridisciplinaire (RCP) constitué de neurochirurgien, neuro-oncologue, médecin radiothérapeute, neuroradiologue et pathologiste, afin de discuter du dossier patient et ainsi de soumettre au choix du patient un plan personnalisé de soin le plus adapté à sa pathologie, à ses antécédents et à sa volonté. Après la RCP, le médecin radiothérapeute reçoit le patient en consultation.
Lors de cette consultation, le médecin radiothérapeute expliquera les bénéfices attendus par le traitement de la radiothérapie ainsi que les effets indésirables qui peuvent survenir pendant et après le traitement. Après la consultation avec le médecin radiothérapeute où il aborde toutes les questions relatives au traitement et le temps à passer avec le personnel soignant, suivra la consultation paramédicale.
- Imagerie pour la préparation des traitements
La consultation paramédicale ou la simulation a pour but principal de définir l’isocentre et la position de traitement. Cette identification se fait à l’aide de la tomodensitométrie (CT) avec des accessoires comme les contentions thermoformées. La contention est appliquée sur le visage du patient et fixée à la table du CT, et a pour but d’assurer une bonne reproductibilité en salle de radiothérapie. Dans certaines centres, le CT offre la possibilité de faire des séries d’images à l’aide d’un système de synchronisation respiratoire (gating) afin de déterminer et de reproduire la meilleure phase respiratoire pour l’irradiation[2] [20].
- Coregistration des données d’imagerie et délinéation des volumes d’intérêt
Selon la pratique en radiothérapie, une fois les images reconstruites, le médecin radiothérapeute dépendamment du centre va impliquer le neuro-oncologue, le neurochirurgien et le neuroradiologue dans la réalisation de la délinéation appelée familièrement « contourage » des volumes cibles ainsi que des organes à risques. Il s’agit de délimiter le volume PVT, constitué du volume GTV, le CTV et la marge de sécurité (0-2mm). Le médecin se sert des séquences anatomiques IRM pour faire le contourage, parce que T1 et T2 permettent la localisation précise de la tumeur, généralement, il s’agit du T1-G et T2-Flair. D’habitude cette étape se faire manuellement, mais depuis peu, l’utilisation des atlas par localisation anatomique (organes à risque) et d’intelligence artificielle (tumeurs) permet son automatisation.
Après le contourage, suivra la coregistration de l’imagerie IRM contourée avec l’imagerie CT de planification. Actuellement les cliniciens utilisent soit de la coregistration par recalage rigide soit élastique, mais le plus courant en neuro-oncologie est le recalage rigide. Il permet donc au médecin de visualiser d’éventuels changements entre les deux modalités d’imagerie. La prescription médicale est alors complétée par la détermination du fractionnement en tenant compte des paramètres cliniques (type histologique, le volume de la lésion ou encore le type de technique)[2] [20].
- Planification du traitement
À partir de la prescription médicale, est réalisé le plan de traitement, comprenant la planification dosimétrique et la définition de la balistique (énergie du faisceau, angles/arcs d’incidence du faisceau, etc.). La dosimétrie est établie en fonction de la localisation à traiter, des organes à risques présents dans la zone d’irradiation ainsi que du matériel disponible dans le centre. Le plan dosimétrique contient le calcul de dose nécessaire à partir des acquisitions d’imagerie CT de diagnostic. La majorité des logiciels actuels sont basées sur un algorithme de Monte Carlo. Il existe actuellement d’autres solutions nommées « pseudo-synthetic » qui permettent le calcul de dose à partir de l’imagerie IRM de diagnostic, une méthode en cours de validation. Le plan balistique consiste à choisir le type de particules ionisantes (photon, électron ou proton). Selon le type de particules retenues, le choix de la balistique déterminera la méthode de traitement. Par exemple pour les photons, il y a deux types de plan balistique : direct « correspondant à une méthode simple et rapide de création de balistique de traitement » et indirecte « correspondant à une construction balistique basée sur la modulation d’intensité (IMRT et VMAT) ».
Le plan de traitement est élaboré par des physiciens médicaux et dosimétristes, à l’aide du logiciel de planification de traitement ou Treatment Planning System (TPS). Les TPS sont généralement composés des éléments suivants :
- une base de données rassemblant les caractéristiques et données physiques des équipements du centre qui produisent des rayonnements ionisants. Une modélisation spécifique de chaque énergie, de chaque accélérateur du centre est obligatoirement réalisée avant son utilisation clinique ;
- différents outils d’imagerie pour manipuler des séries d’images DICOM ;
- des algorithmes mathématiques permettant un calcul de dépôt de dose à travers un modèle d’interaction rayonnement/matière.
- des algorithmes de planification inverse utilisés pour les traitements complexes (IMRT et VMAT) ;
- une interface graphique permettant l’affichage du dépôt de dose dans les trois dimensions de l’espace et sous forme d’histogramme dose-volume (HDV).
Le plan de traitement réalisé est validé conjointement avec le médecin prescripteur de manière à vérifier qu’elle réalise un bon compromis entre couverture des volumes cibles et épargne des organes à risques permettant des effets secondaires acceptables pour le patient[2] [20].
- Positionnement pré-traitement et délivrance du traitement
La préparation du traitement ayant été effectuée et validée, la phase d'exécution du traitement peut débuter. Il s'agit en premier lieu à faire l’assurance qualité, qui consiste à un contrôle secondaire des dispositifs médicaux et des plans de traitement des patients à l’aide de fantômes. Suivra, la phase de la délivrance où le manipulateur va installer le patient avec les mêmes contentions que lors de la simulation. Durant cette phase, l'imagerie radiographique (EPID, CBCT) embarquée dans l’accélérateur linéaire est utilisée pour repositionner le patient et parfois pour la replanification offline du plan de traitement selon la morphologie de la tumeur au cours du traitement. Pour les accélérateurs linéaires associés à l’IRM « IRM-LINAC », le repositionnement et la replanification du plan de traitement peuvent se faire en temps réel et présentent le bénéfice de ne pas être ionisants, et fournissent aussi plus d’informations anatomiques sur les tissus mous que la CBCT. D’autres outils spécifiques complémentaires ont été développés comme le gating où l’accélérateur ne va réaliser un faisceau que sur une phase de mouvement déterminée ; et des systèmes permettant un tracking où l’accélérateur ne stoppera pas son faisceau et va le synchroniser au mouvement.
- Suivi lors de la délivrance du traitement
Cette étape comporte deux (2) défis majeurs, le premier consiste à pouvoir maîtriser la délivrance de rayonnement en temps réel, par la suite vérifier la cohérence entre le calcul et ce qui est réellement délivré au patient à travers des mesures pendant et après le traitement.
Le premier défi est réalisé par les systèmes d’information oncologique (OIS) ou R&V pour Record and Verify. Il s’agit des logiciels de vérification de données entre le traitement programmé et l’état de l’accélérateur linéaire.
Le second défi est souvent réalisé par la dosimétrie in vitro, en mesurant la dose délivrée par le faisceau soit via un détecteur posé sur le patient dans le champ de traitement (méthode classique), soit via un détecteur portal situé après le patient, on parle de dosimétrie de transit[2] [20].
- Suivi post-traitement
Le suivi post-traitement commence généralement dans les six semaines après le traitement. Il consiste à suivre le patient pendant au moins cinq (5) années. Durant cette étape, le médecin radiothérapeute et/ou neuro-oncologue compare suivant des périodes déterminées la récente et l’ancienne imagerie d’IRM du patient pour faire des analyses cliniques et d’imageries afin d’évaluer les effets secondaires du traitement et la réponse au traitement.
- Dossier ou rapport post traitement
Le rapport de traitement contenant la prescription de dose, les paramètres d'installation, le calcul de dose et le formulaire d'enregistrement de la dose quotidienne ; représente un outil de travail important en radiothérapie, non seulement pour la compilation de données, mais aussi pour le mode de communication entre médecins, physiciens, dosimétriste et manipulateurs (Annexe 5). Il est généralement constitué[36]:
- Résumé des prescriptions ;
- Fiche de traitement regroupant les informations sur l’identité, localisation, position, contentions, paramètres de chacun des faisceaux et les doses ;
- Radiographie numérique reconstruite (DRR en anglais) ;
- Histogrammes de dose volume (HDV) ;
- Isodoses ou organes à risque ;
- Vue 2D ou 3D ;
- Préparation des mesures de dosimétrie in vivo (DIV) ;
- Mise sur le réseau informatique (R&V) des données en vue du traitement du patient.
- Difficultés de suivi en imagerie
La radiothérapie peut avoir trois conséquences, selon le moment où elle se produit et la présentation clinique. Il peut s’agir de la radionécrose, la mort des tissus à la suite de la radiothérapie ; de la pseudo-progression, définie comme une augmentation de la taille de la tumeur primaire ou l’apparition d’une nouvelle lésion suivie d’une régression tumorale ; ou de la progression de la tumeur.
Cependant, aucune technique neuro-radiographique n’a suffisamment démontré la différence entre ces trois phénomènes liés au traitement du patient. Bien que certains profils radiographiques sur les séquences IRM conventionnel (T1, T1-G, T2), tels que l’implication du corps calleux avec une propagation sous-épendymaire ou des lésions multiples de rehaussement, soient plus cohérents avec une maladie progressive qu’une pseudo-progression, pourtant ces profils ne sont pas assez répandus ou fiables pour classer tous les changements radiographiques comme la nécrose. Ce phénomène biologique est la difficulté à laquelle sont confrontés les cliniciens et les neuroradiologues lors du suivi post traitement. Des techniques d'imagerie avancées (DWI, PWI, SRM) et les stratégies basées sur la TEP sont actuellement à l'étude pour pallier les insuffisances de l’IRM conventionnel[37] [38].
3.4.4 Politique de remboursement
- EUROPE
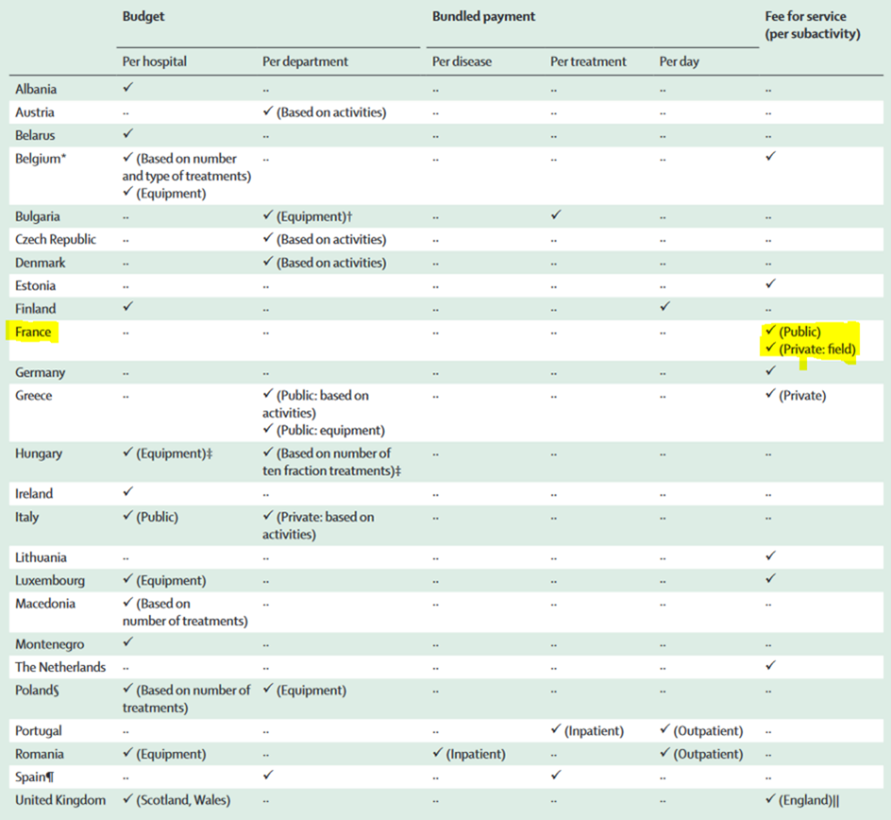
Le système de remboursement européen est basé sur trois différents types de remboursement. Le remboursement financé par définition du budget « Italie, Belgique », paiement groupé « Espagne, Portugal » et rémunération à l’acte « France, Allemagne » (Tableau 8) (Rappel 2). Chaque système inclut un remboursement spécifique en fonction du plan de fractionnement, des différentes techniques ou types de patients. Par exemple, la France rembourse essentiellement le secteur public sur les différents plans de fractionnement, techniques et les traitements effectués avec la machine Cyberknife ou Tomotherapy d'Accuray ou avec la technologie SRS de Brainlab ; cependant, la Grèce rembourse le secteur privé et fait une distinction entre le rayonnement au cobalt et les accélérateurs linéaires. De plus, il existe un autre remboursement basé sur les indications cliniques selon le type de cancer (sein, prostate, poumon, cerveau). Dans le cas des tumeurs cérébrales notamment les métastases cérébrales, l’enquête publiée en 2020 par le groupe ESTRO-HERO a révélé que le remboursement de la radiothérapie de l'ensemble du cerveau (WBRT) est plus élevé que la radiochirurgie crânienne stéréotaxique (SRS) dans seulement quatre pays de l’Europe (Denmark, France, Luxembourg, Macedonia) [39].
Tableau 8 : Description du type de système de remboursement appliqué dans chaque pays
Source : https://www.sciencedirect.com/science/article/pii/S1470204519307946
Rappel 2 :
- *Le budget est défini comme un montant annuel payé pour fournir des services de radiothérapie.
- *Le budget de l'hôpital fait référence au budget de la radiothérapie inclus dans le budget de l'hôpital.
- *Le budget départemental désigne le budget spécifique du service de radiothérapie.
- *Le paiement groupé fait référence à un paiement unique qui couvre toutes les activités et ressources nécessaires pour fournir des traitements dans un cycle total de soins pour la condition médicale d'un patient spécifique.
- *Le paiement par maladie fait référence au paiement par type de maladie, par pathologie (codes de la classification internationale des maladies) ou par diagnostic (groupe lié au diagnostic), ou les deux, qui peut également être pondéré par la procédure, l'âge, le sexe, le statut de sortie et la présence de complications ou de comorbidités.
- *Le paiement par traitement inclus le traitement pendant une période définie, couvrant au moins le coût de la préparation et de l'administration du traitement, indépendamment du nombre de fractions.
- *Le paiement journalier comprend le paiement d'une fraction quotidienne, où toutes les fractions prises ensemble représentent le traitement, couvrant au moins le coût de la préparation et de l'administration du traitement.
- *La rémunération à l'acte est un modèle de paiement dans lequel les activités du traitement ou du parcours de soins sont dégroupées et payées séparément.
- USA
Le système de remboursement des USA est basé sur la rémunération à l’acte appelé « Medicare fee-for-service (FFS) ». Cette rémunération est payée différemment selon le cadre clinique. Par exemple, les services professionnels et techniques sont payés selon Medicare Physician Fee Schedule (PFS) lorsque ces services sont fournis par des centres de radiothérapie indépendant, et dans les services hospitaliers les professionnels sont payés par le PFS, mais les services techniques sont payés selon l’Outpatient Prospective Payment System (OPPS).
Dans le cadre du PFS, Medicare part B (Rappel 3) paie les services fournis par les médecins, physiciens, les infirmières, les assistants médicaux et les kinésithérapeutes. Ces paiements sont basés sur les ressources relatives généralement utilisées pour fournir le service. Le service est identifié soit par un code CPT (Current Procedural Terminology), administré par l'American Medical Association, soit par un code HCPCS (Healthcare Common Procedure Coding System) de niveau II, géré par Centers for Medicare and Medicaid Services (CMS) à des fins programmatiques. Les ressources relatives de chaque code sont mesurées en unités de valeur relative (RVU) pour chacune des trois composantes d'un service : (1) le travail professionnel, reflète le temps et l'intensité relatifs associés à la prestation du service ; (2) les frais de pratique comprennent à la fois les dépenses indirectes, comme l'espace de bureau, et les dépenses directes, comme l'équipement et les fournitures utilisés dans une procédure particulière ; et (3) la faute professionnelle, reflète les coûts de l'assurance contre les fautes professionnelles.
L’Outpatient Prospective Payment System (OPPS) paie les services ambulatoires hospitaliers désignés, certains services Medicare Part B fournis à des patients hospitalisés lorsque le paiement de Medicare Part A (Rappel 3) ne peut être effectué. Les services de radio-oncologie sont inclus dans les services ambulatoires couverts payés par l'OPPS. Dans le cadre de l'OPPS, les services individuels décrits par des codes CPT® ou HCPCS de niveau II sont affectés à des groupes de paiement appelés Ambulatory Payment Classifications (APC). Les APC de radiothérapie de l'OPPS sont actuellement organisés en deux niveaux du plus bas au plus haut coût : les niveaux 1-3 pour la préparation du traitement et les niveaux 1-7 pour l'administration du traitement [40]. Par exemple, les tumeurs cérébrales sont couvertes à 80 % avec une franchise prédéfinie par Medicare Part B. Toutefois, si le patient est hospitalisé, Part A peut couvrir les séjours hospitaliers et certains médicaments sauf les traitements par voie orale sur ordonnance, couverts par Part D. Pour une couverture à 100 %, le patient doit souscrire au plan d’assurance Medigap, qui réduit le partage des coûts requis dans les Part A et B [41].
Rappel 3 :
- Part A : couvre l’hospitalisation ;
- Part B : couvre les services professionnels et ambulatoires (incluant les médicaments administrés par les professionnels) ;
- Medigap est une assurance complémentaire Medicare.
La radiothérapie a connu une évolution technique et technologique importante au cours de ces dernières années. Malgré cette progression, des améliorations restent à apporter surtout au niveau des solutions de planification du traitement et du diagnostic de suivi pendant et post traitement. D’une part, des solutions automatiques de contourage des organes à risque et de la tumeur sont importants pour améliorer la précision du plan de traitement. D’autre part, l’introduction de l’IRM-LINAC en routine clinique pourrait améliorer l’analyse d’imagerie et le plan de traitement lors de la délivrance du traitement. Mais cette technologie nécessite selon les cliniciens, une modification importante des pratiques et un apport conséquent en ressources humaines dans le service de radiothérapie. Enfin, la standardisation des techniques d’imagerie avancées pourrait répondre au dilemme diagnostic des résultats post traitement.
Chapitre 4 : Macro-Business « CONFIDENTIEL »
Dans ce chapitre, je ferai avec l’assistance des différents services (commercial, marketing) l’évaluation de la faisabilité économique du produit de base.
4.1 Etudes de marché
Grâce à la veille documentaire, je vais analyser les données pour estimer la taille du marché et proposer les portes d’entrée sur le marché européen et américain.
4.2 Concurrences
Grâce à la veille documentaire et aux entretiens, je vais énumérer les principaux acteurs du domaine, leurs produits ainsi que leur part de marché.
4.3 Minimums requis
Le minimum requis est défini à la suite des entretiens effectués avec les acteurs intervenant dans le parcours patient en radiothérapie. Nous avons eu l’opportunité de discuter avec deux (2) médecins radiothérapeutes, quatre (4) physiciens médicaux et un (1) ingénieur biomédical. Ce qui a permis d’une part, d’énumérer les besoins cliniques et industriels, d’autre part proposer un produit de base pouvant permettre à OLEA MEDICAL de pénétrer le marché de la radiothérapie.
4.4 Estimation de l’effort
L’objectif est d’apporter des informations nécessaires sur la possibilité de réaliser le produit. Ainsi, je ferai l’analyse de faisabilité technique en étudiant la capacité technique des solutions de l’entreprise (Olea Sphere et la solution en développement) et la faisabilité économique en estimant l’effort humain (interne et externe).
4.5 Potentiel de prise de marché
Je vais discuter avec les commerciaux pour analyser le potentiel de pénétration de l’entreprise dans le domaine de la radiothérapie.
4.6 Coût
Pour estimer le coût, je fais d’abord le Business model ensuite le business plan.
4.7 Estimation point mort
Je vais avec l’assistance du service marketing, estimer la durée maximum pour que le produit soit rentable économiquement pour l’entreprise.
Chapitre 5 : Apports du stage
Au cours de ce stage de fin d’études, j’ai pu participer à des formations comme la gestion de projet organisée par le département solution clinique, des journées de travail du groupe neuro et un congrès à Milan. Ces séances de travail dont les valeurs sont vraiment centrées sur l’amélioration du workflow du radiologue et l’amélioration de la prise en charge du patient, sont pour moi une expérience très enrichissante. De plus, les missions qui m’ont été confiées ont servi à mon développement professionnel et personnel.
J’avais une mission de chef de projet sous un responsable de solutions cliniques chargée des solutions dédiées à la neuroimagerie. Le métier de chef projet est essentiel pour toutes entreprises, puisque c’est un poste associant maîtrise technique et capacité de gouvernance. Dans le département solutions cliniques, le rôle du chef projet est centré sur les études exploratoires de possibles futurs produits de l’entreprise.
Cependant, j’ai réalisé d’une part le QQOQCP (Annexe 1) pour mieux cadrer la problématique, ensuite le Gantt (Annexe 2) pour la planification des tâches et la durée d’exécution, après le diagramme cause-effet (Annexe 3) pour identifier les causes possibles pour que le livrable ne soit par inachevé et enfin le diagramme en arbre (Annexe 4) pour trouver les alternatives aux causes. Je me suis aussi impliqué dans certaines tâches comme la proposition de cliniciens pour améliorer notre compréhension du parcours patient afin d’énumérer les besoins de la radiothérapie. Cela m’a fait réaliser l’importance et les engagements du métier.
Ainsi, grâce aux missions, j’ai pu monter en compétences en conduite de projet, la pratique de l’anglais, la veille technologique et bibliographique. Le métier de chef de projet est donc en adéquation avec mes valeurs professionnelles.
Conclusion
Les tumeurs du système nerveux central (SNC) sont rares et leur cause n'est pas bien comprise. La radiothérapie est l’un des traitements les plus utilisés dans la prise en charge de ces tumeurs. Quel que soit le type de radiothérapie (interne ou externe), la place de l’imagerie est capitale. En radiothérapie externe, l’imagerie intervient dans toutes les phases du traitement de la maladie. Les examens de scanner (CT) et l’IRM sont nécessaires pour le diagnostic, la simulation, la planification du traitement, la délivrance du traitement et le suivi post traitement.
Ce stage a permis à travers le parcours patient en radiothérapie neuro-oncologie, d’identifier les besoins du domaine comme le contourage automatique des volumes cibles, les difficultés de suivi patient en imagerie ainsi que les contraintes liées à la nouvelle technologie IRM-LINAC.
À travers ce projet, j’ai eu l’opportunité d’appliquer certains enseignements de l’UTC liés à la gestion de projet. J’ai aussi amélioré mes compétences techniques, stratégiques et linguistiques en conduite de projet. Ce qui me permet d’affirmer que l’objectif de mon Master en Ingénierie de la Santé est atteint.
Bibliographie
[1] R. S. of N. A. (RSNA) and A. C. of Radiology (ACR), « Proton Therapy », Radiologyinfo.org. https://www.radiologyinfo.org/en/info/protonthera (consulté le 11 mars 2022).
[2] E. Berenger et al., « ASTRO 2018 : état de l’art en radiothérapie », IRBM News, vol. 40, no 3, p. 75‑108, mai 2019, doi : https://doi.org/10.1016/j.irbmnw.2019.02.002.
[3] B. Chitti et al., « The role of brachytherapy in the management of brain metastases : a systematic review », J. Contemp. Brachytherapy, vol. 12, no 1, p. 67‑83, févr. 2020, doi : https://doi.org/10.5114/jcb.2020.93543.
[4] J. H. Suh et G. H. Barnett, « BRACHYTHERAPY FOR BRAIN TUMOR », Hematol. Oncol. Clin. North Am., vol. 13, no 3, p. 635‑650, juin 1999, doi : https://doi.org/10.1016/S0889-8588(05)70080-0.
[5] « Full Text PDF ». Consulté le : 11 février 2022. [En ligne]. Disponible sur : https://tel.archives-ouvertes.fr/tel-01740330/document
[6] David N. Louis et al., « The 2021 WHO Classification of Tumors of the Central Nervous System : a summary », Oxf. Univ. Press Behalf Soc. Neuro-Oncol., juin 2021, doi : https://doi.org/doi:10.1093/neuonc/noab106.
[7] « 900-world-fact-sheets.pdf ». Consulté le : 11 février 2022. [En ligne]. Disponible sur : https://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf
[8] « 31-Brain-central-nervous-system-fact-sheet.pdf ». Consulté le : 10 février 2022. [En ligne]. Disponible sur : https://gco.iarc.fr/today/data/factsheets/cancers/31-Brain-central-nervous-system-fact-sheet.pdf
[9] C. O. Johnson et al., « Global, regional, and national burden of stroke, 1990–2016 : a systematic analysis for the Global Burden of Disease Study 2016 », Lancet Neurol., vol. 18, no 5, p. 439‑458, mai 2019, doi : https://doi.org/10.1016/S1474-4422(19)30034-1.
[10] A. P. Patel et al., « Global, regional, and national burden of brain and other CNS cancer, 1990–2016 : a systematic analysis for the Global Burden of Disease Study 2016 », Lancet Neurol., vol. 18, no 4, p. 376‑393, avr. 2019, doi : https://doi.org/10.1016/S1474-4422(18)30468-X.
[11] M. C. Chamberlain, C. S. Baik, V. K. Gadi, S. Bhatia, et L. Q. M. Chow, « Systemic therapy of brain metastases : non–small cell lung cancer, breast cancer, and melanoma », Neuro-Oncol., vol. 19, no 1, p. i1‑i24, déc. 2016, doi : https://doi.org/10.1093/neuonc/now197.
[12] L. B. Nabors et al., « Central Nervous System Cancers, Version 3.2020, NCCN Clinical Practice Guidelines in Oncology », J. Natl. Compr. Canc. Netw., vol. 18, no 11, p. 1537‑1570, nov. 2020, doi : https://doi.org/10.6004/jnccn.2020.0052.
[13] P. R. Ng, B. D. Choi, M. K. Aghi, et B. V. Nahed, « Surgical advances in the management of brain metastases », Neuro-Oncol. Adv., vol. 3, no Suppl 5, p. v4‑v15, nov. 2021, doi : https://doi.org/10.1093/noajnl/vdab130.
[14] Q. T. Ostrom, C. H. Wright, et J. S. Barnholtz-Sloan, « Chapter 2 - Brain metastases : epidemiology », in Handbook of Clinical Neurology, vol. 149, D. Schiff et M. J. van den Bent, Éd. Elsevier, 2018, p. 27‑42. Consulté le : 23 février 2022. [En ligne]. Disponible sur : https://www.sciencedirect.com/science/article/pii/B9780128111611000025
[15] M. Valiente et al., « The Evolving Landscape of Brain Metastasis », Trends Cancer, vol. 4, no 3, p. 176‑196, févr. 2018, doi : https://doi.org/10.1016/j.trecan.2018.01.003.
[16] N. Wijetunga et T. Yang, « A radiation oncology approach to brain metastases », Front. Neurol., vol. 11, août 2020, doi : https://doi.org/10.3389/fneur.2020.00801.
[17] X. Lin et L. M. DeAngelis, « Treatment of Brain Metastases », J. Clin. Oncol., vol. 33, no 30, p. 3475‑3484, oct. 2015, doi : https://doi.org/10.1200/JCO.2015.60.9503.
[18] « ald_30_gp_cancer_snc_edite_2011-04-08_09-38-48_889.pdf ». Consulté le : 16 février 2022. [En ligne]. Disponible sur : https://www.has-sante.fr/upload/docs/application/pdf/2011-04/ald_30_gp_cancer_snc_edite_2011-04-08_09-38-48_889.pdf
[19] J.-P Dillenseger, E. Moerschel, et C. Zorn, Guide des technologies de l’imagerie médicale et de la radiothérapie, 2e éd. Elsevier Masson, 2016. [En ligne]. Disponible sur : https://www.elsevier-masson.fr/guide-des-technologies-de-limagerie-medicale-et-de-la-radiotherapie-9782294752018.html
[20] V. Chassin, N. Dehaynin, J. Le Bourhis, B. Nord, H. Szymczak, et P. Meyer, « Mission ESTRO 2019 : focus physique en radiothérapie », IRBM News, vol. 41, no 1, p. 100228, févr. 2020, doi : https://doi.org/10.1016/j.irbmnw.2019.100228.
[21] A. C. Nonnotte, « Spécificités de la radiothérapie », Elsevier Connect, Consulté le : 25 février 2022. [En ligne]. Disponible sur : https://www.elsevier.com/fr-fr/connect/imagerie-medicale/specificites-de-la-radiotherapie
[22] S. Lapointe, A. Perry, et N. A. Butowski, « Primary brain tumours in adults », The Lancet, vol. 392, no 10145, p. 432‑446, juill. 2018, doi : https://doi.org/10.1016/S0140-6736(18)30990-5.
[23] G. Dissaux et al., « Radiotherapy of benign intracranial tumours », Cancer/Radiothérapie, vol. 26, no 1, p. 137‑146, avr. 2022, doi : https://doi.org/10.1016/j.canrad.2021.08.005.
[24] D. K. Mitchell, H. J. Kwon, P. A. Kubica, W. X. Huff, R. O’Regan, et M. Dey, « Brain metastases : An update on the multi-disciplinary approach of clinical management », Neurochirurgie, vol. 68, no 1, p. 69‑85, janv. 2022, doi : https://doi.org/10.1016/j.neuchi.2021.04.001.
[25] T. Siu et F. F. Lang, « Chapter 15 - Surgical Management of Cerebral Metastases », in Schmidek and Sweet Operative Neurosurgical Techniques (Sixth Edition), A. Quiñones-Hinojosa, Éd. Philadelphia : W.B. Saunders, 2012, p. 178‑191. Consulté le : 4 mars 2022. [En ligne]. Disponible sur : https://www.sciencedirect.com/science/article/pii/B9781416068396100152
[26] D. Wagner, H. Christiansen, H. Wolff, et H. Vorwerk, « Radiotherapy of malignant gliomas : Comparison of volumetric single arc technique (RapidArc), dynamic intensity-modulated technique and 3D conformal technique », Radiother. Oncol., vol. 93, no 3, p. 593‑596, déc. 2009, doi : https://doi.org/10.1016/j.radonc.2009.10.002.
[27] C. Scaringi, L. Agolli, et G. Minniti, « Technical Advances in Radiation Therapy for Brain Tumors », Anticancer Res., vol. 38, no 11, p. 6041‑6045, nov. 2018, doi : https://doi.org/10.21873/anticanres.12954.
[28] A. Andrevska, K. A. Knight, et C. A. Sale, « The feasibility and benefits of using volumetric arc therapy in patients with brain metastases : a systematic review », J. Med. Radiat. Sci., vol. 61, no 4, p. 267‑276, déc. 2014, doi : https://doi.org/10.1002/jmrs.69.
[29] JenniferDe Los Santos, Richard Popple, Nzhde Agazaryan, et John E. Bayouth, « Image Guided Radiation Therapy (IGRT) Technologies for Radiation Therapy Localization and Delivery | Elsevier Enhanced Reader », p. 33‑45, sept. 2013, doi : https://doi.org/10.1016/j.ijrobp.2013.02.021.
[30] R. S. of N. A. (RSNA) and A. C. of Radiology (ACR), « Gamma Knife », Radiologyinfo.org. https://www.radiologyinfo.org/en/info/gamma_knife (consulté le 11 mars 2022).
[31] R. S. of N. A. (RSNA) and A. C. of Radiology (ACR), « Linear Accelerator », Radiologyinfo. https://www.radiologyinfo.org/en/info/linac (consulté le 11 mars 2022).
[32] H. Paganetti et al., « Roadmap : proton therapy physics and biology », Phys. Med. Biol., vol. 66, no 5, p. 05RM01, févr. 2021, doi : https://doi.org/10.1088/1361-6560/abcd16.
[33] « Les biomarqueurs en cancérologie », Fondation contre le cancer. https://www.cancer.be/le-cancer/examens-m-dicaux/biomarqueurs/les-biomarqueurs-en-canc-rologie (consulté le 12 mai 2022).
[34] S. C. Thust et al., « Glioma imaging in Europe : A survey of 220 centres and recommendations for best clinical practice », Eur. Radiol., vol. 28, no 8, p. 3306‑3317, mars 2018, doi : https://doi.org/10.1007/s00330-018-5314-5.
[35] Marion Smits, « MRI biomarkers in neuro-oncology », vol. 17, août 2021, doi : https://doi.org/10.1038/ s41582-021-00510-y.
[36] « UE 4.8 DOSIMETRIE », wordpress « FICHES MANIP », 15 mars 2017. https://fichesmanip.wordpress.com/2017/03/15/ue-4-8-dosimetrie/ (consulté le 30 mars 2022).
[37] T. J. Kruser, M. P. Mehta, et H. I. Robins, « Pseudoprogression after glioma therapy : a comprehensive review », Expert Rev. Neurother., vol. 13, no 4, p. 389‑403, janv. 2014, doi : https://doi.org/10.1586/ern.13.7.
[38] K. Parvez, A. Parvez, et G. Zadeh, « The Diagnosis and Treatment of Pseudoprogression, Radiation Necrosis and Brain Tumor Recurrence », Int. J. Mol. Sci., vol. 15, no 7, p. 11832‑11846, juill. 2014, doi : https://doi.org/10.3390/ijms150711832.
[39] Y. Lievens et al., « How public health services pay for radiotherapy in Europe : an ESTRO–HERO analysis of reimbursement », Lancet Oncol., vol. 21, no 1, p. e42‑e54, janv. 2020, doi : https://doi.org/10.1016/S1470-2045(19)30794-6.
[40] A. B. Mariotto, L. Enewold, J. Zhao, C. A. Zeruto, et K. R. Yabroff, « Medical Care Costs Associated with Cancer Survivorship in the United States », Cancer Epidemiol. Biomarkers Prev., vol. 29, no 7, p. 1304‑1312, oct. 2020, doi : https://doi.org/10.1158/1055-9965.EPI-19-1534.
[41] « Medicare Coverage for Brain Tumors », End Brain Cancer. https://endbraincancer.org/portfolio-item/medicare-coverage-for-brain-tumors/ (consulté le 16 avril 2022).
Annexes
Annexe 1 : QQOQCP
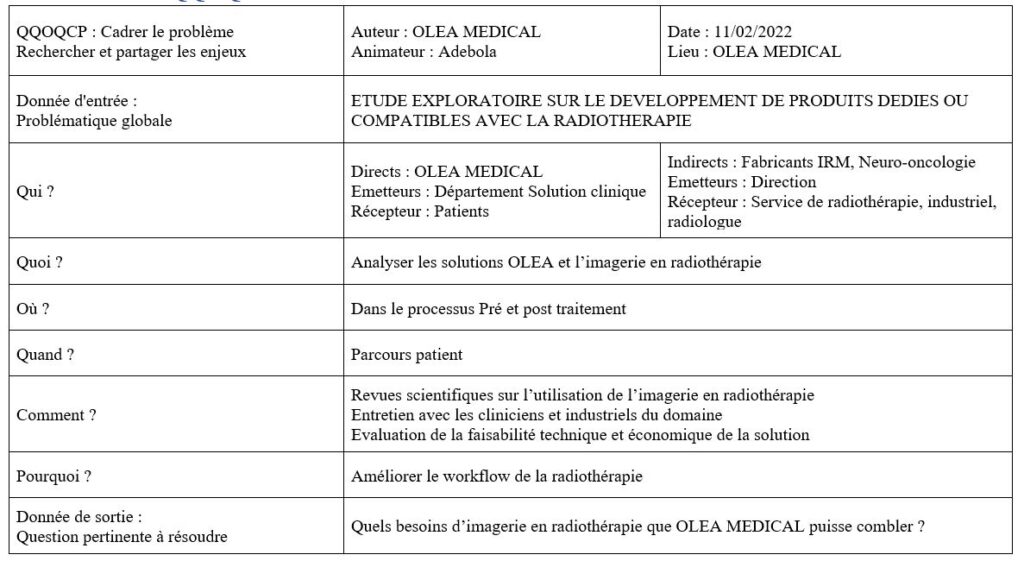
Annexe 2 : GANTT
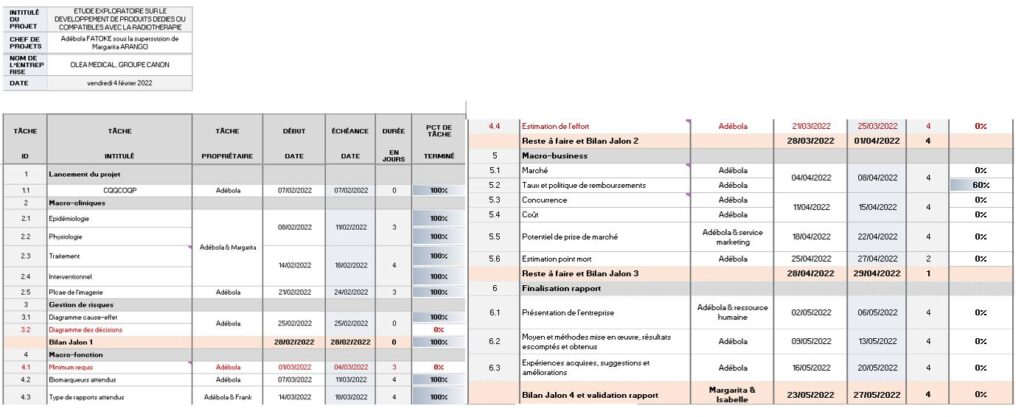
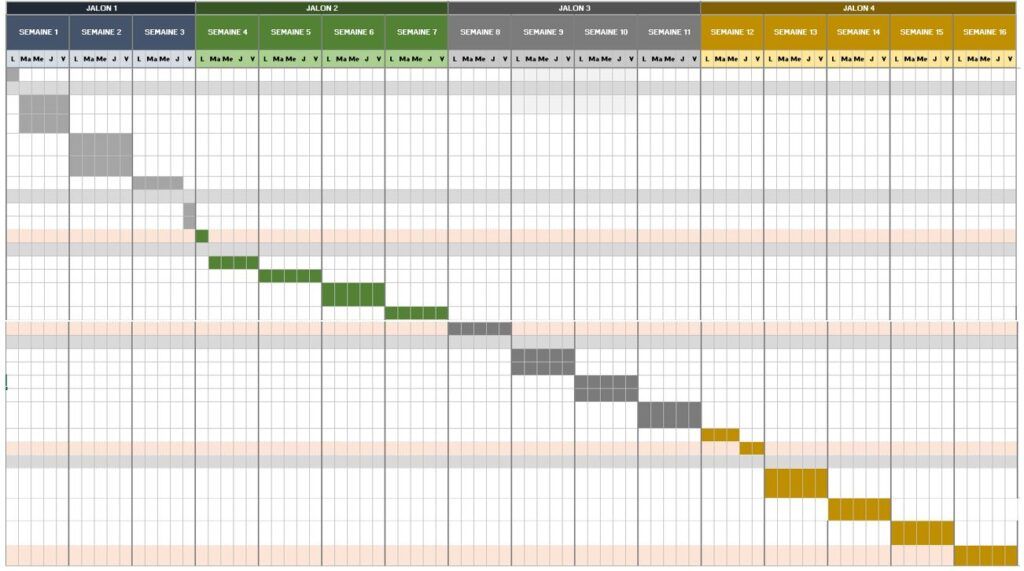
Annexe 3 : DIAGRAMME CAUSES-EFFETS
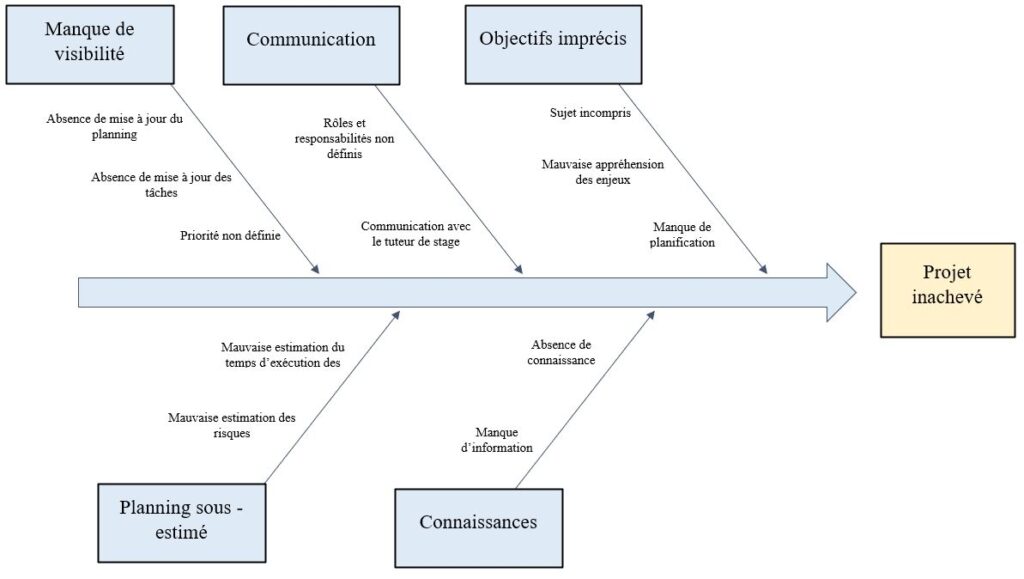
Annexe 4 : DIAGRAMME EN ARBRE
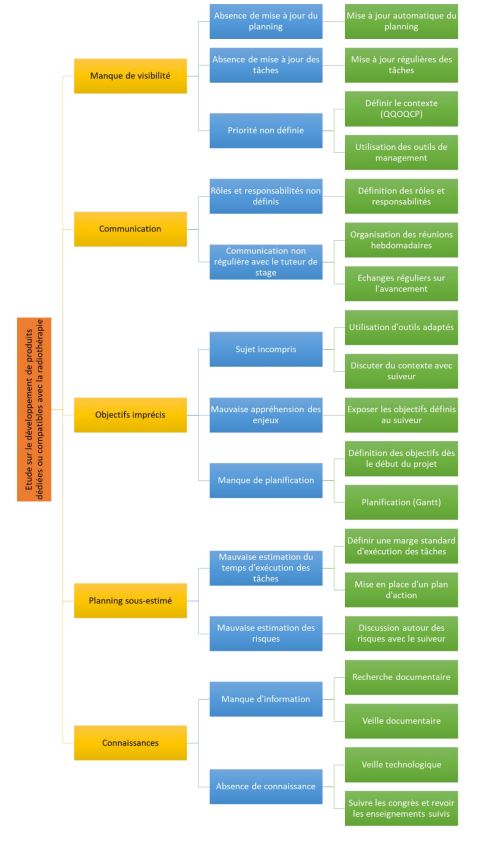
Annexe 5 : MODELE DE DOSSIER DE TRAITEMENT
