IDS209 - Évolution du parcours patient insuffisant cardiaque grâce aux dispositifs médicaux implantables
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs




Contacts
- Alizée BOZOR : alizee.bozor@hotmail.fr
- Ali Az-eddine CHAKIRI : ali.azeddine.chakiri@gmail.com
- Swann GHEUNG : swanngheung@gmail.com
- Asmae NADIM : asmaenadim@gmail.com
Citation
A rappeler pour tout usage : A. BOZOR, A.CHAKIRI, S.GHEUNG, A.NADIM « Évolution du parcours patient insuffisant cardiaque grâce aux dispositifs médicaux implantables », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Projet, https://travaux.master.utc.fr/, réf n° IDS209, https://doi.org/10.34746/ids209, janvier 2024, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids209/
Glossaire
AV : Atrioventriculaire
AVC : Accidents Vasculaires Cérébraux
ARS : Agence régionale de Santé
BAV : Balloon Aortic Valvuloplasty
CHU : Centre Hospitalier Universitaire
CRT : Cardiac Resynchronisation Therapy
ECG : Electrocardiogramme
ETO : Échocardiographie Transœsophagienne
FA : Fibrillation Atriale
FDA : Food and Drug Administration, équivalent du marquage CE aux États-Unis
FEVG : Fraction d’éjection Ventriculaire Gauche
HAS : Haute Autorité de Santé
HFpEV : Insuffisance Cardiaque à Fraction d'éjection préservée
HFrEV : Insuffisance Cardiaque à Fraction réduite
IA : Intelligence Artificielle
IC : Insuffisance Cardiaque
ICC : Insuffisance Cardiaque Chronique
IECA : Enzyme de Conversion de l'Angiotensine
IRC : Insuffisance Rénale Chronique
NP : Peptides Natriurétiques
RCP : Réunion de Concertation Pluridisciplinaire
SA : Sténose Aortique
SA : Sino-Auriculaire
SAVR : Surgical Aortic Valve Replacement
SRAA : Système Rénine-Angiotensine-Aldostérone
STS : Society Thoracic Surgeons
TAVI : Transcatheter Aortic Valve Implantation
Résumé
Les maladies cardiovasculaires sont l’une des affections les plus représentées en France. Afin de soigner et d’améliorer la qualité de vie des personnes touchées, de nombreuses avancées médicales font émerger de nouvelles technologies et innovations des plus novatrices et de moins en moins invasives. Parmi celles-ci on distingue : les nouveaux défibrillateurs actifs sans sonde endocavitaire, les pacemakers miniaturisés, ou encore une nouvelle alternative moins invasive au remplacement de la valve aortique ou mitrale avec le TAVI et le MitraClip. Ces technologies permettent une réelle évolution dans la qualité de la prise en charge des patients.
Toutefois, malgré des avancées prometteuses, toutes ne présentent pas réellement de plus-value notamment au yeux des praticiens. S’ajoutent à cela de nombreux freins en termes de coût, d’accessibilité et de temps de démocratisation de l’utilisation des nouveaux dispositifs. Ainsi, aujourd’hui, une collaboration entre les industries et le personnel de santé est indispensable afin que les dispositifs futurs répondent aux besoins réels du terrain, garantissant une certaine qualité des soins cardiovasculaires futurs.
Abstract
Cardiovascular diseases are among the most common conditions in France. In order to treat and improve the quality of life for those affected, researches are made to create new technologies and innovations less invasive. Among these we distinguish : new active leadless defibrillators, miniaturized pacemakers such as the MICRA, or even a new less invasive alternative to replacement of the aortic or mitral valve with the TAVI and the MitraClip. These technologies definitely improve the way patients are treated.
However, despite promising advances, some of them do not really present any added value, particularly in the eyes of caregivers. Plus there are numerous difficulties in terms of cost, accessibility and duration of release of those new devices. Thus, today, collaboration between industries and health workers is essential so that future devices meet the real needs on the ground, guaranteeing a certain quality of future cardiovascular care.
Téléchargements

Évolution du parcours patient insuffisant cardiaque grâce aux dispositifs médicaux implantables
Introduction
L’innovation est au cœur de notre société et au service de notre santé. Les moyens mis en œuvre sont colossaux, la France mobilise 7 milliards d’euros dans le plan innovation santé 2030 [1]. Les enjeux de tels investissements sont motivés par la qualité des recherches et progrès ouvrant d’immenses possibilités pour le soin et le confort des patients. Aujourd’hui les maladies cardiovasculaires provoquent le décès de 17 millions de personnes par an dans le monde, soit environ 30% des décès [2]. Des solutions médicamenteuses et surtout technologiques existent pour soigner et améliorer la vie des individus atteints de telles maladies. Cependant, les avancées techniques sont rapides et il n’est pas évident de suivre l’ensemble des nouveautés pour soigner et améliorer la vie des patients atteints d’insuffisance cardiaque pour laquelle le cœur nécessite notamment un dispositif implantable.
Dans ce contexte, une question se pose : L'évolution des dispositifs médicaux implantables cardiaques a révolutionné le traitement de l’insuffisance cardiaque, comment ces innovations améliorent-elles le parcours patient ?
Ainsi ce travail a pour intention de décrire dans un premier temps le contexte et les enjeux de l’étude. Puis, les maladies les plus courantes responsables de l’insuffisance cardiaque seront détaillées afin de mieux comprendre le mécanisme d’apparition de ce trouble. Ensuite, les améliorations du parcours patient, dans le cadre du traitement de l’insuffisance cardiaque, permise grâce aux nouveaux dispositifs médicaux implantables cardiaques seront mises en avant. Enfin, un point sera fait sur les limites et perspectives d’avenir de ces dispositifs.
Contexte et enjeux
L’insuffisance cardiaque est une maladie chronique et grave dont on ne guérit pas et qui touche environ 64 millions de personnes dans le monde dont 1.5 million de personnes en France en 2022 [3],[4], avec une prévalence qui augmente avec l’âge. En effet 10% des plus de 75 ans en sont atteints. On dénombre 73 000 décès par an et environ 50% des patients meurent dans les trois années qui suivent le diagnostic [4]. Dû au vieillissement de la population, le nombre de personnes atteintes devrait augmenter de 25% tous les quatre ans, durant les prochaines années [3]. Plusieurs pathologies sont responsables de l'insuffisance cardiaque comme les coronaropathies, valvulopathies, troubles du rythme cardiaque [5]. C’est une maladie qui génère donc d’importants coûts de santé annuel, notamment en termes de prise en charge, de traitements qui sont généralement suivis à vie, d’hospitalisation (200 000/an), de morbidité et d'utilisation des ressources de soins de santé associées [6]. Une bonne prise en charge de cette maladie afin de mieux la diagnostiquer et traiter est donc un enjeu de santé publique. Ainsi, il est important de détecter la maladie à son stade le plus précoce pour prévenir les éventuelles complications qui vont non seulement impacter la vie des personnes touchées, mais aussi augmenter le coût en dépense de santé. Toutefois, même si sa fréquence augmente énormément, les symptômes restent inconnus de la population. Entre 400 000 et 700 000 de personnes ne savent pas qu’elles en souffrent [3]. Si elle n’est pas traitée, la maladie peut dégénérer en décompensation de l’insuffisance cardiaque qui nécessite une hospitalisation [3]. L'enjeu ici est de stabiliser la maladie et de la maintenir dans cet état le plus longtemps possible. Cela afin d’assurer la meilleure qualité de vie possible aux patients. Cela passe généralement par un maintien d’une hygiène de vie stricte, notamment en ajustant son régime alimentaire et en pratiquant une activité physique régulière et adaptée. En termes de traitement de la maladie, en première alternative, les traitements médicamenteux permettent de diminuer les symptômes et ralentissent la propagation de la maladie. Toutefois, ces traitements sont souvent sources d’effets indésirables. De plus, si ce type de traitement n’est pas ou n’est plus suffisant, il y a alors recours aux dispositifs médicaux implantables cardiaques. Ceux-ci ont permis de transformer la vie de milliers de patients. Aujourd’hui, ils en existent de nombreux, divers et variés, employant de nouvelles techniques, de nouveaux matériaux, équipements et procédures. Électronique, mécanique, biologique ou pharmaceutique, du stents à la valve en passant par le pacemaker, les possibilités d’innovations et de progrès dans ce domaine sont donc nombreuses. Il est alors intéressant de faire un état de l’art des nouveautés disponibles sur le marché en matière de dispositifs cardiaques implantables et comment elles transforment le travail des soignants ainsi que le confort des patients.
I. Physiopathologie, diagnostic et premier traitement de l'insuffisance cardiaque
Dans cette partie vous trouverez les informations nécessaires à la bonne compréhension de ce travail notamment sur le fonctionnement et apports des nouvelles technologies autour des dispositifs cardiaques implantables.
A. Comprendre le fonctionnement du cœur
Le cœur, un organe musculaire vital, voir figure n°1, est situé dans la cage thoracique, derrière le sternum et légèrement décalé vers la gauche chez la plupart des individus. Il mesure environ 1,5 fois la taille d'un poing. Une paroi épaisse le divise en deux parties distinctes, la partie gauche et la partie droite, chacune abritant une oreillette et un ventricule, reliés par une valve cruciale dans la circulation sanguine.
Le cœur fonctionne comme une pompe, grâce à des contractions rythmées pour propulser le sang à travers tout l'organisme. Garantissant ainsi une distribution adéquate d'oxygène à chaque cellule. Chaque jour, il pompe environ 8 000 litres de sang.
Quatre valves cardiaques sont stratégiquement positionnées entre les oreillettes et les ventricules d'une part, et à la sortie des ventricules de l'autre, jouant un rôle crucial en empêchant le reflux sanguin indésirable lorsqu'elles sont fermées. Lors de leur fermeture, ces valves émettent le son caractéristique du battement cardiaque, témoignant du bon fonctionnement du cœur [7].
Figure n°1 : Vue générale du coeur
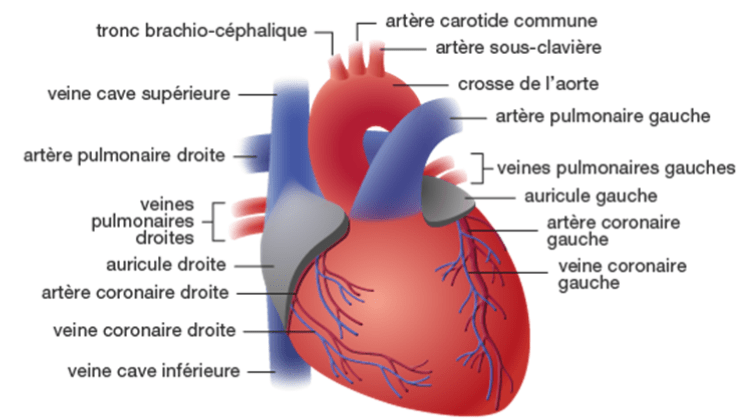
Source : Https://www.chuv.ch/fr/transplantation/cto-home/patients-et-familles/coeur/anatomie-et-physiologie
La circulation du sang à travers le cœur est permise par une séquence d'impulsions électriques qui coordonne chaque mouvement. Les contractions du muscle cardiaque sont déclenchées par un processus électrique qui prend naissance dans une région spécifique, située en haut de l'oreillette droite, connue sous différents noms tels que le nœud sinusal, le nœud sino-atrial, le nœud sino-auriculaire, ou le nœud de Keith et Flack. Ce nœud sinusal est responsable de la génération de décharges électriques spontanées, à un rythme d'environ 100 par minute. L'activité électrique de ce nœud est sous le contrôle du nerf vagal, qui a pour effet de modérer la fréquence à environ 70 décharges par minute, notamment au repos.
Cette activité électrique initiée par le nœud sinusal et influencée par le nerf vagal a pour conséquence la contraction des oreillettes du cœur, permettant ainsi le transfert du sang qu'elles contiennent vers les ventricules. Cependant, cette activité électrique ne s'arrête pas aux oreillettes. Elle se propage vers la partie inférieure du cœur, atteignant une autre région située entre les oreillettes, appelée le nœud atrioventriculaire ou auriculo-ventriculaire, également connu sous le nom de nœud d'Aschoff-Tawara.
À partir de ce nœud, l'activité électrique se propage dans les ventricules grâce à des fibres spéciales de conduction, parfois appelées le faisceau de His. Ces fibres sont organisées en deux branches distinctes, l'une destinée au ventricule gauche et l'autre au ventricule droit. Lorsque l'activité électrique atteint les ventricules, ils se contractent de manière synchronisée, propulsant le sang qu'ils renferment respectivement dans l'aorte (pour le ventricule gauche) ou l'artère pulmonaire (pour le ventricule droit). Ce processus électrique et mécanique est perçu comme le pouls [8].
Le sang désoxygéné converge vers l'oreillette droite, et est propulsé ensuite dans le ventricule droit par une contraction. Une valve, appelée valve tricuspide en raison de ses trois feuillets, se referme, évitant ainsi le reflux. Le ventricule droit envoie le sang vers le tronc pulmonaire, guidé la valve pulmonaire, qui s'ouvre pour permettre au sang de passer vers les poumons dans lesquels il s'enrichit en oxygène. Le sang oxygéné retourne au cœur, passant par l'oreillette gauche, puis est propulsé dans le ventricule gauche. La valve mitrale se ferme pour empêcher le reflux. Le ventricule gauche, stimulé par l'activité électrique du nœud atrioventriculaire (AV), envoie le sang oxygéné dans l'aorte, scellé par une dernière valve, la valve aortique. Les artères distribuent ce sang dans tout l'organisme.
Le réseau coronaire, également appelé système vasculaire coronaire, est un ensemble d'artères et de veines à la surface du cœur. Ce réseau assure l'approvisionnement en sang du muscle cardiaque, le myocarde, en oxygène et nutriments. Le réseau coronaire comprend principalement deux grandes artères : l'artère coronaire gauche et l'artère coronaire droite, qui se ramifient en de nombreuses branches plus petites. Ces artères se trouvent le long de la surface extérieure du cœur et irriguent différentes parties du myocarde, voir figure n°2.
Lorsque le cœur bat, le sang circule à travers le réseau coronaire pour fournir de l'oxygène et des nutriments au myocarde. Cela maintient la santé et la fonction du muscle cardiaque, assurant ainsi que le cœur peut pomper le sang dans tout le corps de manière efficace [9].
Figure n°2 : Détails de la circulation sanguine dans le coeur
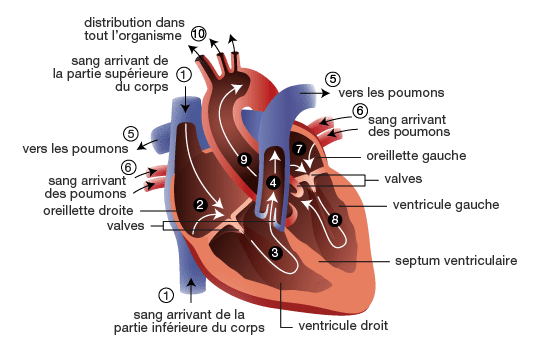
Source : Https://www.chuv.ch/fr/transplantation/cto-home/patients-et-familles/coeur/anatomie-et-physiologie
B. Physiopathologie des maladies provoquant l’insuffisance cardiaque
B.1 Description de l’insuffisance cardiaque
L’insuffisance cardiaque se définit comme un syndrome clinique complexe causé par une anomalie cardiaque qui altère la capacité du ventricule à se remplir ou à éjecter du sang. Afin de maintenir un fonctionnement physiologique, des mécanismes compensatoires, cellulaires et moléculaires sont activés par l’organisme [10], [11], [12], [13]. On observe alors une augmentation de l’activité des systèmes nerveux sympathiques, et du système rénine-angiotensine-aldostérone (SRAA) ce qui va augmenter la pression artérielle afin d’obtenir une meilleure perfusion sanguine [10], [13]. On observe aussi une modification du volume d’éjection et du débit cardiaque. Ces évènements compensatoires peuvent également entraîner une détérioration supplémentaire du myocarde et sont associés parallèlement à des signes et symptômes cliniques différents. L’IC est généralement classée en fonction de la fraction d’éjection ventriculaire gauche (FEVG). On distingue deux types d’insuffisance cardiaque [14].
- L’insuffisance cardiaque systolique (HFrEV) , se caractérise par une perte de la capacité du myocarde à pomper une quantité suffisante de sang lors de la systole. On parle ici de dysfonctionnement systolique ventriculaire gauche où la fraction d’éjection ventriculaire gauche est réduite (⩽40% )[11]. Ainsi, le débit cardiaque est directement diminué par une réduction de la fonction ventriculaire gauche [10]. L’ICC résulte souvent d’une une atteinte cardiaque directe tels que les coronaropathie, les valvulopathies ou les cardiomyopathie [14].
- L’insuffisance cardiaque diastolique (HFpEV) connaît la croissance la fulgurante. Jusqu’à 40 à 50 % des patients atteints d’insuffisance cardiaque souffrent d’insuffisance cardiaque diastolique et la mortalité globale est similaire à celle de l’insuffisance cardiaque systolique [10]. Elle se caractérise par une fonction systolique ventriculaire gauche normale (FEVG > 40%) mais pour lesquels des pressions de remplissage plus élevées sont nécessaires pour obtenir un volume diastolique final normal du ventricule gauche. Ainsi, le débit cardiaque est compromis par une mauvaise compliance ventriculaire, une relaxation altérée et une aggravation de la pression diastolique [10]. L’insuffisance cardiaque diastolique résulte souvent d’anomalies cardiaques dues à des comorbidités (obésité, maladie rénale chronique (IRC), bronchopneumopathie chronique obstructive). Elle est associée à la libération accrue de peptides natriurétiques (NP) [14].
L’insuffisance cardiaque systolique et diastolique ne s’excluent pas mutuellement. En effet, chez les patients atteints d’insuffisance cardiaque présentant une insuffisance systolique du ventricule gauche, des anomalies diastoliques sont souvent également observées et inversement. On parle alors d’insuffisance de milieu de gamme (FEVG = 40–49 %).Aujourd’hui, au-delà du traitement pharmacologique, les traitements interventionnels et chirurgicaux offrent de nouvelles chances dans la prise en charge de l’insuffisance cardiaque [13]. Afin de s’assurer de l’amélioration et de la mise en place de ces approches thérapeutiques une compréhension des mécanismes pathologies et facteurs de risques sous-jacents est essentielle. La partie qui suit y est dédiée.
B.2 Les maladies coronariennes
La coronaropathie ou maladie coronarienne peut être responsable de l’insuffisance cardiaque, cette partie apporte un support de connaissance suffisant sur cette pathologie à la bonne compréhension du travail.
Les chiffres autour de cette pathologie sont marquants, en effet 3,9 % des décès en France sont liés aux coronaropathies et l'Assurance Maladie recense environ 800 000 patients en affection de longue durée liée aux maladies coronariennes [15]. Les personnes souffrant de maladies coronariennes sont donc majoritairement représentées chez les patients atteints d'insuffisance cardiaque.
L’athérosclérose est la grande responsable des coronaropathies, elle a été décrite pour la première fois au XVIIIème siècle, le réseau coronaire était alors qualifié de “de véritables tuyaux ossifiés” [16]. En effet, l’athérosclérose est responsable de la rigidification et de la diminution de la lumière des vaisseaux du système vasculaire. Ce phénomène est lié à une réaction inflammatoire entre les lipoprotéines modifiées, les macrophages, les lymphocytes T et les cellules de la paroi artérielle. Les cellules musculaires lisses et la matrice extracellulaire des coronaires tendent alors à cicatriser face à l’inflammation. Cependant le processus de cicatrisation comporte des défauts et laisse dans la lumière des vaisseaux sanguins des plaques d’athéromes. Ces dernières étant des amoncellements de glucides, de tissus fibreux, de lipides, de produits du sang et de dépôts calcaires [17], [18], [19].
Figure n°3 : Illustration d’une plaque d’athérome
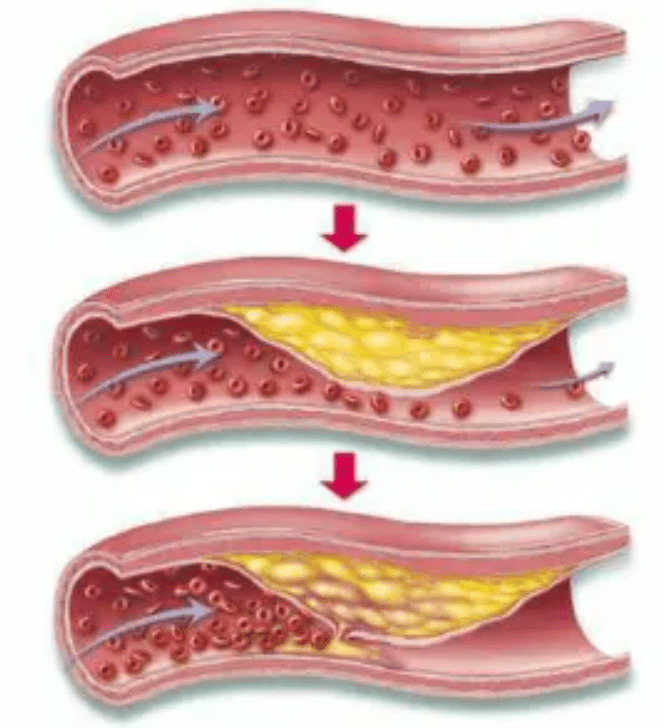
Source : https://www.santescience.fr/atherosclerose/
Comme figuré sur la figure n°3, on remarque alors un rétrécissement qui peut être plus ou moins important des vaisseaux qui impacte la perfusion myocardique c’est-à-dire l'apport sanguin vers le muscle cardiaque. En cas d'obstructions d'artères coronaires, le myocarde n’est plus oxygéné et ne peut plus évacuer ses déchets comme l’acide lactique. L’accumulation de cet acide lactique provoque une forte douleur thoracique principalement à l’effort, il s’agit du même phénomène que pour une crampe musculaire. Enfin un trop faible apport en oxygène amène alors une mort des cellules privé de sang et provoque une nécrose d’une partie des tissus du myocarde, c’est l’infarctus. Le diagnostic de maladies coronariennes s’appuie sur plusieurs types d’examens : de l’ECG à la scintigraphie en passant par l’échographie et le scanner.
B.3 Troubles du rythmes cardiaques
Les troubles du rythme cardiaque, également appelés arythmies cardiaques, sont une maladie courante qui touchent de nombreuses personnes à tout âge. Le nombre est en constante croissance dû au vieillissement de la population, certaines sont temporaires et bénignes notamment grâce au moyen de dépistage. Cependant d’autres formes peuvent être mortelles.
En temps normal chez un individu adulte au repos le rythme cardiaque est compris entre 50 et 100 battements par minute [20]. On parle de troubles du rythme cardiaque lorsque les battements du cœur sont irréguliers sans raison physiologique apparente mais cela peut influer sur la quantité de sang que le cœur va pomper. Dans la plupart des cas les symptômes sont souvent non perceptibles, mais lorsqu’ils le sont, le patient ressent des palpitations, des douleurs thoraciques , des vertiges/évanouissements . Ces troubles lorsqu’ils perdurent provoquent une fatigue le cœur ce qui fatigue le patient, provoque des essouflements, de l’anxiété et jusqu'à des confusions ou étourdissements [21].
Il existe deux grands types d’arythmie :
- les complications dites cardiaques : sans traitement elles fatiguent le cœur et mènent ce dernier à ne plus assurer sa fonction et ni s’adapter à la vie quotidienne du patient.
- les complications dites vasculaires : la formation de caillot est favorisée suite à la mauvaise circulation sanguine dans les cavités du cœur. Des caillots se détachent et peuvent provoquer des AVC (accidents vasculaires cérébraux) ou des embolies pulmonaires [8].
Le trouble du rythme cardiaque le plus courant est la fibrillation atriale, en France presque un million de personnes en sont atteintes, deux millions estimés en 2050, avec 10% des plus de 80 ans qui en souffrent. Elle est souvent causé par une autre pathologie cardiovasculaire comme l’hypertension artérielle, mais également l’obésité, l’âge, le sexe [22]. Elle se traduit par une pathologie du myocarde atriale au niveau électrophysiologique, les périodes réfractaires sont trop courtes et très inégales les unes par rapport aux autres et sont donc facilement affectées par la moindre contraction prématurée. Ces anomalies font partie d'un phénomène de remodelage myocardique dans lequel une surcharge de pression ou de traction entraîne des changements morphologiques tel qu’une hypertrophie, dilatation, fibrose et des altérations de la régulation des courants ioniques transmembranaires, modifiant ainsi les caractéristiques électrophysiologiques des myocytes auriculaires. La fibrillation atriale agrave ce processus et le rend chronique. Elle entraîne une surmortalité deux fois supérieure à celle de la même population sans troubles du rythme cardiaque car elle augmente 4 à 5 fois le risque d’AVC, une décompensation cardiaque, ainsi que des iatrogénies (qui sont des accidents hémorragiques suite à la prise de certains médicaments) [23].
La FA est classée, elle peut être paroxystique lorsque l’épisode dure moins de 7 jours ou se réduit de façon spontanée, persistante lorsqu’elle dure plus de 7 jours et enfin permanente si la cardioversion (procédure qui permet de rétablir le rythme cardiaque) [23].
Parmis les autres arythmies il existe également :
- la bradycardie lorsque le cœur bat trop lentement, ceci est souvent causé par un dysfonctionnement du nœud sino-auriculaire (SA), le "pacemaker" naturel du cœur.
- À l’inverse la tachycardie lorsqu’il bat trop vite ou de façon irrégulière, cela peut être le résultat de cicatrices cardiaques, de cardiomyopathies, ou d'autres maladies du cœur.
- les blocages auriculo-ventriculaire : c’est un ralentissement ou un blocage de la transmission des signaux électriques entre les oreillettes et les ventricules [21].
B.4 Les valvulopathies
Hormis les coronaropathies, les valvulopathies peuvent elles aussi être responsables d’insuffisance cardiaque. En 2014, elles sont responsables de 11 179 décès et en 2016, elles concernent 38 875 hospitalisations en France [24]. Les valvulopathies regroupent les pathologies qui touchent l’une des quatre valves cardiaques (détaillées dans la partie anatomie du cœur). 61% des valvulopathies touche la valve aortique [25]. Ces affections vont principalement perturber le flux sanguin en permettant le reflux de celui-ci par obstruction et/ou fuite [24].
La valvulopathie la plus répandue est la sténose valvulaire aortique, il s’agit d’un épaississement et d’une calcification dégénérescente de la valve aortique, voir figure n°4. Cette pathologie est notamment liée à l'avancée en âge et la prédisposition génétique et à de graves conséquences sur le fonctionnement du cœur. En effet, une fois que les valvules sont touchées par la calcification et la fibrose, elles ne peuvent plus s’ouvrir et se refermer convenablement. On a alors une obstruction de l’écoulement au niveau du ventricule gauche [26].
Figure n°4 : Dessin d’une valve aortique normale et d’une valve aortique calcifiée
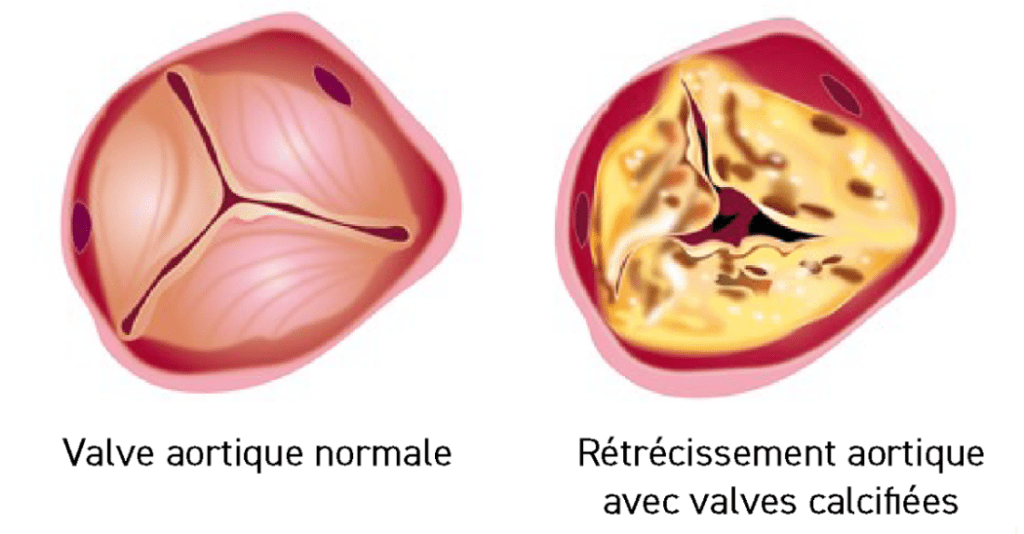
Source : la-stenose-aortique-et-ses-traitements.pdf (chu-montpellier.fr)
Les symptômes de la sténose ne se développent généralement pas avant une surface valvulaire inférieure à 1 cm2 (contre 3 cm2 pour une valve saine). Les symptômes les plus courants sont l’angine de poitrine, une dyspnée à l’effort, la syncope ou l’insuffisance cardiaque qui est l’objet de notre étude [25]. Pour l’évaluation et le diagnostic des adultes atteints, l’échographie reste la norme clinique [26].
C. Diagnostic et traitement de première intention
L'identification précoce et le traitement initial de l'insuffisance cardiaque sont essentiels pour améliorer la qualité de vie des patients et leur pronostic. Cette section se concentrera sur les aspects du diagnostic de l'insuffisance cardiaque ainsi que sur les traitements de première intention qui visent à gérer les symptômes et à ralentir la progression de la maladie.
Distinguer de manière précise entre les diverses pathologies cardiaques exige une évaluation minutieuse des symptômes et des examens médicaux, ainsi qu'une approche méthodique envers les patients.
Les manifestations cliniques telles que la fatigue, l'essoufflement, et l'œdème constituent des indicateurs initiaux, mais la nature spécifique de ces symptômes peut offrir des pistes cruciales pour distinguer les troubles cardiaques spécifiques. Par exemple, la présence de douleur thoracique peut évoquer des maladies coronariennes, tandis que des palpitations peuvent signaler des anomalies du rythme cardiaque [27]. Les examens médicaux jouent un rôle essentiel dans cette démarche diagnostique : L'électrocardiogramme (ECG) permet de détecter les anomalies du rythme cardiaque, l'échocardiographie fournit des images détaillées de la structure et de la fonction cardiaques, tandis que les biomarqueurs tels que la troponine contribuent à évaluer les dommages au muscle cardiaque. Des investigations plus poussées, telles que le test d’effort, l'examen électrophysiologique, et les études d'imagerie, complètent ces données pour une identification précise des pathologies cardiaques [28].
La démarche des patients débute par une consultation médicale initiale, mettant en avant l'importance pour les individus présentant des symptômes cardiaques de consulter rapidement. À ce stade, un questionnaire détaillé, orienté vers les antécédents familiaux et personnels, guide la première évaluation. Cette étape préliminaire permet d'orienter la suite du processus diagnostique de manière ciblée.
Dans la continuité, la collaboration entre médecins généralistes et cardiologues s'avère cruciale. Des protocoles standardisés, fondés sur les symptômes observés, dirigent les patients vers les spécialistes appropriés. Cette approche collaborative et spécialisée garantit une évaluation approfondie, établissant ainsi les bases d'une prise en charge adaptée.
L'éducation des patients constitue un volet essentiel de la démarche. Informer les individus sur les signes d'alerte et sensibiliser à l'insuffisance cardiaque sont des éléments clés pour favoriser la détection précoce et la collaboration active du patient dans son propre suivi médical.
Dans la phase de traitement, les médicaments de première intention, tels que les inhibiteurs de l'enzyme de conversion de l'angiotensine (IECA) et les bêta-bloquants, sont utilisés pour réduire la pression artérielle et améliorer la fonction cardiaque. Les médecins adaptent les traitements en fonction des caractéristiques individuelles du patient, introduisant progressivement les médicaments pour minimiser les effets secondaires [29]. L'hygiène de vie, y compris l'activité physique régulière et une alimentation équilibrée, est intégrée au traitement initial. Le contrôle régulier de la pression artérielle, de la glycémie, et du poids est crucial pour maintenir une santé cardiaque optimale.
Les patients sont encouragés à adopter des modifications du mode de vie pour soutenir le traitement, et des programmes de suivi réguliers sont mis en place pour évaluer l'efficacité du traitement initial [30]. Ainsi, cette approche intégrée vise à assurer une prise en charge holistique des patients présentant des pathologies cardiaques. En suivant ces étapes, les professionnels de la santé peuvent fournir des soins personnalisés et efficaces, améliorant ainsi le parcours des patients tout au long de leur traitement.
II. Prise en charge et amélioration du parcours patient
Le développement des dispositifs médicaux implantables palliant aux pathologies responsables d’insuffisance cardiaque, a largement fait évoluer la prise en charge des patients au cours des dernières décennies. En effet, lorsque le changement d'hygiène de vie et les traitements médicamenteux ne suffisent plus ou ne sont pas utiles, l’implantation d’un dispositif médical adapté peut devenir une nécessité. Afin de garantir la meilleure prise en charge du patient, les fabricants ne cessent d’innover. Les industriels sont nombreux et par conséquent les évolutions présentées sur le marché le sont aussi, que ce soit pour les stents coronaires, les prothèses valvulaires ou les stimulateurs, tous ces dispositifs sont concernés par le progrès.
L’objectif est alors de mesurer l’impact de ces innovations sur le parcours patient et la sécurité des personnes atteintes d'insuffisance cardiaque. Ainsi des indicateurs tels que le temps d’intervention, le type d'anesthésie pratiquée, la nécessité d’hospitalisation et sur les différences majeures entre les innovations et les implants traditionnels permettront d’évaluer l'intérêt des innovations.
A. Les stents une solution sûre pour pallier aux coronaropathies
pathologie) chez les personnes atteintes d'insuffisance, soigner correctement et efficacement les maladies coronariennes est primordial. Le parcours de soin d’un patient pour cette pathologie est un peu particulier puisque le diagnostic et le traitement peuvent être réalisés durant le même acte médical.
En effet, au vu d’un bilan cardiologique réalisé en amont (recensement des symptômes, ECG, échocardiographie, …) le praticien peut estimer, la nécessité de réaliser une coronarographie. La coronarographie étant une technique d’imagerie médicale spécifique à l’étude des coronaires. Elle nécessite l’utilisation de rayons X et l’introduction d’un cathéter par l'artère radiale ou fémorale afin d’injecter un produit de contraste iodé dans les artères coronaires et obtenir des images de ces dernières, voir figure n°5 et n°6.
Figure n°5 : Salle de coronarographie & Figure n°6 : image de coronarographie avec en foncé les artères contrastées avec de l’iode
Source : https://www.chu-rouen.fr/les-maladies-des-arteres-coronaires/angioplastie/ & https://www.passeportsante.net/fr/Maux/examens-medicaux-operations/Fiche.aspx?doc=examen-coronarographie
Pendant l’intervention le cardiologue peut alors visualiser les zones de rétrécissements des artères et envisager la pose de stents, aussi appelé angioplastie.
Le stent est un petit ressort développé dans les années 80 qui s’introduit par voie endovasculaire, même cathéter que pour le produit de contraste, dans les coronaires afin de rétablir une lumière suffisante [31]. Le stent est plié et monté sur un ballonnet lui-même monté sur le cathéter. Une fois le cathéter mené sur la zone du rétrécissement, le praticien peut alors gonfler le ballonnet qui va venir déplier et plaquer le stent sur les plaques d'athéromes, le ballonnet et le cathéter peuvent être retirés, voir figure n°7.
Figure n°7 : Principe de pose d’un stent
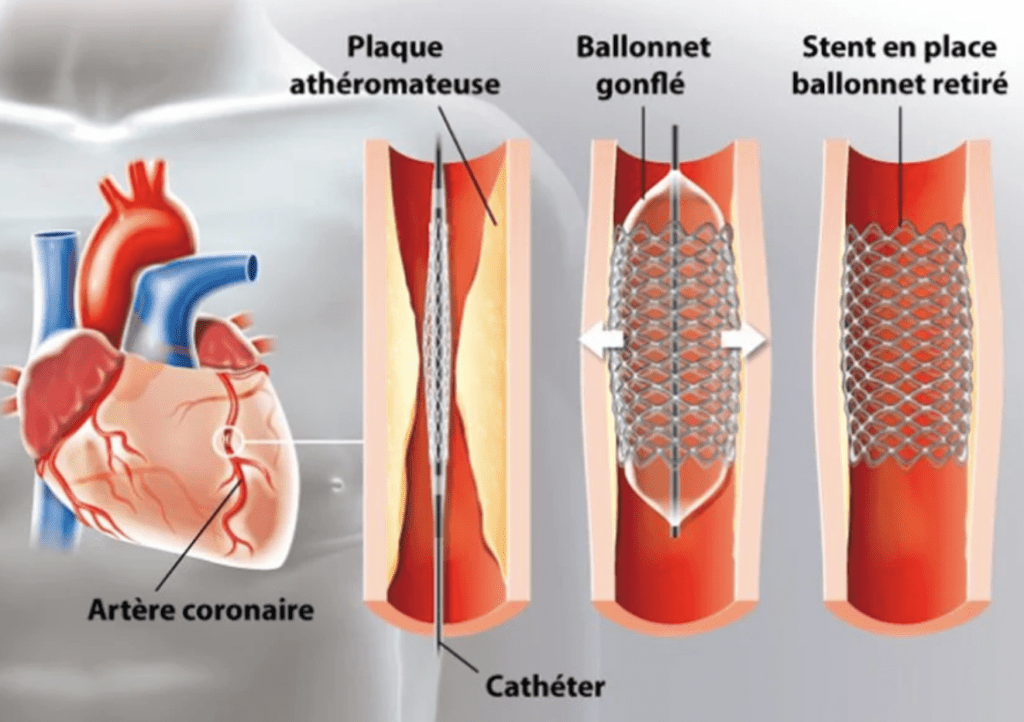
Source : https://www.docteurclic.com/technique/stent.aspx
Afin de limiter les complications pour les patients, des évolutions techniques ont permis de sécuriser davantage la procédure et le port du stent. Les matériaux utilisés majoritairement sont des alliages de Cobalt et chrome ou plus rarement platine et chrome. L’armature est ensuite enrobée de différentes molécules selon les fabricants. Ces substances, autour des stents appelées éluants, ont pour but de prévenir la réapparition prématurée de plaques d’athéromes et permettent aux patients de limiter la récidive trop rapide des symptômes et risques de sa maladie. C’est autour des choix de ces éluants que se basent les principales innovations apportées par les fabricants.
Cette intervention de 20 à 50 min est une pratique courante, environ 120 000 angioplasties par an en France, que l’on retrouve dans la plupart des hôpitaux et cliniques. Malgré le caractère peu invasif de l’intervention, une seule anesthésie locale au niveau du cathéter, le patient se verra hospitaliser 1 à 2 journées [32].
Le parcours de soin d’un patient bénéficiant d’une angioplastie est donc globalement assez rapide puisque diagnostic et angioplastie sont condensés en une même intervention. Le patient sera ensuite suivi une à deux fois par an, voir figure n°8.
Figure n°8 : Résumé des points forts du parcours patient bénéficiant d’une angioplastie

Source : auteurs
B. L’évolution de la prise en charge des troubles du rythme cardiaque
La bradycardie, la tachycardie ou les fibrillations atriales et ventriculaires sont difficilement traitables sur le long terme avec des substances pharmaceutiques. Le recours à l’utilisation de dispositifs médicaux implantables actifs est donc une nécessité dans le parcours de soin des patients.
C’est durant la seconde moitié du XXieme siècle que les dispositifs médicaux palliant aux troubles du rythme cardiaque sont apparus et ont rapidement évolué. En effet, en 1958 un pacemaker (ou stimulateur cardiaque) externe fut élaboré par Medtronic, voir figure n°9, afin de traiter la bradycardie. Dans le même temps deux chercheurs Suédois s'intéressent à la possibilité d’implanter un tel système. C’est donc à la toute fin des années 50 début 60 que les premières implantations de pacemaker sont réalisées grâce au travail des scandinaves Senning et Elmquist [33].
Figure n°9 : Medtronic 5800 premier pacemaker externe

Source : https://americanhistory.si.edu/collections/search/object/nmah_1458882
Une vraie course à l’innovation s’est alors organisée dans le but d’étendre le principe à d’autres pathologies comme la tachycardie et à surtout optimiser l’autonomie des implants, afin de limiter le retour au bloc du patient.
En effet, après le lancement des premiers implants, le grand défi fut le développement de l’endurance des piles et non le principe de fonctionnement. Des implants introduits dans les années 70 ont même fonctionné avec de l’énergie atomique [34].
En parallèle de la maîtrise et la considérable augmentation de l’autonomie, les évolutions ont permis d’étendre les utilisations des dispositifs cardiaques implantables actifs. On distingue actuellement trois grandes familles, les pacemakers ou stimulateurs cardiaques, les défibrillateurs ainsi que la thérapie par resynchronisation cardiaque.
B.1 Pacemaker et Cardiac Resynchronisation Therapy CRT
Il y a par an, en France, un peu moins de 70 000 implantations de stimulateur cardiaque avec une hausse prévisible du besoin d’environ 2% par an, il est donc nécessaire que le parcours de soin de patient devant recevoir un tel dispositif soit le plus efficace et confortable [35].
Le stimulateur cardiaque est principalement utilisé dans le but de pallier un dysfonctionnement sinusal ou des blocs auriculo-ventriculaires se manifestant par de la bradycardie, c’est-à-dire un ralentissement du rythme cardiaque voir des arythmies. Il s’agit donc d’établir un support supplémentaire ou complet à l’activité électrique normalement déjà présente dans le cœur.
Les principales fonctions de ce dispositif médical implantable actif sont de détecter l’absence de contraction du muscle cardiaque afin de stimuler les cellules musculaires du cœur lorsque la contraction n’est pas naturellement déclencher, d'accélérer le rythme cardiaque du malade lorsque son cœur n’a plus la faculté d’être chronotrope, et enfin de continuellement récolter des données sur l’activité électrique cardiaque.
La construction d’un pacemaker est globalement la même peu importe le fabricant. En effet, on trouve un boîtier qui comprend les composants électroniques permettant l’acquisition et le traitement des données via un logiciel propre au dispositif ainsi que la source d'énergie souvent une batterie au lithium d’une durée de vie allant de 5 à plus de 10 ans. La récolte, la transmission (sans fil) et l’interprétation des données électriques cardiaques sont les principales missions de ce boîtier d’une taille variable en fonction des modèles mais d’environ 4 cm de diamètre [36]. À ce boîtier, sont connectées 1 à 3 sondes en fonction du traitement choisi pour le patient, il s’agit des pacemakers dit simple, double chambre ou triple chambre.
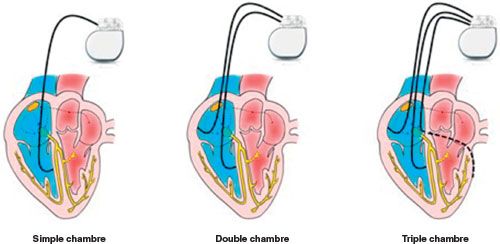
Le pacemaker simple chambre possède une unique sonde qui va détecter et stimuler et qui va se loger à la pointe du ventricule droit ou dans l’oreillette gauche en passant par la veine cave supérieure, voir figure n°10.
Figure n°10 : types de pacemaker
Source : https://www.sfcardio.fr/page/chapitre-14-item-236-troubles-de-la-conduction-intracardiaque
Le pacemaker double chambre lui possède deux sondes, une dans l’oreillette droite et une à la pointe du ventricule droit qui vont stimuler et/ou détecter des anomalies électriques au sein du cœur [37].
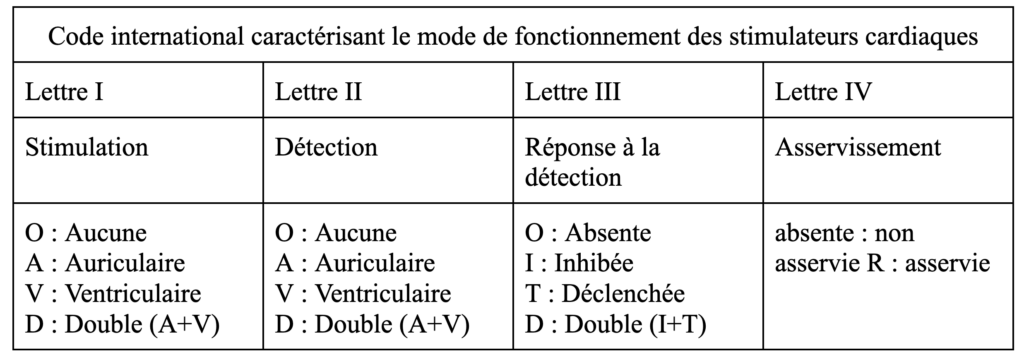
Afin de distinguer les diverses possibilités de configuration et de fonctionnement d’un pacemaker un code international à 4 lettres a été mis en place afin de caractériser les différents stimulateurs, voir tableau n°1.
Tableau n°1 : Code international caractérisant le mode de fonctionnement des stimulateurs cardiaques
Source : auteurs
La “réponse à la détection” correspond au déclenchement ou non d’une stimulation en cas de détection d’anomalies, et “l’asservissement” correspond à la capacité du pacemaker à reconnaître un effort physique ou un stress. L’adaptation aux activités du stimulateur permet au patient de vivre au quotidien sans contrainte particulière.
Enfin le pacemaker triple chambres a une troisième sonde qui passe par le sinus coronaire. Ce stimulateur très élaboré permet de remplir les fonctions classiques mais aussi de stimuler le ventricule gauche et ainsi permettre une contraction synchrone des deux ventricules, il s’agit de Cardiac Resynchronisation Therapy CRT. Le fait de synchroniser les contractions des ventricules permet aux patients de retrouver une bonne efficacité du flux sanguin dans le corps, de pallier certains symptômes de l'insuffisance cardiaque notamment la fatigue [38].
Les impulsions électriques permettant la stimulation des myocytes cardiaques sont générées entre une anode et une cathode. Les conducteurs des anodes et cathodes sont souvent des alliages de titane, iridium et carbone et sont isolés par du polyuréthane ou/et du silicone.
Les choix de ces matériaux sont motivés par la nécessité d’une grande sécurité ainsi que d’une excellente tolérance de ces derniers par le porteur du dispositif médical.
De plus, en fonction du trouble du rythme à traiter, la conception du pacemaker varie il peut être unipolaire ou bipolaire.
Lorsque le stimulateur est dit unipolaire, cela signifie que le boîtier en lui-même est la cathode et que le bout de la sonde est l’anode. Ce type de pacemaker est peu fréquent comparé au stimulateur bipolaire dont la sonde comporte aussi bien l’anode que la cathode [39].
Les algorithmes qui permettent le traitement du signal ainsi que le contrôle des signaux électriques envoyés sont complexes et sont minutieusement réglés pour traiter de façon optimale les troubles du rythmes dont le patient est atteint. Les ingénieurs d’application des fabricants qui paramètrent en collaboration avec les médecins, de tels dispositifs jouent un rôle très important dans la qualité de la prise en charge du patient.
Aujourd’hui la course au miniaturisme des stimulateurs cardiaques est lancée. Les avancées sont importantes notamment avec la sortie courant des années 2010, de pacemakers sans sondes et directement implantables par voie endovasculaire dans le ventricule droit.
St Jude Medical avec le Nanostim™, voir figure n°11, ainsi que Medtronic et le Micra™,voir figure n°12, sont les premiers à se lancer. St Jude Medical ayant reçu le marquage CE en 2016 pour le Nanostim, les 1423 stimulateurs sont finalement rappelés à cause d’une défaillance de la batterie. La course s'arrête alors là pour St Jude Medical aujourd’hui Abbott [40].
Medtronic s’impose alors comme l’unique fabricant de ces minis pacemakers pendant quelques années avant d’être tout récemment rattrapé par Boston Scientific et le Empower™ pas encore approuvé par la FDA (Food and Drug Administration, équivalent du marquage CE aux États-Unis) et Abbott et le Aveir™ qui lui est approuvé. Par conséquent , tous deux sont non marqués CE [41]. En revanche, ces dispositifs sont approuvés par la FDA et sont donc commercialisables aux États-Unis.
Ce pacemaker simple chambre est uniquement implantable, dans le cas d’indication de blocs auriculo-ventriculaires sans ou avec faible rythme sinusal et représente alors une population cible de 15 700 à 18 900 patients par an [42].
Les bénéfices d’un dispositif implantable cardiaque actif miniature comme le Micra sont nombreux tant pour la qualité du parcours patient que pour la sécurité.
Figure n°11 : Nanostim™ & Figure n°12 : Micra™


Source : https://www.businesswire.com/news/home/20160310006614/fr/ & https://www.chu-poitiers.fr/pose-de-pacemaker-sans-sonde-une-innovation-majeure-realisee-au-chu-de-poitiers/
En effet, en ce qui concerne la sécurité, la petite taille du Micra™ 25,9 mm de long, pour un diamètre de 6,7 mm et un poids de 2g, donne des résultats très intéressants. Sa position, directement dans le l’oreillette, et l’absence de sonde diminuent considérablement les risques tels qu'un hématome local au niveau du boitier, un délogement ou une fracture de la sonde, un pneumo- ou un hémothorax après une ponction veineuse, une sténose ou une occlusion veineuse, une endocardite ou un traumatisme valvulaire [43]. Le Micra permet alors une réduction de 51% des complications par rapport à un stimulateur cardiaque conventionnel.
Aussi son implantation par la veine fémorale apporte un réel gain sur la prise en charge du patient puisque l’intervention se fait en 30 à 45 min sous anesthésie locale et permet donc une prise en charge en ambulatoire [42],[43],[44]. De plus, le risque qui paraît évident, de décrochage du pacemaker directement fixé à un muscle en mouvement continuel est observé dans que dans 0,13% [44].
Cependant l'accès à ce dispositif particulièrement technologique n’est pas encore démocratisé dans tous les centres de rythmologie en France. Les patients pouvant bénéficier d’un pacemaker miniature ne se voient pas proposer ce stimulateur.
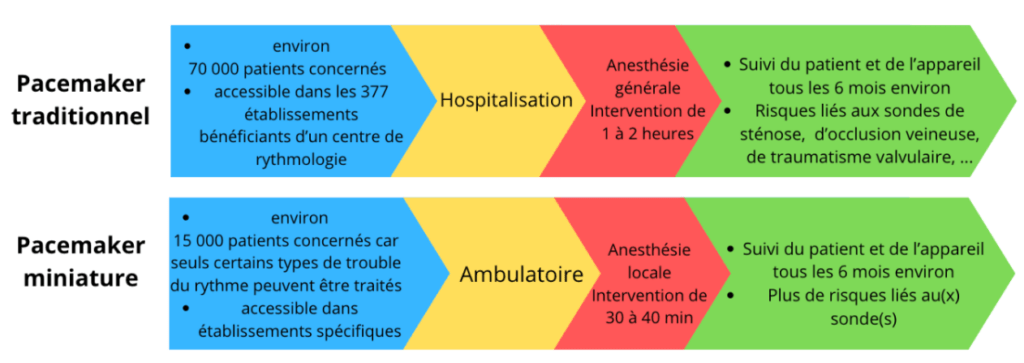
En résumé, pour les patients pouvant bénéficier d’un pacemaker miniature, le parcours de soin connaît une vraie révolution. En effet, la pose d’un pacemaker en une journée passé à l'hôpital pour le patient sous anesthésie locale contraste avec le stimulateur plus traditionnel nécessitant une anesthésie générale et quelques jours d’hospitalisation. Aussi les risques et types de complications connaissent eux aussi un bouleversement important dans l'intérêt du patient, voir figure n°13.
Figure n°13 : Résumé de la comparaison entre pacemaker traditionnel et miniature dans le parcours de soin du patient
Source : auteurs
B.2 Défibrillateur actif
Les défibrillateurs actifs sont des dispositifs très proches en structure des pacemakers mais dont la fonction n’est pas d'accélérer, stimuler le myocarde en cas de bradycardies, mais de synchroniser les myocytes cardiaques en cas de tachycardie c’est-à-dire d’un rythme cardiaque trop rapide.
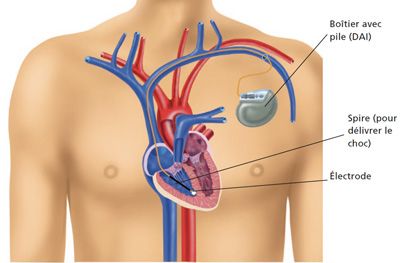
On retrouve alors un boîtier ainsi qu’une sonde se logeant à la pointe du ventricule droit, voir figure n°14.
La sonde remplit la fonction de détection et stimulation permettant la resynchronisation battements.
Figure n°14 : Position d’un défibrillateur
Source : https://www.ccjj.fr/defibrillateur-cardiaque-implantable
Les innovations n’ont pas été très nombreuses pour ce type de dispositif jusqu’à récemment. En effet, Boston Scientific a proposé en 2015 le défibrillateur Emblem MRI™. Contrairement au défibrillateur actif traditionnel l’Emblem MRI™, voir figure n°15, et n’a pas de sonde passant par la veine cave supérieure et traversant l'oreillette droite et le ventricule droit. En effet, le boitier de 83.1 x 69.1 x 12.7 mm se trouve sur le flanc gauche et la sonde détectant et délivrant les stimulis électriques, vient se glisser le long de la sixième côte avant de former un angle droit pour poursuivre sa trajectoire définitive sur le côté gauche du sternum, voir figure n°16.
Figure n°15 : Boston Scientific Emblem MRI
Source : https://www.bostonscientific.com/en-US/products/defibrillators/emblem-s-icd-system.html
Pour ce défibrillateur sans sonde endocavitaire, la détection de tachycardie s'opère au travers de la sonde sous cutanée placée au niveau du sternum, entourée en rouge sur la figure n°16. Cette sonde fait aussi office d’anode pour l’administration de choc électrique pour synchroniser les myocytes, le boîtier opérant comme cathode.
Figure n°16 : Schéma implantation défibrillateur avec sonde sous cutanée
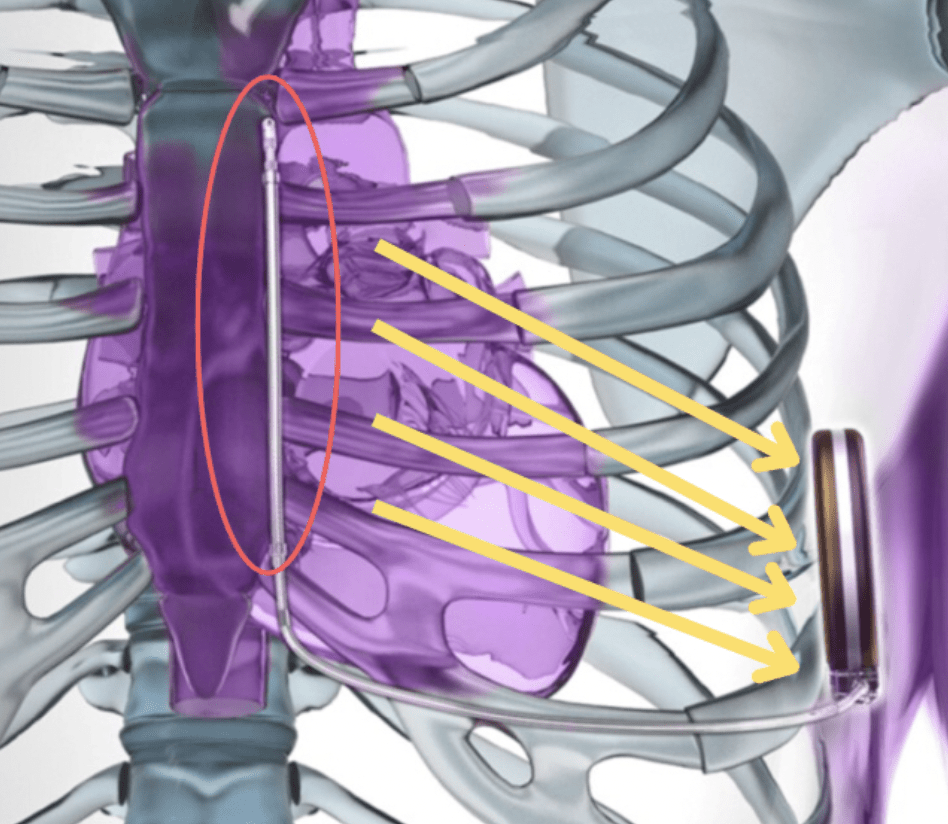
Source : https://www.bostonscientific.com/en-US/products/defibrillators/emblem-s-icd-system.html
Cet automne Medtronic a également reçu l'approbation de la FDA (Food and Drug Administration, équivalent du marquage CE aux États-Unis) pour son défibrillateur extravasculaire Aurora EV-ICD™ en principe très proche de celui de Boston Scientific.
Tout comme pour le Micra, les risques liés aux sondes comme la délocalisation de la sonde, la perforation ou sclérose des vaisseaux sont donc éliminés. En effet, selon l’étude clinique ATLAS, 92% des complications liées aux sondes ont pu être écartées. Cependant 27 cas de fractures de la sonde sous cutanée ont été reportés sur presque 47,000 implantations, c’est finalement l’apparition de nouvelles complications qu’engendre ce nouveau dispositif [45], [46].
Malgré ce gain en termes de sécurité, en ce qui concerne le parcours patient, l’intervention d’une à deux heures, se fait sous anesthésie générale et nécessite une hospitalisation [47]. Encore une fois l’innovation de ce dispositif transforme le soin des patients à haut risque d’arrêt cardiaques liés à la tachycardie, puisque les risques liés aux sondes disparaissent. Cependant la technologie est récente et n’est pas accessible partout en France de plus ce dispositif pourrait être implanté chez seulement 650 à 2000 patients en France, voir figure n°17,[48].
Figure n°17 : Résumé de la comparaison entre défibrillateur traditionnel et sans sonde endocavitaire dans le parcours de soin du patient.
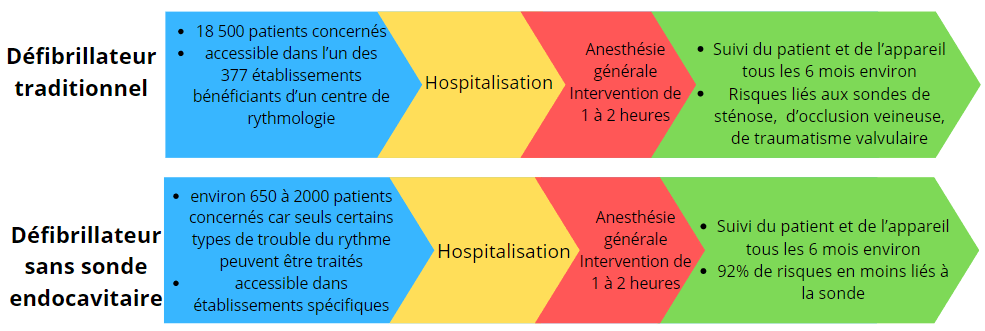
Source : auteurs
C. L’évolution du traitement des valvulopathies
C.1 Définition du risque chirurgical
Le risque chirurgical se définit comme étant le risque de mortalité ou l'apparition d'éventuelles complications (insuffisance rénale, accident vasculaire cérébral) pouvant se dérouler lors de la procédure chirurgicale et jusqu'à 30 jours après. La détermination du degré de risque se base sur des caractéristiques cliniques comme : l’âge, le sexe, antécédents chirurgicaux, mobilité et autres comorbidités. Il peut être évalué selon deux scores : l’Euroscore ou le STS (Society Thoracic Surgeons). Ce dernier est le plus utilisé dans l’évaluation du risque de remplacement valvulaire aortique par le TAVI. Un risque chirurgical élevé se caractérise par un STS supérieur à 8%, le risque intermédiaire se caractérise par un STS compris entre 4 et 8 %. Le risque est dit faible s’il est inférieur à 3% [49].
C.2 De la chirurgie à coeur ouvert à l’arrivée du TAVI
Comme énoncé dans la partie (B.3) la sténose aortique causée par une dégénérescence de la valve est la valvulopathie la plus répandue et évolue graduellement [50]. Le traitement de cette affection passe généralement par la chirurgie à cœur ouvert. C’est en effet le traitement de base depuis près d’un siècle. Tout d’abord, le premier traitement passe par la chirurgie de réparation valvulaire aortique vers les années 1913, initiée par Théodore Marin Tuffier. Puis, celle-ci laisse place à la chirurgie de remplacement aortique de remplacement de la valve pathologique par une valve mécanique qui débute vers les années 1960 avec la prothèse valvulaire d’Albert Starr et Lowell Edwards [51]. Cette technique montre des résultats très satisfaisants en termes de mortalité, de complication et de rétablissement chez les patients ne présentant pas ou peu de comorbidités, et notamment avec un risque chirurgical faible ou intermédiaire [52]. De fait, aujourd’hui, en l’absence de contre-indication ou de risque opératoire élevé, l’approche chirurgicale sous anesthésie générale et circulation extracorporelle reste la méthode de référence [53].
Il est important de souligner qu’il s’agit d’une opération à cœur ouvert, qui reste très lourde, nécessitant une sternotomie, une circulation extra-corporelle et une hospitalisation prolongée mais aussi une réadaptation fonctionnelle nécessaire pendant plusieurs semaines [52].
Toutefois, chez les patients très âgés présentant un risque élevé de chirurgie voir inopérable, dû à une sévérité symptomatique accrue de la maladie et présentant des comorbidités, les résultats de la chirurgie de remplacement sont très peu satisfaisants. Malgré des évolutions techniques, on observe une forte mortalité péri et post-opératoire [51]. C’est dans cet objectif qu’a été tout d’abord développée à Rouen la technique de dilatation aortique à ballonnet (Ballon Aortic Valvuloplasty : BAV), semblable à la technique de dilatation des sténoses pulmonaires congénitales vers 1985 [52]. Jusqu’en 1992, le traitement médical avec ou sans valvuloplastie aortique par ballonnet était la seule alternative pour les patients inopérables [54]. Cette technique a par la suite été mise de côté (sauf cas exceptionnel) du fait d’un taux de re-sténose valvulaire précoce de 80 % à un an, et l’absence d’effet sur la mortalité [52].
Grâce à l’équipe de cardiologie du CHU de Rouen, depuis 2002, une nouvelle alternative à la chirurgie se présente aux patients inopérables et à haut risque chirurgical. C’est Le TAVI ou Transcatheter Aortic Valve Implantation (ou remplacement de la valve aortique par voie percutanée). Remboursé par le système de santé français depuis 2010, il s’agit d’une innovation française révolutionnaire en cardiologie interventionnelle. La technique consiste à implanter une prothèse valvulaire au sein de la valve aortique calcifiée par voies usuelles de cathétérisme valvulaire. L’implantation par voie fémorale est la moins invasive mais l’implantation peut aussi se faire par voie sous-clavière, carotidienne ou trans-aortique directe ou trans-apical, voir figure n°18, [55].
Figure n°18 : Les différentes voies du TAVI
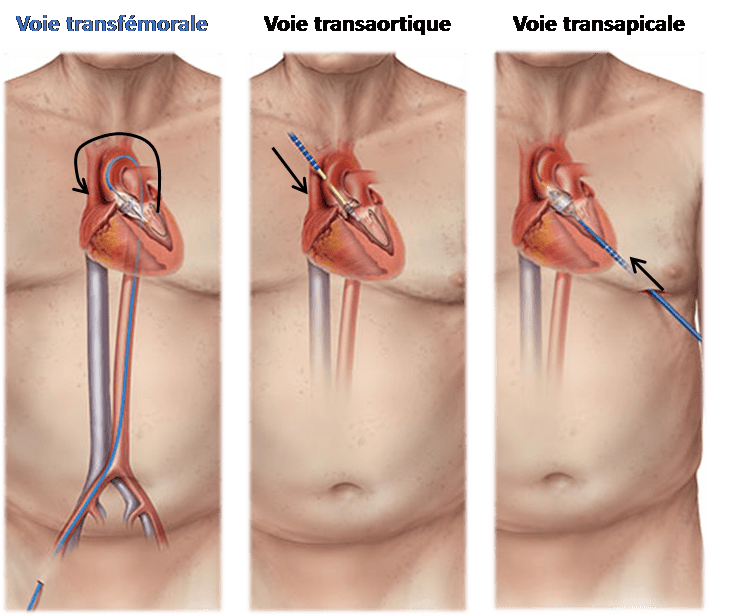
Source : https://www.chu-rouen.fr/remplacement-de-valves-tavi/le-tavi/
On distingue deux types de valves pour le TAVI :
- Les valves à ballonnet, extensibles comme la troisième génération de SAPIEN ((Edwards Lifesciences Corporation, Irvine, CA, États-Unis). Celle-ci contient une endoprothèse cylindrique en cobalt-chrome ou on retrouve trois folioles symétriques en péricarde d’origine bovine voir figure n° 19 - A.
- Les valves auto-expansibles. La CoreValveTM Evolut R (Medtronic, Inc., Minneapolis, MN, États-Unis), disponibles en 4 tailles, est la plus utilisée et se compose d’une armature radio-opaque asymétrique en nitinol ou l’on retrouve trois folioles de péricarde porcin avec des sutures en polytétrafluoroéthylène, voir figure n°19 - B[56], [57]. Deux autres modèles commercialisés et auto-expansibles, sont disponibles sur le marché et proviennent des compagnies Boston-Scientific et Abbott [55]. Ces bioprothèses ne sont pas implantables par voie transapicale [57].
Figure n°19 : Les types de valve utilisés en procédure TAVI

Source : https://www.chu-rouen.fr/remplacement-de-valves-tavi/le-tavi/
Après 20 ans, cette technique s’ impose comme étant la norme chez les patients âgés à hauts risques chirurgicaux avec un nombre grandissant d’interventions à l’international. En France, depuis 2010 le nombre d'interventions a fortement augmenté comme on peut le voir figure n°20, [58],[59].
Figure n°20 : évolution des procédures TAVI entre 2010 et 2021
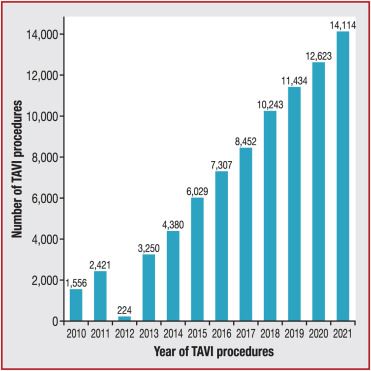
Source : [59]
De fait, elle s’étend donc aux patients à risque chirurgical intermédiaire ou plus faible. Toutefois, la moyenne d’âge reste aux alentours de 83 ans car cela n’est pas nécessairement associé à une évolution vers des patients plus jeunes. En effet, la sténose aortique est un trouble qui touche principalement les personnes âgées. Dans le cas des patients jeunes, la chirurgie conventionnelle reste la meilleure alternative étant donné la durée de vie de 10 ans du TAVI à l’heure actuelle [60] .
Ainsi, aujourd’hui, le TAVI est de plus en plus accessible et devrait s’élargir aux patients présentant un risque chirurgical intermédiaire ou faible, même si la chirurgie reste choisie pour les non-candidats au TAVI. En effet, plusieurs essais ont comparé TAVI et chirurgie classique dans des populations de patients à haut risque, risque intermédiaire et risque faible, voir figure n°21.
L’étude PARTNER I a montré l’efficacité du remplacement valvulaire aortique par voie percutanée chez les patients à haut risque chirurgical ou inopérables. Un traitement par TAVI montrait une réduction de la mortalité absolue à un an de 20 % (30,7 % versus 50,7 %, p < 0,001) [61].
L’étude PARTNER II a quant à elle montré que le TAVI représente actuellement une intervention sûre, chez les patients à risque intermédiaire avec des taux de succès procéduraux élevés (86-100 %) et où le risque de décès ou d’AVC est similaire, voire moindre par rapport à la chirurgie [61].
L’étude PARTNER III a démontré la non-infériorité du TAVI par rapport à la chirurgie de remplacement chez 1000 patients à faible risque (mortalité prédite à 4 %). Sur le critère de jugement associant mortalité, AVC et réadmission à un an, les auteurs retrouvent de meilleurs résultats avec le TAVI (8,5 % vs 15,1 % ; p < 0,001) [62].
Figure n°21 : Évolution des indications du remplacement valvulaire aortique percutané. La Figure 21 représente l’évolution chronologique des indications du TAVI et les principales études randomisées dont elle découle. Dans les bulles jaunes, sont représentées les études dans lesquelles le TAVI a été démontré supérieur par rapport à la chirurgie dans la situation clinique en question et les bulles grises représentent la non-infériorité.
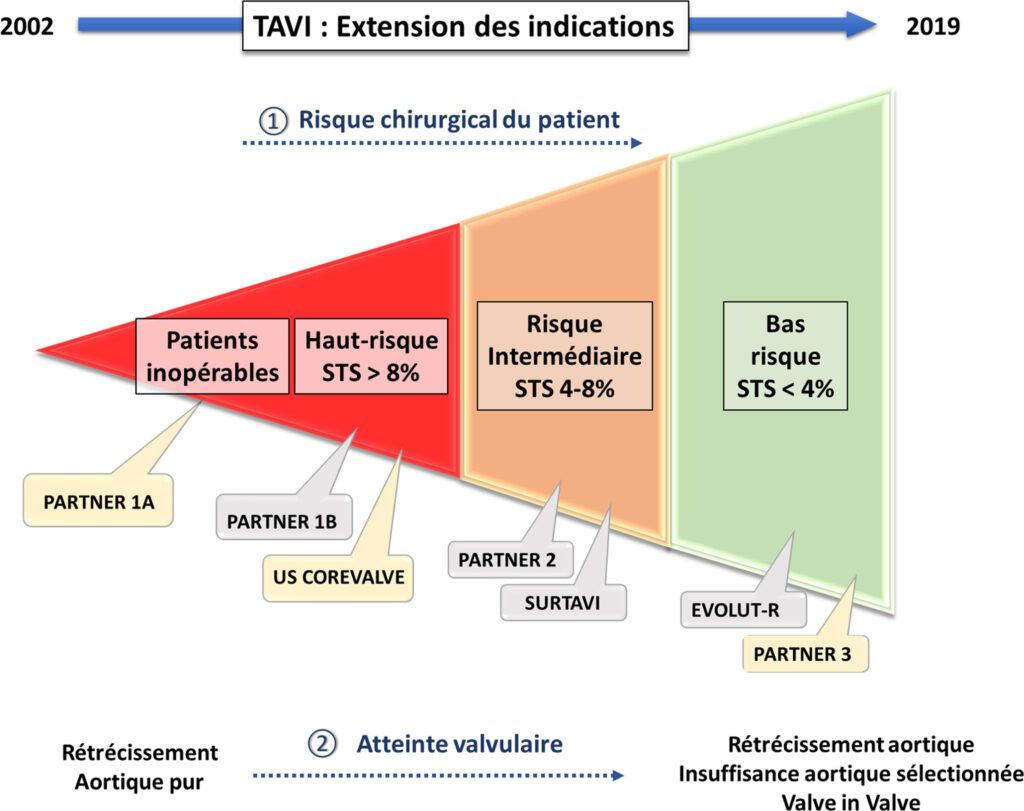
Source : [49]
Ainsi, afin de garantir le succès de l’intervention, éviter les complications et garantir la longévité du dispositif (15 ans à l’heure actuelle), la sélection du patient reste essentielle.
En premier lieu, une évaluation préopératoire détaillée doit être réalisée lors d’une réunion de concertation pluridisciplinaire (RCP) qui va être associée à la rédaction d’un compte rendu présent dans le dossier médical du patient [57]. Cela afin de confirmer la gravité de la sténose aortique (SA), d’évaluer la nécessité de l’intervention, le risque préopératoire d’informer le patient et de choisir la prothèse la plus adaptée [56]. Cette réunion de concertation implique à la fois le chirurgien cardiaque, le cardiologue interventionnel et l’anesthésiste-réanimateur. L’avis d’un gériatre est recommandé [57]. Cette évaluation associe l’examen clinique, biologique et imagerie médicale (échocardiographie, tomodensitométrie (CCT), test d’effort ou biomarqueurs), angiographie transœsophagienne 3D [62].
Après l’évaluation pré-opératoire, l’équipe médicale se réunit afin de déterminer si le patient doit subir le SAVR (Surgical Aortic Valve Replacement) ou le TAVI. Cette décision est prise au cas par cas, en tenant compte du risque de l’intervention chirurgicale, de l’âge du patient et de son espérance de vie estimée, des comorbidités et de la présence de certaines caractéristiques anatomiques et procédurales et de la voie utilisée.
Aujourd’hui, l’approche par voie fémorale est la plus fréquente, car celle qui présente de meilleurs résultats, voir figure n°22.
Figure n°22 : Évolution de l’utilisation des sites d’accès au fil du temps
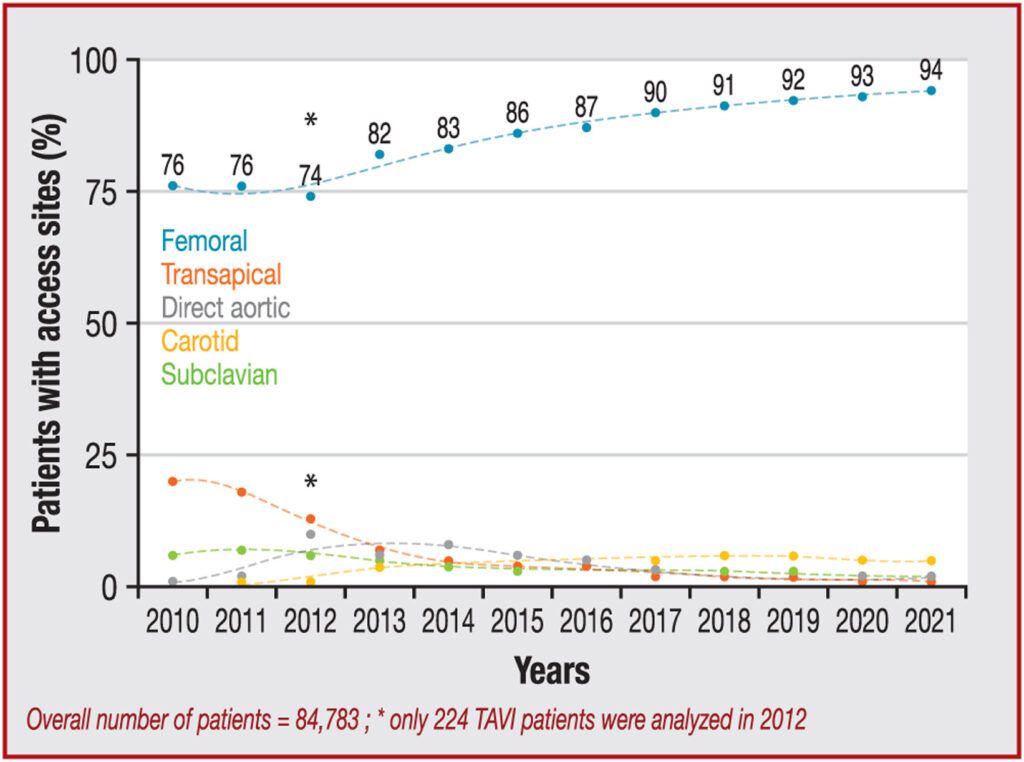
Source : [60]
Pour ce faire, l’accès à l’artère fémorale est obtenu pour l’angiographie aortique, puis, une gaine veineuse est insérée, à travers laquelle on place temporairement un stimulateur cardiaque dans le ventricule droit. Puis, un fil-guide est monté jusqu’au cœur. Une valvuloplastie aortique par ballonnet est réalisée sous stimulation ventriculaire rapide. Un cathéter dans lequel est insérée la valve artificielle est acheminé au cœur. La prothèse est ensuite avancée et après confirmation de l’emplacement approprié par angiographie, la valve est déployée lors d’une stimulation ventriculaire rapide. En fonction du type de valve utilisée, un ballonnet pourra être utilisé pour déployer la nouvelle valve ou elle pourra aussi s’ouvrir comme un parapluie au milieu de l’ancienne valve, voir figure n°23, [63]. Une échocardiographie transthoracique est réalisée en fin d’intervention afin d’évaluer la fonction de la prothèse, en particulier la sévérité de la régurgitation aortique [56].
Figure n°23 : Techniques d’implantation des deux modèles de valve percutanée. En haut : Valve d’Edwards expansible par ballonnet : A : positionnement ; B : gonflage du ballonnet ; C : valve en place. En bas – CoreValve auto-expansible – mécanisme de largage : A : retrait de la gaine ; B : valve ouverte ; C : aspect radiologique de la valve en place
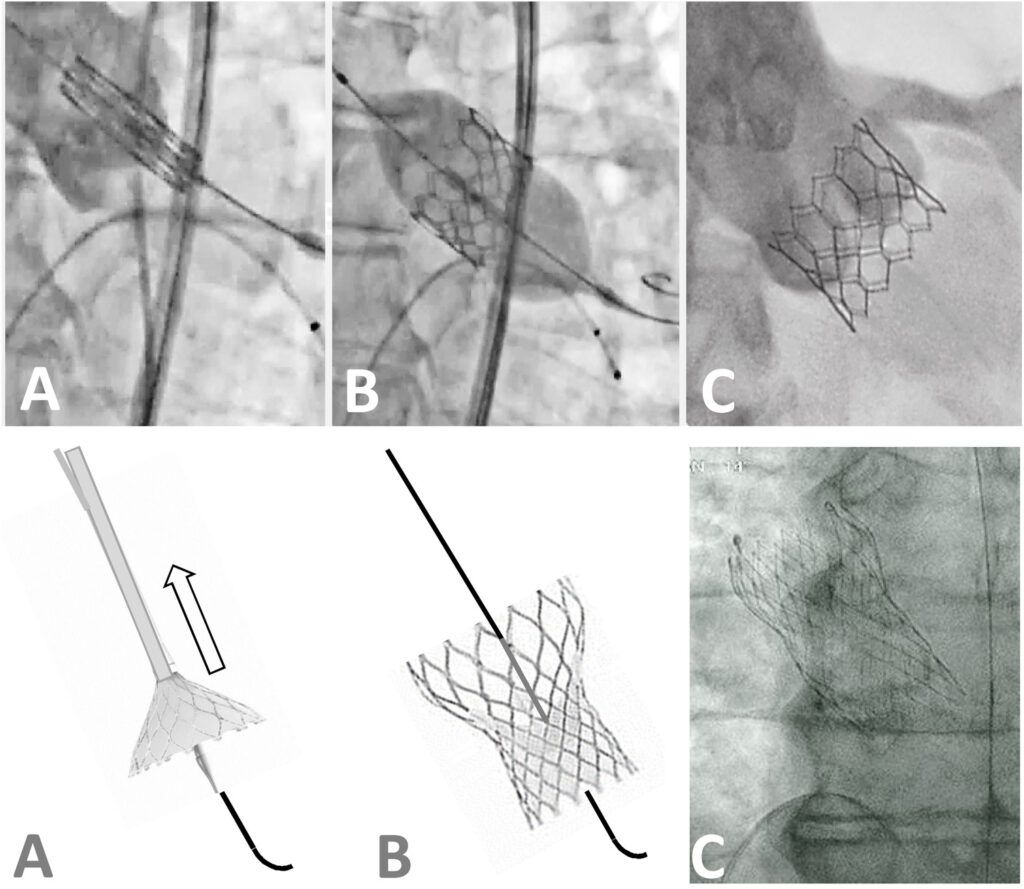
Source : [52]
Avant, le TAVI était réalisé sous anesthésie générale, avec un guidage angiographique et échocardiographique transœsophagien. Aujourd’hui, près de 95% des procédures TAVI par voir fémorales sont dites « minimalistes ». Cette technique permet d’avoir une équipe réduite en salle, une simple anesthésie locale accompagnée d’une sédation, pas d’échocardiographie transœsophagienne (ETO) péri-procédurale, une diminution de la durée d’intervention, environ de 35 min à 1h par rapport à 3 et 4h pour la chirurgie conventionnelle et une très courte hospitalisation [55] avec retour à domicile entre 2 ou 3 jours, voir figure n°24. Cela s’accompagne d’une récupération plus rapide que lors de la chirurgie conventionnelle (test de marche de 8 min après 4 jours). Réduisant ainsi les coûts liés à l'hospitalisation [56]. Il n’y a pas de cicatrice, pas de nécessité de réanimation ou réadaptation. La reprise des activités normales est en effet quasi immédiate. Il n’y a aucune indication de traitement anticoagulant contrairement à ce que nécessite les prothèses chirurgicales mécaniques, mais uniquement un traitement antiagrégant plaquettaire. Le suivi est assuré par consultation et échographie au premier mois puis chaque année et l'entraînement physique est encouragé [55].
Figure n°24 : Durée médiane du séjour à l’hôpital au fil du temps. Les lignes verticales indiquent l’écart interquartile
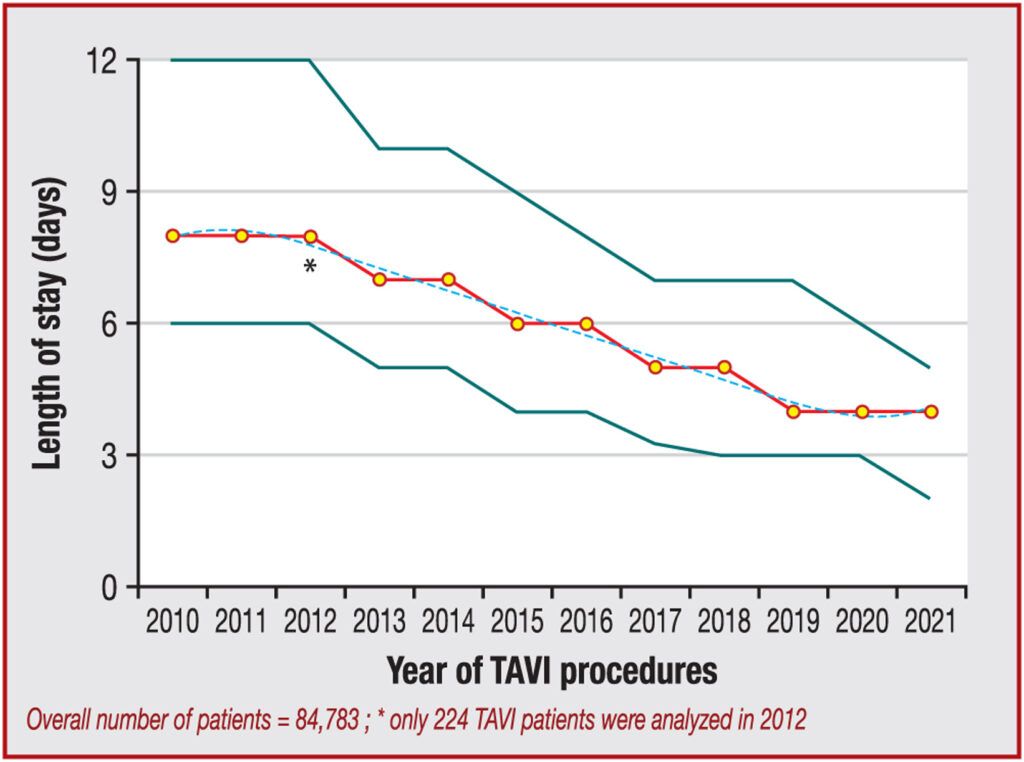
Source : [59]
En résumé, avec des avantages notables et non négligeable à la chirurgie de remplacement conventionnelle, les patients pouvant bénéficier de la procédure TAVI voit leur parcours de soin nettement amélioré, voir figure n°25.
Figure n°25 : Résumé de la comparaison entre la chirurgie de remplacement et le TAVI dans le parcours de soin du patient.
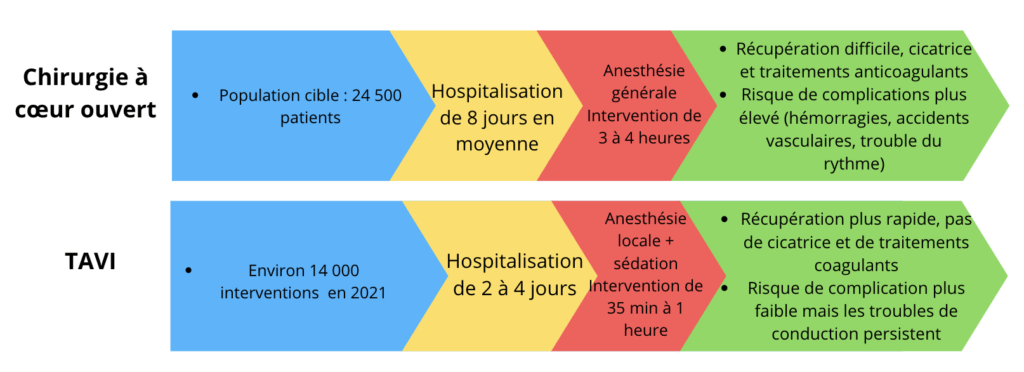
Source : auteurs
L’implantation de bioprothèse par la procédure TAVI est réellement strictement encadrée de 2009, année de l’obtention du marquage CE. Tout d’abord, selon l’arrêté du 29 décembre 2009 et pour une durée de 2 ans, la possibilité d’exécuter la procédure était uniquement limitée à 33 centres à des fins de récolte de données cliniques en situation réelle d’utilisation [59]. Puis cette autorisation s’est étendue aux centres attestant de compétences et de critères spécifiques, sous le contrôle des ARS, voir figure n°26.
Figure n°26 : Carte de France de l’activité de pose de TAVI en 2019 sauf Chartres
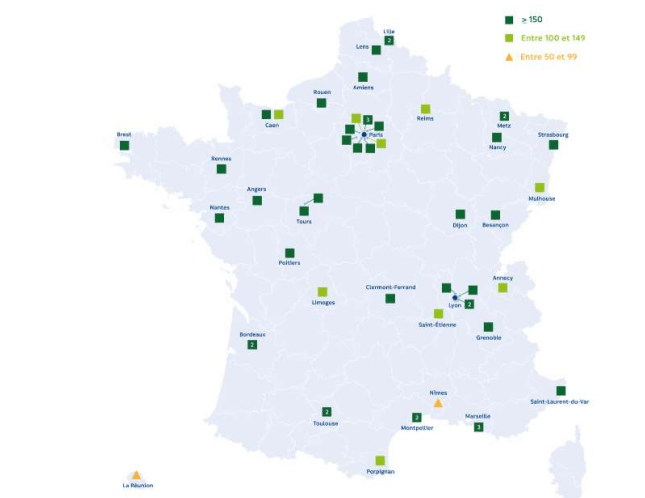
Source : [64]
Aujourd’hui, l’implantation valvulaire par voie transcathéter est une alternative acceptée et reconnue. Toutefois, malgré un nombre de complications moins élevé par rapport à la chirurgie à cœur ouvert et grâce à une meilleure connaissance des médecins sur la procédure, la plupart des études montrent toujours un taux accident vasculaire cérébral périopératoire plus élevé qu’en chirurgie conventionnelle et une incidence plus élevée d’anomalies de conduction induites par la procédure TAVI par rapport à SAVR [56],[65]. Cette dernière est la complication la plus fréquente, représentant 34,8% des patients à la sortie de l'hôpital avec une incidence plus élevée chez les patients dotés d’une valve auto-expansible, voir figure n°27. Afin de pallier ce problème, l’implantation d’un stimulateur cardiaque (pacemaker) a été choisie comme solution, mais les indications restent encore peu claires entraînant souvent du surtraitement [65]. De nouvelles approches sont donc nécessaires afin de pallier à de telles complications, en particulier à l’ère actuelle du TAVI qui s’étend vers les patients à faible risque chirurgical.
Figure n°27 : Résumé des principaux essais et registres impliquant différents types (auto-expansibles et expansibles à ballonnet) de valves et signalement de l’incidence des nouveaux IPP. IPP, implantation permanente d’un stimulateur cardiaque.
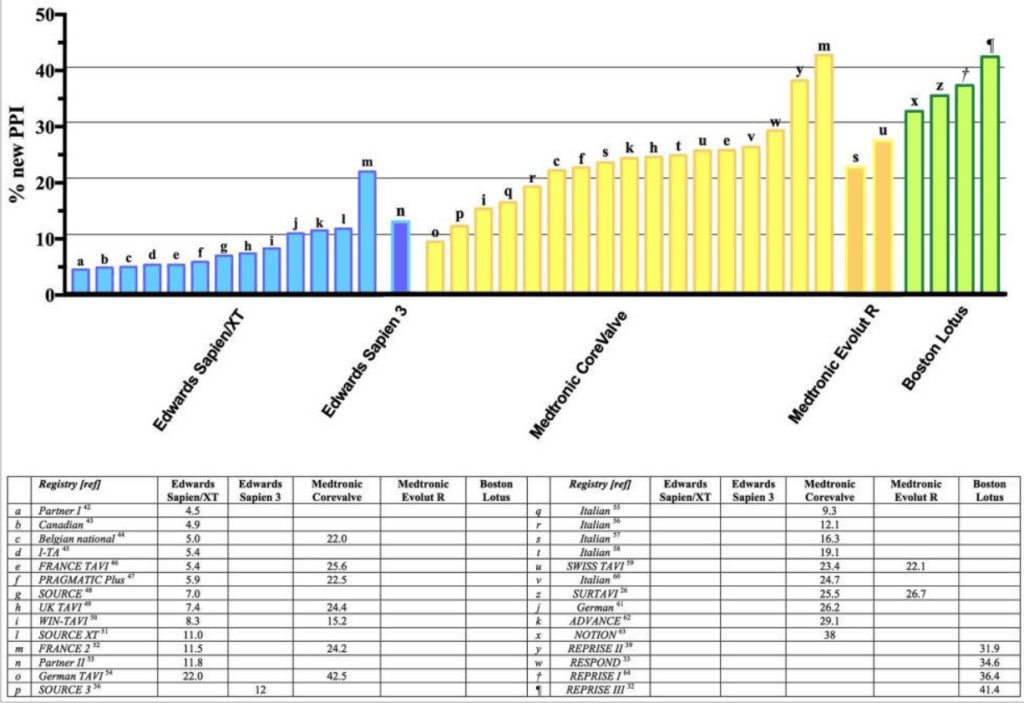
Source : [65]
C.3 Le MitraClip
Suite à une valvulopathie plusieurs traitements sont proposés, l’un d’entre eux est l'utilisation des clips Mitral. Ce dispositif médical intervient lorsque la valve mitrale du cœur ne se renferme pas correctement menant à l’insuffisance cardiaque, et que l’opération n’est pas possible, cela concerne plus de 1500 patients en France. En effet, il ne convient pas à tous les patients, seulement un type de patient avec une anatomie et un type de fuite correspondant à certains critères cliniques. C’est un traitement transdermique qui permet de rapprocher les deux feuillets de la valve mitrale et réduire le creux, voir figure n°28 et figure n°29.
Figure n°28 : Principe du Mitraclip
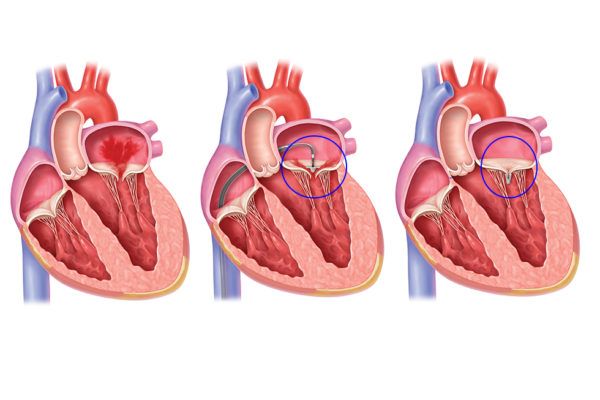
Source : https://icps.fr/wp-content/uploads/2018/07/pour-billet-humeur-600x400.jpg
Figure n°29 : Principe du Mitraclip

Source : https://citoday.com/
La procédure se déroule en salle de cathétérisme cardiaque, sous anesthésie générale, le mitraclip est amené par un cathéter jusqu’à la valve mitrale, guidé par l’imagerie. La durée d’hospitalisation varie de un à sept jours [66]. Selon l’hôpital Louis-Pradel à Lyon, le taux de succès de la procédure est de 99%, pour une intervention qui dure 2 heures.
La première implantation du MitraClip date de 2010 depuis une trentaine de centres implanteurs existent. Certains constructeurs, tels que Abbott, aimeraient pouvoir l’utiliser dans les cas où le patient est opérable, mais à haut risque chirurgical et cela n’a pas été autorisé par la Commission Nationale d’Évaluation des Dispositifs Médicaux et des Technologies de Santé ( Cnedimts ) ainsi que la Haute Autorité de Santé.
Il existe deux types de MitraClip sur le marché :
- MitraClip Contour-Flex : ce clip est auto-expansible et est fabriqué en nitinol, ce dispositif, développé par Abbott, est conçu avec des matériaux innovants et une technologie avancée pour assurer une fixation sécurisée sur les feuillets de la valve mitrale.
- MitraClip NeoChord : cette technique, développée par NeoChord, Inc., vise à restaurer la fonction de la valve mitrale en utilisant des cordages artificiels pour corriger la fuite de la valve mitrale, ce clip est extensible par ballonnet et est fabriqué en polyester.
Le choix de la prothèse dépend des caractéristiques anatomiques de la valve mitrale du patient et des préférences du chirurgien [67],[68].
Ainsi, ce traitement moins invasif permet de réduire considérablement les symptômes de la régurgitation mitrale et surtout de réduire les risques de morbidités et les complications post-opératoires liés à la chirurgie à cœur ouvert. Cependant, il est important de retenir que ce n’est pas un dispositif dédié à de nombreux patients. La décision de l’utilisation d’un MitraClip résulte d’une évaluation multidisciplinaire avec des cardiologues interventionnels, des chirurgiens cardiaques et d’autres disciplines si nécessaire.
III. Perspectives futures et limites
A. Ce qui nous attend dans les années à venir
L’innovation est le mot d’ordre pour toutes les entreprises du biomédical, ainsi bien que les innovations en termes de dispositifs médicaux cardiaques semblent bien avancées, l’investissement en recherche et développement pour ces types de dispositifs continue.
Même si le classique stent semble être déjà performant, une entreprise américaine, Elixir Medical, propose une nouvelle géométrie de stent. Indisponible en France, le Dynamx BioAdaptator est composé de 3 armatures entrelacées, voir figure n°30. Cette architecture permettrait au vaisseau sur lequel il est placé, de retrouver son élasticité en s'adaptant au flux sanguin pulsé à chaque battement, contrairement aux stents classiques qui eux restent figés [69].
Figure n°30 : Stent Dynamx BioAdaptator

Source : https://www.dynamxbioadaptor.com/
Les résultats sont prometteurs notamment sur le retour à un état presque physiologique de l'artère traitée [70]. Cependant, il y a encore un grand manque de recul vis-à-vis de cette technologie, car toutes les études cliniques sont faites sur 3 ans maximum.
Il se pourrait que les innovations majeures autour de coronaropathies ne se trouvent plus sur le principe du stent en lui-même, mais plutôt sur l’arrivée d’un regard extérieur sur la façon de le poser. Effectivement l’apport de l’IA notamment dans l’aide à la prise de décision, en se basant sur les images obtenues par la coronarographie est une option qui est en cours de développement et pourrait être utilisée dans les prochaines années [71].
Dans le même cas, Medtronic vient d’avoir l’approbation en mai 2023, par la FDA, de son tout nouveau pacemaker Micra AV2, VR2x se proclament être le plus petit pacemaker du monde, avec une promesse d’une durée de vie de 16 à 17 ans, soit 40% de plus que le pacemaker traditionnel. Cela signifie que les patients auraient besoin d’un seul dispositif au cours de leur vie, par conséquent une seule procédure à réaliser également. Le nouveau Micra AV2 est équipé d’un algorithme mis à jour qui programme automatiquement la stimulation synchrone afin d’aider à la coordination entre l’atrium et le ventricule [72]. C’est donc le seul stimulateur miniature double chambre.
L’innovation ne s'arrête pas et les recherches continuent toujours autour de la miniaturisation. Le stockage et la délivrance d'énergie électrique nécessaire au bon fonctionnement du dispositif représente la plus grosse contrainte à la réduction de la taille des stimulateurs. De ce fait, des recherches encore au stade d'expérimentation, ont lieu pour l’élaboration d’un pacemaker sans batterie puisant son énergie dans le mouvement du cœur [73]. Ce serait donc une évolution majeure dans le futur.
En effet, des chercheurs ont fait des tests, chez des porcs vivants, à l’aide d’un stimulateur cardiaque alimenté par leur battement du cœur. C’est un succès qui pourrait ouvrir la voie au développement de dispositifs médicaux implantables sans piles. Ce simulateur dit symbiotique se compose de trois éléments : un générateur attaché au cœur, permettant de convertir l’énergie mécanique de celui-ci en énergie électrique, une unité de gestion de l’alimentation comprenant un condensateur qui stocke l’énergie ainsi que le stimulateur cardiaque afin de réguler et de stimuler le cœur. Cette première étude est encourageante, mais il reste beaucoup de recherches à effectuer afin de pouvoir l’appliquer à l’Homme. Le dispositif devant être inséré autour du cœur nécessite une chirurgie à cœur ouvert, ce qui peut entraîner beaucoup plus de complications que les procédures de pose d’un pacemaker. Cela pourrait donc mener à la réticence de nombreux praticiens et patients. Ainsi, une autre piste serait que le dispositif utilise les mouvements d’autres muscles aux alentours afin d’éviter ce problème. Il faut également s’assurer que l’espace de stockage de l'énergie soit suffisant pour les personnes ayant besoin d’un grand rendement.
Une autre avancée notable se trouve dans les systèmes de resynchronisation cardiaque (CRT). Grâce à l'introduction d'un système sans fil qui utilise la stimulation endocardiaque pour transmettre de l'énergie ultrasonique à une électrode réceptrice du ventricule gauche, favorisant ainsi une stimulation biventriculaire. Il y a une implantation sous pectoral ou abdominal d’un émetteur ultrasonore et de sa batterie d’alimentation dans un espace intercostal. On trouve aussi une électrode de stimulation électrique qui reçoit les ondes ultrasonores et se situe dans ventricule gauche. L'émetteur ultrasonore détecte l'impulsion générée par le co-implant puis envoie de l'énergie ultrasonore à l'électrode réceptrice, et cette dernière stimule les myocytes en convertissant l'énergie ultrasonore en énergie électrique. Cette approche pourrait constituer une solution pour les patients chez qui une CRT classique n’a pas fonctionné, voir figure n°31. Cependant, elle complexifie encore plus la procédure avec l’introduction de deux dispositifs supplémentaires.
Figure n°31 : Fonctionnement du système Wise-CRT.
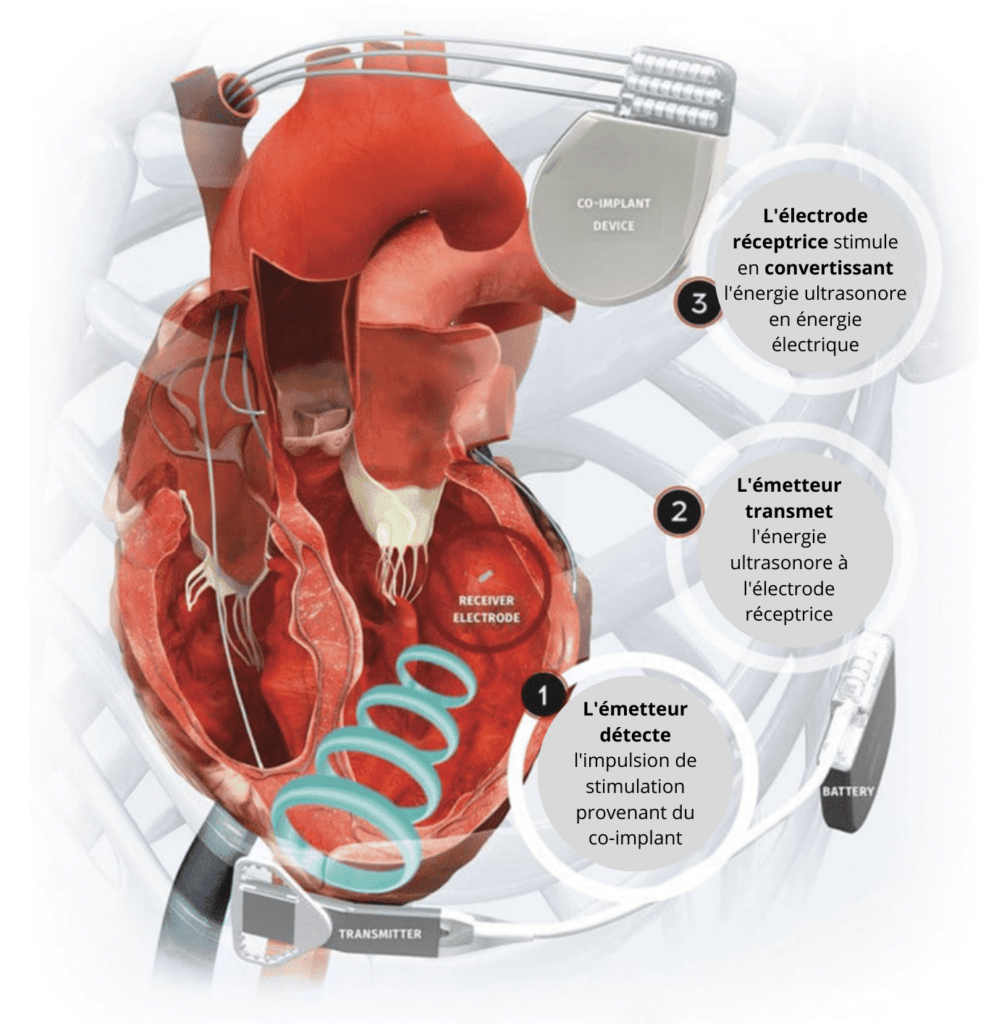
Récemment, un système de stimulation biventriculaire entièrement sans fil a été développé en combinant les technologies des systèmes Micra et WiSE-CRT. Cette méthode sans fil pourrait être particulièrement bénéfique pour les patients équipés de stimulateurs cardiaques sans fil qui présentent une dysfonction du ventricule gauche liée à une dyssynchronie iatrogène. Cependant, il faut savoir que cette technologie présente certaines limites, notamment l'incertitude quant à la procédure d'extraction des électrodes intracardiaques sans fil en fin de vie, en raison de la complication potentielle due à l'endothélialisation avancée.
Le coût élevé du dispositif WiSE-CRT reste un problème. Surtout si l'implantation se fait en deux étapes, les coûts péri procéduraux et les coûts des dispositifs peuvent être plus élevés que ceux des systèmes CRT classiques.
De plus, la transmission d'énergie via des ultrasons est moins efficace que via des fils conventionnels. Cela conduit à un besoin plus fréquent de remplacement de la batterie.
Et enfin, nous retrouverons l’utilisation de dispositifs “intelligents” qui utilisent l’intelligence artificielle (IA) afin de mieux analyser les données transmises par ces derniers lors de la télésurveillance notamment et réajuster de façon autonome les paramètres du dispositif. L’IA compte également être utilisée lors des interventions afin d’aider et de conseiller le chirurgien lors de la pose d’un stent ou du TAVI par exemple afin que celle-ci soit la plus précise possible et faciliter ainsi l’intervention.
L’utilisation d’un dispositif médical implantable est dû au mauvais fonctionnement du cœur, dans certains cas ces dispositifs médicaux bien qu’avancés technologiquement et divers en fonction des cas ne sont pas suffisants. C’est là qu’entre en jeu une avancée technologique considérable le cœur artificiel développé par l’entreprise Carmat. Il a été conçu afin de pallier les insuffisances cardiaques en phase terminale et qui attendent une implantation. Malheureusement, les délais d’attente sont trop longs ce qui mène au décès du patient.
Ainsi, le cœur artificiel Carmat pourrait suppléer au cœur, il est défini comme “un dispositif implantable actif destiné à remplacer les ventricules du cœur natif chez les patients souffrant d'insuffisance cardiaque”. Sa forme est similaire à celle du cœur et il a un fonctionnement électrohydraulique, lorsqu’il est connecté, il reproduit l’action du cœur humain en rétablissant la circulation sanguine dans le corps. Il peut se garder 180 jours après transplantation. Malgré ses avancées il y a encore de nombreuses contraintes, en France il est seulement utilisé dans le cadre d’essais cliniques car il n’est pas commercialisé malgré son marquage CE.
Au-delà de l’innovation technologique des avancées en recherche sur les thérapies cellulaires de l’insuffisance cardiaque semblent ouvrir une nouvelle voie de guérison pour les patients. Cette stratégie viserait à améliorer le myocarde défaillant. Les études cliniques sont en cours depuis les 20 dernières années, et de nombreuses questions restent en suspens sur les différentes cellules à utiliser. En effet, les cellules de cardiomyocytes fœtaux ou néonataux améliorent la performance cardiaque des animaux testés en phase pré-clinique, mais des problèmes immunologiques, logistiques et éthiques bloquent les perspectives cliniques d’une telle utilisation chez l’homme. Cependant, les cardiomyocytes adultes peuvent être préparés à partir de cellules souches présentes dans différents tissus (moelle osseuse, vaisseaux, cœur adulte, tissu adipeux) ce qui pourrait régler ce problème. L’utilisation de cellules souches hématopoïétiques issues de la moelle osseuse ou du sang circulant pourrait être une option. La transplantation de cellules musculaires squelettiques (myoblastes) améliore la fonction du myocarde dans les modèles animaux et entraîne la formation in situ de tissu musculaire squelettique différencié [74]. Les stimulateurs biologiques en sont aux premiers stades de développement, et les défis actuels comprennent la difficulté d'assurer une greffe à long terme et le risque potentiel de proarythmie. Les chercheurs restent optimistes, ces recherches couplées à l'ingénierie cardiaque tissulaire et les nanotechnologies pourraient aider à relever ces défis dans le futur et les essais cliniques se multiplient en faveur de cette avancée [75].
B. Les limites et critiques de cette course à l'innovation
Malgré les innovations qui semblent être prometteuses certaines d’entre elles semblent superflues d’après l’avis de certains praticiens qui reviennent à des dispositifs médicaux de première génération.
Ce sont des limites que l’on peut retrouver notamment avec les stents. En effet, les stents actifs sont des stents recouverts d’une molécule qui va volontairement ralentir et améliorer la cicatrisation de l’artère afin d’éviter une prolifération cellulaire dû à une cicatrisation excessive de la paroi qui entraînerait à nouveau un rétrécissement et donc une resténose. Depuis leur mise sur le marché, il y a environ 15 ans, aucune innovation n’a su initier leur remplacement car leurs résultats sont positifs et stables dans le temps. Les stents résorbables d’Abbott représenteraient une avancée prometteuse, avec l’avantage de se résorber progressivement dans le corps. En France, ces stents ont montré des résultats encourageant en termes d’efficacité et de réduction des risques, sur du long terme. Cependant, ils ont tout de même été perçus comme trop épais par rapport aux stents métalliques traditionnels, ce qui peut avoir des conséquences délétères pour des artères plus petites avec la création de lésions complexes.
Ces stents n’ont donc pas été bien reçus par les professionnels de santé aux Etats-Unis, lieu où est réalisé la majeure partie du processus de recherche et développement avant la commercialisation des dispositifs médicaux, en général. Ils ont donc été retirés du marché. Ainsi, la question de relocalisation des processus de test ou de développement, sur le territoire doit se poser.
Il est aussi notable de souligner que selon les professionnels de santé le frein premier des innovations actuelles est le fait que celles-ci ne répondent pas aux réels besoins du terrain, du fait de la scission et du manque d’intéractions entre les ingénieurs et acteurs sur le terrain.
On pourrait ainsi s’interroger sur une potentielle arrivée à la limite de l’innovation dans le cadre des dispositifs médicaux cardiaques implantables au vu de l'avancée rapide des innovations dans ce domaine au cours des dernières années.
Cette limite semble être d’autant plus une réalité du fait de l’accès à ces innovations. En effet en France la politique de remboursement des dispositifs médicaux implantables cardiaques est très complexe et change d’un dispositif à un autre, plus il sera innovant plus le coût sera élevé ce qui peut freiner les patients à l’utilisation de ces dernières innovations. Ceux-ci, considérant que les dispositifs médicaux implantables cardiaques présents ont déjà fait leur preuve et semblent être suffisants dans la plupart des cas.
Conclusion
Ce travail a permis de mettre en lumière, la nécessité d’innover pour faire évoluer au mieux le parcours de soin des patients nécessitant l’implantation d’un dispositif médical cardiaque. Le virage ambulatoire et l’idée de limiter les suites opératoires sont largement compris par les fabricants notamment avec la mise en avant de techniques par voie vasculaire pour la pose de ces implants. La démocratisation de l’approche par cathéter fait ses preuves et commence à révolutionner le traitement de pathologies en passant des chirurgies lourdes à des procédures moins traumatisantes, plus rapides et ne nécessitant plus toujours d'anesthésie générale. Les perspectives pour l’avenir sont aussi nombreuses et risquent d’amener un nouveau virage technologique avec l’exploitation de cellules souches.
Cependant, il est important de se rendre compte que l'accès à ces innovations n’est pas aisé en France et sont souvent réservées pendant des années à des centres spécialisés avant d’être démocratisées sur l’ensemble du territoire. S’ajoute à cette disparité d’accès, un temps de mise sur le marché souvent très long, le constat est qu’il faut plus d’une décennie pour voir une idée se démocratiser sur le territoire.
Enfin, afin d’élucider les zones d’ombre, nous avons eu la chance de rencontrer des professionnels particulièrement pédagogues et instructifs. Les échanges avec un chef de produit et un cardiologue interventionnel ont permis l’acquisition de nouvelles connaissances et ont beaucoup apporté autant académiquement que personnellement aux membres du groupe.