IDS210 - Les produits de contraste en imagerie médicale : usages, caractéristiques, risques et remboursement
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs




Contacts
- Luisa ARCOS : luisa.m.arcos26@gmail.com
- Yan HUSEIN : yrahusein@gmail.com
- Naïda IBRAHIM : naida.ibrahim.976@gmail.com
- Aashna ROBINS : rashrobsetude@gmail.com
Citation
A rappeler pour tout usage : ARCOS L, HUSEIN Y, IBRAHIM N, ROBINS A, « Les produits de contraste en imagerie médicale : usages, caractéristiques, risques et remboursement », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Projet, https://travaux.master.utc.fr/, réf n° IDS210, (https://doi.org/10.34746/ids210), décembre 2023,https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids210
Résumé
Ce Mémoire d’Intelligence Méthodologique plonge en profondeur dans l'utilisation des produits de contraste en France, offrant une exploration approfondie de leur rôle essentiel en imagerie médicale, de leur composition, des enjeux réglementaires, des risques associés, et des implications économiques. L'étude analyse les divers modalités d'imagerie, tels que l'urographie intraveineuse et la cystographie rétrograde, mettant en avant leur importance cruciale dans le diagnostic des affections urogénitales, notamment le reflux vésico-urétéral traité à travers la cystographie rétrograde. Une attention particulière est portée aux diverses applications cliniques.
Le cadre réglementaire encadrant les produits de contraste est décrypté, soulignant leur classification en tant que médicaments et les strictes régulations de l'Agence nationale de sécurité du médicament et des produits de santé. Les risques, tels que les réactions allergiques, l'insuffisance rénale, et les interactions médicamenteuses, sont analysés en détail, présentant une gestion proactive des risques qui souligne l'importance d'une évaluation préalable de la fonction rénale et d'une prévention des réactions allergiques.
La section sur le remboursement et la politique de santé en France met en lumière le processus de demande d'autorisation de mise sur le marché, la pharmacovigilance, et explique le remboursement des produits de contraste dans le cadre du forfait technique. Les coûts associés aux produits de contraste sont également examinés, avec des détails sur la récente réforme modifiant le circuit d'approvisionnement.
Ainsi, ce mémoire offre une vision exhaustive, recensant la situation des produits de contraste en France, embrassant le cadre réglementaire, et soulignant la nécessité impérative d'une gestion rigoureuse des risques.
Abstract
This report delves into the utilization of Contrast Agents in France, providing a thorough exploration of their crucial role in medical imaging. It offers a detailed examination of their composition, regulatory framework, associated risks, and economic implications. Additionally, the report analyzes various medical applications, such as intravenous urography and retrograde cystography, highlighting their significance in diagnosing diseases affecting the urogenital system, amongs others.
The regulatory framework of contrast agents is elucidated, with a particular focus on their classification, as they are considered medicaments. These agents are subject to control and supervision by the National Agency for Drug and Health Product Safety (ANSM). The report outlines adverse effects and risks, including allergic reactions and kidney dysfunction, along with preventive measures.
To cover diverse range of aspects of Contrast Agents, extensive research was conducted within the current health policy in France. The report underscores the functioning of the patient supply chain, starting from the approval of marketing authorization (AMM) and extending to surveillance, costs, and reimbursements. These costs, linked to contrast agents, are being reviwed by a reform to integrate them into the existing patient supply chain, aiming to benefit all stakeholders.
This report provides a comprehensive overview, allowing the identification of how the contrast agents market operates in France throughout its life cycle.
Téléchargements

MIM - Mémoire d’Intelligence Méthodologique
Les produits de contraste en imagerie médicale : Usages, caractéristiques, risques et remboursement.
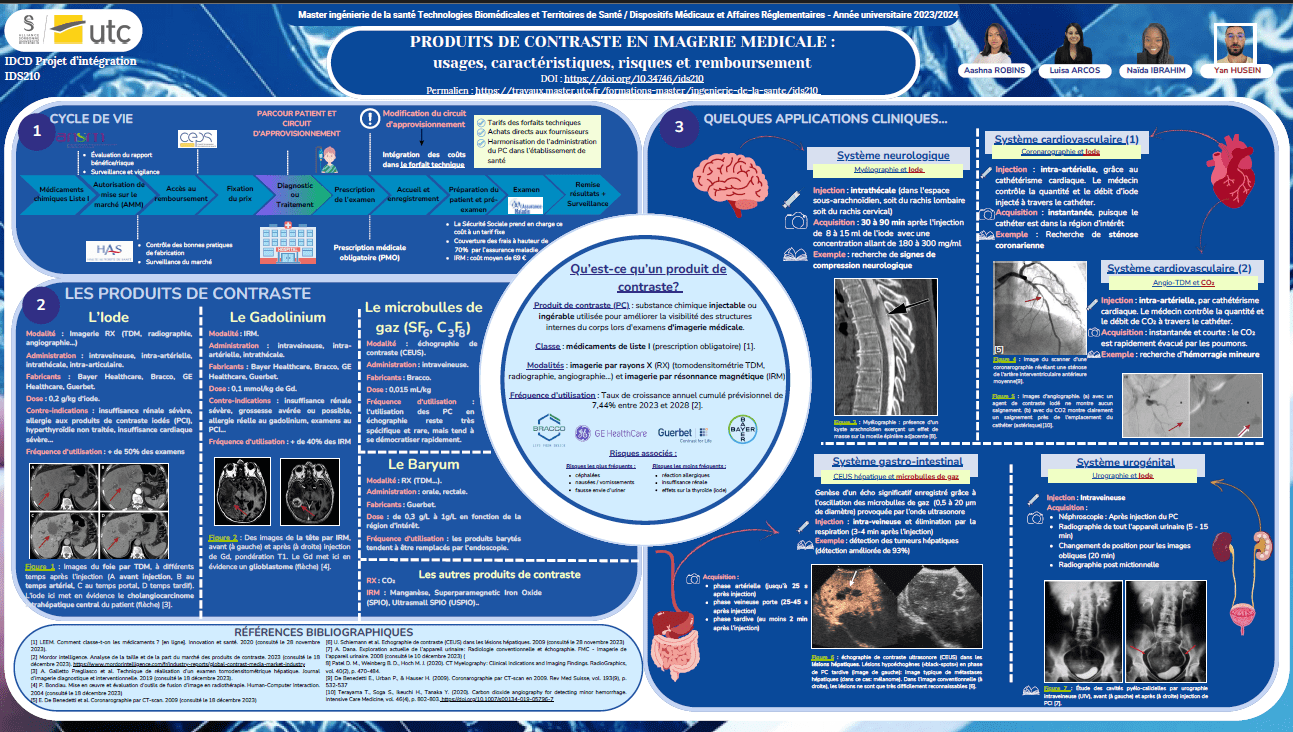
Poster - Les produits de contraste en imagerie médicale : Usages, caractéristiques, risques et remboursement
Liste des abréviations
- AAA : Abdominal Aortic Aneurysm
- AMM : Autorisation de mise sur le marché
- ANSM : Agence nationale de sécurité du médicament et des produits de santé
- ARS : Agences Régionales de Santé
- CEPS : Comité économique des produits de santé
- DGOS : Direction générale de l’offre de soins
- DSS : Direction de la sécurité sociale
- HAS : Haute autorité de santé
- HTA : Hypertension Artérielle
- IRM : Imagerie par résonance magnétique
- IV : Intra-Veineuse
- IA : Intra-Artérielle
- LFSS : Loi de Financement de la Sécurité Sociale
- PC : Produits de contraste
- PCI : Produits de contraste iodés
- PCG : Produits de contraste gadolinés
- SFR : Société Française de Radiologie
- TDM : Tomodensitométrie
- TDM : Tomodensitométrie
- UIV : Urographie Intraveineuse
- UNCAM : Union nationale des caisses d’assurance maladie
Liste des figures
- Figure 01. Illustration de l'atténuation des rayons X en radiographie [25]
- Figure 02. Influence des séquences pondérées T1 et T2 sur le contraste au sein du SNC [7]
- Figure 03. Formule chimique d’un PCI de basse osmolalité, non ionique, monomère : OMNIPAQUE (iohexol) [9]
- Figure 04. Formule chimique d’un PCI de basse osmolalité, non ionique, dimère (hexa-iodé) : VISIPAQUE (iodixanol) [10]
- Figure 05. Tableau des temps d'injection d’iode en fonction du type de scanner [45] .
- Figure 06. Utilisations possibles de l’angiographie CO2 [47]. AAA : Abdominal Aortic Aneurysm.
- Figure 07. Formules chimiques de quelques produits de contraste gadolinés. La plupart des chélates linéaires du gadolinium ne sont plus commercialisés pour leur implication dans la FNS [15][20].
- Figure 08. Schéma simplifié de la distribution et de l’élimination des PC gadolinés par le corps[11]
- Figure 09. Angiographie par IRM avec utilisation de gadolinium comme agent de contraste montrant des occlusions
- Figure 10. Myélographie en coupe sagittal montrant la présence d'un kyste arachnoïdien intradural extramédullaire (flèche), partiellement opacifié par du produit de contraste intrathécal, exerçant un effet de masse sur la moelle épinière adjacente
- Figure 11. Coupe sagittale de l’aorte abdominale par angio-TDM. La flèche blanche montre un anévrisme de l'aorte abdominale de 5 cm [51].
- Figure 12. Modèle 3D de l'aorte thoracique par angio-IRM. L’injection de gadolinium quant à elle, également par voie intraveineuse, permet d’obtenir des détails plus précis sur l’anévrisme par angio-IRM [51].
- Figure 13. Angio-TDM d’une femme de 63 ans montrant une hématome intramural de la crosse aortique (a, zoom en b)
- Figure 14. IRM médullaire, montrant un hypersignal T2 centromédullaire (flèches en a) au renflement lombaire, signant l’ischémie médullaire. Ici, 0,2 mmol/kg de gadolinium sont injectés chez l’homme de 82 ans. La dissection aortique est montrée par les flèches en b [54].
- Figure 15. Image du scanner d'une coronarographie révélant une sténose (flèche) significative de l'artère interventriculaire antérieure moyenne [56].
- Figure 16. Images d'angiographie. (a) L'angiographie avec un agent de contraste iodé ne montre aucun saignement. (b) L'angiographie avec du CO2 montre un saignement (flèche) près de l'emplacement du cathéter (astérisque) [57].
- Figure 17. Image par microscopie d’un échantillon de microbulles BR-14® [59]
- Figure 18. Échographie de contraste hépatique. Lésions hypoéchogènes (« black-spots ») en phase de PC tardive (à gauche) : image typique de métastases hépatiques (dans ce cas : mélanome). Dans l’image conventionnelle (à droite), les lésions n’étaient que très difficilement reconnaissables [50].
- Figure 19. Ulcération de la paroi du côlon, visible grâce au lavement baryté du tube digestif sur un cliché radiographique [61]
- Figure 20. Coloscopie virtuelle (colographie tdm) d’une anatomie normale. Le contraste induit par le lavement baryté permet d’obtenir une image 3D et 2D du côlon grâce à la TDM, et ainsi étudier la présence de lésions [61].
- Figure 21. Étude des cavités pyélo-calicielles par UIV [62].
- Figure 22. Cathéter de Foley [64]
- Figure 23. Étude de réplétion vésicale [63]
- Figure 24. Figure illustrant la mention présente sur l’ensemble des médicaments appartenant à la liste I
Les produits de contraste en imagerie médicale : usages, caractéristiques, risques et remboursement
Introduction
Les avancées technologiques dans le domaine de l'imagerie médicale ont permis le développement de nouvelles méthodes thérapeutiques et diagnostiques, parmi lesquelles l'utilisation des produits de contraste (PC) occupe une place importante. Parfois désignées sous le nom d'agent de contraste, ces substances sont le plus souvent administrées par voie intraveineuse (IV) ou intra-artérielle (IA) afin de mettre en évidence les structures internes du corps par l’augmentation du contraste entre les tissus et l’image.
Dans le monde médical, ces agents offrent des possibilités innovantes pour le diagnostic des maladies émergentes modernes [2]. De plus, le marché des produits de contraste continue de croître à travers le monde, pour une taille de 5,37 milliards USD en 2023, et un taux de croissance annuel composé prévisionnel de 7,44% entre 2023 et 2028, d’après Mordor Intelligence [1]. En effet, l’augmentation du nombre de maladies chroniques et notamment de cancers s’accompagne de l’augmentation du nombre de diagnostics à réaliser. Or, selon la Société Française de Radiologie (SFR), près d’un scanner sur deux réalisé et plus de 40% des Imageries par Résonance Magnétique (IRM) nécessitent l’injection d’un produit de contraste [42].
Ainsi, l’importance de ce marché en pleine évolution depuis quelques années a conduit à la réalisation de ce rapport, qui vise à recenser les produits de contraste les plus utilisés et développer leurs caractéristiques, leurs usages, leurs applications cliniques et leurs risques. Ce rapport se penche alors sur l’étude des produits de contraste en France et vise à répondre à la problématique suivante : "Quels sont les produits de contraste utilisés en France aujourd’hui et quelles sont leurs caractéristiques?"
Pour répondre à cette problématique, nous aborderons tout d'abord les différentes modalités d'imagerie médicale et leurs exigences en matière de produits de contraste, tout en analysant la composition de ces agents. Ensuite, nous plongerons dans les applications cliniques des produits de contraste, en nous penchant sur les spécificités de chaque technique d'imagerie. Dans la suite de ce rapport, nous approfondirons la réglementation, la tarification et la politique de remboursement de ces médicaments en France. Nous examinerons les mécanismes en place pour déterminer le coût de ces agents, ainsi que les politiques de remboursement mises en œuvre par les autorités de santé.
I. Imagerie médicale et produits de contraste
A. Modalités d’imagerie et leurs exigences
1. Imagerie radiographique
Dans la radiologie, le principe repose sur le fait qu’un faisceau de rayons X homogène est plus ou moins absorbé en fonction des structures anatomiques rencontrées. Suivant la densité et l’épaisseur des tissus que le faisceau rencontre, on observe une différence d’atténuation des rayons X avec une modification du faisceau de rayons. La densité des tissus influe directement sur l'absorption des rayons X : plus un tissu est dense, plus il apparaîtra en blanc sur l'image radiographique (Figure 1).
Les rayons X non absorbés après avoir traversé les tissus, sont recueillis par un récepteur qui peut être un film photosensible situé en arrière du tissu ou un détecteur sensible aux rayons. Le film photosensible contient l’image du tissu qui est ensuite révélée par un processus de développement et le détecteur fournit directement ou indirectement l’information à l’ordinateur qui restitue l’image finale.
La tomodensitométrie (TDM) combine des radiographies de multiples angles pour créer des images tridimensionnelles détaillées [5].
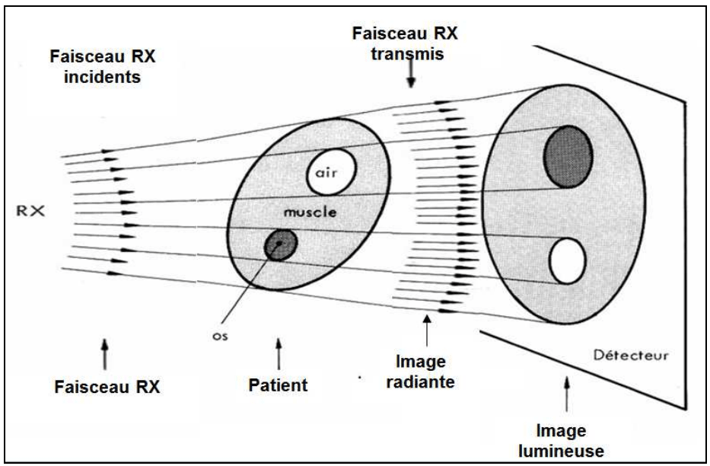
Figure 1 : Illustration de l'atténuation des rayons X en radiographie [25]
Les produits de contraste sont couramment utilisés en TDM, bien plus fréquemment qu’en radiologie conventionnelle. Les produits de contraste à base d'iode ou de baryum permettent de visualiser ces structures de manière plus claire et précise. Lorsqu'ils sont administrés, les tissus mous apparaîtront hyperdenses, soit plus « blancs », plus visibles sur l'image [4]. Le dioxyde de carbone est également utilisé comme agent de contraste, principalement dans l'angiographie, notamment dans des cas particuliers tels que l'insuffisance rénale [6]. L'angiographie -TDM est une technique qui combine des produits de contraste à base d'iode et des rayons X, vise à assurer le bon fonctionnement des vaisseaux en détectant toute lésion, obstruction ou rétrécissement.
2. Imagerie par résonance magnétique
L'IRM repose sur la résonance magnétique nucléaire des noyaux d'hydrogène (protons) présents dans les molécules d'eau, qui constituent une part significative de notre corps. En IRM, on exploite le fait que ces noyaux s'alignent dans la direction d'un champ magnétique statique (Bo) et que leur orientation peut être perturbée par des impulsions de radiofréquence (RF), induisant la résonance magnétique nucléaire (RMN).
Après cette excitation, les noyaux retournent à leur état d'équilibre. Deux temps caractéristiques, T1 et T2, sont essentiels : T1 représente le temps nécessaire pour que les noyaux rétablissent leur alignement avec le champ Bo, tandis que T2 mesure le temps nécessaire pour que les noyaux perdent leur cohérence sous l'influence du champ magnétique.
En IRM, des séquences spécifiques sont utilisées pour mesurer T1 et T2. Les images T1 mettent en évidence les différences de relaxation longitudinale (T1) entre les tissus, permettant de distinguer les structures anatomiques, tandis que les images T2 révèlent les variations de relaxation transversale (T2) entre les tissus, mettant en évidence des propriétés telles que la quantité d'eau (figure 2) [7].
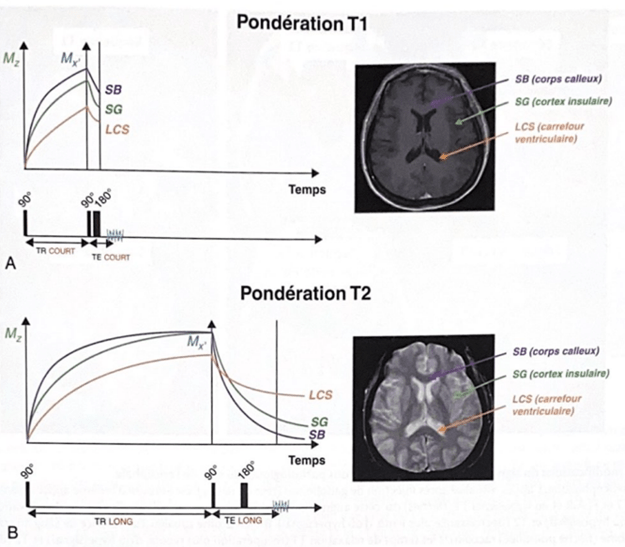
Figure 2 : Influence des séquences pondérées T1 et T2 sur le contraste au sein du Système Nerveux Centrale [7].
Lors d’un examen par IRM, certaines régions sont difficiles à visualiser : on accentue le contraste à l’aide d’agents de contraste, notamment le gadolinium [8]. Les progrès technologiques dans le domaine de l'IRM ont conduit à une diminution du nombre d'examens nécessitant une injection de contraste. Toutefois, cette pratique demeure indispensable dans environ 30 à 40% des cas à l'heure actuelle [43].
Cette nécessité persistante d'injection de contraste guide également le choix entre différentes modalités d'imagerie, notamment l'angio-IRM, qui, bien que partageant le même principe que l'angio-scanner, est souvent préconisée en seconde intention en raison de sa complexité technique et du temps d'acquisition prolongé [54].
3. Imagerie échographique
L'échographie est une technique qui utilise des ondes sonores pour créer des images des organes internes du corps. Un appareil émet des ondes ultrasonores à travers une sonde, et ces ondes pénètrent dans les tissus. Lorsque les ondes rencontrent une interface, c'est-à-dire la frontière entre deux types de tissus, une partie de ces ondes est réfléchie vers la sonde, et l'autre continue à traverser les tissus. En analysant ces échos, l'appareil crée une image détaillée des organes et des structures internes.
Chaque type de tissu a une impédance acoustique différente, ce qui influence la façon dont les ondes sont réfléchies. Ainsi, l'échographie permet de distinguer différents tissus en fonction de leurs propriétés acoustiques. Il existe plusieurs modes :
• Mode A (Amplitude) : Affiche la profondeur des tissus sous forme d'une courbe basée sur l'amplitude du signal capté par la sonde.
• Mode TM (Temps Mouvement) : Montre les changements de position et de luminosité des échos au fil du temps en utilisant un faisceau ultrasonore unidirectionnel.
• Mode 3D (Trois Dimensions) : Permet de visualiser en trois dimensions les zones explorées.
• Imagerie Harmonique Tissulaire : En sélectionnant la composante harmonique du signal renvoyé vers la sonde, cette technique réduit la dégradation du signal. Couplée à l'utilisation de produits de contraste ultrasonores, elle complète le mode B pour une meilleure visualisation.
L'échographie de contraste utilise de micro bulles (exemple : hexafluorure de soufre) injectées dans la circulation sanguine pour améliorer la visualisation des organes. Ces bulles apparaissent comme des points blancs sur l'image et sont utiles pour examiner les tissus ou vérifier la perméabilité des vaisseaux [5].
B. Les produits de contraste et leur composition
Dans un service d’imagerie médicale sont utilisés différents produits de contraste en fonction de l’imagerie à réaliser. Ainsi, en fonction de leur réaction avec le type de rayonnement ou avec la modalité d’imagerie, on utilisera des produits à composition différente.
1. Les Produits de contraste en imagerie par RX
a. Les produits iodés
1. Composition
En radiologie, la différence de numéro atomique dans les tissus observés est un facteur responsable de la présence de contraste entre les tissus. On utilise alors l’iode (Z=53) pour les imageries des régions où le contraste est très faible. D’après nos entretiens avec plusieurs radiologues des différents hôpitaux, les produits iodés sont les produits de contraste les plus utilisés en imagerie par rayons X, que ce soit la TDM, la radiologie conventionnelle ou l’angiographie par exemple. De plus, il est courant que ces médecins et que les professionnels de santé en service de radiologie ne connaissent pas d’autres produits de contraste que ceux-ci pouvant être utilisés en imagerie radiographique.
L’iode est toxique, par son interaction avec la thyroïde, c’est pourquoi elle est intégrée dans des macrocycles hydrophiles benzéniques. Les PCI (Produits de Contraste Iodés) sont donc des molécules constituées de 3 atomes d’iode fixés sur un ou 2 cycles benzéniques. Leur caractère hydrophile permet au PDC de se mélanger au sang rapidement de manière homogène, et sa visualisation au scanner ou à la radiographie dépend grandement de la vascularisation des organes : plus une région est vascularisée, plus on y trouvera de PDC. Ainsi, la distribution du médicament se fait en trois temps : dans un premier temps, le produit iodé est situé dans les vaisseaux, après son injection intraveineuse (ou artérielle dans le cas d’une angiographie). Ensuite, on définit un temps interstitiel, correspondant à la diffusion du PDC à travers les capillaires fenestrés. Enfin, le temps excrétoire correspond à l'élimination du produit de contraste, principalement par les reins, mais aussi en partie par le tube digestif, le foie, la salive ou la bile [5].
Parmi les PCI, on distingue 2 catégories, selon leur osmolalité :
- Les PCI de haute osmolalité ont une concentration plus élevée en iode, ils sont donc plus réactifs et plus susceptibles de provoquer des réactions d’hypersensibilité. Ces derniers sont des monomères ioniques, associés donc à un cation sodium ou méglumine. C’est la séparation du cation et du cycle benzénique en milieux aqueux qui en augmente l’osmolalité. Ces médicaments commercialisés en France sont Gastrografine et Radioselectan commercialisés par Bayer Healthcare, et Telebrix commercialisé par Guerbet.
- Les PCI de basse osmolalité quant à eux ont une osmolalité égale ou plus faible que l’autre catégorie, et présentent donc une sécurité plus importante pour le patient. En effet, cette catégorie de PCI peut être soit monomère non ionique ou dimère ionique, doublant la quantité d’iode par molécule. Ces médicaments commercialisés en France sont Iomeron et Iopamiron commercialisés par Bracco, Omnipaque (figure 3) et Visipaque (figure 4) commercialisés par GE Healthcare, Optiject, Optiray et Xenetix commercialisés par Guerbet et Ultravist commercialisé par Bayer [14].
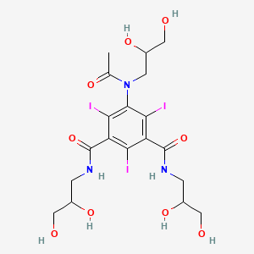
Figure 3. Formule chimique d’un PCI de basse osmolalité, non ionique, monomère : OMNIPAQUE (iohexol) [9]
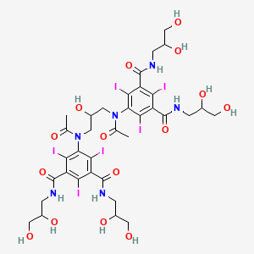
Figure 4. Formule chimique d’un PCI de basse osmolalité, non ionique, dimère (hexa-iodé) : VISIPAQUE (iodixanol) [10]
2. Doses et débits
D’après les dernières recommandations de la Société Française de Radiologie (SFR), une dose fixe de PC n’a plus lieu d’être lors d’une injection pour différents patients. Les doses sont aujourd’hui toujours adaptées en fonction du poids du patient, du rehaussement en Unités Hounsfield (UH) désiré et du kilovoltage utilisé pour l’acquisition. Les dernières technologies d‘imagerie par rayons X permettant de choisir un kilovoltage (kV) déterminé par examen, il est possible de baisser la dose d’exposition et de PCI nécessaire afin de réduire les éventuels effets indésirables chez le patient et la consommation en PCI.
Dans le cadre d’un protocole oncologique et tissulaire, l’iode est injectée pour l’opacification des parenchymes par voie intraveineuse, et la charge doit correspondre à une valeur entre 0,4 et 0,6 g/kg. Pour y parvenir, on injecte un volume correspondant à [charge en iode (g/kg) * poids du patient (kg) / concentration du PCI (g/L)] en L. Le débit quant à lui doit permettre un temps d’injection de 30 secondes, et augmente également avec le poids du patient. Il est calculé par [quantité d’iode injectée (g/s) / concentration du PCI (g/L)], et va de 2,5 cc/s pour un patient de 45 kg à 6,1 cc/s pour un patient de 110 kg. On utilise d’autres formules pour les patients obèses, en s’aidant de la surface corporelle plutôt que du poids du patient [44].
Dans le cadre d’un protocole vasculaire, le facteur clé à optimiser est le débit d’iode, en fonction du temps d’injection. La SFR recommande un débit fonction des kV utilisés pour l’acquisition de 0,8 à 1 g/s d’iode pour 80 kV, à 1,2 à 1,6 g/s d’iode pour 120 kV [44].
Ensuite, ce débit doit être injecté pendant une certaine durée en fonction de l’application voulue, selon la formule suivante : [temps d’injection = temps d’arrivée du PCI - (temps d’acquisition/2)]. Elle décrit alors les temps d’injections suivants (figure 5) :
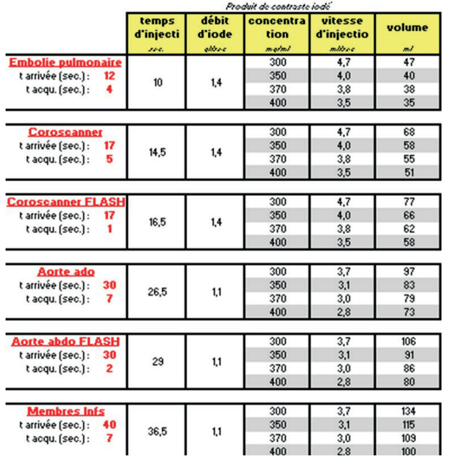
Figure 5. Tableau des temps d'injection d’iode en fonction du type de scanner [45] .
La même fiche de recommandation pour la pratique clinique de la SFR décrit un protocole particulier pour les cas d’embolies pulmonaires, qui sont des cas particuliers puisque le protocole est l’un des plus difficiles à réaliser, étant sensible au débit cardiaque et à la corpulence du patient [45].
3. Utilisations et effets indésirables
En fonction de l’examen réalisé, et de la structure que l’on souhaite examiner, on utilisera un PCI différent : chaque PCI possède des spécificités et une ou plusieurs voies d’injection. Le choix du PCI porte également sur la tolérance du patient à un produit de contraste ou un autre, ses antécédents et ses allergies ou réactions indésirables avec un produit en particulier, et surtout, le choix porte sur le prix du produit de contraste et dépend de chaque établissement de santé. Il est courant qu’un établissement de santé ne se procure en produit de contraste que chez un fabricant tel que BAYER ou GUERBET.
En pratique, les PCI de haute osmolalité sont de moins en moins utilisés depuis plusieurs années, puisqu’ils sont moins bien tolérés.
Les produits de contraste iodés sont le plus souvent injectés par voie intraveineuse ou intra artérielle, mais elle peut aussi l’être par voie intrathécale ou entérale, ou directement au sein d’une cavité, selon l’application voulue.
Parmi les effets indésirables de l’ingestion ou de l'injection de PCI, on trouve notamment des douleurs au point d’injection, des sensations de chaleur, des perturbations du métabolisme thyroïdien, des réactions allergiques et d’hypersensibilité ou des complications cardiovasculaires ou rénales, dues à l’hyperosmolarité et la chimiotoxicité des PCI. Les néphropathies post injection de PCI, caractérisée par une augmentation de la créatinine suivant l’injection, due à une hypoxie rénale et à une toxicité directe du PCI sur les tubules rénaux (nécrose tubulaire aiguë) sont également courantes [5]. Enfin, les PCI sont contre-indiqués chez la femme enceinte, les personnes allergiques à l’iode, les patient en hyperthyroïdie non traitée ou les patient insuffisant rénal [7].
b. Sulfate de baryum
1. Composition
Les suspensions de sulfate de baryum (BaSO4) sont des médicaments utilisés comme produits de contraste dans l’opacification de l’appareil digestif en général en radiographie et TDM, grâce au numéro atomique du baryum élevé (Z=56) et à la densité des molécules. Il agit alors comme agent de contraste positif. Ce médicament, qui fait partie de la liste des médicaments essentiels de l’OMS, est relativement sans danger [21].
2. Utilisations et risques
Ses effets secondaires incluent la diarrhée, la constipation, l’appendicite, la pneumopathie en cas d’inhalation, et, plus rarement, des réactions d’hypersensibilité et des chocs anaphylactiques. Les PC à base de sulfate de baryum sont administrés indifféremment par voie orale ou, éventuellement, rectale, et sont contre-indiqués dans quelques cas cliniques, incluant les perforations intestinales. En effet, cette molécule étant non hydrosoluble, elle ne peut pas être injectée dans le sang, c’est pourquoi les PC à base de BaSO4 sont indiqués uniquement dans l’opacification du tube digestif. De plus, en raison de sa structure granulométrique, ce PC peut entraîner des effets indésirables tels que des embolies. En France, MICROPAQUE, MICROPAQUE SCANNER et MICROTRAST sont commercialisés par GUERBET [13][20].
Ce PC, historiquement le premier à être utilisé, n’est plus que rarement indiqué de nos jours, à cause du développement de nouvelles techniques d’exploration, en particulier l’endoscopie. Ainsi, il est rare de nos jours de prescrire une imagerie d’une région du tube digestif avec PC à base de sulfate de baryum [6].
c. Dioxyde de carbone
1. Utilisations et doses
De nombreuses recherches ont lieu sur l’utilisation du dioxyde de carbone comme produit de contraste positif intravasculaire, et comme alternative aux PCI. En effet, il pourrait être très utile chez les patients souffrant d'insuffisance rénale puisqu’il est éliminé par voie respiratoire, et chez les patients souffrant d’allergie à l’iode. Il permettrait ainsi l’imagerie vasculaire à moindre risque pour les patients. Injecté soit par injecteur automatique, soit par seringue, une injection de 30 à 40 mL de CO2 à un débit de 10 mL/s serait efficace dans de nombreuses applications cliniques (figure 6).
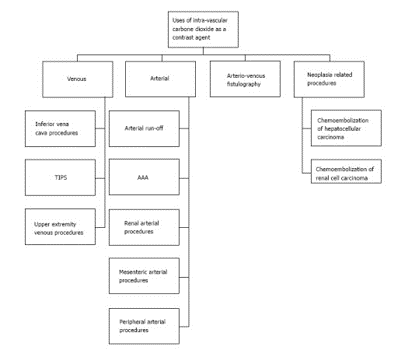
Figure 6. Utilisations possibles de l’angiographie CO2 [6]. AAA : Abdominal Aortic Aneurysm.
2. Risques
Les risques liés à l’utilisation du CO2 comme produit de contraste sont surtout dus à la dose injectée, qui, si excessive, peut causer des obstructions de vaisseaux, donc des ischémies. Pour cette raison, l’utilisation de ce PC devrait être évitée pour l’imagerie cérébrale, spinale ou cardiaque pour éviter les complications trop graves. Concernant l’efficacité, il y a dissolution rapide du CO2 dans le sang, ainsi que par sa nature expansive, le CO2 comme produit de contraste pourrait entraîner des erreurs de mesure du diamètre des vaisseaux et dans le choix des stents. Des recherches ont encore lieu sur les nombreuses utilisations du CO2 comme PC en imagerie par RX, comme alternative aux PCI [47].
2. Les produits de contraste en IRM
Les produits de contraste en IRM se divisent en deux catégories, selon leur effet en pondération T1 ou T2 : les PC paramagnétiques et superparamagnétiques. On utilise aujourd’hui en France principalement les chélates de Gadolinium, paramagnétiques, et, bien plus rarement, les particules de ferrite superparamagnétiques (SPIO (Superparamagnetic Iron Oxide) et USIO (Ultrasmall Superparamagnetic Iron Oxide)). De plus, d'après les entretiens que nous avons pu avoir avec différents radiologues, il semble commun que seuls les chélates de Gadolinium ne soient utilisés dans les établissements de santé et qu’on ne connaisse même pas l’existence d’autres produits de contraste pour l’IRM [46].
a. Les PC gadolinés paramagnétiques
1. Composition
Le gadolinium (Gd) est l’élément chimique de numéro atomique 64. Ce métal faisant partie de la famille des lanthanides est utilisé sous sa forme ionique Gd3+ en imagerie par résonance magnétique. Cet ion est cependant très toxique pour le corps humain, puisque, de par sa taille et ses propriétés chimiques similaires à celles du cation Ca2+, il agit comme un inhibiteur compétitif de ce dernier. Le gadolinium est donc utilisé comme PC en imagerie uniquement sous la forme d’un ion chélaté au sein d’un macrocycle ou d’une chaîne linéaire, ou associé à un ligand afin de réduire sa cytotoxicité (figure 7) [19].
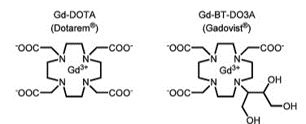
Figure 7 : Formules chimiques du Dotarem et du Gadovist. La plupart des chélates linéaires du gadolinium ne sont plus commercialisés pour leur implication dans la Fibrose Néphrogénique Systémique [15][20].
2. Utilisation et doses
Sous sa forme ionique, le gadolinium possède 7 électrons non appariés. Ces électrons permettent de réduire le temps de relaxation longitudinal T1 de l’eau tissulaire, engendrant un hypersignal T1 pour obtenir une image plus contrastée. Le gadolinium accélère également la relaxation transversale, donc augmente le signal T2, quand il est concentré, mais l’effet est moindre par rapport à l’hypersignal T1. En fonction de l’examen réalisé, le produit de contraste gadoliné (PCG) peut être injecté par voie intraveineuse, intra-artérielle, ou, plus rarement, intrathécale ou intraventriculaire. Son caractère hydrophile rend sa pénétration dans le compartiment intracellulaire faible, en fonction du chélateur ou du ligand auquel le Gd est lié. Le gadolinium est généralement éliminé par voie rénale, et parfois par le système digestif en passant par le foie (figure 8) [11]. En France, Dotarem (Guerbet), Prohance et Multihance (Bracco), Clariscan (GE Healthcare) et Gadovist (Bayer) sont commercialisés aujourd’hui. La plupart sont non spécifiques. Cependant, le Multihance et d’autres PCG linéaires ont vu leur AMM retirée du marché par le Pharmacovigilance Risk Assessment Committee (PRAC) pour la mise en évidence de l’accumulation de Gd dans les tissus, notamment le cerveau. Cette suspension pour le Multihance a été revue en 2017, pour que son utilisation devienne hépato-spécifique, “en cas de besoin important de diagnostic”. Ainsi, Multihance reste le seul PCG linéaire toujours utilisé en France à l’heure actuelle [47].
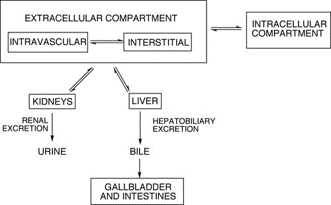
Figure 8. Schéma simplifié de la distribution et de l’élimination des PC gadolinés par le corps [11]
La dose clinique des chélates de gadolinium macrocycliques doit être de 0,1 mL/kg pour les PCG de concentration 1 mmol/mL, et 0,2 mL/kg pour les produits concentrés à 0,5 mmol/mL. Dans le cas du PCG hépato-spécifique, la dose clinique est de 0,05 mmol/kg. Afin d’optimiser les injections, cette dose est donc adaptée en fonction du poids du patient, et des tableaux de référence sont disponibles sur les fiches de recommandation pour la pratique clinique de la SFR [43].
3. Risques
Le produit de contraste à base de gadolinium est très bien toléré, et rares sont les cas d’hypersensibilité et de chocs anaphylactiques. En 2006, des études ont montré l’implication de l’accumulation du gadolinium dans les tissus chez les patients souffrant d’insuffisance rénale dans le développement de fibrose néphrogénique systémique (FNS) [17][18]. Il a été également démontré que le gadolinium s’accumule dans certains noyaux gris du SNC, sans que cette rétention ne présente d’effet indésirable ou de conséquence particulière pour le moment. Enfin, il n’a pas été observé d’effet tératogène ou mutagène chez l’Homme [7].
b. Oxyde de fer superparamagnétique
En fonction de leur taille, on parle de Superparamagnetic Iron Oxide (SPIO) à tropisme hépatique et de Ultrasmall Superparamagnetic Iron Oxide (USPIO) à tropisme ganglionnaire. Ce sont des produits de contraste utilisés en IRM, puisqu’ils ont un effet sur le temps de relaxation T2. Les USPIO étant fixés aux macrophages, un hyposignal a lieu, plus il y a de ces cellules dans un tissu. Or, les tissus cancéreux contiennent moins de macrophages que les tissus sains : ce produit de contraste permet d’augmenter le contraste entre les tissus sains et les tissus métastatiques. Ces produits de contraste, tels que le Sinerem, Ferahem, Endorem ou Resovist, sont encore en phase de recherche clinique, par les fabricants Guerbet, Bayer et GE Healthcare, et leur efficacité n’est pas toujours prouvée. De plus, pour de nombreux SPIO et USPIO, la demi-vie des molécules est encore trop faible pour obtenir des images à temps et correctement [7].
c. Autres PC en IRM et recherche
Des PC à base de manganèse sont en cours de recherche, puisqu’ils sont plus rapidement éliminés et tout aussi efficaces que le Gd [12]. Ils pourraient remplacer le gadolinium dans les indications d’IRM chez les patients souffrant d’insuffisance rénale. L’utilisation de cette molécule en phase de recherche clinique est tout de même limitée, par sa faible disponibilité et à cause de la difficulté de trouver un ligand stable et inerte pour former un complexe [48].
D’autres PC sont en recherche clinique pour la modalité de l’IRM, incluant les PC à effet Chemical Exchange Saturation Transfer (CEST), correspondant à des agents capable d’échanger des ions H+ avec des molécules d’eau suite à une onde de radiofréquence (RF) donnée, propre à la molécule. Le principal avantage de ce type d’agents de contraste est la possibilité d’appliquer ou non avec un effet “on/off” le contraste, par l’application de la RF nécessaire ou non.
Enfin, d’autres PC en IRM sont en recherche, notamment les agents fluorés pour la possibilité de quantification et sa complémentarité avec l’IRM, et les agents hyperpolarisés, très sensibles et améliorant le champ magnétique principal, sous forme de gaz [49].
3. Les produits de contraste en imagerie US
En imagerie par ultrasons (US), il est très rare d’utiliser des produits de contraste, sauf pour des applications très spécialisées. Il est possible, en cas de nécessité, d’utiliser des microbulles de gaz entourées d’une enveloppe de galactose ou de phospholipides, pour augmenter leur propriétés réfléchissantes des US et l’augmentation de l’échogénicité du sang. Aujourd’hui, Optison (Perfluoropropane, C3F8, fabriqué par GE Healthcare) et Sonovue (Hexafluorure de soufre, SF6, fabriqué par Bracco) sont commercialisés en France [50].
Les PC pour l’échographie (PC-US) sont des gaz inertes, inodores et incolores. Ils sont injectés par voie intraveineuse et ne diffusent pas dans le tissu interstitiel. Ils permettent ainsi de mettre en valeur la perfusion d’un organe ou certaines régions vascularisées à l’image. Ces agents de contraste sont très bien tolérés avec peu d’effets indésirables si les doses injectées sont bien maîtrisées, mais ils sont contre-indiqués en cas de grossesse ou d’infarctus du myocarde récent, ou d’insuffisance respiratoire sévère [16].
II. Applications cliniques des produits de contraste
Les produits de contraste sont utilisés dans l’imagerie diagnostique de nombreuses pathologies. Ils sont donc indiqués dans plusieurs applications cliniques dans différents systèmes anatomiques, comme en imagerie neurologique, cardiaque ou gastro-intestinale. Cette partie s’intéresse à quelques exemples d’applications cliniques des produits de contraste en imagerie médicale.
A. Imagerie neurologique
1. Angio-TDM ou angio-IRM pour l’Accident Vasculaire cérébral
Les accidents vasculaires cérébraux (AVC) représentent la principale cause d'handicap moteur acquis chez l'adulte, la deuxième cause de démence, et la troisième cause de mortalité [65].
C’est une perte d’une fonction du cerveau et il existe deux types d’AVC : l’AVC ischémique et l’AVC hémorragique. L’AVC ischémique ou l’infarctus cérébral est dû à un caillot qui bouche une artère qui a comme destination, le cerveau. Plus rarement, l’infarctus cérébral peut avoir une origine veineuse et on parle donc de thrombose veineuse cérébrale ou thrombophlébite. L’AVC hémorragique, comme son nom l’indique, provoque un saignement dans le cerveau après une rupture d’une artère cérébrale à cause d’une tension artérielle élevée ou anévrisme ou d’une malformation artério-veineuse [66].
a. Angio-TDM
La TDM offre une performance supérieure à l'IRM dans l'étude détaillée des structures osseuses, en particulier dans la fosse cérébrale postérieure, la base du crâne et le canal rachidien, bien qu'elle ne permette pas de visualiser leur contenu.
L’angiographie par TDM (angio-TDM) avec contraste constitue une technique éliminant la nécessité de recourir à l'IRM ou à l'angiographie classique pour la visualisation des vaisseaux cérébraux. Deux types d’angio-TDM sont disponibles [67] :
- Angio-TDM artérielle : Cette modalité explore les troncs supra-aortiques et le polygone de Willis pour détecter d'éventuelles pathologies cérébro-vasculaires. L'acquisition s'effectue de manière précoce, 15 à 20 secondes après l'injection du produit de contraste iodé.
- Angio-TDM veineuse : Cette variante explore les sinus veineux du crâne à la recherche de thrombophlébites. L'acquisition intervient de manière plus tardive, soit 40 à 45 secondes après l'injection du produit de contraste iodé [5].
L'utilisation d'un produit de contraste radio-opaque, administré par voie intraveineuse, permet de repérer des anomalies structurelles telles que des tumeurs cérébrales, des abcès cérébraux et certaines anomalies vasculaires, notamment les malformations artérioveineuses.
L'injection intrathécale de produit de contraste peut être utilisée pour visualiser des compressions extrinsèques du tronc cérébral, de la moelle épinière ou des racines, bien que cette méthode soit moins courante aujourd'hui en raison de la disponibilité de l'IRM [67].
b. Angio- IRM
L'IRM cérébrale est la modalité d'imagerie la plus adaptée pour l'exploration du cerveau. Pour des procédures telles que l'angiographie, il est courant d'administrer du gadolinium. Ce produit a pour effet de réduire le temps de relaxation T1 du sang, facilitant ainsi la distinction entre le sang et les autres tissus. L'utilisation du gadolinium permet d'obtenir une image des vaisseaux avec un contraste amélioré (figure 9). La figure 9 met en évidence des occlusions signalées par des flèches rouges, potentiellement responsables d'un infarctus cérébral.
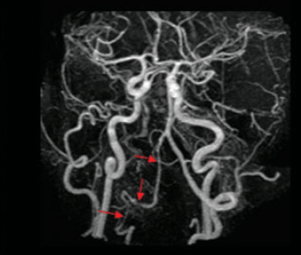
Figure 9. Angiographie par IRM avec utilisation de gadolinium comme agent de contraste montrant des occlusions (flèches rouges) [68].
2. Myélographie pour les signes de compressions et les douleurs neurologiques
La myélographie, également connue sous le nom de saccoradiculographie, est un examen radiographique de la moelle épinière prescrit dans le cadre du bilan de douleurs neurologiques tel que les sciatiques et de la recherche de signes de compression neurologique pour déterminer le niveau précis de l'atteinte et sa cause (hernie discale, tumeur, abcès, hématome) (figure 10).
L'examen utilise des rayons X et un produit de contraste à base d'iode. Le principe consiste à opacifier et visualiser les contours de la moelle épinière. Ce produit de contraste à base d'iode tapisse les parois de la moelle épinière, rendant ainsi les contours visibles [69].
La myélographie, procédure diagnostique médicale, requiert l'administration de 8 à 15 ml d'un produit de contraste iodé hydrosoluble, avec une concentration allant de 180 à 300 mg par millilitre. Cette injection intrathécale se réalise dans l'espace sous-arachnoïdien, soit au niveau du rachis lombaire soit du rachis cervical accompagné d’une anesthésie locale ou une pommade anesthésiante. Le scanner est souvent réalisé après la myélographie, il porte le nom de myéloscanner. Il est réalisé entre 30 à 90 minutes après l’injection [70].
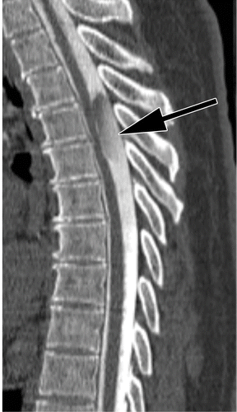
Figure 10. Myélographie en coupe sagittal montrant la présence d'un kyste arachnoïdien intradural extramédullaire (flèche), partiellement opacifié par du produit de contraste intrathécal, exerçant un effet de masse sur la moelle épinière adjacente [71]
B. Imagerie du système cardiovasculaire
De nombreux diagnostics en imagerie cardiovasculaire peuvent être faits par angio-TDM ou angio-IRM. Comme indiqué dans la première partie, de manière générale, l’angio-TDM est souvent indiquée en premier lieu en France, par son accessibilité plus importante, et sa réalisation plus simple (temps d’acquisition plus faible). Cependant, l’angio-IRM a l’avantage de ne pas émettre de rayonnements ionisants.
1. Angio-TDM ou angio-IRM pour les anévrismes de l’aorte
L’anévrisme est une dilatation anormale d’une artère, qui se traduit par une augmentation d’au moins 50% du diamètre du vaisseau. L’affaiblissement de la paroi artérielle en est responsable. L’anévrisme peut être fusiforme (circonférentiel de l’artère) ou sacculaire (localisé, asymétrique). Différentes causes peuvent induire un anévrisme, comme une nécrose kystique médiale, un traumatisme ou une vascularite, et de nombreux facteurs augmentent le risque, incluant le tabac et l’HTA. Ce trouble peut concerner toutes les artères, mais principalement l’aorte abdominale (figure 11) ou thoracique (figure 12), et très rarement les artères les artères périphériques. Le diagnostic a lieu souvent par échographie ou TDM et angio-TDM.
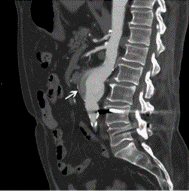
Figure 11. Coupe sagittale de l’aorte abdominale par angio-TDM. La flèche blanche montre un anévrisme de l'aorte abdominale de 5 cm [51].
L’injection de PCI permet de mieux visualiser le vaisseau et d’obtenir plus de détails sur la structure et l’emplacement de l’anévrisme. Lorsqu'il n’y a pas de risque de rupture important, l’angio TDM permet donc d’estimer précisément la taille de l’anévrisme. Le PCI est injecté par voie IV avant l’acquisition de l’image. Dans le cas de l’anévrisme, l’acquisition est synchronisée avec l’injection du PCI. Ainsi, l’injection IV à lieu à t = 0 s, et le PCI atteint généralement la portion abdominale de l’aorte entre 30 et 35 s. C’est la région d’intérêt, et l’acquisition est donc faite à ce temps là afin d’optimiser l’utilisation du PCI. Ces temps sont identiques pour le PDG puisqu’ils dépendent principalement du débit cardiaque et de l’état physiologique du patient, et varient donc selon les patients [52].
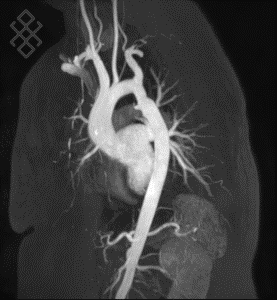
Figure 12. Modèle 3D de l'aorte thoracique par angio-IRM. L’injection de gadolinium quant à elle, également par voie intraveineuse, permet d’obtenir des détails plus précis sur l’anévrisme par angio-IRM [51].
L’anévrisme est traité par une prise en charge médicale du patient par le contrôle de la pression artérielle avec un hypertenseur, et l’arrêt du tabac. Les risques de rupture dépendent de la taille de l’anévrisme, et sont alors traités par voie chirurgicale [52].
2. Angio-TDM ou angio-IRM pour les dissections aortiques
La dissection aortique est une déchirure de l’intima (la couche interne du vaisseau sanguin, par rapport à la media et l’adventice), créant ainsi un faux canal. C’est une pathologie rare mais dangereuse, puisqu'elle peut provoquer une insuffisance aortique et un trouble circulatoire, et ses symptômes sont principalement l'apparition brutale d’une douleur au niveau de la déchirure. Cette pathologie est diagnostiquée par imagerie, soit par échocardiographie ou angio-TDM et angio-IRM.
L’angio-TDM est l’examen de premier lieu puisqu’il est disponible rapidement et facilement, plus que l’angio-IRM (figure 13). Ainsi, cet examen est indiqué chez les patients en urgence, tandis que l’angio-IRM est plutôt indiquée chez les patients stables, puisque sa sensibilité et sa spécificité sont plus importantes, mais qu’elle est plus longue à mettre en place. En effet, le temps d’acquisition est plus important en IRM (figure 14) qu’en TDM, ce facteur influe sur le choix de la modalité d’imagerie. L’image permet donc de mettre en évidence la dissection par l’aspect d’une double lumière au niveau de l’aorte. Les deux examens nécessitent l’injection de produit de contraste, à base d’iode pour les rayons X et de gadolinium pour la résonance magnétique nucléaire. De la même manière que pour la recherche d’anévrisme, les temps physiologiques d’opacification par voie IV des différentes régions d’intérêt sont connus. Si l’injection est à t=0 s, alors l’opacificatin de la crosse aortique aura lieu à t = 20 s, et celle de la partie abdominale de l’aorte à t = 30 ou 35 s. En fonction de la position suspectée de la dissection aortique, l’acquisition se fera habituellement entre ces valeurs, selon la situation du patient [53].
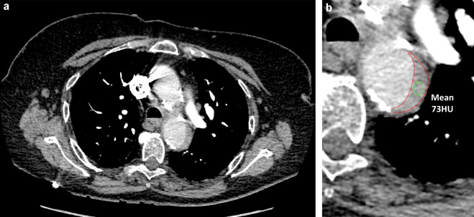
Figure 13. Angio-TDM d’une femme de 63 ans montrant une hématome intramural de la crosse aortique (a, zoom en b).
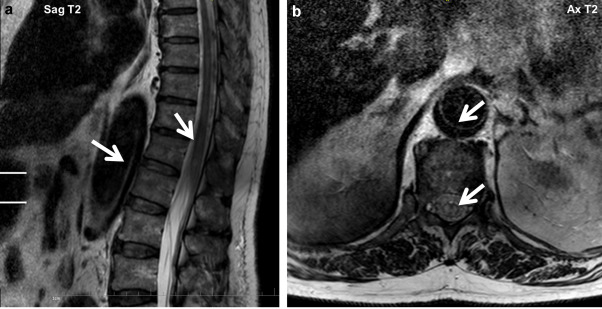
Figure 14. IRM médullaire, montrant un hypersignal T2 centromédullaire (flèches en a) au renflement lombaire, signant l’ischémie médullaire. Ici, 0,2 mmol/kg de gadolinium sont injectés chez l’homme de 82 ans. La dissection aortique est montrée par les flèches en b [54].
Le traitement est médical par l’utilisation de bêta bloqueurs et de médicaments de contrôle de la PA. Une réparation endovasculaire ou chirurgicale à ciel ouvert est proposée aux patients les plus graves. La chirurgie consiste à fermer l'entrée du faux canal et donc de reconstituer l’aorte. Cependant, la chirurgie est complexe et entraîne des complications, incluant la mort, les AVC (embolies), les paraplégies (ischémie de la moelle épinière) ou les insuffisances rénales. De plus, de nouvelles angio-TDM sont régulièrement réalisées (tous les 1 ou 2 ans) dans le cadre du suivi du patient [54].
3. Angiographie coronaire pour les sténoses coronaires
Une suspicion de sténose coronaire mène souvent au cathétérisme cardiaque pour la réalisation d’une angiographie coronaire (ou coronarographie). Cet examen consiste donc à l’injection du produit de contraste iodé directement dans les artères coronaires via un cathéter intra-artériel, souvent inséré dans l’artère radiale droite, parfois dans l’artère fémorale (cela dépend de l’anatomie du patient et du cas clinique), pour la visualisation des artères coronaires par imagerie par RX. On peut alors avoir une image en temps réel des artères coronaires afin d’étudier leur forme et de repérer les sténoses. Ensuite, le traitement a lieu par la pose d’un stent, si nécessaire. En pratique, d’après un cardiologue spécialisé dans la coronarographie du centre hospitalier de Compiègne, le cathétérisme pour l’étude des artères coronaires est souvent suivi de la pose d’un stent (effectuée en cas de sténose inférieure à 50%). L’imagerie est alors ici toujours utile pour le guidage du médecin pendant la pose vers la sténose. Un ballon entouré du stent est alors conduit, via un guide, en suivant le cathéter, à la zone sténosée, pour être gonflé et donner au stent une forme plus élargie, agrandissant alors la lumière du vaisseau (figure 15). Une fois de plus, les images permettent non seulement de suivre la procédure mais aussi de vérifier que l’opération a été correctement menée. Le PCI est injecté de manière pulsée, par le médecin, lorsqu’il l’estime nécessaire, pour se guider et vérifier la correcte réalisation de l‘opération. Sans l’injection, il est impossible de voir et d’identifier les artères par imagerie par RX, puisqu’ils ne réfléchissent par assez les RX pour être visibles à l’image [55].
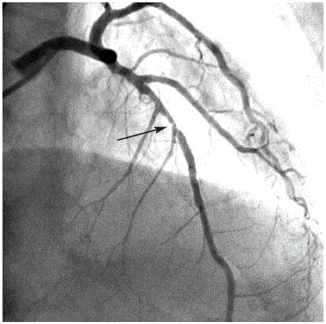
Figure 15. Image du scanner d'une coronarographie révélant une sténose (flèche) significative de l'artère interventriculaire antérieure moyenne [56].
4. L’angiographie au CO2 pour les hémorragies mineures
Quelques recherches récentes, dont celle de T. Terayama publiée en 2019, mènent petit à petit à l’utilisation réelle du CO2 comme alternative moins dangereuse pour le patient à l’iode. Cette alternative permet notamment de détecter les faibles saignements qui ne sont pas toujours détectés à l’angio-TDM avec injection de PCI. Cet article de T. Terayama fait la comparaison entre l’angiographie avec injection de PCI et l’angiographie avec injection de CO2 en figure 16.
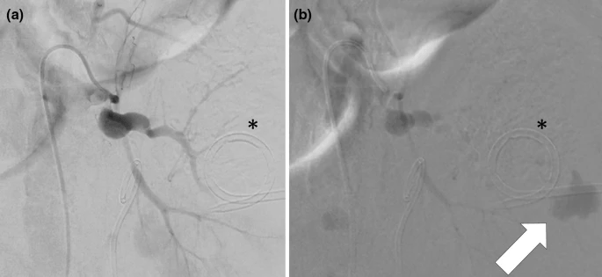
Figure 16. Angiography images. a Angiography with an iodinated contrast agent shows no bleeding. b Angiography with CO2 clearly shows bleeding (arrow) near the location of the pigtail catheter (asterisk) [57]
Sur cette image, on peut voir l’hémorragie mise en évidence par le CO2 d’une artère rénale. Ainsi, il est possible d’observer des hémorragies mineures, mais il est plus difficile de voir les structures anatomiques, c’est pourquoi l'application du CO2 reste limitée à ces hémorragies aujourd’hui [57].
C. Imagerie du système gastro-intestinal
Les produits de contraste sont également utilisés en imagerie du système gastro-intestinal. Cette partie se concentre sur une pathologie, la tumeur du foie, et l'utilisation des produits de contraste dans le diagnostic de cette maladie.
1. Tumeurs foie US SF6
Le cancer du foie le plus fréquent est le carcinome hépatocellulaire ou hépatocarcinome (80 à 90 % des cas). En France, on estime environ 11 658 nouveaux cas de cancer du foie en 2023. L'échographie de contraste ultrasonore (CEUS) est de loin la technique la plus fréquemment utilisée pour le diagnostic de cette pathologie. Les agents de contraste ultrasonore sont des microbulles gazeuses non toxiques pour l'organisme. Lorsque ces microbulles sont soumises à une onde ultrasonore ils ont la particularité de subir une oscillation, générant ainsi un écho significatif qui est enregistré. Ces agents sont introduits dans le corps par voie intraveineuse (bolus ou perfusion continue) dans le but d'accroître l'échogénicité des vaisseaux sanguins.
Une solution de contraste est composée de millions de bulles, chacune ayant une taille de l'ordre de quelques micromètres (0,5 à 20 µm de diamètre). Cette dimension permet aux microbulles de traverser les capillaires pulmonaires et d'atteindre la circulation systémique. Ce processus permet une étude d'une durée de 3 à 4 minutes, après quoi les bulles seront éliminées par la respiration. La figure 17 représente une image par microscopie d’un échantillon de microbulles BR-14® [58] [50] [59].

Figure 17 : Image par microscopie d’un échantillon de microbulles BR-14® [59]
Une étude publiée en 2004 par C. Dietrich, A. Ignee, J. Trojan, C. Fellbaum a démontré que sur 174 patients l’utilisation de produits de contraste améliore la détection des tumeurs hépatiques de 93% [72]. L’utilisation de PC améliore également la différenciation entre les tumeurs malignes et les lésions bénignes. Ceci est possible même lorsque les lésions sont inférieures à 1 cm [61]. Ces résultats soulignent ainsi le rôle crucial des produits de contraste dans l'amélioration de la sensibilité diagnostique. La figure 18 permet d’illustrer ce constat.
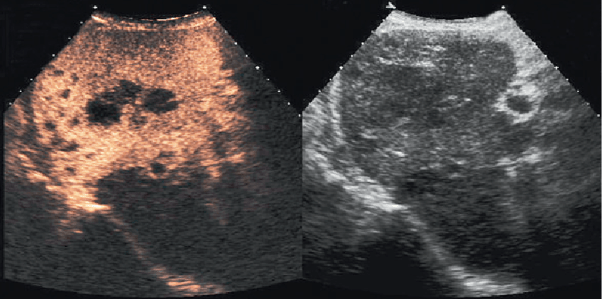
Figure 18 : Échographie de contraste hépatique. Lésions hypoéchogènes (« black-spots ») en phase de PC tardive (à gauche) : image typique de métastases hépatiques (dans ce cas : mélanome). Dans l’image conventionnelle (à droite), les lésions n’étaient que très difficilement reconnaissables [50]
Cependant, aujourd’hui encore, l’utilisation de ces produits de contraste reste rare. D’après une interview réalisée auprès d’un radiologue de l’hôpital Saint Denis, certains centres spécialisés dans l’imagerie hépatique situés en Île-de-France peuvent y avoir recours pour la recherche de tumeurs.
2. Examens abdomino-pelviens aux sulfates de baryum
Les agents de contraste à base de sulfate de baryum sont parmi les plus anciens produits de contraste utilisés pour l'imagerie du tube digestif. Leur utilisation consiste à rendre le tube digestif visible en l'opacifiant, facilitant ainsi la visualisation et l'évaluation de ses structures.
Ces produits sont généralement administrés par voie orale pour des examens abdomino-pelviens. Lors de cet examen, le patient doit absorber des fractions spécifiques de 250 mL de suspension barytée diluée à des moments précis. La première portion est ingérée 60 minutes avant l’examen, les deux suivantes à 45 minutes et 30 minutes avant l’examen. Enfin, juste avant l’examen le patient absorbe les 250 mL restants, totalisant ainsi 1000 ML de suspension diluée. Le respect de ce protocole permet d’améliorer la visualisation des organes abdomino-pelviens lors d’examens radiologiques. De plus, ces produits peuvent également être administrés par voie rectale pour une visualisation plus approfondie du côlon et du rectum. Dans ce cas de figure 19, le PC à base de sulfate de baryum est introduit dans le rectum à l’aide d’un cathéter ou d’une sonde. Par la suite, le PC remplit le colon et opacifie ses contours pour permettre une meilleure visualisation lors de radiographies. Cette méthode est souvent utilisée dans le cadre de coloscopies virtuelles ou de radiographies du côlon (figure 20) [60].
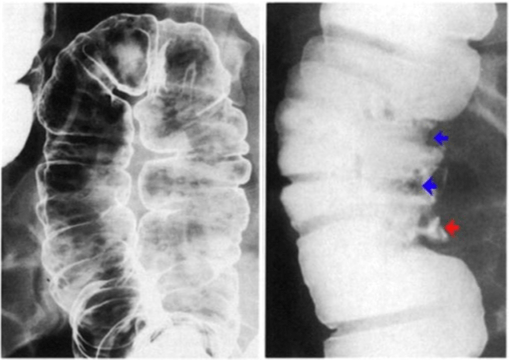
Figure 19 : ulcération de la paroi du côlon, visible grâce au lavement baryté du tube digestif sur un cliché radiographique [61]
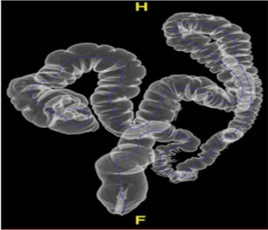
Figure 20 : Coloscopie virtuelle (colographie TDM) d’une anatomie normale. Le contraste induit par le lavement baryté permet d’obtenir une image 3D et 2D du côlon grâce à la TDM, et ainsi étudier la présence de lésions [61].
Il est important de noter qu’il existe d’autres modalités utilisées dans l’imagerie gastro-intestinale avec injection de produit de contraste. Parmi ces modalités, l'injection intraveineuse de produit de contraste iodé permet d'améliorer la visibilité des vaisseaux sanguins, des organes et des tissus mous lors de la tomodensitométrie. De plus, l'utilisation de produits de contraste à base de gadolinium (produits de contraste hépato biliaire ou hépato-spécifique) en IRM permet d’améliorer la visibilité des structures abdominales telles que le foie, les voies biliaires et les lésions intestinales. Pour finir, l'angiographie avec injection de produits de contraste iodé directement dans les vaisseaux sanguins peut également être réalisée pour évaluer certains aspects du système gastro-intestinal [60].
D. Imagerie du système urogenital
L'imagerie urogénitale avec injection de produits de contraste se concentre sur la visualisation des organes du système urinaire (reins, vessie, uretères et urètre) et génital. Ces examens permettent de diagnostiquer plusieurs pathologies, notamment le diagnostic des calculs rénaux (détection et évaluation de leur taille et de leur emplacement), les obstructions, les anomalies anatomiques, mais également de suivre l'évolution des maladies rénales et d'évaluer les tumeurs urogénitales.
1. Urographie intraveineuse : diagnostic d’anomalies congénitales et surveillance de tumeurs vésicales
Parmi les modalités d'imagerie, l'urographie intraveineuse (UIV) est un examen radiologique utilisant les rayons X et l'injection intraveineuse de produit de contraste iodé, opaque au rayon X, pour explorer l'appareil urinaire (figure 21). Cet examen est de moins en moins utilisé au profit de l’uroscanner ou l’’échographie.
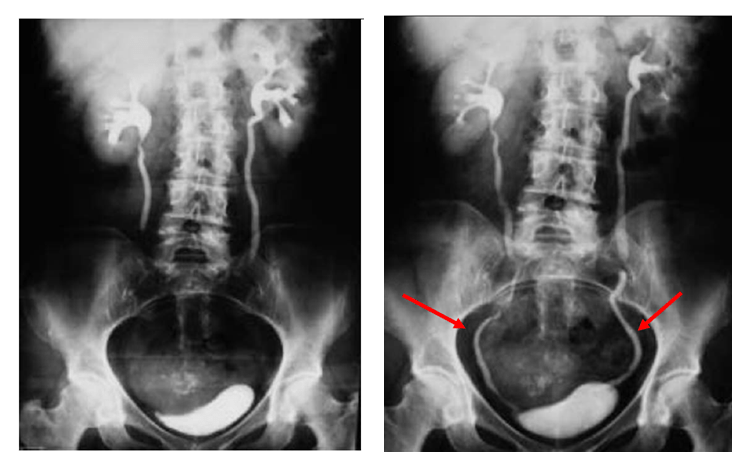
Figure 21 : Étude des uretères par UIV [62]
L’UIV, comprend une exploration radiologique de l’appareil urinaire, débute par une exploration sans préparation. En utilisant des produits de contraste non ioniques, grâce à leur caractéristiques, ils favorisent une meilleure opacification de la voie excrétrice. La procédure de l’UIV est décrite ci-dessous en fonction des temps d’obtention des images (Tx) en minutes :
- T0 - Néphroscopie : C’est la première image, qui est obtenue après injection du produit de contraste. C’est celle qui capture les phases initiales d’entrée de contraste dans le système collecteur.
- T5 Image comprenant le rein, l’uretère et la vessie 5 minutes après injection de contraste.
- T10 a T15 Radiographie de tout l’appareil urinaire. Décubitus dorsal est la position la plus fréquemment demandée.
- T20 Changement de position pour les images et avoir un changement de perspective sur les reins et favoriser les protections des uretères qui sont plus éloignés de la colonne.
- Tfinal Radiographie post mictionnelle. Elle peut être réalisée en Décubitus prono ou en Décubitus couché en bipédstation. Elle doit inclure la vessie.
L’interprétation de l’étude par UIV exige une concentration de produit appropriée dans l’urine : c’est-à-dire, plus souvent une injection de 2 ml/kg de poids d’un produit contenant 300 à 400 mg d’iode par ml est souhaitable, ou si l’UIV ne comprend pas Tfinal, il est possible de modifier la concentration utiliser à 1 ml/kg de poids [62].
2. Reflux vésico-urétéral
Le reflux vésico-urétéral (RVU) est le plus fréquent des uropathies malformatives. La gravité éventuelle du RVU vient de la néphropathie de reflux ou des lésions congénitales et des séquelles des pyélonéphrites. Le diagnostic du RVU repose sur la cystographie rétrograde.
La cystographie rétrograde ne s’agit pas d’une étude fonctionnelle parce qu’elle utilise un cathéter (Figure 22) pour visualiser l’ensemble de l’appareil rénal, vérifier le bas des voies urinaires, le tiers distal des uretères, la vessie et l’urètre, où le passage du produit de contraste va dans le sens inverse du passage de l’urine [63].
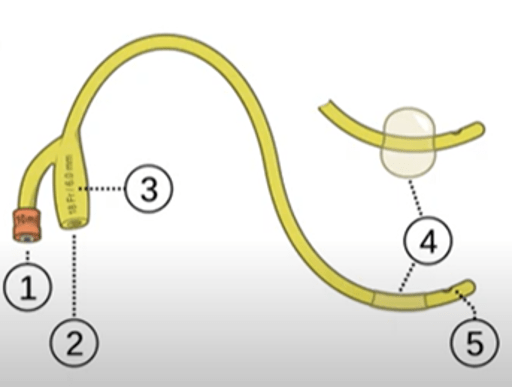
Figure 22 : Cathéter de Foley [64]
Pendant de cette procédure, le médecin va gonfler le ballon et va laisser sortir tout résidu d’urine et assurer que l’administration du produit de contraste soit appropriée. Le médecin peut utiliser des produits de contraste de type iodé ionique ou non ionique, mais à une concentration inférieure à celle utilisée en intraveineuse.
La capacité maximale du produit de contraste est liée à l’anatomie du patient, et il faut que le médecin calcule la quantité de contraste à injecter selon ses spécifications, en évitant qu’il dépasse cette limite pour supprimer le risque de douleur au patient.
Finalement, l’entrée du produit de contraste permettra une bonne réplétion vésicale qui va favoriser la visualisation correcte des parois de la vessie (Figure 23) [63].
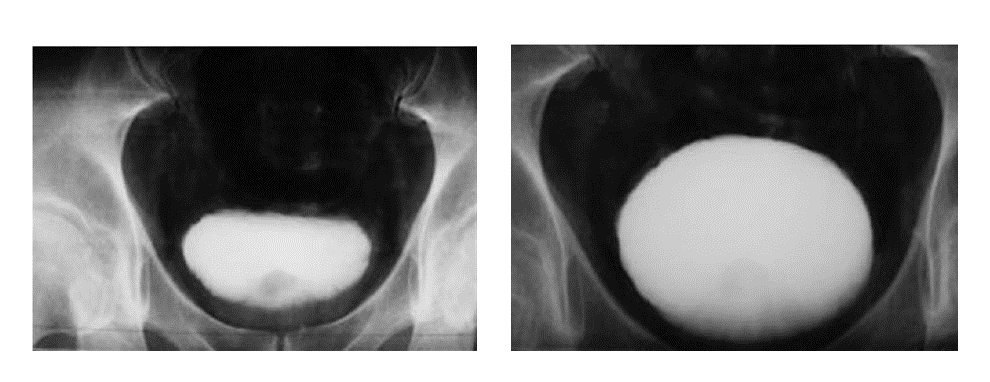
Figure 23 : Étude de réplétion vésicale [63]
III. Réglementation, Risques et Remboursement
A. Cadre réglementaire : contexte légal
Les produits de contraste, comme nous l'avons énoncé précédemment, sont des substances injectables ou ingérables considérées comme des médicaments en raison de leur impact sur le diagnostic, de leur nature chimique et de leur interaction spécifique avec les tissus du corps. Selon le Code de la Santé publique (article L.5111-1), un médicament correspond à : « toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l’égard des maladies humaines ou animales, ainsi que toute substance ou composition pouvant être utilisée chez l’homme ou chez l’animal ou pouvant leur être administrée, en vue d’établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique » [3]. On distingue deux grandes familles de médicaments, les médicaments dits « classiques » ou chimiques et les médicaments biologiques qui sont les médicaments de demain. Les produits de contraste appartiennent à la famille des médicaments chimiques car ils sont fabriqués à partir de substances actives d'origine chimique et via des processus industriels [26]. Ainsi, ces agents font l'objet d'une surveillance réglementaire stricte afin de garantir leur sécurité, leur efficacité et leur qualité.
Les produits de contraste sont inscrits sur la liste spécifique des médicaments à prescription obligatoire (liste I). Leur délivrance nécessite la rédaction par le médecin, après consultation, d'une ordonnance. Cette ordonnance n'est valable qu'une seule fois (sauf si le médecin mentionne la possibilité d'un renouvellement) et le produit de contraste ne pourra être délivré que par le pharmacien. Il est également important de noter que la durée de validité de cette ordonnance est de trois mois, passé ce délai le médicament ne pourra plus être délivré [27]. De plus, le conditionnement externe des médicaments de liste I doit obligatoirement comporter les mentions « uniquement sur ordonnance » où « médicament soumis à prescription médicale » ainsi qu'un espace dont la bordure est de couleur rouge pour que le pharmacien puisse y inscrire les mentions prévues par le code de la santé publique (figure 24).

Figure 24 : Figure illustrant la mention présente sur l’ensemble des médicaments appartenant à la liste I
Comme tous médicaments, les produits de contraste doivent obligatoirement obtenir une autorisation de mise sur le marché (AMM) pour pouvoir être commercialisés. En France, l'AMM est délivrée par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) [28]. Pour obtenir cette AMM, le fabricant (entreprise pharmaceutique) doit présenter à l'autorité compétente nationale un dossier d'AMM contenant :
- Les données collectées au cours des essais précliniques (test sur les animaux) et cliniques (premiers essais chez l'homme)
- Les données portant sur la qualité chimique du produit fini ainsi que les procédés de fabrication de la substance active et du produit fini [29].
L'AMM ne pourra être délivrée que si et uniquement si la bénéfice risque est favorable et si ce dossier apporte la preuve de la qualité, de la sécurité et de l'efficacité du produit de contraste. L'AMM doit également être accompagnée [30] :
- du Résumé des caractéristiques du produit (RCP) qui offre des détails essentiels tels que le nom du médicament, sa composition qualitative et quantitative, sa forme pharmaceutique, les indications thérapeutiques approuvées, les contre-indications, les précautions d'emploi et les effets indésirables.
- de la notice destinée à l'utilisateur qui fournit des informations essentielles sur le médicament, telles que le nom, le dosage, la forme, les indications thérapeutiques, les contre-indications, les précautions, les interactions, la posologie, le mode d'administration, et les effets indésirables.
- Ainsi que de l’étiquetage qui inclut des détails essentiels pour identifier le médicament (nom du médicament, substance active, dosage, forme pharmaceutique) ainsi que des informations liées à son utilisation (date de péremption, conditions de conservation, pictogrammes pour la conduite automobile, etc.)
Pour finir, après leur mise sur le marché les produits de contraste sont soumis à la pharmacovigilance. La pharmacovigilance est un processus essentiel pour surveiller les médicaments, collectant des informations sur les effets indésirables présumés, qu'ils soient utilisés conformément à leur autorisation de mise sur le marché ou dans des circonstances telles que le surdosage, le mésusage, l'abus ou les erreurs médicamenteuses. Cette démarche systématique vise à évaluer en permanence la sécurité des médicaments en identifiant et en évaluant les risques potentiels liés à leur utilisation dans différentes situations. En France, la pharmacovigilance mobilise divers acteurs, notamment l'ANSM, les professionnels de la santé, les patients, les associations de patients, et les industriels, avec le soutien du réseau composé de 31 centres régionaux de pharmacovigilance [31].
B. Risques associés à l’utilisation des produits de contraste et gestion des risques
Les produits de contraste utilisés en imagerie médicale peuvent présenter certains risques, bien que les complications soient relativement rares. Les risques fréquemment associés aux produits de contraste comprennent [34] :
- les céphalées (maux de tête)
- les nausées et vomissements
- les sensations de chaleur
- les fausses envie d'uriner
- les dysgueusies (goût inhabituel dans la bouche)
Cependant, les risques peuvent également inclure des risques peu fréquents voire rares. Voici quelques risques possibles liés à l'utilisation de produits de contraste :
Réactions allergiques : Certains patients peuvent développer des réactions allergiques aux produits de contraste. Ces réactions peuvent varier en gravité, allant de légères éruptions cutanées à des réactions plus sévères, telles que l'anaphylaxie [35]. Les réactions allergiques sont plus fréquentes chez les personnes ayant déjà présenté une réaction allergique aux produits de contraste. Une étude menée par une équipe du Pôle Imagerie-Explorations-Recherche de l’hôpital européen Georges-Pompidou AP-HP, de l’université Paris Descartes et de l’Inserm pilotée par le Pr Olivier Clément, et une équipe du CHU et de l’université de Caen Normandie, dirigée par le Dr Dominique Laroche, a démontrée que 20 % des réactions aux produits de contraste en radiologie sont de réelles allergies. Ces tests ont été effectués sur 245 patients et ont révélé que 41 patients présentaient une allergie aux produits iodés, tandis que 10 étaient allergiques aux produits gadolinés. Ces données offrent des informations importantes sur la variété et la fréquence des réactions allergiques et soulignent l'importance de prendre en compte les risques potentiels associés à l'utilisation des agents de contraste [36].
Insuffisance rénale : l'administration de produits de contraste iodé par voie intravasculaire peut entraîner une lésion rénale après injection connue sous le nom de lésion rénale aiguë post-contraste . Cette lésion peut entraîner un dysfonctionnement temporaire des reins chez certains patients, tandis que d'autres peuvent développer une insuffisance rénale [37]. En ce qui concerne les produits de contraste gadolinés, il est important de noter que la survenue d’une insuffisance rénale aiguë n'existe pas aux doses utilisées [38].
Effets sur la thyroïde : Certains produits de contraste contenant de l'iode peuvent avoir des effets sur la thyroïde, en particulier chez les personnes ayant des problèmes thyroïdiens préexistants [39].
Réactions locales au site d'injection : des réactions locales, telles que des douleurs, des rougeurs ou des enflures au site d'injection, peuvent survenir. Environ 1% des cas impliquant des produits de contraste iodés sont sujets à l'extravasation (fuite du produit de contraste dans les tissus entourant la veine perfusée). Cette situation s'accompagne généralement de douleurs au site d'injection [40].
Interaction avec d'autres médicaments : Certains médicaments peuvent interagir avec les produits de contraste et peuvent entraîner des effets indésirables [41].
Bien que ces risques soient possibles, la plupart des patients tolèrent bien les produits de contraste, et les professionnels de la santé prennent des mesures pour minimiser ces risques lors de leur utilisation. Afin de diminuer les risques éventuels de réactions allergiques, une démarche proactive est adoptée, débutant par une collecte minutieuse des antécédents médicaux du patient et mettant l'accent sur les allergies existantes. Un questionnaire dédié aux allergies est systématiquement rempli avant l'examen pour détecter tout risque potentiel. D’après une interview réalisée auprès d’un cardiologue du Centre Hospitalier de Compiègne, une prémédication avec des antihistaminiques est envisagée dans certains cas pour réduire les risques liés à une réaction allergique.
Pour prévenir l'insuffisance rénale induite par les produits de contraste, une évaluation préalable de la fonction rénale est une étape cruciale. Cette évaluation inclut la mesure de la créatinine sérique et le calcul de la clairance de la créatinine. Pour minimiser les risques potentiels associés à l'utilisation de produits de contraste iodés, une hydratation préalable est envisagée, surtout en cas d'altération de la fonction rénale [40].
Afin d'éviter d'éventuels effets sur la thyroïde, une approche préventive est intégrée. Cette approche consiste à ajuster la dose de manière appropriée en identifiant les patients ayant des antécédents de troubles thyroïdiens. Dans les situations à risque de thyrotoxicose (augmentation soudaine de l'activité de la thyroïde), une supplémentation iodée peut être envisagée pour atténuer les impacts sur la thyroïde. Ces mesures réfléchies et préventives contribuent à une utilisation plus sûre des produits de contraste, réduisant ainsi les risques potentiels pour les patients.
C. Remboursement et politique de santé
En France, l’activité économique des entreprises qui travaillent avec les produits de contraste est contrôlée par le Code de la santé publique, dont l’objectif principal est d’assurer que les produits soient administrés après avoir reçu leur AMM.
Le remboursement des produits de contraste est conditionné par l'initiative des laboratoires qui soumettent leurs demandes à la commission de transparence de la Haute Autorité de Santé (HAS). Ce processus a été intégré en 2019 dans le forfait technique qui englobe tous les éléments liés à l'acte d'imagerie médicale et aux services fournis par le radiologue. Cela permet d'assurer le remboursement des produits de contraste tout en respectant les normes de la marge de convention nationale [32]. D’après l'enquête nationale réalisée par le Sénat français, près de 5,9 milliards d'euros des dépenses d'imagerie médicale sont remboursés par l'assurance maladie, dont 2 milliards d'euros sont alloués à l'hôpital et 3,9 milliards à la ville. Ces montants sont déterminés en fonction des honoraires conformes aux tarifs opposables et aux forfaits techniques. La majorité des forfaits techniques concerne l'imagerie de coupe, notamment l'IRM et le scanner [23].
D. Économie et coûts associés aux produits de contraste
Les prix des médicaments et produits de contraste, sont fixés par le Comité économique des produits de santé (CEPS) et le taux de remboursement est décidé par l’Union nationale des caisses d’assurance maladie (UNCAM). La décision finale relève du ministre de la Santé [22].
Dans le contexte de l’imagerie médicale, les coûts sont répartis selon : l’adaptation des équipements, les effectifs de professionnels, leur répartition entre les établissements de santé et les actions engagées. Tous ces éléments sont pris en compte pour assurer une bonne adaptation aux besoins de la société qui va se bénéficier des services et ainsi garantir la pertinence du recours dans tous les cas d’imagerie. Près de 6 milliards d’euros de dépenses d’assurance maladie couvrent environ de 8500 médecins radiologues, 700 médecins nucléaires et près de 33500 employeurs qui travaillent dans l’électroradiologie [23].
Aujourd'hui, de nombreuses procédures d'imagerie nécessitent l'administration de produits de contraste. Les professionnels en radiologie doivent administrer les produits de contraste conformément au cadre réglementaire défini par le décret d'actes et d'exercice. Il est essentiel de connaître les indications, les contre-indications, la composition, le mode d'administration et d'élimination du produit de contraste. Les dépenses associées aux produits de contraste actuellement utilisés, varient en fonction des catégories de modalités, avec une concentration particulière pour certaines anatomies et types de procédures. À titre d'exemple, 80 % des dépenses liées à la radiographie conventionnelle sont attribuées aux membres, au rachis et à la poitrine. De l'autre côté, 28 % des dépenses en IRM concernent les membres inférieurs, tandis que 25 % des coûts de la scanographie sont dédiés à l'appareil digestif. En ce qui concerne l'échographie, un quart des dépenses est associé à l'imagerie du cœur [23].
Au niveau individuel les coûts des examens d’imagerie médicale sont directement liés à la zone du corps à étudier, par exemple, on estime environ 20 € pour les extrémités et le panoramique dentaire et jusqu’à 60 € pour des organes plus spécifiques comme dans le cas des mammographies [33]. Selon l’enquête national réalisée par le Sénat français, le coût d'une IRM, est divisé en deux parties : le forfait technique et les frais médicaux. Dans le cas du forfait technique, c’est l'Assurance maladie qui prend en charge ce coût à une tarif fixe, comme suit : taux plein de 100 à 200 € ou taux réduit entre 25 et 70€. Par ailleurs, les frais médicaux sont couverts à 70 % par l’assurance maladie. Ils sont en moyenne 69 € pour une IRM [23].
Actuellement, l’imagerie médicale fait face à des défis médico-économiques en raison des politiques de régulation qui ne permettent pas une approche complète de ces enjeux. Pour mettre en oeuvre des actions correctives, il est nécessaire de :
- Favorisation de l’innovation en libérant des marges sur l’efficience des actes et en déploiement les ressources
- Réorganisation de l’offre d’imagerie médicale en renforçant les mutualisations
- Revalorisation de l’exercice de l’imagerie hospitalière [23].
Le solde des dépenses allouées aux établissements de santé concerne principalement les consultations qui totalisent près de 20 millions d’actes, pour un remboursement global de 1,18 milliard d’euros par l’assurance maladie. Cette répartition se divise en 64,5 % pour les honoraires et 35,5 % pour le forfait technique. Cette année la Direction Générale de l’Offre de Soins (DGOS) cherche à sensibiliser les cabinets de radiologie et les établissements de santé en adressant une instruction interministérielle pour économiser près de 100 milliards d’euros. Cette instruction sera interprétée comme une nouvelle réforme du financement qui impactera les techniques de TDM et d’IRM, techniques les plus fréquemment utilisées [23],[24].
La nouvelle réforme a pour but de modifier le circuit d’approvisionnement des produits de contraste et qu’ils soient achetés par les cabinets de radiologie de ville et les établissements de santé auprès des fournisseurs pour être administrés aux patients au moment des examens de diagnostic. C’est-à-dire qu’ils ne devront plus être prescrits aux patients pour une délivrance en officine en amont de leur examen. Cette modification implique un accroissement des volumes de produits de contraste achetés par les établissements de santé, dépassant dans la plupart des cas les volumes précédents. Cette démarche implique de coordonner les acteurs en particulier ceux du circuit d’approvisionnement afin de sécuriser et ajuster les stocks. Les établissements privés, titulaires d’autorisation d’imagerie devront également veiller à sécuriser leurs approvisionnements conformément à leurs procédures d’achats habituelles [32], [24].
Conclusion
L’utilisation des produits de contraste en imagerie médicale est toujours importante, et continue de croître, en s’inscrivant dans le contexte d’émergence des maladies chroniques, notamment les cancers,stimulant la demande de diagnostics précis et contribuant à l’essor de l’imagerie médicale avec utilisation de produits de contraste. Cet usage répandu des agents de contraste iodés et du gadolinium en France, représentant respectivement plus de la moitié des examens d’imagerie médicale et plus de 40% des IRM, témoigne de leur efficacité dans différentes modalités d’imagerie.
En parallèle, la diminution de l'emploi du baryum, progressivement remplacé par des techniques plus avancées telles que l’endoscopie, accompagnée de l’émergence de nouveaux agents de contraste, tels que les microbulles de gaz en échographie ou le CO2 en imagerie par rayons X, met en évidence la dynamique constante du domaine de l'imagerie médicale. Ces alternatives innovantes élargissent les possibilités dans le domaine de l’imagerie médicale et facilitent le diagnostic de nombreuses pathologies. Elles offrent également des possibilités de soins aux risques diminués, comme c’est le cas du CO2 comme alternative à l’iode.
Malgré les avantages considérables de ces agents dans l'amélioration de la visualisation des structures internes du corps, leur utilisation doit être rigoureusement contrôlée. La mise en place d’un processus de gestion des risques, appuyée par des directives et des protocoles d’administration, est cruciale pour assurer une utilisation appropriée et efficace tout en minimisant les risques potentiels.
Enfin, la récente réforme visant à modifier le circuit d’approvisionnement des produits de contraste souligne la nécessité d'une coordination efficace des acteurs pour garantir la sécurité et l'ajustement des stocks, tout en répondant aux besoins croissants du secteur de l'imagerie médicale, en restant économiquement abordable pour les patients, les médecins et la société.