IDS227 - Implantation du dispositif d’ablation par électroporation Farapulse dans les blocs de cardiologie interventionnelle
Catégories
Mots-clés
Avertissement
Auteure

Swann GHEUNG
Contact
- GHEUNG Swann : swanngheung@gmail.com
Citation
A rappeler pour tout usage : Swann GHEUNG, « Implantation du dispositif d’ablation par électroporation Farapulse dans les blocs de cardiologie interventionnelle », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Stage, https://travaux.master.utc.fr/, réf n° IDS227, juillet 2024, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids227/
Résumé
Boston Scientific est une entreprise américaine qui développe des dispositifs médicaux de pointe notamment dans le domaine de la cardiologie. Aujourd’hui, cee société est leader dans une nouvelle technique d’ablation des cellules du cœur, l’électroporation. Cte énergie permet de traiter certains troubles du rythme cardiaque avec plus de sécurité que la radio fréquence et la cryo-ablation, historiquement utilisées.
Ce rapport retranscrit mes débuts en tant qu’ingénieure d’application en électrophysiologie. C’est principalement au côté de l’équipe d’ingénieurs de la division d’électrophysiologie d’Île-de-France que j’ai évolué durant 6 mois. L’objectif de ce stage fut de me former afin de supporter techniquement et cliniquement les cardiologues durant les procédures d’ablation par électroporation.
Abstract
Boston Scientific is an American company that develops high-tech medical devices, particularly in cardiology. Currently, Boston Scientific is the leader in a brand-new ablation technic for cardiac cells, electroporation or pulsed field ablation. This energy is used to treat heart rhythm disorders more safely than radiofrequency or cryo-ablation, historically used.
This report transcribes the beginnings as field clinical engineer in electrophysiology. It was within the Île- de-France electrophysiology engineer team, that I mainly worked for 6 months. The internship’s objective was to train myself to support technically and clinically physicians during pulsed field ablation procedures.
Téléchargements

Implantation du dispositif d’ablation par électroporation Farapulse dans les blocs de cardiologie interventionnelle
Introduction
La fibrillation atriale (FA) est l’arythmie cardiaque la plus fréquente et est responsable d’un tiers des accidents vasculaires cérébraux (AVC). En France 110 000 à 230 000 nouveaux cas de fibrillation atriale sont observés par an [1]. Traiter ce trouble du rythme cardiaque est donc un enjeu de santé publique. Les traitements existants sont adaptés à chacun, il peut s’agir d’une simple prescription de médicaments (antiarythmique et anticoagulant) à une désactivation permanente des cellules de certaines zones du cœur nécessitant une intervention au bloc opératoire.
Dans le but de traiter de façon sécurisée et permanente les individus atteints d’arythmie cardiaque, la société Boston Scientific participe très largement au développement de nouvelles technologies et propose une gamme de produits entièrement dédiés au traitement des troubles du rythme. Boston Scientific est notamment précurseur dans l’implantation d’une nouvelle technique de désactivation ou ablation des cellules du cœur responsables d’arythmies, l’électroporation. Cette toute nouvelle méthode particulièrement sûre, rapide et efficace par rapport aux autres technologies d’ablation est de plus en plus adoptée par les cardiologues, rythmologues français pour soulager leurs patients.
L’ingénieur d’application travaille alors en collaboration avec les équipes du bloc opératoire afin d’assurer la bonne implantation et utilisation du système innovant qu’est l’ablation par électroporation (Pulsed Field Ablation PFA). C’est donc au sein de la société Boston Scientific que j’ai eu la chance de découvrir le quotidien et les missions d’un ingénieur d’application en électrophysiologie EP, dans le cadre de mon stage de fin d’études de Master Ingénierie de la Santé (Parcours TBTS) à l’Université Technologique de Compiègne (UTC).
Dans ce contexte d’implantation d’une nouvelle technologie, l’ingénieur d’application répond à la problématique déterminante d’assurer l’utilisation pérenne et adéquate de la PFA pour le traitement des troubles du rythme cardiaque.
I. Boston Scientific et son environnement
A. Boston Scientific au cœur de de l'innovation
La société Boston Scientific est fondée 1979 par John Abele et Peter Nicholas, dans le Massachusetts aux États-Unis. Les premiers produits développés par les fondateurs sont des ballons d’angioplastie. Ils ont ensuite étendu leurs activités à plusieurs spécialités médicales en investissant dans la recherche et le développement (R&D) et également en rachetant des start-ups au fil des années. C’est plus d‘un milliard de U.S dollars investis en R&D par an. Aujourd’hui Boston Scientific propose des dispositifs médicaux en urologie, neurologie, chirurgie, médicine vasculaire et évidement en cardiologie.
La société a une offre de produits essentiellement de haute technologie et à risque. En effet, il s’agit majoritairement de dispositifs médicaux en contact avec l’intérieur des patients et d’implants qui peuvent être électroniques. C’est plus de 37 millions de patients traités chaque année avec un dispositif Boston Scientific à travers les 140 pays dans lesquels la société commercialise ses produits. La diversité de produits et la rigueur portée à la qualité des dispositifs médicaux permettent l’immense croissance que Boston Scientific présente cette dernière décennie, voir figure n°1. Boston Scientific s’impose sur le marché du dispositif médical de pointe au même titre que de célèbres concurrents tels qu’Abbott ou Medtronic, avec un chiffre de vente net à plus 14 milliards de dollars en 2023.
Figure n°1 : Croissance chiffre d’affaires Boston Scientific cette dernière décennie
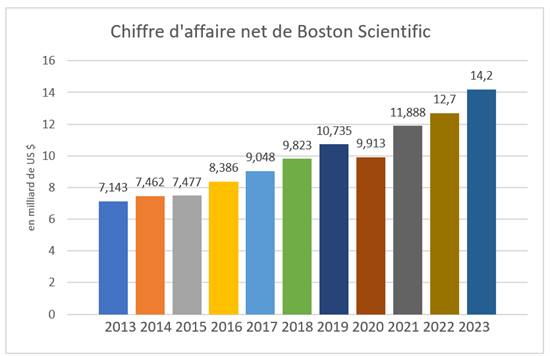
Depuis 2012, le CEO est Michael Mahoney, il a à cœur de faire de Boston Scientific une entreprise avec des valeurs fortes. En effet, l’inclusivité, la diversité ainsi qu’une grande vigilance sur l’empreinte carbone offrent un environnement de travail favorable à la bonne croissance de la société et à la qualité des produits Boston Scientific. Cette politique permet d’ailleurs de placer cette société dans le top de nombreux classements tels que dans le top 100 America’s Just Most Companies [2] ainsi que la sixième place du classement Top Companies LinkedIn [3].
B. Investir et innover pour tous les besoins
La raison d’être de Boston Scientific est « advancing science for life » et cela se traduit par l’investissement et la commercialisation de dispositifs médicaux particulièrement innovants et technologiques dans plusieurs spécialités médicales. Ainsi, six divisions, voir figure n°2, se distinguent autour de spécialités médicales :
Interventions périphériques
Boston Scientific étant historiquement présent sur le marché de la médecine vasculaire, aujourd’hui encore, ils assurent l’accès et le développement de ballon d’angioplastie hightech ou encore l’Angiojet qui permet d’aspirer les thromboses veineuses. S’ajoutent à cela des appareils chirurgicaux utilisés dans le traitement de certain cancer.
Cardiologie interventionnelle et structure cardiaque
Pour diagnostiquer et traiter une variété de maladies cardiovasculaires, cette division offre une large gamme de stents pour les coronaires, des prothèses de valves aortiques et des prothèses de fermeture d’auricule. Encore aujourd’hui, Boston Scientific participe activement à l’innovation pour ces dispositifs médicaux déjà performants dans le but de garantir une sécurité maximale.
Neuromodulation
La neuromodulation est un marché récent, encore peu exploité et à forte croissance avec une augmentation du nombre de patients éligibles. Il s’agit de dispositifs médicaux actifs, intelligents et technologiques qui permettent la gestion de la douleur chronique et des affections neurologiques comme la maladie de Parkinson.
Endoscopie digestive et pulmonaire
Leader sur le marché mondial de technologies pour le diagnostic et le traitement des maladies gastro-intestinales et des affections des voies respiratoires, Boston Scientific propose notamment des bronchoscopes, une large gamme d’endoscopes ainsi que des équipements pour réaliser les biopsies ou encore des prothèses pour le soutien structurel biliaire.
Urologie, Santé pelvienne et Gynécologie
Boston Scientific s’investit également dans la prise en charge des maladies rénales, de la vessie en proposant par exemple des urétroscopes pour le diagnostic et des lasers au CO2 pour les traitements chirurgicaux. S’ajoute à cela des dispositifs pour le traitement de la prostate élargie ou de l’incontinence urinaire.
Rhythm Management (RM)
Enfin, la division RM résulte du rachat en 2006 de l’entreprise Guidant spécialisée dans le traitement des troubles du rythme cardiaque, cette étape est d’ailleurs celle qui a permis l’incroyable croissance de Boston Scientific ces dernières décennies.
RM est divisé en deux sous-divisions : CRM Cardiac Rythm Management et EP Electrophysiologie. CRM propose tous les dispositifs cardiaques implantables actifs tels que les appareils d’enregistrement sous cutané connu sous le nom de holter, les stimulateurs ou pacemakers et les défibrillateurs et notamment le S-ICD qui était jusqu’à ce début d’année 2024 le seul défibrillateur sans sonde endocavitaire.
L’EP offre des solutions pour traiter les arythmies directement dans le cœur lors d’une intervention au bloc opératoire. C’est au sein de cette sous-division que j’ai pu évoluer durant mon stage.
Figure n°2 : Les six divisions de produits Boston Scientific
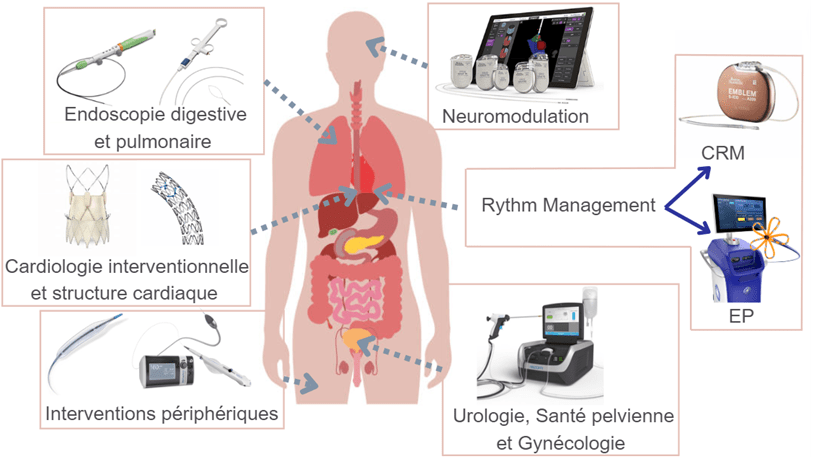
Boston Scientific se coordonne autour de ces six divisions pour un management au plus proche de chacun, réduire le nombre d’intermédiaires et d’interlocuteurs et permettre à chacun d’être entièrement expert de ses produits. Ainsi chaque groupe de produits a sa propre équipe de vente, de marketing et d’ingénieurs d’application.
C. Place dans le monde et en France
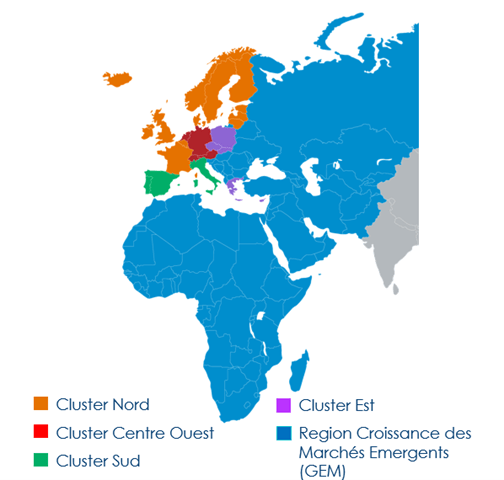
Boston Scientific compte aujourd’hui plus de 48 000 employés à travers le monde. La société américaine est divisée en continents United-State, APAC (Asia-Pacific), LACA (Latin America and Canada) et EMEA (Europe Middle East Africa). La France appartient au « cluster » Nord d’EMEA avec la Belgique, les pays scandinaves, l’Irlande et le Royaume-Uni, voir figure n°3. Cette répartition en cluster permet de s’adapter au mieux aux différents marchés et cultures.
Figure n°3 : Clusters de la région EMEA
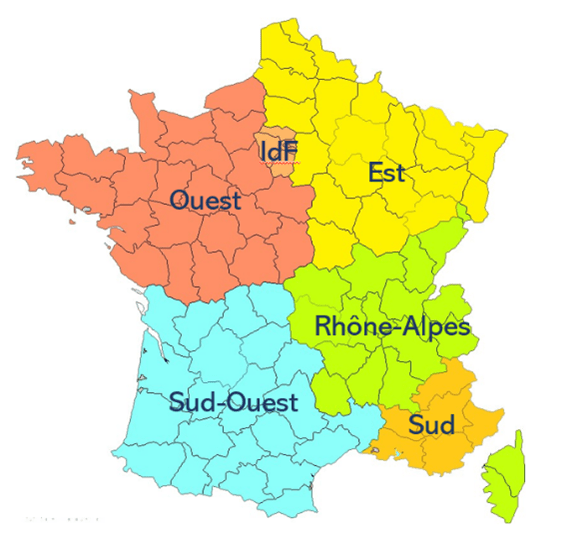
En tant que stagiaire en EP, je dépends de la division RM. Cette dernière est assez large puisqu’elle regroupe également les forces de ventes, ingénieurs et support en Cardiac Rythm Management CRM. C’est donc au côté de 25 ingénieurs d’application en EP, dont deux alternantes, et 12 vendeurs que j’ai effectué mon stage tout comme 9 autres stagiaires. L’équipe de FCS est supervisée par 5 managers qui sont aussi ingénieurs et présents quotidiennement sur le terrain. Ils gèrent les différentes régions, à savoir Sud, Rhône-Alpes, Sud-Ouest, Île-de-France/Est et Île-de-France/Ouest, cette dernière étant celle sur laquelle j’ai exercé, voir figure n°4. Nous sommes alors deux stagiaires basées en région parisienne, les 8 autres stagiaires sont localisés à Bordeaux, Marseille, Nantes, Montpellier, Toulouse, Angers, Clermont-Ferrand et Lyon.
Figure n°4 : Régions des managers
II. Diagnostiquer et traiter les troubles du rythme cardiaque
A. Physiologie du rythme cardiaque
A.1 L'anatomie cardiaque
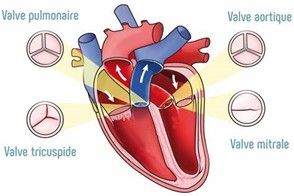
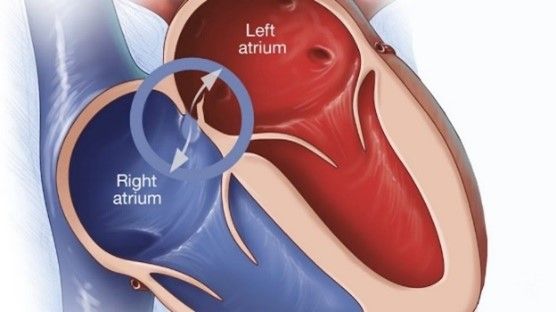
Le cœur est un muscle d’environ 300 à 400 grammes et de la taille d’un point situé sous le poumon gauche. Le cœur est donc le principal organe vital du corps humain car il joue un véritable rôle de « pompe ». Séparé en deux parties par une cloison appelée septum, le cœur droit assure la circulation pulmonaire, le sang qui va s’oxygéner dans les poumons et le cœur gauche la circulation systémique, celle qui va alimenter les muscles et les autres organes. Ces deux parties sont chacune divisées en deux cavités une oreillette et un ventricule, communiquant par une valve. A droite, l’oreillette communique avec le ventricule droit grâce à la valve tricuspide, à gauche c’est la valve mitrale qui sépare les deux cavités gauches, voir figure n°5. Concrètement, le sang désoxygéné est acheminé vers l’oreillette droite via les veines caves inférieure et supérieure. Il passe dans le ventricule droit qui l’éjecte vers les poumons. Une fois oxygéné, le sang est ramené à l’oreillette gauche via les quatre veines pulmonaires, voir figure n°6. Il passe ensuite dans le ventricule gauche puis l’aorte afin d’être redistribué à tous les organes du corps.
Figure n°5 : Schéma du cœur & Figure n°6 : Schéma du cœur vue postérieure
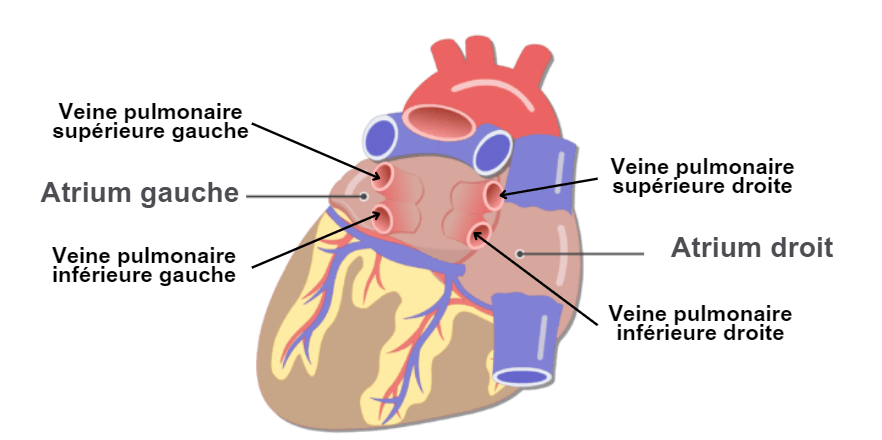
Afin de comprendre au mieux l’ablation des cardiomyocytes dans le cadre du traitement de la fibrillation atriale, il est également important de définir deux structures anatomiques du cœur : la fosse ovale FO et le sinus coronaire CS. La FO est un trou situé au niveau du septum séparant les deux oreillettes, voir figure n°7. Normalement destiné à se boucher lors du développement embryonnaire, il est cependant possible de trouver des patients chez lesquels cette fermeture ne s’est pas réalisée : on appelle ceci un Foramen Ovale Perméable FOP.
Figure n°7 : Schéma de la fosse ovale
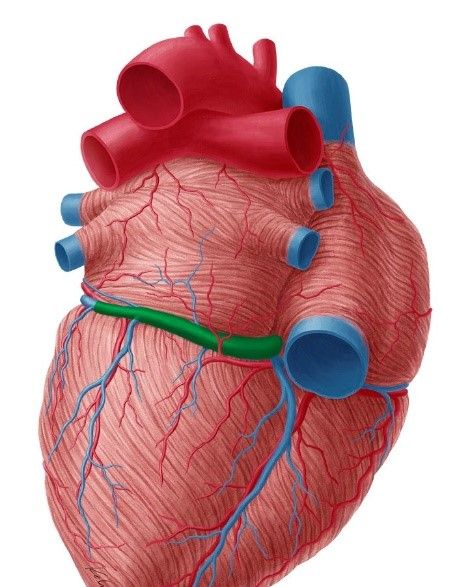
Le CS est une « veine » qui collecte le sang veineux du cœur, voir figure n°8, il s’enroule autour de la valve mitrale et son ostium débouche directement dans l’oreillette droite. En électrophysiologie, les médecins insèrent souvent des cathéters de diagnostic dans cette structure car celle-ci est stable et permet de recueillir les signaux du côté gauche du cœur.
Figure n°8 : En vert le sinus coronaire en vue postérieure
A.2 Le système de conduction cardiaque
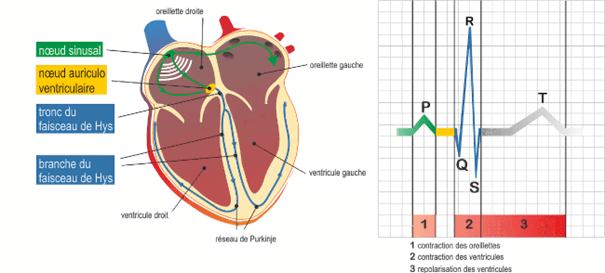
Les contractions du cœur sont contrôlées par un système de conduction électrique. Les cellules cardiaques ont des propriétés particulières qui leur permettent de générer une impulsion et de se dépolariser de proche en proche. Le cheminement de ce courant électrique à travers le cœur assure sa contraction. L’impulsion électrique primaire est engendrée automatiquement au niveau du nœud sinoatrial, aussi appelé nœud sinusal SA. Ce véritable « pacemaker » du cœur est situé à la jonction entre l’oreillette droite et la veine cave supérieure et génère un rythme régulier d’environ 80 battements par minute (bpm). L’impulsion produite par le SA emprunte une voie de conduction particulière appelée faisceau de Bachmann pour rejoindre l’oreillette gauche et la contracter. En parallèle, l’impulsion se déplace via les faisceaux inter-nodaux menant au nœud atrioventriculaire NAV. Une fois excité, le nœud AV transmet le courant au faisceau de His, séparé en deux branches droite et gauche descendantes le long des ventricules. Les branches sont connectées à des filaments situés à l’apex du cœur : les fibres de Purkinje. Le parcours de l’influx électrique prend donc fin au niveau de ces filaments reliés aux fibres musculaires cardiaques, assurant ainsi une contraction des ventricules, voir figure n°9. Ce chemin électrique est le système normal de conduction cardiaque. Le rythme généré est appelé sinusal. Tout schéma de conduction différent du sinusal est appelé arythmie. Pour déterminer quel est le mode de conduction cardiaque d’un patient, il est possible d’enregistrer son activité électrique à l’aide d‘un électrocardiogramme (ECG). Les dépolarisations et repolarisations successives des oreillettes et des ventricules s’observent sur un tracé ECG à l’aide des ondes P,QRS et T. Chaque irrégularité au niveau de ces ondes permet de différencier et discriminer les arythmies cardiaques.
Figure n°9 : Schéma de dépolarisation (à gauche) et électrocardiogramme (à droite)
B. La fibrillation atriale
B.1 Principe et causes
La fibrillation atriale (FA) est un trouble du rythme caractérisé par l’activation rapide et désordonnée des oreillettes, rendant ainsi la contraction atriale inefficace et la contraction ventriculaire irrégulière.
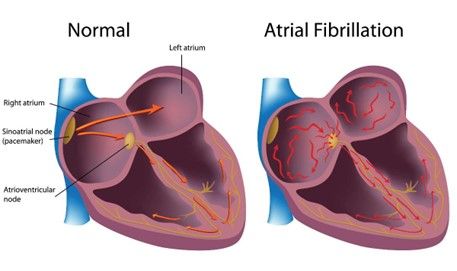
Lors d’un épisode de FA certaines cellules des oreillettes, déchargent successivement et de façon irrégulière, des potentiels qui vont ensuite dépolariser le reste des oreillettes. Ces activations aléatoires ont une fréquence entre 350 et 400 bpm ce qui est largement plus rapide que ce qu’orchestre le SA, entre 60 et 100bpm au repos et 200bpm lors d’une activité physique. Ce rythme atrial provoqué par ces activations prend alors le pas sur le SA, cependant le NAV a la capacité de filtrer les dépolarisations des oreillettes et protège les ventricules de se contracter également à 350/400 bpm, voir figure n°10. Ainsi en FA, les ventricules se contractent de façon rapide et totalement irrégulière avec environ 170bpm. Les mécanismes et sources exactes de la FA posent encore beaucoup de questions et reste un réel sujet de débat au sein de la communauté de rythmologue. Cependant, le travail du Professeur Bordelais Haissaguerre, suggère que ces décharges de potentiels rapides et désorganisées à l’origine de la dépolarisation des oreillettes proviennent très souvent des quatre veines pulmonaires de l’oreillette gauche. En effet, ces dernières initieraient la FA par leur capacité à libérer des triggers, influx électriques dans les oreillettes. Ainsi, ablater l’ostium des veines pulmonaires permet l’isolation électrique et l’interruption des dépolarisations inappropriées des atriums dans une majorité des cas.
Figure n°10 : Schéma de dépolarisation en fibrillation atriale
B.2 Conséquences et diagnostic
La FA est une arythmie très courante, elle touche environ 750 000 personnes en France et elle est responsable d’un tiers des AVC. En 2050 c’est près de 2 millions d’individus qui risquent de souffrir de cette pathologie, cette croissance étant liée à l’augmentation de l’obésité et de la sédentarité [1]. Les symptômes s’expriment de façon très singulière chez chaque individu. En effet, une personne atteinte ne peut présenter aucun symptôme, comme ressentir une fatigue, la sensation d’un poisson dans la poitrine, des vertiges, …
De plus, la FA est discriminée selon deux types qui s’expriment selon les patients et l’avancement de la maladie :
- Paroxystique : Initiation et arrêt spontanés de la FA
- Persistante : FA continue sur plus de 7 jours avec un retour sinusal forcé possible par cardioversion pharmaceutique ou par choc électrique
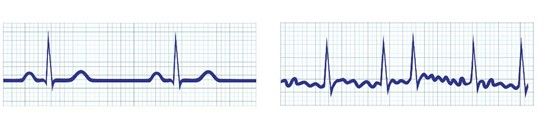
Pour le diagnostic les patients soupçonnés de faire de la FA, passent alors un électrocardiogramme ECG ou portent un holter (appareil qui enregistre l’activité cardiaque sans interruption le temps de quelques jours) si l’épisode d’arythmie ne peut être diagnostiqué lors d’une consultation. A l’ECG la FA se caractérise par l’absence d’onde P puisque les contractions atriales son trop rapides pour être visibles, et l’irrégularité des QRS, voir figure n°11.
Figure n°11 : Electrocardiogramme normal à gauche en fibrillation atriale à droite
C. Traiter la fibrillation atriale avant l'électroporation, techniques d'ablation
La FA étant encore un mystère, il n’y a pas vraiment de réel consensus autour de son traitement. Cependant en première intention, les cardiologues ont pour habitude de prescrire des antiarythmiques afin de diminuer les épisodes de FA et des anticoagulants qui permettent de minimer les risques d’AVC.
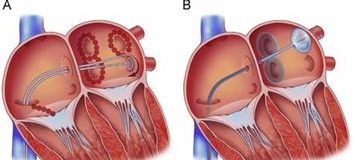
Lorsque les médicaments ne suffisent plus, il est nécessaire d’ablater les zones où des potentielles cellules qui délivrent les triggers sont présentes, en l’occurrence les veines pulmonaires. Avant l’électroporation qui est la technologie avec laquelle j’ai travaillé, ils existaient deux énergies pour neutraliser les cellules, la radiofréquence et la cryo-ablation, voir figure n°12.
Figure n°12 : A. Ablation par radiofréquences et B. Cryo-ablation
C.1 Ponction transeptale
Pour ablater les veines pulmonaires, il est nécessaire d’introduire du matériel dans l’oreillette gauche.
Ainsi, en début de procédure les rythmologues identifient à la main ou à l’échographie, la veine fémorale située au niveau du pli de l’aine. La veine peut alors être ponctionnée et des cathéters peuvent être introduis dedans. Le médecin fait alors monter un guide jusqu’à l’oreillette droite en passant par la veine cave inférieure. Une fois ce guide placé le cardiologue peut introduire une aiguille dans l’oreillette droite depuis le point de ponction au niveau de l’aine. Cette aiguille va permettre de faire la ponction transeptale, c’est-à-dire faire un petit orifice dans le septum séparant les deux atriums, plus précisément au niveau de la FO, et ainsi accéder à l’oreillette gauche.
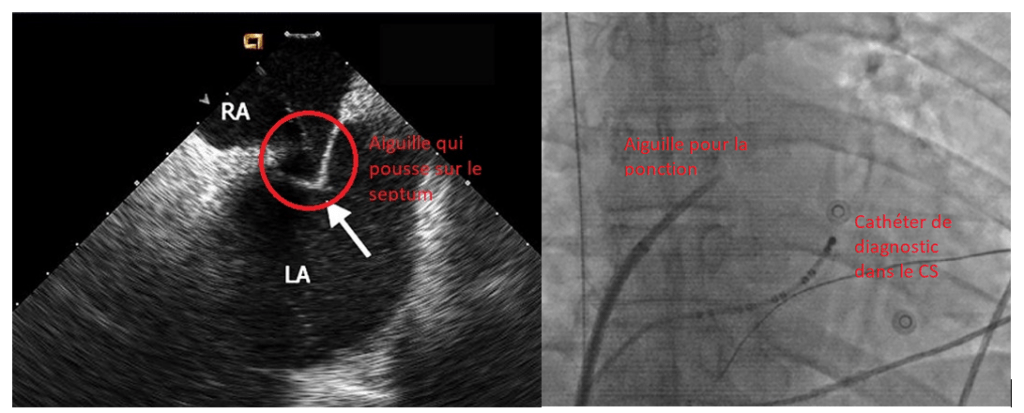
Ce geste rapide est très bien maitrisé, mais il n’en est pas moins anodin, puisqu’à proximité de cette FO se trouve l’aorte, or perforer cette dernière peut être dramatique. Ainsi, les médecins s’appuient souvent sur les images, fournies en temps réel, de l’échographie trans-œsophagienne ETO ou se placent grâce à des repères anatomiques à la scopie et en utilisant une aiguille munie d’un capteur de pression à son extrémité, voir figure n°13, en effet si la pression augmente drastiquement c’est l’aorte qui est perforée.
Figure n°13 : Ponction transeptale. Gauche : échographie trans-œsophagienne, Droite : Scopie
C.2 La radiofréquence avec la cartographie
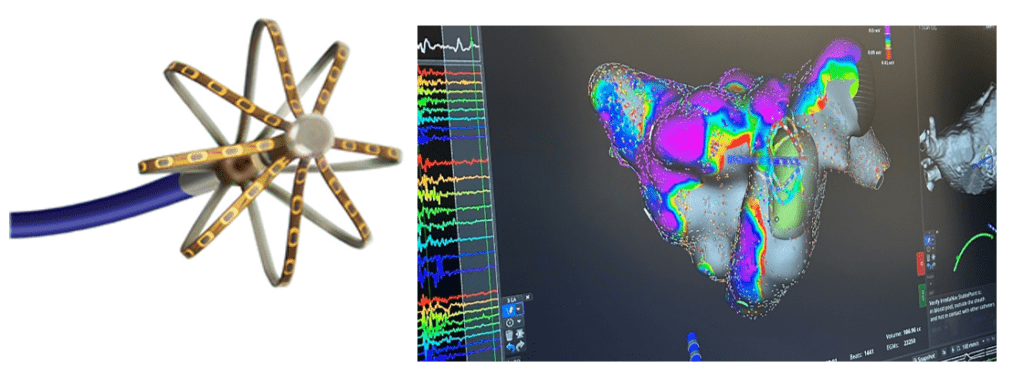
La radiofréquence couplée à la cartographie est une méthode historique, remontant au milieu des années 2000’, pour isoler les veines pulmonaires. Elle consiste dans un premier temps à introduire un cathéter dit de « mapping », voir figure n°14, dans l’oreillette gauche après la ponction transeptale. Puis, il faut faire la carte anatomique et de voltage, c’est-à-dire repérer les zones actives électriquement de l’oreillette gauche, voir figure n°14. Pour cela le médecin bouge doucement le cathéter de mapping sur les tissus de l’oreillette gauche, les signaux émis par les cardiomyocytes sont captés par des électrodes et envoyés directement en traitement sur un ordinateur, l’ingénieur d’application en électrophysiologie formé à la cartographie joue alors un rôle fondamental sur la qualité de la carte en travaillant notamment sur l’anatomie et les signaux pris par le cathéter.
Figure n°14 : Cathéter de Mapping Orion et carte de voltage atrium gauche
Une fois la carte faite, le médecin introduit le cathéter d’ablation dans l’atrium gauche et peut le repérer de façon extrêmement précise (au mm près) en temps réel sur la carte précédemment réalisée grâce à système de détection magnétique et par impédance. Le cathéter d’ablation est connecté à un générateur électrique radiofréquence et peut ainsi sur l’électrode distale envoyer de l’énergie pour chauffer le tissu par convection et ainsi le nécroser, voir figure n°15.
Figure n°15 : Cathéter d’ablation par radiofréquences et isolation par encerclement des veines pulmonaires
Après l’ablation les cellules ne sont plus en mesure de conduire les triggers, ainsi pour l’isolation des veines pulmonaire la stratégie d’ablation est d’encercler point par point les veines pulmonaires
La radiofréquence et la cartographie sont utilisées pour beaucoup d’autres formes d’arythmies, il est notamment possible de cartographier et d’ablater dans l’oreillette et le ventricule droit. Boston Scientific commercialise le système de cartographie Rhythmia, des cathéters d’ablation et de mapping.
C.3 La cryo-ablation
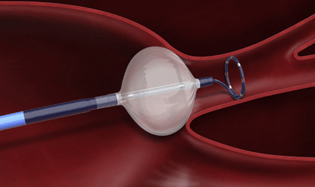
La cryo-ablation est une technique dite « single-shot » pour l’ablation de FA. Après la ponction transeptale, le cardiologue monte sur un guide un cathéter spécifique à la cryo-ablation dans l’oreillette gauche. Grace à la fluoroscopie et au guide le médecin peut trouver chacune des quatre veines pulmonaires. Une fois la veine bien identifiée, le cardiologue peut décider de gonfler un ballon de protoxyde d’azote sous pression situé sur l’extrémité du cathéter de cryo-ablation. L’objectif est de plaquer le ballon à l’ostium de la veine et assurer le contact complet entre le cathéter et le tissu de la veine pour assurer l’isolation électrique, voir figure n°16. Le ballon descend à une température de -50° et ceux durant environ 4 minutes par application. Le tissu gèle et se nécrose, il n’est plus possible pour ces cellules de conduire les triggers, les veines sont donc isolées. Cette technique est donc « single shot » puisqu’en une application par veine, l’isolation est réalisée, contrairement au point par point de la radiofréquence. Boston Scientific propose la technique de cryo-ablation avec le PolarX.
Figure n°16 : PolarX
C.4 Cathéters de diagnostic et baie
Afin de visualiser les signaux et avoir une idée des activations électriques au sein même des cavités cardiaques le médecin introduit comme les cathéters d’ablation, c’est-à-dire par le point de ponction au niveau de l’aine et en remontant la veine cave inférieure, des sondes de diagnostic. Ces cathéters ont entre 4 et 20 électrodes et permettent d’obtenir des signaux très locaux entre chaque dipôle.
Le CS étant un repère et une partie anatomique très stable et dans laquelle la sonde peut rester sans être maintenue par le médecin, il est très fréquent qu’un cathéter y soit introduit pour une procédure. De plus dans cette position, les signaux les plus amples sont les activations de l’oreillette gauche.
Afin de récolter les signaux dits « endocavitaires », les sondes sont connectées à un amplificateur et ensuite on peut afficher en temps réel l’activité électrique de chaque dipôle sur un logiciel qui s’appelle la baie d’électrophysiologie, voir figure n°17. Pendant une procédure le médecin a les yeux rivés sur ces signaux affichés juste en face de lui sur un grand écran.
Figure n°17 : Baie d’électrophysiologie

C.5 Les acteurs principaux en électrophysiologie
Le domaine de l’électrophysiologie dans sa globalité représente un marché mondial qui s’élève à 209 milliards d’euros en 2023 avec une croissance de +18%. Quatre acteurs principaux animent ce marché, Biosense Webster (Johnson & Johnson), Abbott, Medtronic et bien évidement Boston Scientific. Biosense Webster est le premier industriel a proposé la cartographie et la radiofréquence dans les années 2000’, ils ont par la suite été seuls sur le marché pendant plus d’une décennie, ce qui fait qu’encore aujourd’hui ils restent largement leader en système de cartographie et d’ablation par radiofréquence. Puis Medtronic est arrivé avec le premier système d’ablation par la cryo-ablation fin des années 2000.
Ensuite Abbott (anciennement St Jude Medical) et Boston Scientific développent également leur système de cartographie dans les années 2010’. Finalement, Boston Scientific a élargi dans les années 2020’ son catalogue de produits en proposant du single-shot en cryo-ablation et de l’électroporation. L’électroporation est maintenant la grande révolution en EP et provoque une réelle course à l’innovation chez tous les acteurs. Boston Scientific est clairement précurseur dans l’implantation de cette nouvelle énergie.
III. L'électroporation, la révolution aux traitements de la fibrillation atriale : place de l'ingénieur d'application dans l'implantation de cette nouvelle technologie
L’électroporation est une nouvelle énergie, extrêmement prometteuse, d’ablation des cardiomyocytes au regard de techniques comme la radiofréquence et la cryo-ablation. L’implantation de son utilisation en France et dans le monde est en cours, suscite un grand intérêt et une certaine curiosité de la part des rythmologues, infirmiers et même de patients demandant cette énergie pour leur ablation.
C’est donc au sein de l’équipe de vingt-cinq ingénieurs d’application qui développe l’activité d’électroporation en France, que j’ai effectué mon stage de 6 mois.
A. L'électroporation au service des cœurs malades
A.1 Principe et histoire de l’électroporation
L’électroporation est une technique qui repose sur la maitrise de la perméabilité de la membrane de cellule du corps. Elle consiste en l’application d’un champ électrique particulièrement intense qui va provoquer la polarisation de la cellule. Des pores au niveau de sa membrane cellulaire vont alors se créés et permettre le contact entre le milieu intra et extra cellulaire.
Historiquement l’électroporation est un principe développé en oncologie dans les années 90’. En effet, le management de la membrane permet en oncologie de faire entrer les thérapies directement au sein des cellules cancéreuses. Ces dernières une fois traitées récupèrent la perméabilité de leur membrane, c’est l’électroporation réversible. Depuis une quinzaine d’années ce principe évolue pour l’ablation des cardiomyocytes en misant sur une électroporation irréversible, c’est-à-dire que la cellule n’est pas capable de refermer les ports créés dans sa membrane, voir figure n°18. Par conséquent, la cellule se vide de son contenu et finit par mourir par apoptose. Le succès de cette technique pour l’ablation des cardiomyocytes repose sur l’étude de la fréquence, de l’amplitude et le type d’onde du champ électrique appliqué aux cellules. En effet, l’étude de l’application d’un champ électrique sur des cellules est primordiale, car cela peut aussi provoquer l’échauffement plus ou moins intense du tissu. C’est alors soit le principe de l’ablation par RF lors d’échauffement, soit de l’électroporation réversible donc inefficace pour la neutralisation des cardiomyocytes, voir figure n°19.
Figure n°18 : Principe de la PFA
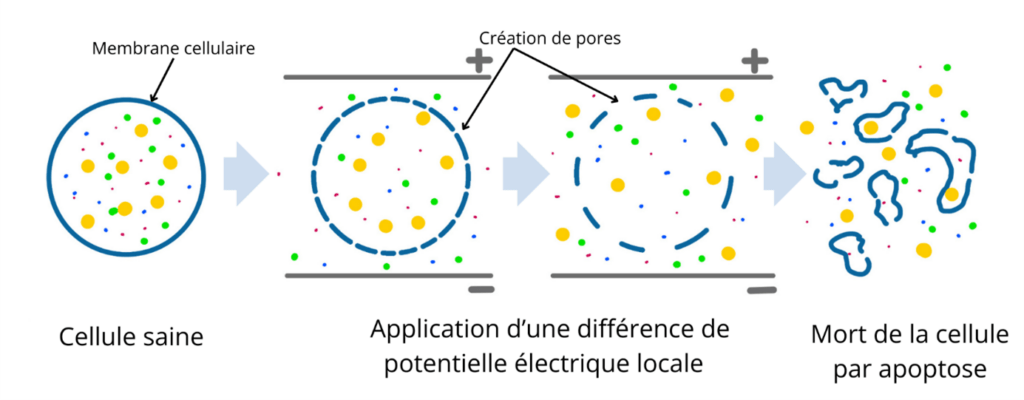
Trois grands paramètres sont à prendre en compte pour l’élaboration d’un champ électrique permettant d’électroporer des cellules. Le premier est le voltage, le second le temps d’application et le troisième la forme d’onde.
Figure n°19 : Seuils de types d’électroporation
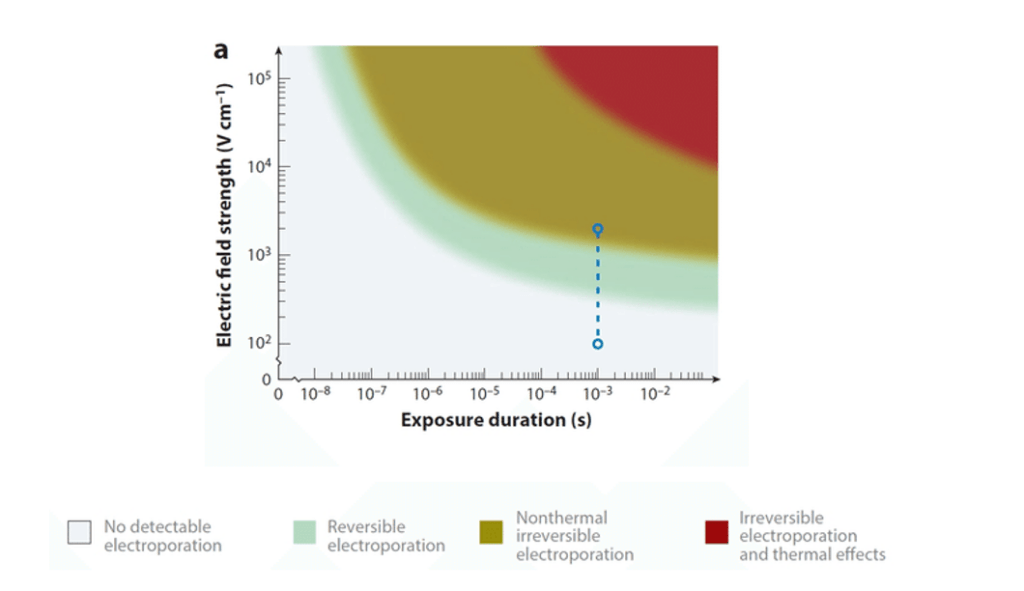
Dans le cadre de l’électroporation des cardiomyocytes pour l’isolation des veines pulmonaires, il y a deux autres paramètres primordiaux à prendre en compte : la forme du cathéter qui va faire l’ablation dans l’oreillette gauche et le « workflow » c’est-à-dire le protocole d’application de PFA.
A.2 Farapulse
Farapulse est le premier système d’ablation par électroporation single-shot. Il a été développé à partir de 2012, par une strat-up du même nom. Les premiers essais sur l’humain ont été réalisés en 2017 et ont été succédés par de multiples études qui ont permis d’optimiser l’utilisation du dispositif médical et prouver son efficacité. C’est en 2020 que la technologie est rachetée par Boston Scientific, suit alors la commercialisation du Farapulse en France en 2021. Aujourd’hui, on compte une cinquantaine d’équipements sur le territoire français. J’ai donc eu la chance d’effectuer mon stage en travaillant avec ce très récent dispositif médical de pointe.
1. Farawave & Faradrive
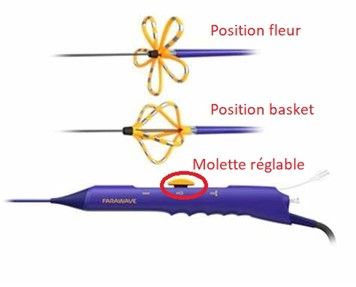
Le Farapulse est donc un système d’ablation par électroporation conçu et marqué CE pour l’ablation des veines pulmonaires. C’est à travers un cathéter, le Farawave, au design conçu spécialement pour les veines pulmonaires que l’énergie est délivrée sur les tissus. Composé de cinq branches, il peut prendre trois formes caractéristiques : nominal, basket et fleur, ces géométries sont modulables grâce à une glissière réglable par le médecin. Sur chacune des branches se trouve quatre électrodes qui permettent d’émettre l’énergie. Les troisièmes électrodes de chaque branche en partant de la distalité permettent en plus d’ablater, de recueillir les signaux locaux des tissus à proximité et de stimuler. Le Farawave est disponible en deux diamètres de position fleur, 31 et 35 mm, voir figure n°20.
Figure n°20 : Cathéter Farawave
Le Farawave n’est pas rigide et ne pas être courbé par le médecin avec une poignée comme les sondes d’ablation par RF. Pour permettre de modifier la courbure du cathéter et le positionner parfaitement à l’ostium de chaque veine, Boston Scientific commercialise également la gaine déflectable Faradrive. Cette gaine dans laquelle est introduit le Farawave et dont le diamètre externe est de 16F, soit environ 5,3mm, assure maintient et maniabilité, voir figure n°21.
Figure n°21 : Gaine FaraDrive
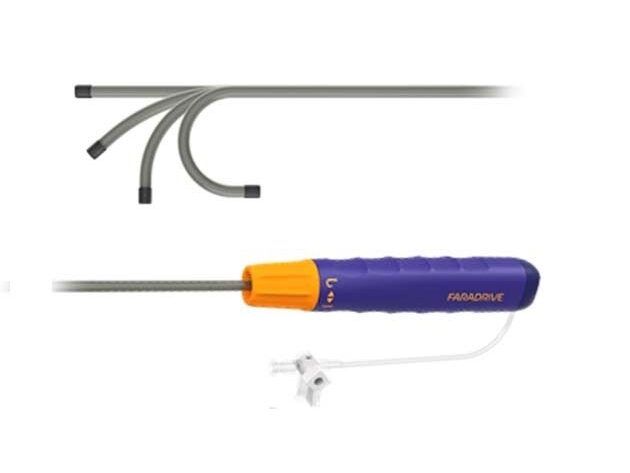
Ces deux équipements sont des consommables, ils sont non stérilisables.
2. Farastar+RSM
Le Farawave ne peut ablater sans avoir la source d’énergie nécessaire. Ainsi la Farastar est une console mobile branchée à une prise de courant au bloc, voir figure n°22. Elle est dotée de condensateurs permettant de délivrer 2000 volts en 2,5 secondes pour chaque application de PFA. Entre chaque tir les condensateurs doivent se recharger durant une petite dizaine de secondes. Un écran tactile sur la console permet à l’ingénieur d’application d’initier un tir en cliquant sur « confirm » puis « deliver » après avoir confirmé avec le médecin le lancement de l’ablation.
L’énergie délivrée par le cathéter dans le cœur du patient est très intense et a pour risque d’endommager les autres équipements du bloc. En effet, le patient étant porteur d’un ECG durant l’intervention et très probablement d’un cathéter de diagnostic, ces derniers ont pour risque de capter cette forte différence de potentiel électrique et d’endommager l’amplificateur de la baie. Ainsi chaque console est connectée à un Recording System Module RSM, voir figure n°22, auquel elle va indiquer lorsqu’un tir est lancé. Le RSM va alors jouer le rôle d’interrupteur et couper la connexion électrique entre l’ECG, les cathéters de diagnostic et l’amplificateur de la baie.
Figure n°22 : Gauche : console FaraStar, Droite : Recording System Module

3. Procédure et « Workflow »
L’utilisation du Farapulse se fait essentiellement et très majoritairement sous fluoroscopie donc sans repérage dans une carte comme en radiofréquence. Il est donc important d’avoir les bons repères anatomiques et l’habitude des images de radiologie pour pouvoir ablater correctement les quatre veines pulmonaires de l’oreillette gauche.
Une procédure d’ablation par électroporation avec le système Farapulse se déroule de la manière suivante :
1 – Installation et anesthésie
La première étape est l’installation du patient et du matériel. L’infirmière du bloc pose un ECG 12 dérivations au malade et prépare la table stérile. Sur la baie avec l’ECG, il est possible de savoir si le patient est déjà en FA ou en rythme sinusal. L’ingénieur d’application va alors faire et vérifier les branchements de la console, du RSM, de l’ECG et des câbles de signaux endocavitaires. On allume la console avant d’endormir le patient pour s’assurer qu’elle est bien opérationnelle sans message d’erreur. L’infirmier anesthésiste supervisé d’un médecin anesthésiste peut procéder à l’endormissement et intubation du patient si le centre fonctionne avec de l’anesthésie générale ou à une sédation profonde qui ne nécessite pas d’intubation.
2 – Reconstruction 3D du scanner
Afin de connaitre au mieux l’anatomie cardiaque du patient ce dernier passe un scanner injecté quelques jours avant la procédure. L’injection permet de mettre en lumière les cavités du cœur. L’ingénieur d’application a alors pour mission de réaliser la reconstruction 3D de l’oreillette gauche et des veines pulmonaires. Le logiciel de cartographie Rhythmia permet de faire cette reconstruction, voir figure n°23. Plusieurs mesures peuvent être effectuées, comme le calcul du volume de l’oreillette gauche souvent dilatée lorsque le patient fait de la FA persistante et le diamètre des veines pulmonaires pour décider de la taille du cathéter Farawave (31mm ou 35mm de diamètre en fleur) la plus adaptée.
Figure n°23 : Etape de construction 3D de l’oreillette gauche depuis un scanner sur Rhythmia

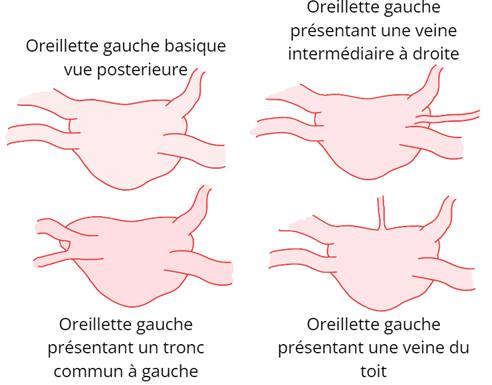
De plus, des anatomies particulières peuvent être rencontrées, voir figure n°24. Grâce au scanner, on peut découvrir une troisième veine à droite, un tronc commun à gauche, une veine sur le toit de l’oreillette ou encore un FOP qui consiste en une connexion entre l’oreillette gauche et droite, ce qui permet de ne pas faire de ponction transeptale.
Figure n°24 : Les anatomies d’oreillette gauche rencontrées
2 - La ponction fémorale et cathéter de diagnostic
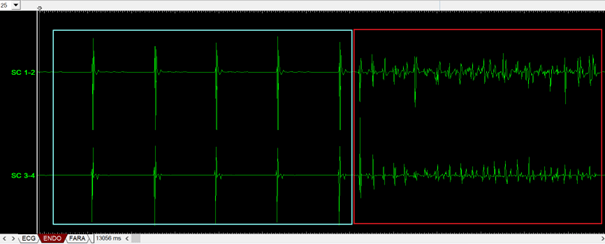
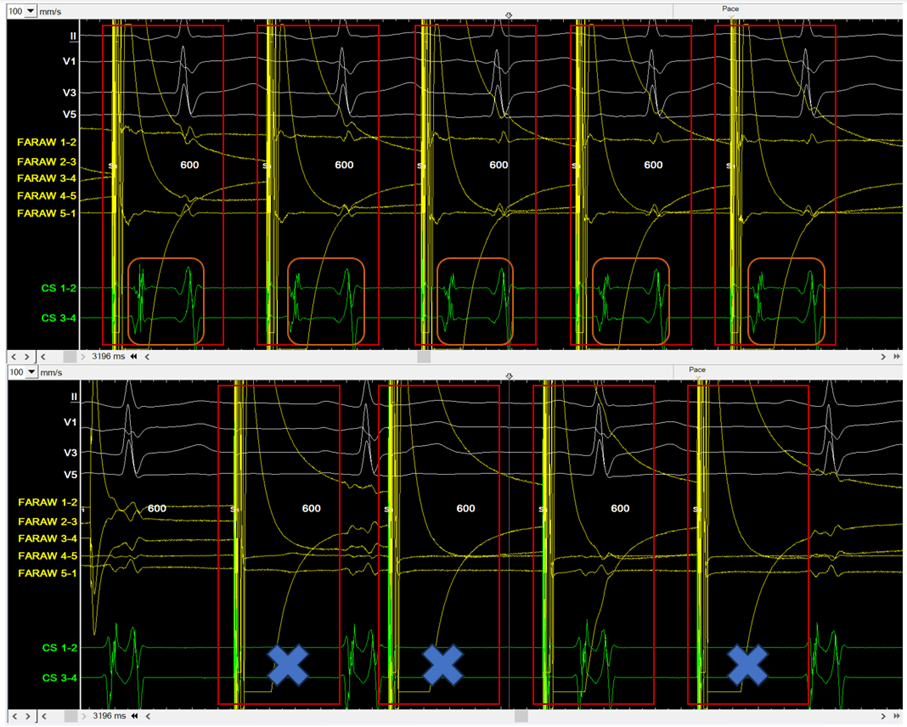
Le médecin habillé en stérile, procède sur le patient endormi ou sédaté, à la ponction de la veine fémorale. Puis, le cardiologue introduit un cathéter de diagnostic généralement quadripolaire dans le CS guidé par la scopie, voir figure n°25. Les signaux obtenus avec cette sonde sont lus sur la baie et permettent de confirmer ou non le rythme supposé à l’ECG en début de procédure, voir figure n°26.
Figure n°25 : Cathéter de diagnostic dans le sinus coronaire
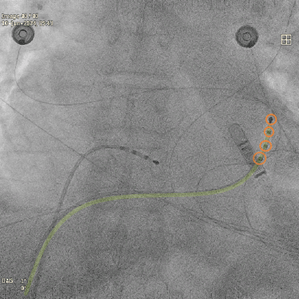
En jaune la transparence du cathéter, entourées en orange : les électrodes
Figure n°26 : Signaux obtenus avec une sonde quadripolaire dans le sinus coronaire, entourés en bleu des signaux d’un rythme sinusal, en rouge de la fibrillation atriale
4 - Transeptal et héparine
Cette étape est certainement la plus délicate même si elle est maitrisée. Le transeptal est donc réalisé soit sous ETO ou à la pression et scopie. Une fois l’accès à l’atrium gauche effectué, un guide est introduit dans la veine pulmonaire supérieure gauche.
Le transeptal réalisé, le médecin demande qu’un bolus d’héparine soit fait, cela permet de fluidifier le sang et de limiter l’apparition de thrombus et risque d’AVC.
5 - Préparation et introduction de la Faradrive
Le cardiologue peut alors procéder à la préparation de la gaine Faradrive, en purgeant le dilatateur et l’intérieur de la gaine avec une solution saline. Il peut ensuite introduire le dilatateur dans la gaine et monter le tout sur le guide. Ce dernier étant déjà dans la veine pulmonaire supérieure gauche, c’est généralement sans difficulté que la gaine et le dilateur peuvent aller jusqu’à la cavité de l’atrium gauche.
Le septum traversé par la Faradrive, le dilatateur et le guide peuvent être retirés, et la gaine est branchée par un port d’irrigation à une poche de solution saline héparinée.
6 - Préparation et introduction du Farawave et chargement des condensateurs
La gaine sécurisée dans l’oreillette gauche, le praticien peut préparer le cathéter d’ablation. Pour cela il branche le Farawave au câble de la console Farastar, cette dernière reconnait le cathéter.
Ensuite, il purge la lumière interne du cathéter dans laquelle passera un guide, et le port d’irrigation. La connexion avec une seconde poche d’irrigation de solution saline héparinée et l’introduction du guide dans le Farawave peuvent être effectuées. Avec le guide bien visible à la distalité du cathéter, le cardiologue teste les différentes positions (fleur et basket) du cathéter et peut introduire le Farawave dans la gaine et le monter jusqu’à la cavité gauche. Pendant cette étape, l’ingénieur d’application guide le médecin sur les différentes purges et autres tests à réaliser. Il agit comme une seconde paire d’yeux pour limiter le risque d’introduction de bulles d’air dans la circulation systémique. Aussi, l’ingénieur d’application appuie sur le bouton « Prepare » de la console pour charger les condensateurs et s’assure que le voltage est bien à 2000 Volts.
7 - Ablation veines pulmonaire gauches
Le cathéter est dans la gaine qui est elle-même dans l’atrium gauche. Le médecin peut alors trouver la veine supérieure gauche avec le guide du Farawave.
Il peut déployer, dans la cavité, le cathéter en dehors de la gaine en forme basket et le plaquer à l’ostium de la veine pulmonaire supérieure gauche en le glissant sur le guide et en s’appuyant sur le retour de scopie. On observe le nombre de branche au-dessus et en dessous du guide. Le médecin et le FCS valident la position et les deux tirs de PFA peuvent être envoyés en appuyant sur « Confirm » et « Deliver » sur la console.
Le médecin peut faire une rotation d’environ 30° du cathéter pour avoir une position complémentaire aux deux premiers tirs. Deux nouveaux tirs sont alors lancés, toujours après accord entre praticien et ingénieur d’application.
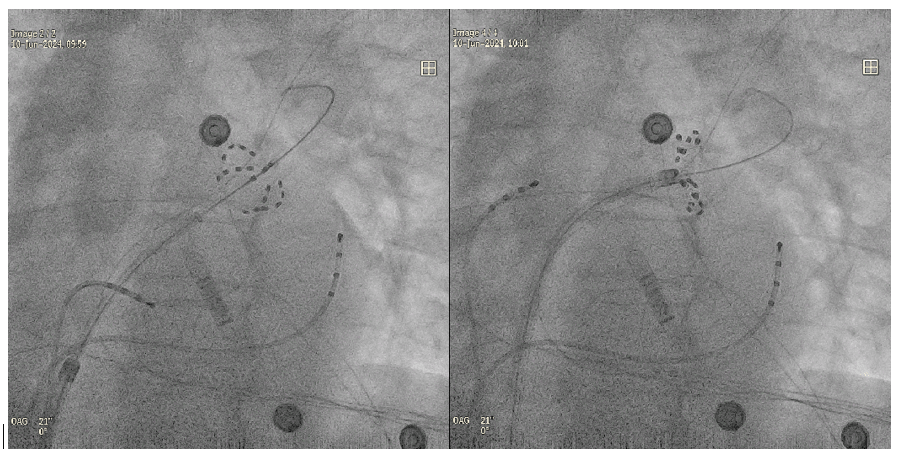
Une fois les quatre tirs en position basket réalisés le praticien peut passer en configuration fleur, voir figure n°27. Il faut alors être vigilant à ce qu’il y ait bien contact avec le tissu et que les pétales soient bien repartis . Pour cela, le médecin peut jouer avec l’incidence de la scopie pour avoir différentes vues, perspectives, et valider les paramètres de répartition et de contact.
Tout comme les baskets 4 tirs dans 2 positions complémentaires sont nécessaires.
Figure n°27 : Position basket et fleur dans la veine pulmonaire supérieure gauche
Le « workflow » recommandé par Boston Scientific est donc 4 tirs dans 2 positions complémentaires en baskets et en fleurs par veine.
Ainsi, pour la veine pulmonaire inférieure le médecin doit la trouver avec le guide en s’appuyant sur la scopie et la reconstruction 3D et en gardant le cathéter en forme de fleur. Ensuite, il suit le workflow d’ablation toujours en étant vigilant sur le contact et sur la bonne répartition des branches.
8 - Ablation veines pulmonaires droites
Pour les veines pulmonaires droites, le médecin peut rentrer le Farawave dans la gaine et courber cette dernière pour ne pas perdre le transeptal et ensuite faire une rotation de la gaine en sens horaire. Sinon, il peut laisser le cathéter en fleur et faire la rotation avec la gaine courbée et bien collée à la fleur et faire la rotation également en sens horaire.
Le workflow est le même pour les deux (ou trois en cas de veines d’intermédiaires) veines pulmonaires droites, voir figure n°28, que pour les gauches. Cependant, elles sont souvent plus difficiles à identifier et les positions fleurs et baskets sont plus compliquées à exécutées correctement à cause de contraintes anatomiques comme celle du septum.
Figure n°28 : Position fleur dans la veine pulmonaire supérieure droite
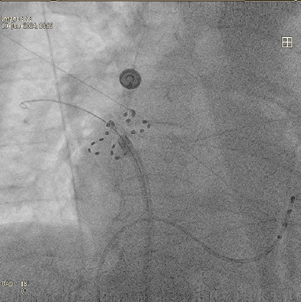
8 Bonus - Ablation d’autres zones potentiellement arythmogènes
Le système Farapulse est marqué CE pour l’ablation des veines pulmonaires uniquement, cependant certains médecins l’utilisent pour ablater d’autres zones qui peuvent être responsables de triggers de FA ou d’autres arythmies. Le mur postérieur de l’oreillette gauche est très régulièrement ablaté.
L’isthme mitrale, c’est à dire la zone entre la veine pulmonaire inférieure gauche et la valve mitrale et l’isthme cavo-tricuspide (zone entre la valve tricuspide et la veine cave supérieure) sont parfois ablatés avec le Farapulse dans certains centres.
9 - Vérification des veines et tirs supplémentaires
Une fois les quatre veines ablatées, la vérification de l’isolation des veines peut être faite. Pour cela le rythme du patient doit être sinusal. Si le patient est en FA après les ablations, une cardioversion avec un défibrillateur externe est nécessaire.
Pour conclure sur l’isolation des veines, le médecin va introduire en position basket aplati le Farawave dans une veine, figure n°29. Grâce à la troisième électrode de chaque branche, les signaux locaux sont obtenus sur la baie comme les signaux du cathéter de diagnostic dans le CS.
Le succès est lorsque on ne voit pas de potentiels sur les dipôles du Farawave.
Figure n°29 : Position pour bloc de sortie dans la veine pulmonaire gauche inférieure
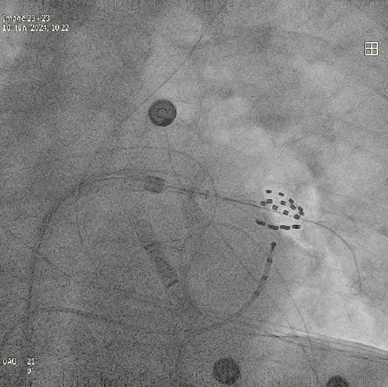
Cependant, il est possible d’avoir des signaux malgré l’ablation. Pour vérifier s’il s’agit de potentiels autres que ceux responsables de la FA ou qu’il s’agit d’une mauvaise ablation, il faut stimuler sur les électrodes du Farawave en envoyant des courants de faible intensité localement. S’il l’on capture, c’est-à-dire que la stimulation dans la veine engendre la contraction de l’oreillette tout entière, les signaux du cathéter de diagnostic dans le CS se synchroniseront avec la stimulation du Farawave, voir figure n°30. Dans ce cas, il est nécessaire de faire des tirs de PFA supplémentaires.
S’il n’y a pas de capture, alors le potentiel visible sur les dipôles sont ceux qu’on appelle du « far field », c’est-dire les signaux d’autres structures.
Figure n°30 : Stimulation avec le Farawave dans la veine, capture sur l’exemple en haut, pas de capture sur l’exemple en bas
7 - Fin de procédure
Une fois les veines vérifiées, le médecin peut extraire tout le matériel du patient, à savoir Farawave, Faradrive, guide, cathéter de diagnostic et faire un point au niveau de la veine fémorale. Le patient se réveille ensuite et passera ou non une nuit à l’hôpital.
Une procédure Farapulse est plutôt rapide, il faut compter 30 à 50 min contre près du double pour un résultat équivalent en RF.
Finalement, quelques médecins font une cartographie de voltage de l’atrium gauche avant et après la PFA. Voici un exemple de carte de voltage, figure n°31, et il est intéressant de voir à quel point cette technique est efficace et permet de couvrir d’immense zone en peu de temps.
Figure n°31 : Carte de l’oreillette gauche après PFA des 4 veines pulmonaires et du mur postérieur
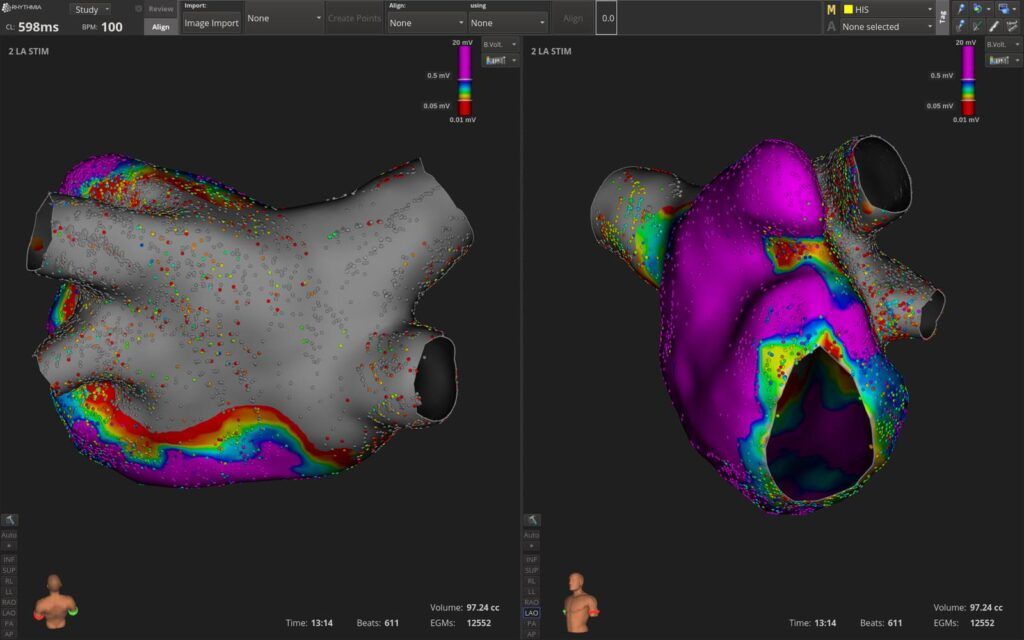
Vue postérieure et latérale gauche de l’oreillette, en gris la zone qui ne présente plus de potentiels électriques et en violet les zones saines
4. Sélectivité et sécurité
Aujourd’hui l’électroporation apparait comme une technique d’ablation sécuritaire, limitant le risque d’apparition des pires complications déjà connues en cryo-ablation et RF. L’engouement des rythmologues envers la PFA est justifié par la sélectivité tissulaire de cette technique. En effet, par chance les cardiomyocytes ont un seuil d’électroporation irréversible plus bas que les autres cellules. Ainsi, lorsqu’une ablation est réalisée, les cardiomyocytes sont neutralisés mais les nerfs, les cellules œsophagiennes, la matrice extra-cellulaire et les vaisseaux proches des zones ablatées ne sont pas impactés. De plus avec la PFA, le tissu cellulaire est largement préservé contrairement à l’ablation par RF, voir figure n°32.
Figure n°32 : Coupes histologiques à gauche après PFA, à droite après RF
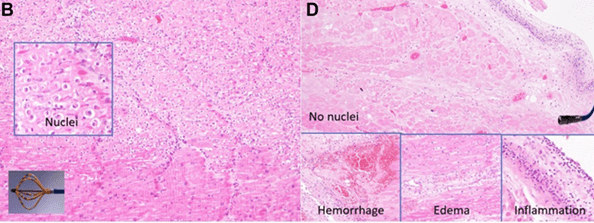
Les complications comme la paralysie du nerf phrénique (permet les mouvements diaphragmatiques) connues avec la cryo-ablation, la sténose des veines pulmonaire et la fistule atrio-œsophagienne provoquées par la RF ne sont pas des dangers que l’on peut trouver avec la PFA, voir figure n°34.
Il est important de savoir que la fistule atrio-œsophagienne, qui consiste en une communication entre l’œsophage et l’oreillette gauche, est la pire des complications aboutissant dans la majorité des cas au décès du patient.
La grande force du Farapulse est également liée aux résultats très favorables en termes de sécurité, d’efficacité et de rapidité obtenus dans différentes études.
En effet, l’étude clinique randomisée ADVENT AF, voir figure n°33, a permis au système Farapulse d’obtenir le marquage de FDA (l’équivalent du marquage CE aux États-Unis) et prouve la non-infériorité de l’électroporation vis-à-vis de la RF ou la cryo-ablation. Il montre que le temps moyen de procédure est largement réduit et qu’il n’y a pas de complications majeures liées à la PFA. Cette étude a été réalisée aux États-Unis dans plus de 30 centres sur plus de 350 patients randomisés entre un bras électroporation et un autre qui regroupe RF et cryo.
Figure n°33 : Schéma de l’étude ADVENT AF
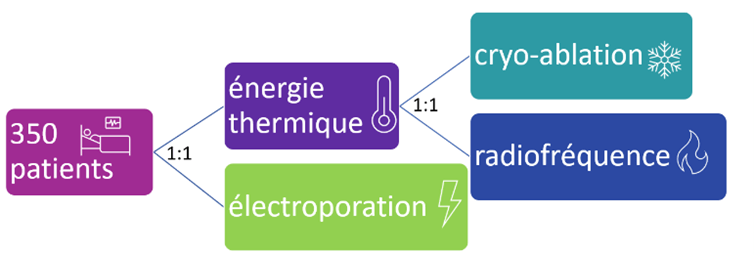
Figure n°34 : Résumé des complications de chaque énergie d’ablation
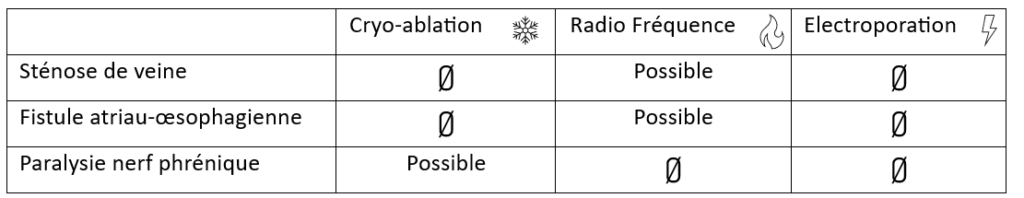
Le registre Manifest AF regroupe au niveau européen plus de 1300 patients sur 24 centres et confirme les résultats d’ADVENT avec : aucune complication majeure (sténose de veine, paralysie définitive du nerf phrenique, fistule atrio-œsophagienne) sur un groupe de patients plus large.
Durant mon stage, le Centre Hospitalier Universitaire de Grenoble a remarqué une réaction d’hémolyse lorsque le nombre de tirs de PFA est supérieur à 100 (le workflow normal est de 32 tirs). L’hémolyse étant la destruction des globules rouges, ces derniers libèrent des protéines d’hémoglobine en grande quantité. Or, il s’agit d’une protéine de grosse taille qui risque de gravement endommager la fonction rénale. Une étude est en cours pour évaluer les effets d’un protocole d’hydratation à la suite de la procédure. Pouvoir suivre tout au long de mon stage l’évolution des discours autour de cette complication était très enrichissant et a permis d’avoir un sens critique.
5. L’arrivée de concurrents et avenir de la PFA chez Boston Scientific
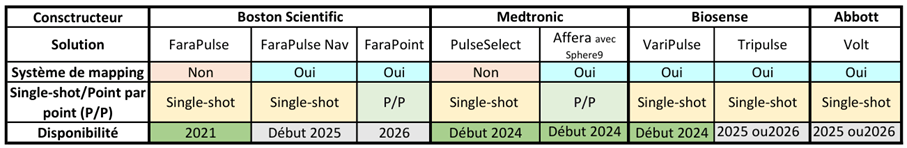
Jusqu’à ce début d’année, cela faisait presque 3 ans que Boston Scientific était l’unique constructeur de système d’ablation par électroporation. Aujourd’hui, MedTronic avec le PulseSelect et l’historique Biosense avec VaryPulse s’essayent à l’électroporation single shot combinée à la cartographie, voir figure n°35.
Figure n°35 : Pulse Select de Medtronic à gauche, VariPulse de Biosense

MedTronic a également fait l’acquisition d’Affera qui propose un système de cartographie ave un cathéter de PFA point par point, c’est-à-dire qui crée des lésions de quelques millimètres. Cependant, la quantité disponible de consommables et d’équipement est très limitée. Aujourd’hui on ne compte que 4 systèmes en France.
Abbott ne rentrera sur le marché de l’électroporation qu’en 2025 avec le Volt.
Aujourd’hui, Boston Scientific envisage de pouvoir utiliser le Farawave combiné à la cartographie Rhytmia pour début 2025 et continue le développement de cathéter d’électroporation point par point pour 2026, voir figure n°36.
Figure n°36 : Tableau des solutions existantes et à venir en électroporation
B. Rôles de l'ingénieur d'application en électrophysiologie
B.1 Formation et observation
Afin d’être un bon FCS, Boston Scientific propose une formation mixte ponctuée de journée au bloc en observation avec un autre ingénieur senior et un apprentissage par e-learning. Ainsi dès mon second jour de stage, j’ai pu découvrir le bloc de rythmologie du Centre Hospitalier Universitaire CHU de Tours avec ma mentor. Les trois premières semaines de stage, le rythme fut donc d’environ trois/quatre journées de bloc par semaine et une/deux journées de e-learning. Des modules sur l’anatomie, les différents types d’arythmies, le fonctionnement des technologies, le comportement à adopter en salle sont obligatoires et à valider sur la plateforme d’apprentissage à distance.
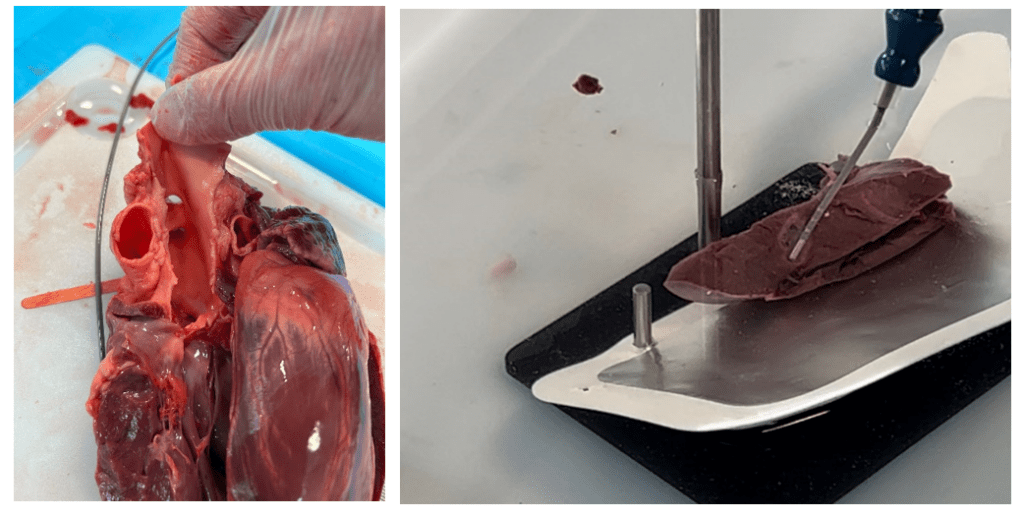
La quatrième semaine de stage s’est déroulée sans bloc, au siège de Boston Scientific France à Voisins-le-Bretonneux. Les dix stagiaires en électrophysiologie ont été réunis pour une semaine de formation en présentielle. Ce qui a été vu en e-learning les trois premières semaines, a été revu plus en détail pour une bonne compréhension. L’anatomie cardiaque, les arythmies, la lecture ECG, les produits Boston en électrophysiologie, Farapulse, la RF, la cryo-abaltion, la cartographie ont été travaillés sous forme d’atelier pratique en petits groupes de 3 ou 4. Nous avons eu la chance de disséquer un cœur afin de bien prendre conscience de la structure des cavités, mais aussi voir de la RF sur du tissus animal et se rendre compte de la lésion, voir figure n°37. Une journée entièrement dédiée à Farapulse nous a permis d’affirmer nos connaissances et de nous essayer à la manipulation du Farawave dans un cœur artificiel.
Figure n°37 : Dissection de cœur porcin et lésion par RF sur le myocarde
Il a été également extrêmement enrichissant de retrouver les autres stagiaires acteurs dans d’autres régions de la France. En effet, cela nous a permis d’échanger sur nos premières expériences au bloc, sur les pratiques des différents centres et rendre compte des différences entre les régions.
Ainsi, à la suite de cette semaine, Boston Scientific nous encourage à voir d’autres centres. J’ai pu alors voir des procédures Farapulse à Grenoble, Aix-en-Provence et Monaco. Découvrir de nouvelles équipes avec leurs propres fonctionnements, des points de vue différents sur la technologie et des usages insolites du Farapulse, fût très formateur. Cela m’a permis par la suite, de voir le système d’électroporation sous un angle plus global et d’avoir une vision moins cloisonnée des utilisations possibles. Un sens critique plus aigu, mais aussi pouvoir débattre de ces observations avec les équipes Franciliennes.
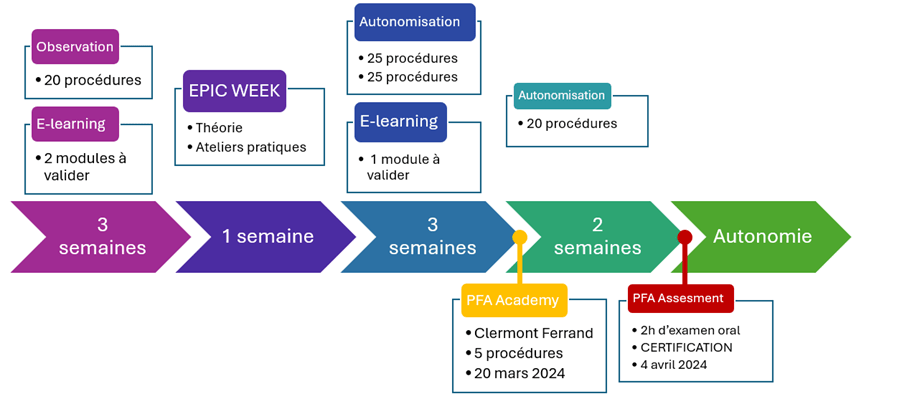
Afin de vérifier nos compétences sur le terrain, je me suis rendue, avec deux autres stagiaires à une PFA Academy le 20 mars au CHU de Clermont Ferrand. Pendant cette journée, nous avons accompagné un médecin très expérimenté avec la technologie sur 5 procédures. Le praticien étant parfaitement à l’aise avec la technologie, il a pris soin de nous tester sur nos connaissances et potentielles recommandations à faire durant une intervention Farapulse.
J’ai été certifiée début avril 2024, voir figure n°38. Cela permet de faire de procédures Farapulse en autonomie, sans FCS senior. Cette certification consiste en une réunion d’environ deux heures, pendant laquelle deux FCS experts du Farapulse, teste nos connaissances et nos capacités à surmonter les difficultés qui peuvent être rencontrées au bloc. Dès le lendemain, j’étais en procédure en autonomie à la Pitié-Salpêtrière.
Figure n°38 : Planning des premiers mois de formation
Cependant même après la certification, des formations doivent régulièrement être faites pour rester à jour, notamment sur les recommandations, les études cliniques ou la concurrence.
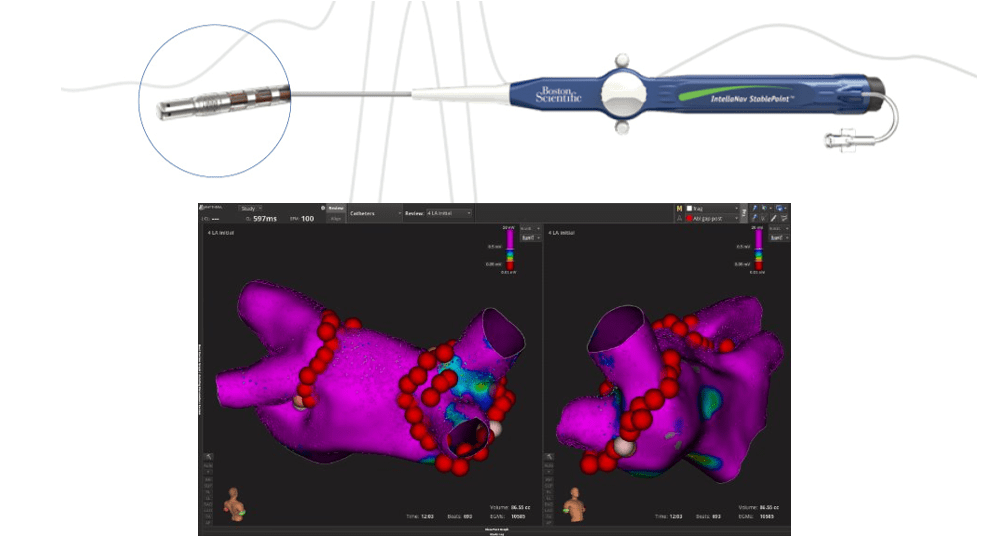
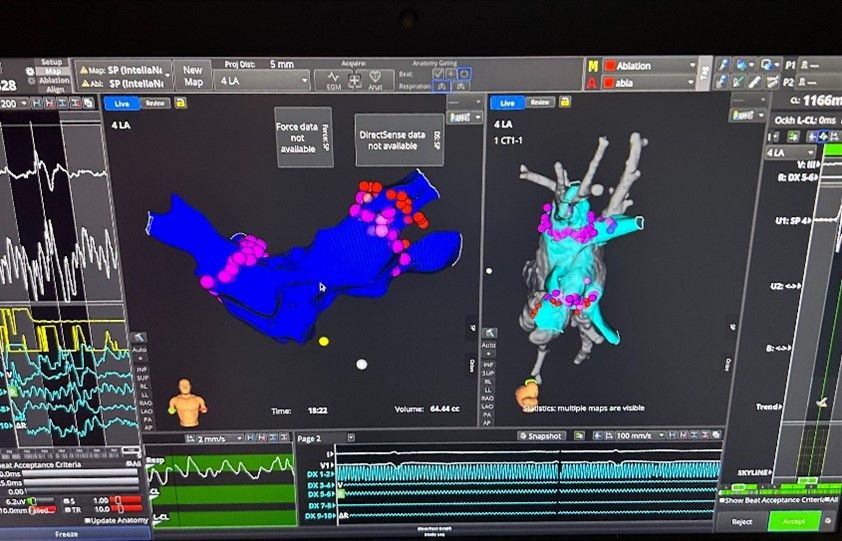
J’ai eu la chance d’observer plusieurs procédures de cartographie Rhythmia avec des ingénieurs d’application formés, et suis actuellement au tout début des e-learning de formation pour la cartographie. Aussi, j’ai eu l’opportunité de m’essayer à cette discipline de cartographie avec ma mentor, cette dernière faisait les cartes que le médecin voyait et je pouvais, avec les mêmes données et en direct, faire également mes propres cartes que seule ma mentor et moi pouvions voir, figure n°39.
Figure n°39 : Carte réalisée en mai 2024 pour l’isolation des veines en RF sur Rhythmia
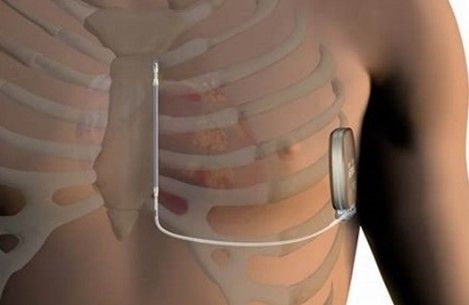
Finalement j’ai pu élargir ma culture du traitement du rythme cardiaque en assistant à l’implantation de deux défibrillateurs sans sonde endocavitaire, voir figure n°40, au CHU de Tours. Ce fut une expérience très enrichissante puisque j’ai pu découvrir le métier, les missions et les enjeux des FCS en CRM.
Figure n°40 : Défibrillateur sans sonde endocavitaire Boston Scientific
Tout ce parcours de formation est évidement encadré par notre manager, et également par un mentor. Chaque nouvel entrant ingénieur d’application se voit attribuer un FSC senior. Le mentor a un unique stagiaire à aider et encadrer durant la formation, ce qui permet un accompagnement vraiment personnalisé. Ce rôle a beaucoup d’importance, puisque le mentor est le premier lien qu’on a avec l’entreprise, il est présent pour répondre aux questions techniques ou administratives, et surtout il a une vraie fonction de transmission du savoir et de passion.
B.2 Place et missions de l’ingénieur d’application au bloc
Au bloc opératoire le FCS assure un rôle de support technique et clinique.
Les premières procédures en autonomie sont réalisées avec des médecins déjà à l’aise avec la technologie et la manipulation du cathéter. L’ingénieur est alors présent pour installer et brancher le matériel en fonction de la configuration du bloc et des cathéters utilisés.
Il réalise ensuite la reconstruction 3D du scanner du patient, établit l’anatomie de l’oreillette (tronc commun, veine supplémentaire, FOP, volume), et mesure le diamètre des veines pour ensuite discuter avec le rythmologue de la taille de cathéter la plus adaptée au patient.
Lors de la préparation de la FaraDrive et du Farawave, le FCS observe chaque geste de purge et s’assure qu’aucune étape n’est omise.
Durant la procédure le FCS s’assure que le workflow est correctement suivi, c’est-à-dire que les 4 tirs par veine dans deux positions différentes en fleur et en basket sont bien réalisés sans oubli. Il peut être décidé de faire des tirs complémentaires, mais ils seront toujours en supplément des 32 tirs recommandés.
Lorsque le médecin est prêt pour le tir de PFA, il fait signe et l’ingénieur peut envoyer les tirs en appuyant sur « confirm » puis « deliver ».
En cas de bruit ou de plat sur les signaux ECG ou endocavitaire, le FCS doit immédiatement réagir et a pour mission de trouver la cause. Le nombre de câbles et d’électronique fait que cette situation arrive régulièrement. Heureusement nous avons été formés à suivre une stratégie de détection des causes et à rétablir rapidement une bonne qualité de signaux. De plus, il arrive que la console indique des erreurs avant ou pendant un tir de PFA. Le plus fréquemment les erreurs sont liées à la trop grande proximité entre les branches du cathéter d’ablation. La console détecte que certaines électrodes sont trop proches et annule le tir, le médecin peut alors essayer de bouger le Farawave et libérer la contrainte sur les branches du cathéter pour que ce dernier prenne une forme fleur ou basket avec une bonne répartition. Le FCS est là pour donner des astuces pour avoir la meilleure position et limiter l’apparition d’erreur.
De plus, les branches du cathéter étant souples il est possible que l’une d’elle s’« inverse », c’est ce qu’on appelle le cobra. Cette situation est rare mais nous avons des conseils pour guider le médecin à libérer le pétale, voir figure n°41.
Figure n°41 : Cathéter en cobra

Enfin à la fin des procédures, le FCS échange sur déroulement de la procédure, des nouvelles recommandations avec le médecin avant de ranger et nettoyer les câbles et la console.
En avançant dans les procédures en autonomie, j’ai travaillé avec des médecins moins à l’aise avec la technologie.
En plus de faire ce qui a été évoqué précédemment s’ajoute un rôle « d’expert » de l’utilisation du Farapulse. Le but est de guider au mieux le médecin débutant en Farapulse pour que les bonnes pratiques et les réflexes nécessaires soient adoptés. Le travail commence dès la préparation en rappelant les étapes clés des purges et aspirations de la gaine et du cathéter d’ablation. Puis lorsque le cathéter est dans la gaine, elle-même dans la cavité de l’atrium gauche le coaching peut commencer. Le FCS guide alors sur la cathérisation des veines, rappelle que le déploiement du cathéter doit se faire au milieu de la cavité, sans contrainte de la gaine, s’assure que les électrodes soient bien en contact avec le tissu cardiaque et que le cathéter a vraiment une position idéale. L’ingénieur d’application invite le médecin à s’habituer aux signaux obtenus avec le Farawave dont l’interprétation n’est pas toujours évidente à cause du far Field.
Lorsque les équipes et les praticiens sont à l’aise et le souhaitent, l’autonomie est possible avec le Farapulse. Une assistance à distance « RythmCare » est également proposée, il s’agit d’un numéro de téléphone qui redirige vers une FCS sénior qui travaille depuis chez elle et guide les équipes à la résolution de problèmes.
IV. Bilan et perspectives
A. Chiffres clés
Il me semble intéressant de communiquer quelques statistiques clés de ce stage. En effet, c’est plus de 150 procédures d’ablation toutes techniques confondues, auxquelles j’ai pu participer, voir figure n°42.
Figure n°42 : Nombre de procédures faites
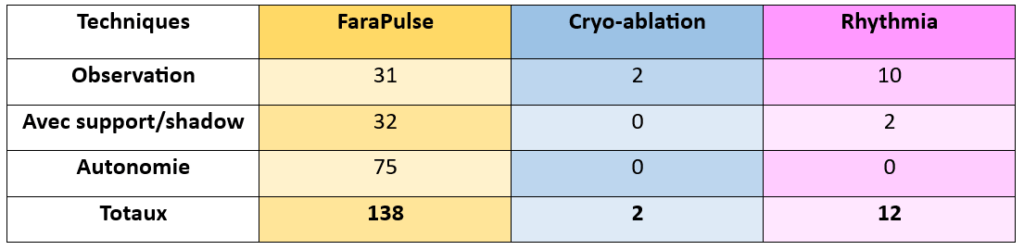
Motivée par mon tuteur et ma mentor, j’ai eu la chance de pouvoir découvrir un très grand nombre de centres, notamment en dehors de la région d’Ile de France. Au total, c’est 18 hôpitaux et cliniques différentes que j’ai pu découvrir, voir figure n°43. Les déplacements étant propres au métier, ils m’ont conduite à parcourir plus 18 000 km en cinq mois de stage.
Figure n°43 : Carte des centres
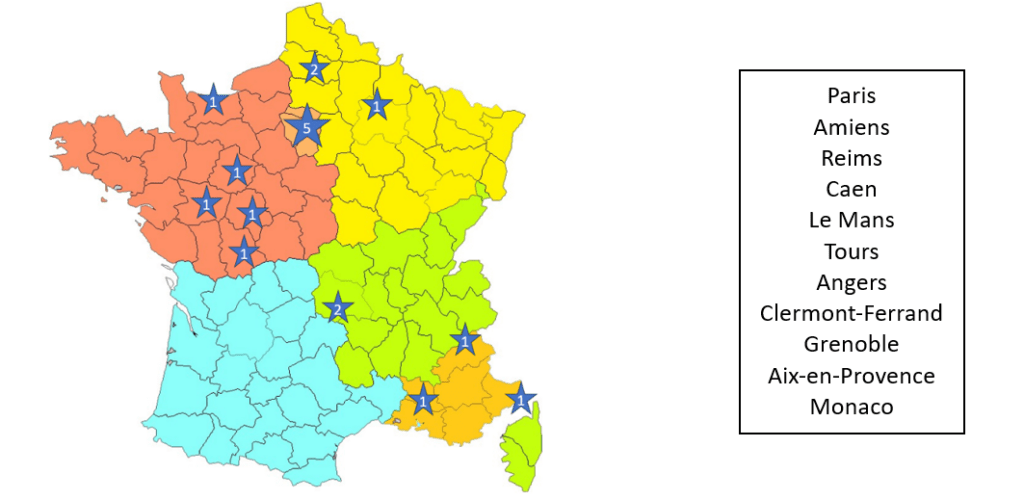
Avoir ainsi circulé durant mon stage m’a également donné la chance de rencontrer plus de 50 médecins, une vingtaine d’équipes de paramédicaux et ainsi autant de techniques, discours et avis différents. Être confrontée à cette diversité fut extrêmement formateur et m’a permis de développer mon sens critique.
B. Apports personnels et professionnels
Cette première expérience professionnelle fut un tremplin pour le développement de compétences professionnelles et personnelles. En effet, une solide base de connaissance en rythmologie a été édifiée au cours de ces six derniers mois. La formation en e-learning complétée par l’apprentissage sur le terrain avec les FCS, médecins et paramédicaux a été passionnante et c’est avec enthousiasme que je souhaite élargir d’avantage mon champs de connaissance en électrophysiologie.
La confiance qui m’a été donnée par les FCS seniors et les superviseurs m’a permis de développer mon assurance et de faire d’immenses progrès sur ma nature timide. J’ai été obligée de sortir de ma zone de confort et cela pour le meilleur. En effet, aller en autonomie (sans senior) dans un bloc encore inconnu me semblait impensable.
La Clinique de l’Europe à Amiens aura été ma première expérience en autonomie dans un centre dans lequel je n’étais jamais allée. Aujourd’hui, je continue à développer davantage mes compétences relationnelles ainsi que ma confiance en moi, et c’est avec fierté que je vois semaines après semaines les progrès réalisés et les difficultés surmontées.
De plus, il a été très gratifiant de voir que mon travail et ma présence est utile et je trouve satisfaisant de voir au fil des procédures certains cardiologues adopter les bonnes pratiques et gestes que vous lui avez précédemment suggérés.
C. Les difficultés rencontrées
Durant ce stage j’ai été confrontée à quelques moments délicats.
La plus grande difficulté a été lorsque j’ai été certifiée et que j’ai fait mes premières procédures en autonomie. Il a été difficile de me sentir légitime et d’affirmer des points de vue sur l’utilisation du Farapulse à des médecins qui ont fait plus de 10 années d’études et qui ont deux, voire trois fois mon âge.
Créer du lien avec le personnel médical et paramédical n’a pas été simple, sachant que l’on est en cous de formation et que l’on change quotidiennement de centres. Pendant mes premières semaines de procédures en autonomie, j’ai été deux à trois fois par semaine dans le même centre. Cela m’a rassurée sur le fait que je pouvais créer de bonnes relations de travail et de confiance avec les équipes de ce centre. Aujourd’hui, je travaille quotidiennement à créer un lien solide avec les différents acteurs des blocs que je fréquente.
Enfin, la balance vie professionnelle et vie personnelle n’a pas toujours été simple à équilibrer. Pourtant, la fluctuation du temps de travail et des sites géographiques font aussi le grand charme de ce métier. En effet, ne pas avoir de routine fait que chaque jour est une surprise. Aucune journée ne se ressemble et surtout cela me montre que pour le moment je ne me vois absolument pas effectuer un travail de bureau.
D. Perspectives
L’électrophysiologie est un domaine passionnant et innovant qui est en pleine mutation avec la technique de la PFA et j’ai eu beaucoup de chance de pouvoir participer son expansion sur le territoire français au cours de ces six derniers mois. Je souhaite poursuivre dans le domaine de l’électrophysiologie et surtout continuer à développer mes compétences et élargir mon champ de connaissance.
Conclusion
Ce stage marque de la meilleure des façons, la fin de cinq ans d’études supérieures. Je suis fière de l’évolution personnelle que m’a permis cette expérience. J’ai été obligée de sortir progressivement de ma zone de confort en rencontrant quotidiennement des personnes passionnées et passionnantes.
Aujourd’hui, c’est un socle de connaissances solides en électrophysiologie que j’ai construit, et c’est avec envie et curiosité que je souhaite poursuivre dans ce domaine innovant.
Pour conclure, c’est avec enthousiasme que je vais poursuivre la construction du parcours professionnel que j’ambitionne.