IDS253 - Prise en charge des douleurs chroniques par les dispositifs médicaux
DOI mémoire
https://doi.org/10.34746/ids253Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs





Contacts
- Aya BOUAZZA : eyabouazzaaa@gmail.com
- Nassima CHERNAI : Nassimachernai@yahoo.fr
- Vincent KONYO : vincentbillkonyo@gmail.com
- Alex MARCHAND : marchand.alex4@gmail.com
- Dinh TRAN QUANG : dinhg@protonmail.com
Citation
Aya BOUAZZA, Nassima CHERNAI, Vincent KONYO, Alex MARCHAND, Dinh TRAN QUANG, Prise en charge des douleurs chroniques par les dispositifs médicaux, Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Projet, Janvier 2025, réf n° IDS253, https://doi.org/10.34746/ids253, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids253/
Résumé
La gestion de la douleur chronique représente un défi majeur en matière de santé publique, tant en France qu'à l'échelle mondiale. En 2023, on estime qu'environ 12 millions d’adultes en France souffrent de douleurs chroniques, dont 70 % ne bénéficient toujours pas d’une prise en charge adéquate [1, 2].
La prise en charge du patient repose sur une approche multidisciplinaire. Elle inclut le diagnostic de la douleur chronique avec les techniques d’imagerie fonctionnelle, l'électromyographie et en complément des échelles d'évaluation. Les approches thérapeutiques pour le soulagement de la douleur chronique comportent notamment la stimulation électrique transcutanée (TENS), ou encore la photobiomodulation (PBM). Enfin, ces affections s’inscrivant dans la durée, la prise en charge inclut logiquement un aspect de suivi à domicile.
Ce mémoire a pour but de mettre en lumière ces dispositifs médicaux utilisés dans la prise en charge de la douleur chronique, leurs principes de fonctionnement, leurs avantages, pour qui et comment ils s’appliquent. Nous espérons ainsi aider les personnes concernées (corps médical, biomédical, patients…) à avoir une meilleure compréhension du panorama de ces solutions.
Abstract
The management of chronic pain represents a major public health challenge, both in France and globally. In 2023, it is estimated that around 12 million adults in France suffer from chronic pain, 70% of which still do not receive adequate care [1, 2].
Patient care is based on a multidisciplinary approach. It includes the diagnosis of chronic pain with functional imaging techniques, electromyography and in addition to rating scales. Management continues with treatment, whose therapeutic approaches for the relief of chronic pain include transcutaneous electrical stimulation (TENS), or photobiomodulation (PBM). Finally, as these conditions are long-term, the treatment logically includes an aspect of home follow-up.
This essay means to showcase these medical devices used in the management of chronic pain, along with how they work, their pros and cons, for whom and how they are used. We aim at helping people interested and involved in the matter (medical, biomedical staff and patients) better understand the scope of these solutions.
Téléchargements


Liste des figures
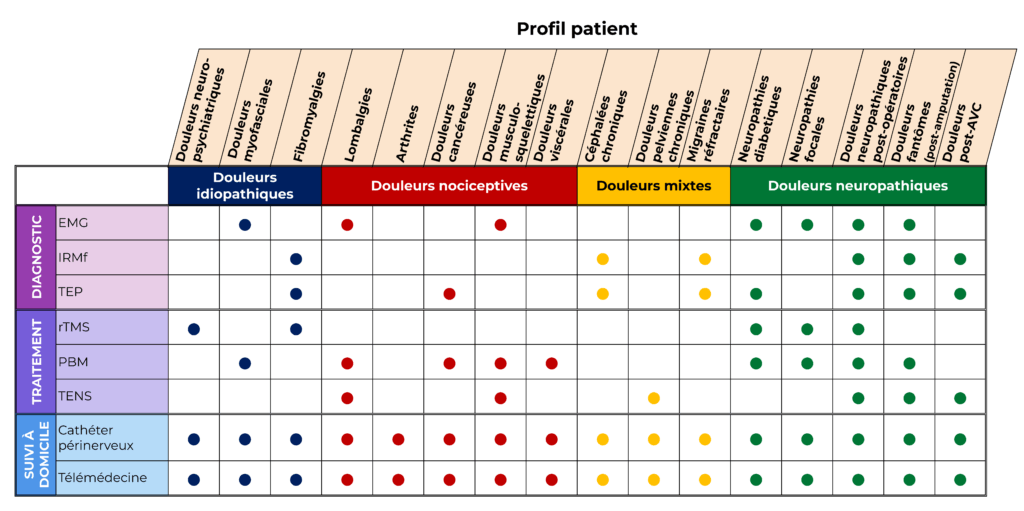
Figure 1 : Liste d'indications en fonction des méthodes
Figure 2 : Tableau non exhaustif présentant les différents types d’échelle d’évaluation de la douleur en fonction de la capacité de communication du patient
Figure 3 : Schéma descriptif de l’électromyographie
Figure 4 : Schéma comparatif des potentiels d’action de l’électromyographie dans 3 cas différents
Figure 5 : Schéma d’une analyse de groupe de patients douloureux chroniques par IRMf en l’absence de traitement par réalité virtuelle (VR) pendant 3,5 minutes par rapport au traitement à la VR pendant 3,5 minutes
Figure 6 : Vue frontale d'un patient de l'étude par scanner, avec les électrodes implantées et les générateurs ;
Figure 7 : Électrostimulateur TENS développé par l’entreprise Verity Medical LTD
Figure 8 : Théorie du Portillon
Figure 9 : Localisation du cortex moteur primaire (en bleu) au sein du cerveau
Figure 10 : Séance de rTMS à l’hôpital Ambroise Paré (Boulogne-Billancourt) et fonctionnement
Figure 11 : Schéma du spectre de lumière utilisé en photobiomodulation
Figure 12 : Mécanisme d'influence de la lumière sur la cellule
Figure 13 : La séance de photomodulation
Figure 14 : Appareil de photobiomodulation Laser-Max de la marque “Laser THOR”
Figure 15 : Bracelet de neuromodulation de Remedee Labs et application
Figure 16 : Image montrant l'exposition de la peau à différentes ondes de fréquence
Figure 17 : Cathéter périnerveux mis en place chez une personne atteinte de douleurs
Figure 18 : Consultation de télémédecine entre l’EHPAD Les Charmilles et le CH de Valenciennes
Abréviations
| Sigle | Signification |
| AINS | Anti-inflammatoire non stéroïdien |
| ARS | Agence Régionale de la Santé |
| AT/MP | accidents du travail et maladies professionnelles |
| CPD | Centre de Prise en charge de la Douleur |
| EMG | Electromyographie |
| EN | Échelle Numérique |
| EVA | Échelle Visuelle Analogique |
| EVS | Échelle Verbale Simple |
| GHPSO | Groupement Hospitalier Public du Sud de l'Oise |
| IASP | Association internationale pour l'étude de la douleur |
| IRMf | Imagerie par résonance magnétique fonctionnelle |
| PBM | Photobiomodulation |
| rTMS | Repetitive Trans-cranial Magnetic Stimulation / Stimulation magnétique trans-cranienne répétitive |
| SDC | Structures de Douleur Chronique |
| SFETD | Société Française d'Étude et de Traitement de la Douleur |
| TENS | Transcutaneous Electrical Nerve Stimulation / Stimulation électrique transcutanée |
| TEP | Tomographie par Émission de Positrons |
| TMS | Troubles musculo-squelettiques |
Introduction
La douleur chronique est un état pathologique qui peut affecter toutes les tranches d’âge, des nouveau-nés aux séniors. Elle est souvent associée à une pathologie sous-jacente, mais peut aussi devenir indépendante de son origine initiale, avec des mécanismes neurologiques complexes en jeu, comme dans le cas de la fibromyalgie. Cet état pathologique entraîne des répercussions significatives sur la qualité de vie physique, psychologique et sociale des patients.
La prise en charge de la douleur chronique inclut un diagnostic précis, un traitement adapté et un suivi à domicile. Parmi les traitements disponibles, les médicaments jouent un rôle essentiel, bien qu'ils présentent des risques potentiels. Les médicaments, tels que les analgésiques, les opioïdes ou les antidépresseurs, sont fréquemment prescrits. Cependant, leur utilisation prolongée peut entraîner des effets secondaires, une dépendance, des complications liées à l’augmentation des doses, et des problèmes de tolérance. Ces risques soulignent la nécessité d'une gestion rigoureuse des traitements médicamenteux.
Dans cette optique, les dispositifs médicaux représentent des solutions complémentaires prometteuses. Pourtant, leur adoption reste limitée, notamment par manque d'information parmi les professionnels de santé et les patients. De plus, le nombre de dispositifs médicaux et la documentation liée est encore aujourd’hui limité. Par conséquent, une meilleure sensibilisation pourrait encourager leur utilisation et ainsi offrir des alternatives adaptées aux besoins spécifiques des patients.
Cela nous conduit à la problématique suivante : « Comment adapter la prise en charge de la douleur chronique grâce à la diversité des dispositifs médicaux ? » L'objectif de ce mémoire est d'informer les médecins —qu’ils soient généralistes,oncologues, rhumatologues— sur les dispositifs existants, leurs champs d’application, ainsi que leurs avantages et inconvénients.
Dans ce but, nous avons décidé de valoriser nos recherches par la création d'un flyer que nous distribuerons aux personnels soignants avec qui nous avons travaillé, par voie électronique et en exemplaires physiques, afin d’informer le plus grand nombre sur les différentes modalités existant sur le marché.
I. La douleur chronique
1. Définition de la douleur chronique
La douleur chronique est une douleur qui persiste au-delà de la période normale de guérison, généralement définie par une durée de plus de trois à six mois. Contrairement à la douleur aiguë, qui est une réaction immédiate à une blessure ou une maladie, la douleur chronique devient une condition pathologique autonome qui affecte considérablement la qualité de vie des patients.
Selon l'Association internationale pour l'étude de la douleur (IASP), la douleur est une expérience sensorielle et émotionnelle désagréable liée à des lésions tissulaires réelles ou potentielles [3, 4]. Cela souligne l'aspect subjectif de la douleur, influencé non seulement par des facteurs physiologiques mais aussi psychologiques.
2. Différents types de douleur chronique
La douleur chronique se manifeste sous plusieurs formes, selon son origine et sa physiopathologie [5] :
- Douleur nociceptive : Résultante de lésions tissulaires réelles, la douleur nociceptive est provoquée par l’activation des nocicepteurs, des récepteurs sensoriels spécialisés. Elle est généralement bien localisée et répond aux traitements anti-inflammatoires. Les exemples incluent l'arthrose et les douleurs post-opératoires.
- Douleur neuropathique : Cette douleur est causée par des lésions ou des dysfonctionnements du système nerveux central ou périphérique. Elle est souvent décrite comme des sensations de brûlure, de fourmillement ou de décharge électrique. Des exemples incluent la neuropathie diabétique ou les douleurs post-zostériennes.
- Douleur mixte : Certaines douleurs combinent des composantes nociceptives et neuropathiques, comme dans le cas de certaines douleurs liées au cancer ou aux lombalgies chroniques.
- Douleur idiopathique : Lorsque la cause de la douleur est inconnue ou mal comprise, on parle de douleur idiopathique, comme dans le cas de la fibromyalgie, où aucun dommage tissulaire évident n’est observable.
3. Épidémiologie de la douleur chronique
En 2023, la douleur chronique touche plus de 12 millions de Français [6]. Environ 30 % des adultes en souffrent, avec une prévalence qui augmente nettement avec l’âge, notamment chez les individus âgés de 50 à 64 ans. Les douleurs neuropathiques concernent près de 7 % des Français, touchant davantage les personnes exerçant des professions manuelles et vivant en milieu rural [7]. Les douleurs les plus fréquentes affectent le dos, le cou, les épaules, les membres, la tête et l'abdomen. Ces douleurs s'accompagnent souvent de troubles psychologiques tels que l'anxiété, la dépression et des troubles du sommeil, altérant ainsi significativement la qualité de vie et de travail des patients. 1 patient sur 2 a une qualité de vie altérée et 60% des patients douloureux chroniques sont moins aptes au travail. Ainsi, 1 patient sur 5 se retrouve sans emploi et 1 patient sur 2 se retrouve en arrêt de travail d’une durée de plus de 4 mois par an [8].
Certaines maladies chroniques sont fortement associées à la douleur chronique, formant un cercle vicieux difficile à rompre. Les troubles musculo-squelettiques (comme les lombalgies et cervicalgies), les affections neurologiques, le diabète et les maladies cardiovasculaires sont des pathologies souvent corrélées à des douleurs persistantes. Par exemple, les douleurs découlant des troubles musculo-squelettiques (TMS) sont parmi les causes les plus fréquentes de consultations dans les structures de prise en charge de la douleur [7]. Les TMS représentent 87% des maladies professionnelles et les maux de dos (lombalgies) représentent 20% des accidents de travail [9].
En 2017, le coût économique direct de ces types de douleur pour les entreprises était d’environ 2 milliards d’euros à travers leurs cotisations accidents du travail et maladies professionnelles (AT/MP) [9].
Pour faire face à cette crise de santé publique, dans les années 80, la France a initié la mise en place d’un réseau de Structures de Douleur Chronique (SDC) [10]. A cet effet, 2 circulaires ont vu le jour dans les années 90 [10]. La circulaire DGS/DH n° 94-3 du 7 janvier 1994 a défini les critères organisationnels pour la prise en charge de la douleur chronique et les objectifs à atteindre. La circulaire DGS/DH n° 98-47 du 4 février 1998, qui visait à identifier et structurer les unités spécialisées dans la lutte contre la douleur chronique. En 2018, On compte environ 273 SDC réparties sur le territoire national, avec un délai d’attente de 3 mois et plus pour une première consultation [11]. Selon les données de l’Agence Régionale de la Santé, 5000 patients sont reçus par centre et par an [11]. Ces structures regroupent des centres de prise en charge de la douleur (CPD) et des consultations hospitalières spécialisées.
4. Impact de la douleur chronique sur la vie quotidienne
La douleur chronique a des répercussions profondes sur de nombreux aspects de la vie quotidienne. Le bien-être mental est autant affecté que le bien-être physique. Voici une liste non exhaustive de quelques impacts :
- Perte d'autonomie : La douleur chronique rend les tâches quotidiennes difficiles à réaliser, telles que la marche, le ménage et toute activité professionnelle. Cette limitation favorise la sédentarité, ce qui aggrave la douleur et induit d'autres problèmes de santé.
- Exclusion sociale : La douleur chronique peut également nuire à la capacité de participer à des activités familiales et à des événements sociaux, ce qui affecte la santé mentale.
- Perturbations du sommeil : Les personnes souffrant de douleurs chroniques ont souvent du mal à dormir. La douleur les réveille fréquemment ou les empêche de s'endormir.
- Isolement du monde professionnel : L'incapacité partielle ou totale de travailler, ainsi que les absences répétées, peuvent nuire à la carrière d'une personne.
5. Histoire et évolution de la prise en charge de la douleur chronique : traitements médicamenteux et leurs limites
La gestion de la douleur a considérablement évolué au fil du temps. Dans l'Antiquité, la douleur était souvent considérée comme une punition divine ou un phénomène mystique, traitée avec des remèdes à base de plantes ou des interventions spirituelles. Au Moyen Âge, malgré une meilleure compréhension des blessures physiques, les traitements restaient rudimentaires (amputations, saignées) [12].
C'est au XIXe siècle que des avancées significatives ont été faites, avec l'introduction de l'anesthésie (éther, chloroforme), révolutionnant la gestion de la douleur aiguë. Toutefois, la douleur chronique était encore mal comprise et souvent ignorée.
Au XXe siècle, l’utilisation des opioïdes pour traiter les douleurs sévères a pris de l’ampleur, mais cette approche a également mis en lumière les défis associés à la dépendance et à la tolérance. Dès la deuxième moitié du siècle, la prise en charge de la douleur chronique a évolué vers une approche plus globale et multidisciplinaire, intégrant non seulement des traitements médicamenteux mais aussi des thérapies physiques, psychologiques et des innovations technologiques, notamment la stimulation nerveuse électrique transcutanée (TENS) et la stimulation magnétique transcrânienne répétitive (rTMS) , ainsi que des approches complémentaires comme l'acupuncture et la thérapie cognitivo-comportementale. C’est dans ce cadre que la gestion de la douleur a commencé à inclure un éventail plus large de stratégies, associant des médicaments et dispositifs médicaux , tels que les neurostimulateurs implantables et les systèmes de radiofréquence, avec un souci croissant d’adaptation du traitement au profils de patients associant dispositifs médicaux et stratégies pharmacologiques [13].
Les traitements médicamenteux actuels incluent principalement les antalgiques (paracétamol, AINS), les opioïdes, les antidépresseurs tricycliques et les anticonvulsivants, diffèrent par leurs mécanismes d’action et leurs indications spécifiques.
- Les antalgiques (paracétamol, AINS) agissent en réduisant l’inflammation et en inhibant les médiateurs chimiques responsables de la douleur. Ils sont surtout efficaces pour les douleurs musculo-squelettiques légères à modérées.
- Les opioïdes (morphine, oxycodone) se lient aux récepteurs opioïdes du système nerveux central pour moduler la perception de la douleur, mais sont réservés aux douleurs sévères en raison des risques élevés de dépendance.
- Les antidépresseurs tricycliques (amitriptyline) et les anticonvulsivants (gabapentine, prégabaline) sont souvent utilisés pour les douleurs neuropathiques, agissant respectivement sur la modulation des neurotransmetteurs et sur la stabilisation des membranes neuronales [14].
Cependant, leur utilisation prolongée présente des limites importantes. Par exemple, selon une étude récente, environ 30 à 50 % des patients sous opioïdes développent une tolérance dans les 6 à 12 mois [15]. De plus, le risque d’accoutumance est préoccupant, avec des taux de dépendance estimés entre 8 et 12 % pour les opioïdes prescrits à long terme [16]. Les effets secondaires, comme la somnolence, les nausées ou la constipation, peuvent également altérer la qualité de vie [17]. Pour minimiser ces risques, une prise en charge multidisciplinaire associant des thérapies non pharmacologiques est souvent recommandée pour limiter ces complications.
Pourtant, en France, avec 12 millions d’adultes touchés par cet état pathologique et 70 % d’entre eux ne bénéficiant toujours pas d'une prise en charge adéquate en 2023 [1, 2], l'exploration de solutions technologiques devient primordiale. La mise en avant des dispositifs médicaux pour la prise en charge de la douleur chronique répond aux limites des traitements médicamenteux traditionnels. Le développement constant de ces technologies offre des perspectives prometteuses pour une prise en charge plus efficace et adaptée de la douleur chronique.
II. Dispositifs médicaux et solutions pour la prise en charge de la douleur chronique
Nous avons opté pour la description des dispositifs médicaux utilisés dans les centres spécialisés de douleur chronique par les professionnels de ces cas. Nous nous sommes intéressés à leurs applications aux douleurs chroniques (comment, pour quel type de douleur chronique et pourquoi), leurs avantages et limites. Ainsi, on pourra distinguer leur adaptation dans la prise en charge des douleurs chroniques. Cette liste non exhaustive des dispositifs médicaux et des différentes thérapies de traitement a été établie grâce à la collaboration avec le centre spécialisé de la douleur chronique du GHPSO Creil-Senlis.
Nous avons établi la liste des méthodes et thérapies mentionnées dans ce mémoire, avec les douleurs pour lesquelles elles sont indiquées (figure 1).
Figure 1 : Liste d'indications en fonction des méthodes (source : Auteurs)
1. Diagnostic de la douleur chronique
Le diagnostic de 1er niveau réalisé par les médecins traitants dans les cabinets médicaux, les médecins de centre hospitalier non spécialiste de la douleur chronique, se fait généralement avec des échelles d’évaluation de la douleur. Pour quantifier l'intensité de la douleur, on utilise plusieurs types d’échelles en fonction du contexte clinique et des caractéristiques du patient (âge, capacité de communication, etc.). La figure 2 ci-dessous présente les deux catégories d’échelles utilisées, en fonction de la capacité de communication du patient.
Figure 2 : Tableau non exhaustif présentant les différents types d’échelle d’évaluation de la douleur en fonction de la capacité de communication du patient
source : auteurs
Ce tableau décrit les outils d’évaluation utilisés actuellement pour quantifier la douleur chronique, leurs profils cibles et les critères de prise en charge [12,13]. Ces échelles d’évaluation sont, aujourd’hui, les bases du diagnostic des douleurs chroniques. Au moins une des échelles est systématiquement utilisée en diagnostic de premiers recours dans tous les établissements de santé et les cabinets médicaux généralistes. Néanmoins, ces échelles présentent des limites. Elles sont influencées par des biais subjectifs liés aux émotions et à la mémoire des patients, ce qui peut entraîner une sous ou sur-évaluation de la douleur. De plus, les scores obtenus ne permettent pas de différencier les types de douleur (neuropathique, nociceptive), et donc l’on ne peut pas détecter l’origine réelle de la douleur afin de prescrire le traitement adéquat. Aussi, l'évaluation ponctuelle ne reflète pas la variabilité des douleurs chroniques, qui peut fluctuer de 3 à 7 points sur une EVA en une journée. Ces limites justifient le recours à des dispositifs médicaux de diagnostic plus précis et objectifs.
En ce qui concerne les dispositifs médicaux actuellement utilisés, il n’en existe pas de spécifique pour l’évaluation de la douleur chronique. Ce sont des dispositifs qui sont couramment utilisés dans le domaine médical, qui ont été adaptés dans ce but. On retrouve entre autres des dispositifs d’imagerie médicale (Imagerie par Résonance Magnétique fonctionnelle, Tomographie par Émission de Positons) et également de l’électromyographie [18,19]. Ces dispositifs servent à réaliser des examens complémentaires en cas de suspicion de douleurs chroniques afin de confirmer le diagnostic de 1er niveau et de déterminer le type de douleur chronique (son origine).
A. L’électromyographie (EMG)
Description
L'électromyographie (EMG) est une technique de diagnostic électrophysiologique utilisée pour évaluer l’activité des muscles et des nerfs qui les contrôlent [22]. Cette méthode repose sur la mesure des signaux électriques générés par les muscles lorsqu'ils se contractent ou lorsqu'ils sont au repos (figure 3).
Figure 3 : Schéma descriptif de l’électromyographie [23]
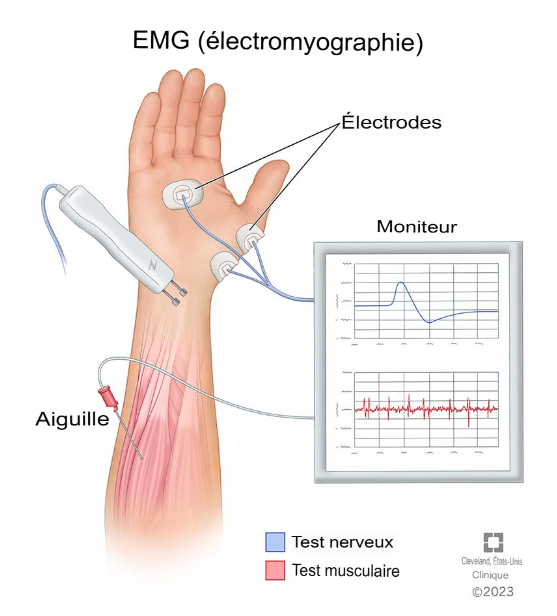
Le test se compose de deux parties [24,25] :
- Étude de conduction nerveuse : De petites impulsions électriques sont appliquées sur la peau au-dessus des nerfs moteurs et sensitifs. Ces impulsions permettent de mesurer la vitesse et l'intensité de la réponse nerveuse. Cette étape aide à localiser et à quantifier les lésions nerveuses.
- Examen à l'aiguille : De fines aiguilles munies d'électrodes sont insérées dans les muscles. Ces électrodes captent l'activité électrique du muscle à l'état de repos et pendant la contraction. Les signaux captés sont affichés sous forme de tracés d'ondes sur un oscilloscope et peuvent révéler des anomalies dans l'activité musculaire, telles que des potentiels de fibrillation, des fasciculations ou des ondes aiguës positives.
Utilisation dans le diagnostic des douleurs chroniques
Cette technique permet de détecter des anomalies en analysant les potentiels d'action musculaires, l'activité électrique spontanée au repos, le recrutement des unités motrices et les potentiels évoqués somesthésiques.
Ces analyses permettent d'identifier si la douleur est due à des lésions nerveuses ou à des dysfonctionnements musculaires [26]. Cette distinction repose sur plusieurs paramètres clés mesurés au cours de l'examen.
En cas de lésion musculaire (myopathie), les potentiels d'action enregistrés par l'EMG sont de faible amplitude et de courte durée (Figure 4), car le nombre de fibres musculaires activées par chaque neurone moteur est réduit. Ces anomalies sont détectées lors de l'examen par aiguille. On observe également des potentiels de fibrillation et des ondes aiguës positives, qui indiquent une dénervation musculaire locale. Le nombre d'unités motrices fonctionnelles est réduit, mais la vitesse de conduction nerveuse reste normale. Par conséquent, le signal de l'EMG montre une diminution de la force du signal, mais le rythme de recrutement des unités motrices est maintenu ou accéléré.
Figure 4 : Schéma comparatif des potentiels d’action de l’électromyographie dans 3 cas différents (patient sain, myopathique et neuropathique) [27]. Amplitude en ordonnées et temps en abscisses.

Dans le cas d'une neuropathie (atteinte nerveuse), la vitesse de conduction nerveuse, mesurée lors de la conduction nerveuse est réduite. Les signaux obtenus montrent une augmentation de l'amplitude des potentiels d’action, des intervalles irréguliers entre les signaux et la présence d’un recrutement retardé des unités motrices. Les potentiels évoqués somesthésiques (PES) sont également affectés, révélant un ralentissement de la conduction nerveuse au niveau des racines nerveuses ou des troncs nerveux affectés. Lorsqu'un nerf périphérique est stimulé, le signal est suivi jusqu'au cortex cérébral. En cas de neuropathie périphérique ou radiculopathie, le signal est soit ralenti, soit absent, ce qui témoigne d'un dysfonctionnement de la conduction sensorielle.
Applications cliniques
L'EMG est particulièrement utile pour le diagnostic de douleurs chroniques d'origine neuromusculaire, telles que les neuropathies périphériques, la radiculopathie (compression d’une racine nerveuse due à une hernie discale ou une arthrose) et la myopathie.
Avantages et limites
En identifiant précisément l'origine des douleurs neuropathiques ou musculaires, il est possible de mieux orienter le traitement (rééducation, chirurgie, etc.) [28]. Contrairement aux questionnaires de douleur, l'EMG fournit des mesures objectives et reproductibles.
Concrètement, l'EMG ne détecte pas les douleurs d'origine centrale (lésions de la moelle épinière ou du cerveau, comme la douleur neuropathique centrale après un AVC) et viscérale (douleur abdominale, pelvienne). Elle est limitée dans le diagnostic des douleurs chroniques fonctionnelles (Ex : fibromyalgie), où les anomalies musculaires sont davantage liées au traitement de l’information dans le cerveau et non à un dysfonctionnement des nerfs périphériques. L'EMG ne permet pas d'évaluer les douleurs issues de l'inflammation ou des lésions des tissus mous (tendons, ligaments, os) qui sont souvent à l'origine de douleurs chroniques [29].
B. Les techniques d’imagerie médicale
La douleur chronique impacte fortement les fonctions cognitives et émotionnelles du système nerveux central. Les techniques d’imagerie médicale reposent sur la caractérisation de ces fonctions et apportent des informations complémentaires dans le diagnostic de la douleur chronique, en permettant une évaluation approfondie des causes sous-jacentes et des mécanismes physiopathologiques [30].
L’Imagerie par Résonance Magnétique fonctionnelle (IRMf)
Description & Utilisation dans le diagnostic des douleurs chroniques
L’imagerie par résonance magnétique fonctionnelle (IRMf) est une technique non invasive utilisée pour étudier l'activité cérébrale en mesurant les variations du flux sanguin [7]. Elle repose sur le principe de l'aimantation nucléaire des atomes d'hydrogène présents dans les tissus du corps humain. En réponse à un champ magnétique puissant, ces atomes s'alignent, et lorsqu'une impulsion radiofréquence est envoyée, ils émettent un signal capté par des capteurs. Dans le contexte de la douleur chronique, l’IRMf détecte les changements de débit sanguin dans des zones spécifiques du cerveau, notamment le cortex somatosensoriel, le thalamus, l'insula et le cortex cingulaire antérieur, toutes impliquées dans la perception de la douleur. Ces zones d'activation permettent de mieux comprendre le circuit de la douleur et d'identifier les altérations potentielles liées à la chronicité de la douleur.
Figure 5 : Schéma d’une analyse de groupe de patients douloureux chroniques par IRMf en l’absence de traitement par réalité virtuelle (VR) pendant 3,5 minutes par rapport au traitement à la VR pendant 3,5 minutes [31]
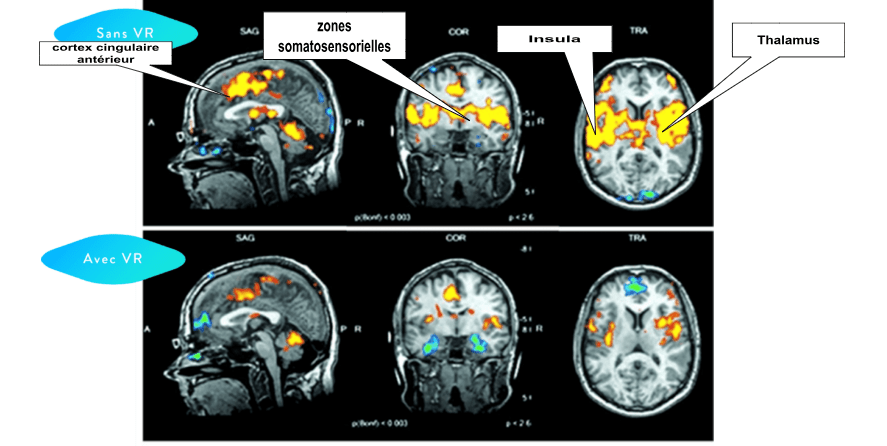
Sans le traitement à la réalité virtuelle, on remarque clairement sur la figure 5, une hyperactivité des zones cérébrales de la douleur : cortex cingulaire antérieur (1ère coupe à gauche), zones somatosensorielles primaires et secondaires (coupe du milieu), insula et thalamus (3ème coupe à droite) .
Le principe de fonctionnement de l'IRMf dans le diagnostic des douleurs chroniques repose sur la méthode BOLD (Blood Oxygen Level Dependent), qui détecte les variations d'oxygénation du sang [21]. Lorsqu'une région cérébrale est activée en réponse à un stimulus douloureux, la demande en oxygène augmente, entraînant une modification du rapport oxyhémoglobine/désoxyhémoglobine. Ces changements sont captés par l'IRMf, permettant de localiser avec précision les régions du cerveau impliquées dans la perception de la douleur. Par exemple, les douleurs neuropathiques peuvent activer de manière anormale des régions du cerveau (aires insulaires et le cortex somatosensoriel secondaire), qui ne sont pas sollicitées chez les sujets sains [21]. L'IRMf est donc utilisée pour mieux comprendre les mécanismes de la douleur chronique, mais aussi pour évaluer l'efficacité des traitements [32] et des interventions psychologiques ou pharmacologiques, en mesurant la réponse cérébrale au fil du temps.
Applications cliniques
L'IRMf permet de suivre l'évolution de la douleur au fil du temps, ce qui est particulièrement pertinent pour les patients atteints de douleurs chroniques post-chirurgicales ou de douleurs persistantes liées à des pathologies neurologiques (comme la sclérose en plaques) et les patients fibromyalgiques. Les études ont montré que, chez les patients atteints de fibromyalgie, certaines régions du cerveau, notamment l'amygdale et le cortex préfrontal, présentent une hyperactivité anormale en réponse à des stimuli douloureux. L’IRMf détecte cette hyperactivité avec une précision de 92 à 94%, sur 37 patients fibromyalgiques étudiés [33].
Au-delà de la clinique, l'IRMf contribue à la recherche en neurosciences sur la douleur chronique [34]. Elle permet de mieux comprendre les mécanismes centraux de la douleur, la plasticité cérébrale et l'hyperactivité des réseaux de douleur. Ces connaissances permettent de développer de nouvelles thérapies ciblées sur des régions cérébrales spécifiques.
Avantages et limites
L'IRMf présente de nombreux avantages dans le diagnostic des douleurs chroniques. Elle permet de visualiser les zones cérébrales impliquées dans la perception de la douleur (cortex somatosensoriel, insula, cortex cingulaire), de suivre l'efficacité des traitements et d'objectiver la douleur, dépassant ainsi les limites des échelles subjectives et de l’EMG (qui s’arrête à l’exploration périphérique des fonctions de la douleur). Elle contribue également à la recherche sur la plasticité cérébrale, ouvrant la voie à des thérapies ciblées. Par exemple, le neurofeedback pour la rééducation post-AVC s’appuie sur le suivi en temps réel de l’activité cérébrale grâce à l’IRMf et l'électroencéphalographie [35].
Cependant, l'IRMf présente des limites, notamment son coût élevé. Un examen d’IRMf coûte entre 300 et 500 euros selon la partie du corps explorée, avec un taux de remboursement de 70% par la sécurité sociale [36]. Elle ne distingue pas la douleur “objective” de la douleur “perçue”, car les mêmes régions peuvent être activées par des émotions. De plus, son accessibilité est limitée, ce qui restreint son usage aux centres de recherche ou de référence.
La Tomographie par émission de positons (TEP)
Description & Utilisation dans le diagnostic des douleurs chroniques
La tomographie par émission de positons (TEP) est une technique d'imagerie médicale avancée permettant d'étudier l'activité métabolique et fonctionnelle du cerveau. Son application au diagnostic des douleurs chroniques, notamment des douleurs neuropathiques, repose sur l'utilisation de traceurs radioactifs (souvent du fluorodésoxyglucose) [21]. Après injection, les traceurs radioactifs se propagent dans tout l'organisme via le système sanguin. Ces molécules se concentrent dans des zones spécifiques d'intérêt. L'isotope radioactif émet des positons, qui interagissent avec les électrons présents dans les tissus environnants. Cette interaction entraîne un phénomène d'annihilation, libérant deux photons d'énergie identique, mais voyageant dans des directions opposées. Ces photons sont ensuite détectés par les capteurs du scanner, permettant de localiser précisément les zones d'activité métabolique anormale [37]. Ces zones sont visualisées sous forme d'images tridimensionnelles où l'intensité du signal reflète l'activation neuronale. Les douleurs chroniques étant associées à une sensibilisation du système nerveux central, la TEP permet de détecter des anomalies métaboliques dans des régions cérébrales clés impliquées dans la perception de la douleur, telles que le cortex préfrontal, le thalamus, l’insula et le cortex cingulaire antérieur [38]. Par exemple, dans les douleurs neuropathiques, des hyperactivations de ces régions ont été rapportées, traduisant l'existence de "boucles de douleur" persistantes au niveau cérébral et des anomalies du système endorphinique [38].
L'utilisation pratique de la TEP dans le diagnostic des douleurs chroniques repose sur des protocoles précis. Après injection du traceur, le patient est allongé dans le scanner sur 60 minutes, pendant que l'acquisition des images se fait sur 25 à 40 minutes [39]. Pour les douleurs neuropathiques, la TEP est souvent combinée à des tâches ou des stimuli sensoriels destinés à "activer" la douleur, ce qui permet d'observer la réponse cérébrale en temps réel. Les résultats de la TEP permettent d'affiner le diagnostic en différenciant, par exemple, une douleur neuropathique d'une douleur nociceptive classique, ce qui est crucial pour choisir le traitement le plus approprié. Cette méthode peut également évaluer l'efficacité d'un traitement, en mesurant la réduction des anomalies métaboliques cérébrales avant et après intervention thérapeutique [38]. La TEP contribue à mieux comprendre et à traiter les douleurs neuropathiques, qui touchent près de 7 % de la population générale en France.
Applications cliniques
Cette technique est particulièrement utile pour explorer les anomalies du métabolisme cérébral associées à la douleur chronique. Par exemple, la TEP permet de visualiser l'activité des récepteurs opioïdes et d'autres neurotransmetteurs dans le cerveau, ce qui est crucial pour comprendre la nature des douleurs neuropathiques et centralisées, comme la fibromyalgie [38].
La TEP est également utilisée dans le cadre de la recherche clinique pour évaluer l'efficacité des traitements pharmacologiques. Elle permet de mesurer les variations de la liaison des récepteurs aux opioïdes avant et après le traitement, fournissant ainsi des indications sur l'efficacité des thérapies. Cette application est essentielle dans les cas de douleurs persistantes post-opératoires ou de douleurs neuropathiques complexes, où la réponse aux traitements classiques est insuffisante.
Avantages et limites
La TEP offre une précision élevée dans la localisation des anomalies cérébrales liées à la douleur chronique, aidant à personnaliser les traitements et à évaluer leur efficacité .
Cependant, la TEP présente également des limites importantes. Son coût élevé (1200 euros) et la nécessité d'utiliser des isotopes radioactifs limitent son accessibilité à certaines structures de santé [39]. Cette contrainte financière est accentuée par le besoin d'un personnel spécialisé pour la manipulation des radio-isotopes et l'interprétation des résultats. Par ailleurs, l'exposition à la radioactivité, bien que contrôlée et faible, constitue une limite à son usage fréquent chez un même patient et également interdit chez certains patients à risque (femmes enceintes et les patients diabétiques) [39].
Après avoir exploré les dispositifs médicaux utilisés pour le diagnostic de la douleur chronique, il convient maintenant de se concentrer sur les solutions thérapeutiques disponibles.
C. La stimulation cérébrale profonde
La stimulation cérébrale profonde (SCP) est une approche thérapeutique à l’étude pour traiter des douleurs chroniques réfractaires. C’est une technique totalement invasive puisque des électrodes sont implantées au niveau du cortex.
Une étude récente publiée en mai 2023, intitulée « First-in-human prediction of chronic pain state using intracranial neural biomarkers », explore une nouvelle application concernant cette technologie : elle pourrait quantifier en temps réel l’intensité de la douleur chronique en étant couplée à des outils avancés de machine learning. Le machine learning est une sous-discipline de l’intelligence artificielle permettant aux algorithmes utilisés d’apprendre à partir de données.
Méthodologie
Quatre participants souffrant de douleurs neuropathiques chroniques réfractaires ont été équipés d’électrodes intracrâniennes bidirectionnelles implantées dans le cortex antérieur cingulaire (ACC) et le cortex orbitofrontal (OFC).
Ces deux régions sont liées aux processus émotionnels et cognitifs de la douleur : l'ACC, bien étudié pour son rôle dans la modulation de la douleur, et l'OFC, moins exploré, mais stratégiquement connecté à d’autres réseaux de la douleur comme l’amygdale
Figure 6 : a = Vue frontale d'un patient de l'étude par scanner, avec les électrodes implantées et les générateurs ;
b = Vue frontale et vue sagittale représentant la localisation des électrodes et exemple d’enregistrement provenant de l’ACC (bleu) et de l’OFC (jaune) [40]
Avant de procéder à l'intervention chirurgicale, une sélection rigoureuse des patients est essentielle pour garantir le succès de l’implantation. Tous les patients ne sont pas éligibles pour une chirurgie par SCP. La décision est prise de manière collaborative par une équipe pluridisciplinaire composée de neurologues, de neurochirurgiens, de neuropsychologues et de psychiatres.
Grâce à l’implantation de ces électrodes, les chercheurs ont collecté des données électrophysiologiques sous forme de potentiels électriques locaux (local field potentials) visibles dans la Figure 6 b , sur des périodes allant de trois à six mois. Les participants ont, pour leur part, fourni des évaluations de leur douleur ressentie à l’aide d’outils standard comme ceux présentés dans la Figure 2 (Echelle Numérique, EVA, EVS).
Ces données recueillies ont été analysées à l’aide d’algorithmes de machine learning.
Résultats
Les résultats montrent que les modèles de machine learning utilisés dans cette étude peuvent estimer de manière fiable les états de douleur chronique lorsque les scores sont classés en catégories (par exemple, douleur élevée vs faible). Cependant, ces modèles se sont avérés moins précis pour évaluer des scores de douleur exacts.
Limites
Malgré des résultats prometteurs, cette étude présente différentes limites.
L'échantillon était très restreint (quatre participants), ce qui empêche de généraliser des conclusions. De plus, les modèles de machine learning pouvaient détecter d’autres signaux comme ceux liés à l’éveil ou à l’attention, qui sont fortement corrélées aux scores de douleur rapportés.
Cette étude apporte de nouvelles perspectives dans la compréhension de la douleur chronique et le développement de traitements personnalisés. Les systèmes de SCP à boucle fermée pourraient offrir une meilleure gestion de la douleur. Un système à boucle fermée adapte sa stimulation en fonction des signaux cérébraux mesurés en temps réel, permettant ainsi de moduler directement l’activité cérébrale.
Cependant, des études à plus grande échelle et plus robustes sont essentielles pour valider ces résultats [40].
2. Les dispositifs médicaux pour le traitement
Nous avons décidé de vous présenter ces dispositifs médicaux par chronologie de commercialisation.
A. La stimulation électrique transcutanée (TENS)
La TENS (Transcutaneous Electrical Nerve Stimulation) est une technique non invasive qui utilise un appareil électrique portable (figure 7) pour soulager la douleur <[41].
Grâce à des impulsions électriques appliquées sur des points spécifiques du corps, elle peut atténuer certaines douleurs chroniques et améliorer le confort des patients [42].
Cette approche repose sur deux mécanismes d’action principaux : le contrôle du portillon (Gate Control) et le mécanisme endorphinique [43]. Les premiers dispositifs TENS ont été mis sur le marché à partir des années 1970, après des recherches pionnières dans le domaine de la gestion de la douleur.
Figure 7 : É Électrostimulateur TENS développé par l’entreprise Verity Medical LTD [44].
Principes de la TENS : Deux mécanismes d'action
- Contrôle du portillon (Gate Control)
Développée à partir de la théorie du contrôle du portillon, la TENS permet de moduler la perception de la douleur en agissant sur la moelle épinière. Les impulsions électriques stimulent les fibres nerveuses cutanées, créant un « portillon » qui bloque partiellement les signaux douloureux avant qu'ils n’atteignent le cerveau (figure 8). Cette modulation immédiate diminue la sensation de douleur ressentie par le patient [45].
Figure 8 : Théorie du Portillon[46]
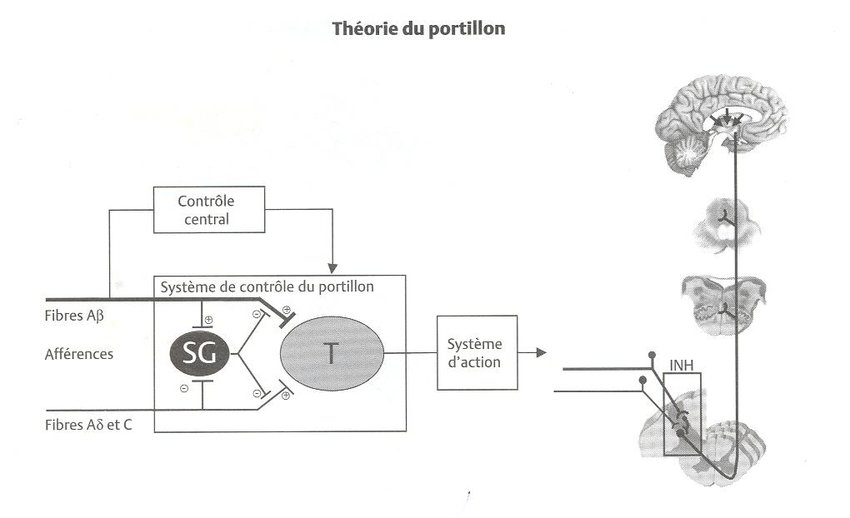
- Mécanisme endorphinique
Le mécanisme endorphinique de la TENS procure un effet analgésique durable, persistant de 2 à 12 heures après l'arrêt de la stimulation [47]. Cet effet, qui s’installe généralement après environ 30 minutes, complète l'action immédiate du mécanisme du Gate Control. Son impact est particulièrement notable dans la réduction de la consommation d'antalgiques, atteignant jusqu'à 93 % pour les médicaments. Les profils des patients concernés par cette efficacité incluent principalement ceux souffrant de douleurs chroniques musculo-squelettiques ou neuropathiques, ainsi que ceux ayant une réponse limitée ou des contre-indications aux traitements médicamenteux traditionnels.
En stimulant la production d'endorphines, des substances analgésiques naturelles, la TENS agit sur l'ensemble de l'organisme. Bien que certaines études, comme celles sur le Patch URGO, rapportent une diminution rapide de la douleur, la variabilité interindividuelle et l'absence de consensus dans les revues systématiques mettent en évidence le besoin de recherches supplémentaires pour mieux évaluer son efficacité à long terme [48].
Aspects pratiques d’utilisation
La TENS est relativement simple à utiliser, avec des séances généralement courtes, variant de 20 à 30 minutes, et pouvant être répétées plusieurs fois par jour. L’intensité du courant est ajustée en fonction de la tolérance individuelle du patient, garantissant ainsi un confort optimal. Ce réglage doit être effectué sous la supervision d’un professionnel de santé qualifié, tel qu'un médecin, un physiothérapeute ou un infirmier en pratique avancée, selon le cadre des soins et les ressources disponibles. L'objectif est d'assurer une utilisation efficace tout en minimisant l'inconfort. De plus, la portabilité de l'appareil permet aux patients de l'intégrer facilement dans leur routine quotidienne, favorisant ainsi une gestion autonome et pratique de la douleur [49].
Indications de la TENS
La Haute Autorité de Santé (HAS) recommande la TENS pour différents types de douleurs chroniques [49], notamment :
Douleurs musculo-squelettiques :
- Lombalgies et lombosciatalgies
- Douleurs consécutives aux syndromes canalaires
Syndrome régional douloureux complexe :
- Douleurs neuropathiques
- Neuropathies diabétiques
- Douleurs post-zostériennes
- Douleurs chroniques postopératoires
Autres indications :
- Fibromyalgie
- Douleurs chroniques réfractaires aux traitements médicamenteux conventionnels
La TENS peut être utilisée en première intention ou en cas d’échec avéré des traitements médicamenteux, selon la situation clinique spécifique.
À l'international, les indications sont similaires, mais certains pays incluent des recommandations supplémentaires :
- Douleurs arthritiques : Plusieurs pays recommandent la TENS pour soulager les douleurs liées à l'arthrite, notamment l'arthrose du genou [50].
- Douleurs pelviennes chroniques : Certaines recommandations internationales incluent l'utilisation de la TENS pour les douleurs pelviennes chroniques [49].
- Douleurs post-opératoires : La TENS est de plus en plus recommandée comme complément aux analgésiques pour la gestion des douleurs post-opératoires.
Contre-indications de la TENS a continue les correction a partir de la
Certaines situations spécifiques nécessitent des précautions ou interdisent l’usage de la TENS :
- Stimulateurs cardiaques : La TENS est strictement contre-indiquée chez les patients portant un stimulateur cardiaque, car cela peut entraîner des interférences dangereuses.
- Troubles cardiaques graves : Les patients atteints de troubles graves tels qu'une insuffisance cardiaque avancée, des arythmies instables ou un syndrome coronarien aigu doivent éviter cette méthode en raison des risques accrus de complications.
- Femmes enceintes : L'utilisation de la TENS est déconseillée, surtout au cours du premier trimestre de grossesse, car son impact potentiel sur le développement embryonnaire reste insuffisamment étudié.
- Zones spécifiques du corps :La TENS ne doit pas être appliquée sur la tête, le cou ou directement sur la région cardiaque pour éviter des complications [51].
Avantages et inconvénients
Avantages
La TENS est une méthode non invasive qui offre un soulagement de la douleur, avec des effets potentiellement immédiats et prolongés. Elle est conçue pour être utilisée de manière autonome après une formation initiale, généralement composée de 1 à 2 séances avec un professionnel de santé. Cette formation permet au patient d'apprendre à positionner correctement les électrodes et à ajuster l'appareil selon ses besoins spécifiques. Une fois la formation terminée, l'utilisation peut être poursuivie à domicile, avec une supervision médicale périodique si nécessaire. En outre, la TENS pourrait réduire les besoins en traitements médicamenteux pour certains patients, offrant ainsi une alternative moins invasive aux médicaments classiques [50].
Les patients rapportent souvent une satisfaction élevée avec cette technique, notamment pour les douleurs chroniques musculo-squelettiques ou neuropathiques [41]. Les essais cliniques ont montré que, dans certains cas, la TENS entraîne une réduction significative de la douleur, mesurée par des scores comme l'EVA. En milieu de soins courants, les patients apprécient particulièrement son caractère non invasif, sa facilité d’utilisation et l’absence d’effets secondaires graves.
Limites
Cependant, bien que la TENS soit généralement bien tolérée, son efficacité à long terme demeure discutable pour certaines douleurs chroniques, notamment les douleurs neuropathiques complexes ou centrales, comme celles liées à la fibromyalgie, aux douleurs post-AVC ou aux lésions de la moelle épinière. Les résultats peuvent varier considérablement d'un patient à l'autre, ce qui rend son efficacité incertaine dans ces cas. De plus, l'utilisation de la TENS peut entraîner des effets secondaires, notamment des problèmes cutanés liés aux électrodes. Environ 46 % des patients peuvent rencontrer des irritations cutanées telles que des rougeurs, des démangeaisons, voire des brûlures superficielles dans de rares cas [50].
Les revues systématiques, comme celles de Cochrane, soulignent la nécessité d’études supplémentaires de haute qualité pour confirmer définitivement l’efficacité de la TENS dans différents contextes de douleur chronique. Ces observations confirment que, bien que la TENS puisse être un complément précieux aux traitements classiques, elle ne constitue pas une solution universelle et doit être adaptée aux besoins individuels des patients [48].
Comparaison avec d'autres techniques de gestion de la douleur
La TENS se distingue par sa capacité à offrir un soulagement immédiat. Comparée à des méthodes telles que l'acupuncture ou la kinésithérapie, qui nécessitent souvent des consultations en clinique, la TENS permet une utilisation à domicile, ce qui est un atout majeur pour les patients chroniques. Cependant, contrairement à des méthodes comme la physiothérapie, qui visent à corriger les causes sous-jacentes de la douleur (en travaillant sur les muscles, les articulations et les structures corporelles pour rétablir la fonction), la TENS se concentre principalement sur la gestion des symptômes en modifiant la perception de la douleur, sans traiter directement les causes fondamentales.
B. La stimulation magnétique transcrânienne répétitive
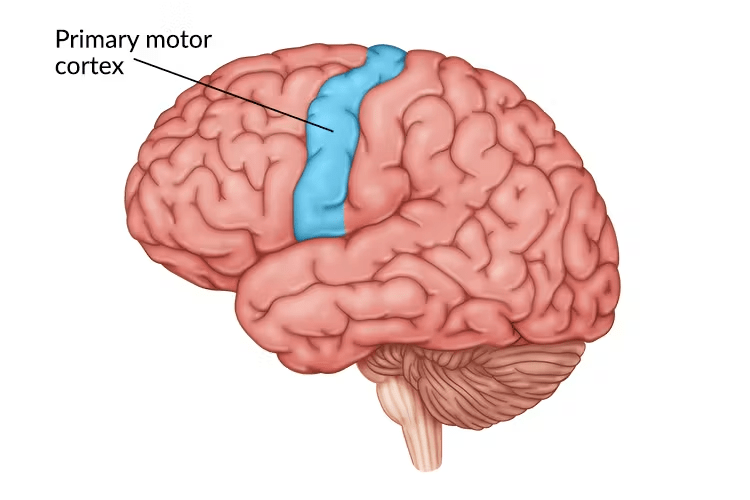
La rTMS (stimulation magnétique transcrânienne répétitive) est une technique non invasive utilisée dans certains cas pour traiter la douleur chronique. En France, elle est mise en œuvre depuis 2014 en soins courants dans les centres anti-douleur [52]. En général, le traitement vise le cortex moteur primaire (figure 9), notamment la partie correspondant à la zone du corps où la douleur est ressentie. Cette stimulation permet de rééquilibrer les circuits neuronaux perturbés qui amplifient la douleur.
Figure 9 : Localisation du cortex moteur primaire (en bleu) au sein du cerveau [53]
Principe de fonctionnement
Elle fonctionne en utilisant des impulsions magnétiques via une bobine de stimulation (figure 10) pour stimuler des zones spécifiques du cerveau, en modulant l'activité des neurones impliqués dans la perception de la douleur. La rTMS agit aussi sur les neurotransmetteurs. Elle peut, par exemple, augmenter la production de sérotonine et d’endorphines, qui jouent un rôle essentiel dans le contrôle de la douleur. Par ailleurs, elle réduit l’hyperactivité de certaines régions cérébrales souvent impliquées dans la sensibilisation à la douleur.Retour des patients et satisfaction
Indications de la rTMS
Ces effets combinés expliquent son intérêt pour des pathologies complexes comme les douleurs neuropathiques, la fibromyalgie, et montre particulièrement son efficacité pour les douleurs liées à des pathologies neuropsychiatriques [54].
Avantages et limites
Figure 10 : Séance de rTMS à l’hôpital Ambroise Paré (Boulogne-Billancourt) et fonctionnement [55].

Les séances de rTMS sont relativement courtes, environ 20 à 30 minutes, et se répètent sur plusieurs jours ou semaines selon les besoins du patient [52][55]. Le protocole est personnalisé, avec une intensité et une fréquence d’impulsions adaptées à chaque cas.
L’un des principaux avantages de la rTMS est qu’elle est non invasive, sans effets secondaires lourds, ce qui en fait une option intéressante lorsque les traitements médicamenteux ne suffisent pas. Selon plusieurs études, elle montre son efficacité sur tout type de douleur [56].
Cette technique a été adoptée par de nombreux centres, comme à l’APHP, aux hôpitaux Ambroise Paré, Louis Mourier, ou encore de la Pitié Salpêtrière [55], ou au CHU de Nantes [57].
C. La photobiomodulation
La photobiomodulation (PBM) est une méthode non invasive, indolore et sans production de chaleur sur la peau. Elle utilise de la lumière rouge (entre 630 et 760 nm) et proche infrarouge (entre 760 et 1400 nm) émise par différentes sources lumineuses (figure 11). Cette technique s’inscrit dans une approche plurimodale de prise en charge de la douleur chronique.
Figure 11 : Schéma du spectre de lumière utilisé en photobiomodulation [58]
Le mécanisme de fonctionnement sur les cellules
La photobiomodulation (PBM), également appelée thérapie par la lumière, agit à plusieurs niveaux. Elle stimule la cicatrisation en favorisant la production de collagène, réduit l'inflammation en limitant la production de molécules pro-inflammatoires et, en atténuant l'inflammation ainsi que le stress oxydatif.
Les cellules de notre corps contiennent des structures appelées mitochondries, qui jouent le rôle de centrales énergétiques en produisant l'énergie nécessaire au bon fonctionnement cellulaire. Cependant, cette production peut être perturbée, notamment en cas d'inflammation. La lumière, en revanche, a la capacité de stimuler l’activité des mitochondries, améliorant ainsi le fonctionnement cellulaire et la production d’énergie [59].
La lumière pénètre dans les mitochondries des cellules et y est absorbée, ce qui stimule l'activité mitochondriale [60] (figure 12).
Figure 12 : Mécanisme d'influence de la lumière sur la cellule [60].
Indications de la Photobiomodulation
La photobiomodulation, initialement employée pour traiter les douleurs oncologiques associées aux traitements de chimiothérapie ou de radiothérapie, s’est imposée comme une méthode efficace, notamment dans la prévention des mucites, ces inflammations douloureuses des muqueuses buccales. Ses applications en oncologie se sont élargies à de nombreuses affections liées aux traitements anticancéreux. Elle contribue à soulager les inflammations cutanées, à atténuer les neuropathies périphériques induites, les douleurs musculaires chroniques, les atteintes de la mâchoire, ou encore les troubles fonctionnels comme le trismus ou la dysphonie.
Au-delà du domaine oncologique, cette technique s’avère également utile dans la prise en charge des douleurs chroniques. Elle offre une intervention efficace sur les douleurs post-opératoires, les neuropathies variées ou les douleurs persistantes associées à des pathologies telles que le diabète ou les lésions nerveuses. Grâce à ses bienfaits et à son caractère non invasif, elle constitue une solution thérapeutique prometteuse et polyvalente.
Comment se déroule une séance de photobiomodulation
En France, peu de centres antidouleur utilisent cette technique. Cependant, certains établissements, tels que le centre antidouleur de Valenciennes, dirigé par le docteur Antoine Lemaire, figurent parmi les pionniers dans ce domaine, aux côtés du Centre de Haute Énergie de Nice, sous la direction du Professeur Bensadoun, l’un des précurseurs de cette approche. Ces initiatives sont également soutenues par la société savante WALT (World Association of Laser Therapy) qui est le principal organisme mondial pour la promotion de la recherche, de l'éducation et des applications cliniques dans le domaine de la photobiomodulation.
Dans le cadre de nos recherches, nous avons rencontré le Docteur Gwladys Fontaine, responsable de la structure douleur chronique du GHPSO à l'hôpital de Senlis, où la photobiomodulation est mise en œuvre dans le service antidouleur depuis octobre 2024.
En oncologie, la photobiomodulation est utilisée pour traiter certains effets secondaires liés à la chimiothérapie et à la radiothérapie. Ce domaine d'application est en plein essor grâce aux découvertes récentes sur ses mécanismes d’action au niveau cellulaire et aux avancées technologiques (nouvelles sondes).
La séance consiste en une exposition à la lumière, d'une durée de 20 à 30 minutes, à l’aide d’une sonde appliquée sur la zone ciblée (figure 13). L’algologue évalue les paramètres essentiels, notamment la longueur d’onde, le mode d’émission (continu ou pulsé), ainsi que la densité énergétique en joules par centimètre carré. Il ajuste également l'angle et la durée d'exposition, sélectionne la sonde appropriée et détermine le nombre de séances nécessaires en fonction de l'intensité, de la profondeur et de la cause de la douleur.
Figure 13 : La séance de photomodulation [61]
Les séances de photobiomodulation sont réalisées par des infirmiers spécialisés dans la gestion de la douleur, formés à l'utilisation de cette technique. Toutes les interventions respectent les exigences de qualité et de sécurité définies par le décret du 27 décembre 2019, qui régit les protocoles de coopération entre professionnels de santé [62].
L'Hôpital de Senlis est équipé du Laser-Max, doté de sondes variées adaptées aux caractéristiques spécifiques des différentes zones à traiter (Figure14). Cet équipement permet une prise en charge précise et personnalisée des patients, optimisant ainsi l'efficacité des protocoles thérapeutiques.
Figure 14 : Appareil de photobiomodulation Laser-Max de la marque “Laser THOR” [63]
Retour des patients et satisfaction
Bien que récente en France pour le traitement de la douleur chronique, cette méthode manque encore de recul et de données précises pour en garantir pleinement la fiabilité. Cependant, son efficacité est largement reconnue dans la prévention et le traitement de la mucite orale chez les adultes.
Une méta-analyse de six essais contrôlés randomisés, regroupant 398 participants provenant de quatre pays (Brésil, Italie, Belgique et France), a démontré que la photobiomodulation réduit significativement la gravité de la mucite orale induite par la chimiothérapie, comparée à une irradiation fictive [64]. Parmi les 36 patients français inclus, le taux de succès thérapeutique chez ceux présentant des lésions existantes était de 83 %, ce qui était significativement supérieur au taux de succès obtenu chez les patients traités par placebo (11 %). De plus, le délai de développement de la mucosite de grade 3 était significativement plus court chez les patients traités par placebo (p < 0,001). Ces résultats renforcent l'efficacité de la PBM comme approche thérapeutique pour gérer la mucite orale [64].
Compte tenu de l'efficacité de la photobiomodulation sur la mucite, cette méthode commence à être utilisée pour traiter d'autres douleurs chroniques non oncologiques. Le Dr Fontaine, responsable de la structure douleur chronique du GHPSO à Senlis, rapporte un taux de succès de 80 % à 90 % après avoir traité 20 patients depuis le 6 octobre 2024. Parmi ces patients, la majorité ont constaté une diminution notable, voire une disparition complète de leurs symptômes. Les résultats sont particulièrement probants pour les douleurs neuropathiques et inflammatoires. Par ailleurs, une prise en charge précoce améliore encore davantage les résultats.
Avantages et limite de la photobiomodulation
La photobiomodulation présente de nombreux avantages pour le traitement de la douleur. Cette technique non invasive est douce, ne nécessite pas d’intervention chirurgicale et engendre peu d’effets secondaires significatifs. Elle procure un soulagement rapide et durable, pouvant être immédiat et prolongé selon les cas. De plus, elle contribue à réduire de manière significative la dépendance aux traitements médicamenteux, limitant ainsi les effets secondaires liés à leur utilisation.
Cependant, la méthode comporte également certaines limites. Elle est déconseillée pour les patients épileptiques en raison du risque de déclenchement de crises provoqué par une exposition à la lumière sur le visage. Par précaution, elle n’est pas recommandée aux femmes enceintes, faute de données fiables sur ses effets durant la grossesse. Elle est également contre-indiquée pour les patients atteints de cancers actifs ou récents, en raison du risque potentiel de stimulation des cellules cancéreuses. Enfin, les résultats peuvent varier selon les individus, en fonction de la nature de la douleur traitée, ce qui peut influencer l’efficacité perçue de la méthode.
D. Réalité virtuelle
La réalité virtuelle, autrefois associée principalement aux jeux vidéo, est aujourd’hui un outil innovant utilisé dans le domaine médical pour soulager la douleur. Elle agit en captivant l’attention des patients à travers des expériences immersives, ce qui diminue la perception de la douleur en modifiant le traitement des signaux douloureux par le cerveau.
Son efficacité est confirmée par de nombreuses études. Une étude portant sur plus de 1000 patients souffrant de douleurs chroniques lombaires a montré que la thérapie en réalité virtuelle basée sur le développement de compétences (VR Skills-Based Therapy) réduisait significativement l’intensité de la douleur et son impact sur la vie quotidienne [65]. Cette approche multimodale combine des techniques validées scientifiquement, comme la respiration diaphragmatique, le biofeedback, la régulation des émotions et des pensées, la pleine conscience, et l’éducation à la gestion de la douleur, dans un programme thérapeutique structuré de 56 séances. Après 12 mois de traitement à domicile, plus de 50 % des participants ont constaté une amélioration d’au moins deux points sur l’échelle de la douleur, des résultats nettement supérieurs à ceux obtenus avec un placebo.
La réalité virtuelle trouve également sa place dans divers contextes médicaux, tels que les soins pédiatriques, dentaires, gynécologiques ou post-opératoires. Les casques de réalité virtuelle offrent des scénarios interactifs combinant des éléments visuels, sonores et narratifs. Ces expériences immersives peuvent aussi intégrer des approches complémentaires comme la musicothérapie, renforçant ainsi leur pouvoir apaisant.
E. Neuromodulation par ondes millimétriques
La start-up française Remedee Labs a conçu, après plusieurs années de recherche scientifique, le premier bracelet de neuromodulation par ondes millimétriques visant à stimuler la production d’endorphines (figure 15). Ce dispositif médical a reçu son marquage CE en 2024 pour le traitement de la fibromyalgie. Bien que cette certification ne couvre que la fibromyalgie, une étude clinique menée sur des patients atteints d'arthrose a démontré l’efficacité de la neuromodulation par ondes millimétriques dans la gestion des douleurs chroniques liées à cette pathologie [66].
Figure 15 : Bracelet de neuromodulation de Remedee Labs et application

L’efficacité de cette technologie pour les personnes souffrantes d’arthrose périphérique (cheville, genou, hanche, épaule, coude, doigts) a été confirmée par l’étude FIBREPIK, menée par le CHU de Grenoble Alpes et incluant près de 60 patients. Ces derniers ont rapporté une réduction de la douleur, de la fatigue, de l’anxiété et de la dépression, ainsi qu'une amélioration notable de la qualité du sommeil.
Principe de fonctionnement
L’utilisation thérapeutique des Ondes Millimétriques (OMM) remonte aux années 1970 dans les pays du bloc de l’Est. Les ondes millimétriques (OMM) correspondent aux rayonnements électromagnétiques de fréquences comprises entre 30 et 100 GHz.
Elles étaient alors employées pour traiter diverses pathologies, comme les ulcères digestifs, les neuropathies diabétiques, les infarctus du myocarde ou les arthropathies inflammatoires, avec une prédominance pour leur usage antalgique.
Ce n’est que récemment qu’on a identifié des mécanismes liés à une stimulation périphérique locale déclenchant une réponse centrale via le système opioïde endogène, impliquant également d’autres neuromédiateurs (dopamine) et le système nerveux autonome (activation parasympathique). Ces traitements non toxiques pourraient ainsi être envisagés dans la prise en charge des douleurs nociplastiques/nociceptives [67].
Phase d'interaction biophysique
Lorsqu’on expose la peau à ces ondes, celles-ci pénètrent uniquement la couche superficielle, jusqu’à une profondeur de 0,3 à 0,5 mm. En effet, plus la fréquence des ondes est élevée, plus leur capacité de pénétration dans les tissus diminue (figure 16). Ainsi, les OMM déposent leur énergie au niveau des terminaisons nerveuses situées juste sous la surface de la peau. Cette absorption d'énergie déclenche une stimulation des nerfs périphériques, sans pour autant provoquer de lésion tissulaire, créant ainsi une réponse neuromodulatrice localisée.
Figure 16 : Image montrant l'exposition de la peau à différentes ondes de fréquence (a) inférieure à 30 GHz, (b) 61,2 GHz, (c) supérieure à 300 GHz. Les flèches violettes représentent l’absorption d’énergie par la peau. [67]
Deuxième phase de réponse « Physiologique »
Cette augmentation des stimulations périphériques déclenche une réponse au niveau du système nerveux central, en favorisant la production d’opioïdes endogènes, principalement sous forme d’endorphines.
'effet de neuromodulation des ondes millimétriques, qui agit principalement sur le système inhibiteur descendant via le système opioïde endogène, mais aussi sur les systèmes dopaminergique et sérotoninergique, présente un intérêt évident pour le traitement des douleurs nociceptives [67].
Avantages par rapport à la TENS
Ce dispositif présente plusieurs avantages par rapport à la TENS : il est facile à utiliser, portable, discret (ressemblant à une montre) et indolore, pouvant être porté quotidiennement sans interruption. Contrairement à la TENS, qui utilise des impulsions électriques, les ondes millimétriques stimulent la production d’endorphines sans électrochocs, offrant ainsi un effet analgésique prolongé et mieux toléré, sans effets secondaires connus. Cependant, ce bracelet est uniquement utilisé pour traiter les douleurs liées à la fibromyalgie. Avec ce dernier, Remedee Labs propose également une prise en charge personnalisée, incluant un suivi à distance par des coachs et des services digitaux accessibles 24/7.
3. Dispositifs pour le suivi à domicile
La douleur chronique nécessite une prise en charge dans la durée, souvent en dehors de toute hospitalisation et donc à domicile. Alors que les traitements médicamenteux sont majoritaires dans le soulagement de la douleur chronique à domicile, certains dispositifs médicaux aident à la prise en charge de populations plus fragiles, telles que les personnes âgées ou les patients à la douleur récalcitrante.
A. Le cathéter périnerveux
Le cathéter périnerveux représente une avancée significative dans la prise en charge de la douleur chronique, notamment chez les personnes âgées. Ce dispositif permet l'administration prolongée d'anesthésiques locaux directement au niveau des nerfs, offrant une alternative efficace pour les patients souffrant de douleurs rebelles [68]. Son utilisation à domicile présente l'avantage de réduire les interactions médicamenteuses, fréquentes chez cette population souvent polymédiquée.
Cependant, la mise en œuvre de cette méthode nécessite une organisation rigoureuse. Elle repose sur la collaboration entre un prestataire de santé, des infirmières libérales formées, voire des équipes d’hospitalisation à domicile. Un retour d’information régulier vers le médecin responsable est essentiel pour ajuster le traitement et garantir la sécurité du patient.
Figure 17 : Cathéter périnerveux mis en place chez une personne atteinte de douleurs [69].
Malgré ses bénéfices, cette approche se heurte à plusieurs obstacles. La disparition progressive des réseaux de coordination des soins a complexifié l'accès à ce type de prise en charge. De plus, la nomenclature actuelle des actes infirmiers ne couvre que les prises en charge de courte durée, limitant ainsi la diffusion de cette solution pour les traitements prolongés. Des ajustements sont nécessaires, notamment dans le code de santé publique et les autorisations de mise sur le marché (AMM) des anesthésiques locaux, afin de rendre cette option plus accessible et viable pour un plus grand nombre de patients.
B. La télémédecine
A la suite de la crise du Covid 19, durant laquelle recevoir en consultation physique les patients était très limité, les projecteurs se sont portés sur la télémédecine, souvent comme solution de recours de dernière minute. Les solutions concrètes, mieux définies et encadrées se sont par la suite développées, pour aujourd’hui devenir un véritable outil dans la prise en charge de tout patient.
La télémédecine permet le suivi d’un patient à distance, mais aussi les primo consultations, dès lors que les informations médicales ont été fournies et le dossier médical transmis de façon structurée et sécurisée. La télémédecine ne substitue pas les consultations traditionnelles, mais est un outil qui complète la prise en charge de patients atteints de douleurs chronique, et permet de répondre à des besoins réels de patients et soignants : téléassistance en EHPAD, téléexpertise avec un médecin spécialisé en douleur : la télémédecine offre un vaste potentiel qui permet donc de déporter l’expertise en douleurs chroniques au plus proche du patient. La SFETD a pour cela mis à disposition des professionnels de santé une boîte à outils avec toutes les informations nécessaires pour mettre en place des solutions de télémédecine [70].
Un projet de télémédecine nommé Télépallia, est mené par une EMSP (Equipe Mobile de Soins Palliatifs) de Valenciennes depuis 2015, en réponse à une observation : la difficulté de répondre aux demandes croissantes d'avis spécialisés en milieu extra-hospitalier, en sus des demandes intra-hospitalières, avec des moyens humains et financiers constants sur un territoire étendu géographiquement. Ce projet repose sur la mise en place de téléconsultations et télé-expertises en soins palliatifs dans des EHPAD pilotes de la région des Hauts de France, pour apporter des éléments dans la prise en charge du patient, revoir les prescriptions, et limiter les hospitalisations des patients. Après plusieurs années de mise en œuvre, selon les équipes soignantes, cela a permis une amélioration de leurs pratiques dans le domaine des soins palliatifs et de la fin de vie.
Figure 18 : Consultation de télémédecine entre l’EHPAD Les Charmilles et le CH de Valenciennes
Les téléconsultations permettent de réduire les déplacements des patients en situation de fragilité, souvent éprouvants pour eux et leurs familles, tout en garantissant un suivi médical de qualité. Le projet Télépallia illustre parfaitement comment la télémédecine peut s'intégrer dans une dynamique de soins innovants, répondant à la fois aux contraintes des professionnels de santé et aux attentes des patients. Avec un cadre réglementaire et financier adapté, de tels projets pourraient devenir des piliers d'une prise en charge plus humaine, accessible et durable.
Conclusion
Face à la complexité croissante de la gestion de la douleur chronique, nous avons orienté ce mémoire sur les dispositifs médicaux qui jouent un rôle clé dans la prise en charge, en alternative aux traitements médicamenteux. Dans ce cadre, nous avons exploré et présenté les différents outils de diagnostic ainsi que les dispositifs médicaux utilisés pour le soulagement de la douleur chronique.
Lors de nos enquêtes sur le terrain, nous avons constaté les apports significatifs et l’efficacité des thérapies non médicamenteuses, telles que la photobiomodulation. Cette approche met en avant des solutions médicales innovantes, offrant une prise en charge pluridisciplinaire, centrée sur le patient et adaptée à ses besoins à long terme.
L’information et la formation des professionnels de santé constituent des leviers essentiels pour favoriser l’adoption des nouvelles technologies médicales. En sensibilisant le personnel soignant et le grand public grâce à notre flyer, nous aspirons à améliorer la connaissance des options thérapeutiques disponibles. Cette démarche ouvre la voie à des parcours de soins mieux adaptés aux besoins spécifiques des patients.
Adopter une prise en charge globale et intégrée apparaît ainsi comme la clé pour améliorer durablement la qualité de vie des personnes souffrant de douleurs chroniques. Repenser la prise en charge de la douleur chronique à travers des dispositifs médicaux adaptés ouvre la voie à une réflexion plus large sur l’organisation des soins, la formation des professionnels, l’accessibilité aux structures spécialisées et l’importance d’un parcours de soin bien identifié, essentiel pour offrir des réponses durables à cette problématique complexe.