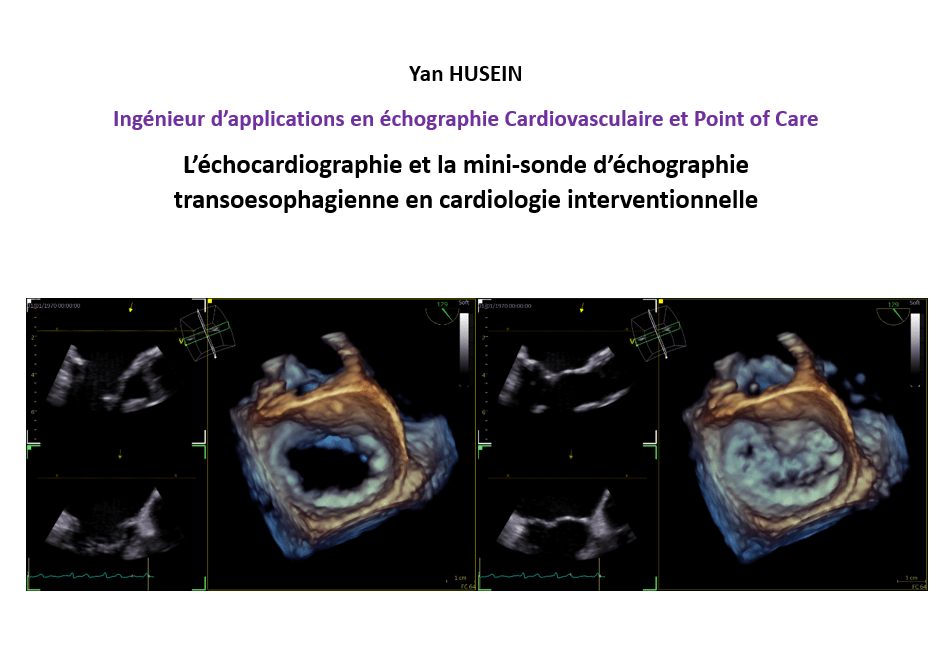
IDS231 - Ingénieur d’applications en échographie Cardiovasculaire et Point of Care - L’échocardiographie et la mini-sonde d’échographie transoesophagienne en cardiologie interventionnelle
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteur

Contact
- HUSEIN Yan : raianhusein@yahoo.fr
Citation
A rappeler pour tout usage : Yan HUSEIN, « Ingénieur d’applications en échographie Cardiovasculaire et Point of Care - L’échocardiographie et la mini-sonde d’échographie transoesophagienne en cardiologie interventionnelle », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Stage, https://travaux.master.utc.fr/, réf n° IDS231, juillet 2024, https://travaux.master.utc.fr/type-de-travaux/ids231
Résumé
En imagerie médicale, l’échographie est, des points de vue patient et médecin, la modalité la plus simple à mettre en place, la moins onéreuse, la plus rapide, et présentant le moins de risques. Elle s’est rapidement installée en cardiologie, et demeure aujourd’hui indispensable à l’examen des structures et de la fonction cardiaques. Elle s’est aussi implantée en cardiologie interventionnelle, pour le guidage du médecin lors de l’opération percutanée, dans de nombreuses indications. L’échographie s’y est si bien implantée qu’on en a créé une sous-spécialisation de cardiologie : les cardiologues échographistes.
Aujourd’hui, le système de santé français fait face à de nombreux enjeux, qui se sont construits avec le temps : la démographie médicale baisse et sa répartition sur le territoire est inégale, en particulier chez les anesthésistes, la population vieillit et les maladies chroniques augmentent, et les dépenses en santé ne font que croître. De nombreuses mesures sont alors mises en place depuis plusieurs années afin d’améliorer la situation qui évolue constamment, issues des stratégies nationales de santé émises tous les 5 ans. Progressivement, on pallie ces problèmes grâce aux lois mises en place, avec un « virage ambulatoire » comme une des mesures phares.
L’innovation technologique en est en partie responsable. En l’occurrence, GE HealthCare commercialise depuis 2022 la mini-sonde pour échographie transoesophagienne (ETO), la 9VT, qui encourage la cardiologie interventionnelle à basculer de l’hospitalisation conventionnelle des patients vers l’ambulatoire. Ce rapport retrace donc l’implantation de l’échographie en cardiologie interventionnelle et les bénéfices que la miniaturisation de la sonde ETO a apportés à la cardiologie interventionnelle et, plus globalement, au système de santé français, et, enfin, les changements impliqués dans le métier d’ingénieur d’applications en ultrasons.
Abstract
From a patient and physician standpoint, ultrasound is the simplest, least expensive, fastest, and least risky imaging modality in medical imaging. It quickly became established in cardiology and remains essential for examining cardiac structures and function today. It has also been implemented in interventional cardiology to guide the physician during percutaneous procedures in numerous indications. Ultrasound has become so well established in this field that a subspecialty of cardiology has been created : echocardiologist cardiologists.
Today, the French healthcare system faces numerous challenges that have built up over time : the medical demography is declining and its distribution across the country is uneven, particularly among anesthesiologists, the population is aging and chronic diseases are increasing, and healthcare spending is only growing. Numerous measures have been implemented for several years to improve the constantly evolving situation, resulting from national health strategies issued every 5 years. Gradually, these problems are being addressed thanks to the laws put in place, with "ambulatory surgery" as one of the key measures.
Technological innovation is partly responsible for this. In this case, GE HealthCare has been marketing the mini-transesophageal echocardiography (ETO) probe, the 9VT, since 2022, which is encouraging interventional cardiology to switch from conventional hospitalization of patients to outpatient care. This report therefore traces the implementation of ultrasound in interventional cardiology and the benefits that the miniaturization of the ETO probe has brought to interventional cardiology and, more generally, to the French healthcare system, and finally, the changes involved in the profession of ultrasound application engineer.
Keywords : Application engineer, Echography, Interventional cardiology, Miniaturization of a medical device, Outpatient surgery
Téléchargement
Rapport de stage d'ingénieur d'applications ultrasons cardiovasculaire et point of care. L'échocardiographie et la mini-sonde d'ETO en cardiologie interventionnelle.
Mémoire Complet
L’échocardiographie et la mini-sonde d’échographie transoesophagienne en cardiologie interventionnelle
Remerciements
Avant de commencer ce rapport, je tiens à remercier toutes les personnes qui m’ont accompagné, aidé, conseillé, enseigné durant mon stage. Je remercie tout d’abord mes parents, qui m’ont accompagné tout au long de mon long parcours d’études, et qui m’ont toujours aidé. Merci pour votre patience, ce diplôme, c’est aussi le vôtre. Merci à mes frères et sœurs qui sont toujours là pour moi.
Ces remerciements s’adressent aussi à mes amis, du master et d’avant, d’avoir toujours été là et de m’avoir assisté de toutes les manières, en particulier Alexandre, Ariane, Aashna, Claire, Wassim, Antoine.
Je remercie mon manager Eloge TINHAN, de m’avoir offert cette opportunité d’évoluer au sein de son équipe, de découvrir l’entreprise et de travailler avec d’excellents produits. Merci à celles et ceux qui, dans l’équipe, m’ont tant appris, m’ont accompagné avec bienveillance et ont contribué au bon déroulement de mon stage.
Merci à Zakaria ZAROUI d’avoir toujours répondu à mes appels et mes questions, de m’avoir suivi pendant mon stage et de m’avoir enseigné tant de choses, et à Houda HAFI de m’avoir montré son quotidien, et appris le terrain. Merci à François BIALY et à Pauclair MOMO GUENA, responsables des ventes publiques et privées dans mon secteur, d’avoir aussi été là pour moi pendant mon stage, d’avoir contribué à mon apprentissage sur le terrain et de m’avoir accordé votre confiance. J’espère à l’avenir que vous pourrez compter sur moi autant que nécessaire.
Je tiens enfin à remercier Madame Julie FOLLET, ma suiveuse à l’UTC, de m’avoir accompagné et aidé à encadrer mon stage, ainsi que Madame Isabelle CLAUDE et Monsieur Jean-Matthieu PROT et tous les enseignants du master pour votre formation et vos enseignements.
Liste des abréviations
- AFI : Automated Function Imaging
- ANAP : l’Agence Nationale d’Appui à la Performance des établissements de santé et médico-sociaux
- AVC : Accident Vasculaire Cérébral
- BPCO : Bronchopneumopathie Obstructive
- CBSM : Consommation de Soins et de Biens Médicaux
- CIA : Communication Inter Atriale
- CNG : Centre national de gestion des praticiens hospitaliers et des personnels de direction de la fonction publique hospitalière
- CMD : Cardiomyopathie Dilatée
- CMH : Cardiomyopathie hypertrophique
- CPTS : Communautés Professionnelles Territoriales de Santé
- CVUS : Cardiovascular Ultrasound
- DCSi : Dépense Courante en Santé au sens international
- DM : Dispositif Médical
- DMP : Dossier Médical Partagé
- ECN : Epreuves Classantes Nationales
- EDN : Examen Dématérialisé National
- ETO : Echographie Transoesophagienne
- ETT : Echographie Transthoracique
- FAG : Fermeture de l’Auricule Gauche
- FDA : Food and Drugs Administration
- FOP : Foramen Ovale Perméable
- GEHC : General Electric HealthCare
- HAS : Haute Autorité de Santé
- HCSP : Haut Conseil de Santé Publique
- IA : Intelligence Artificielle
- IAAS : International Association Ambulatory Surgery
- ICE : Intracardiac Echography
- IFOP : Institut Français d’Opinion Publique
- IRM : Imagerie par Résonnance Magnétique
- MG : Médecine Générale
- MSP : Maison de Santé Pluriprofessionnelles
- NC : Numerus Clausus
- OD : Oreillette Droite
- OG : Oreillette Gauche
- ONDAM : Objectif National des Dépenses d’Assurance Maladie
- PCS : Patient Care Solutions
- PDx : Pharmaceutical Diagnostics
- PoC : Point of Care
- SAEM : Syndicat Autonome des Enseignants en Médecine
- SNITEM : Syndicat National de l'Industrie des Technologies Médicales
- SNS : Stratégie Nationale de Santé
- TAVI : Transcatheter Aortic Valve Implantation
- TDM : Tomodensitométrie
- TEP : Tomographie par Emission de Positions
- VCI : Veine Cave Inférieure
- VCS : Veine Cave Supérieure
- VD : Ventricule Droit
- VG : Ventricule Gauche
Table des figures
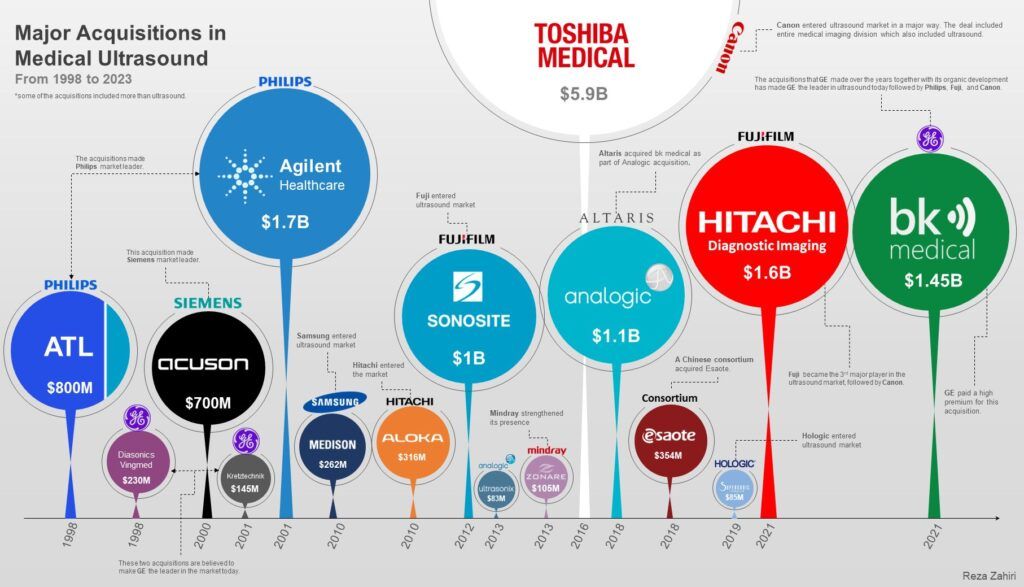
Figure 1 : Voluson S10 Expert BT22 [52]
Figure 2 : Versana Premier [52]
Figure 3 : Logiq E10s [52]
Figure 4 : Venue [52]
Figure 5 : Vscan Air SL [52]
Figure 6 : Vivid E95 [52]
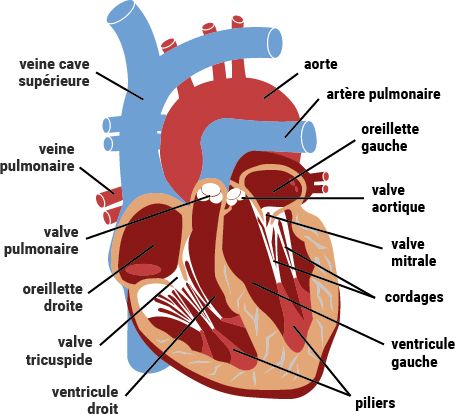
Figure 7 : Schéma simplifié de l'anatomie du cœur [6].
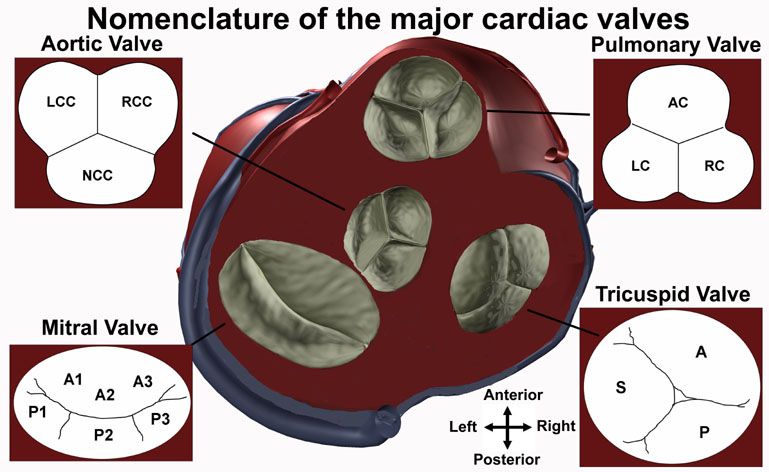
Figure 8 : Schéma de l'anatomie des feuillets des valves. En anglais : la valve aortique : Left, Right et Non Coronary Cusp (LCC, RCC et NCC). La valve pulmonaire : Anterior, Left et Right Cusp (AC, LC et RC). La valve mitrale : feuillet Anterior (A1, A2, A3) et Posterior (P1, P2, P3). La valve tricuspide : feuillets Anterior, Posterior et Septal (A, P, S) [8].
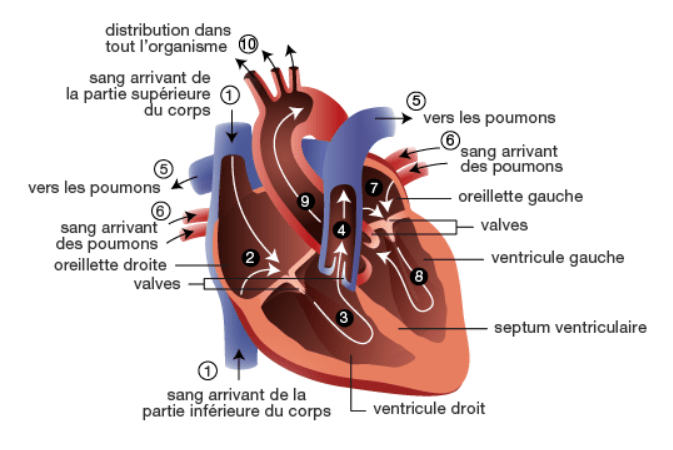
Figure 9 : Schéma de la circulation sanguine au sein du cœur [5].
Figure 10 : 4 vues importantes en ETT et le schéma du cœur correspondant. De gauche à droite sur la première ligne : vue apicale 4 cavités (VG, OG, VD et OD) et vue apicale 2 cavités (VG et OG). Sur la deuxième ligne : vue para-sternale grand axe, puis vue parasternale petit axe [9].
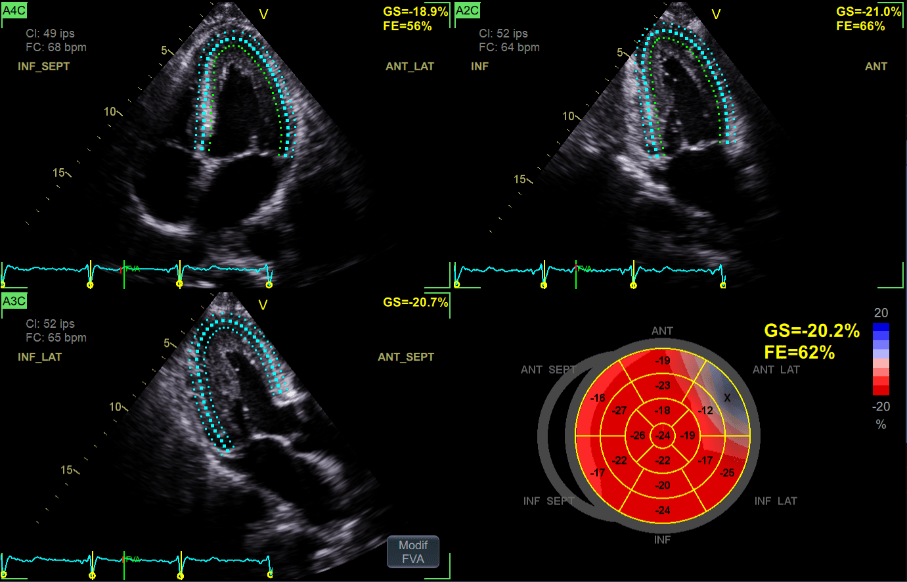
Figure 11 : Le module de Strain de GEHC. Le tracking est fait sur les trois vues 4 cavités, 2 cavités et 3 cavités et donne un graphique en "oeil de boeuf" et la FE. Source : auteur
Figure 12 : La sonde d'ETO 3D/4D classique de General Electric HealthCare 6VT [52].
Figure 13 : Schéma des différentes vues obtenues par ETO en fonction de la position de la sonde et de l'angle de béquillage [14].
Figure 14 : Schéma de la pose d'un clip mitral MitraClip [23].
Figure 15 : Large FOP visible à l'ETT [25].
Figure 16 : Courbe de l'évolution en pourcentage de la DCSi par année [31].
Figure 17 : Nombre de places ouvertes en deuxième année en études de médecine [37].
Figure 18 : Nombre et densité de médecins en activités d’après le scénario tendanciel [38].
Figure 19 : Répartition des médecins en activité selon les groupes de spécialités en 2010, 2022 et 2023 [37].
Figure 20 : Variations en % départementales des densités pour 100 000 habitants de médecins spécialistes hors MG en activité régulière entre 2010 et 2022, en % [39].
Figure 21 : Part des Français qui jugent que la pauvreté, l'exclusion et les inégalités ont augmenté en 2015, en % [41].
Figure 22 : Diapositive de Nicolas AMABILE exposant les indications actuelles et potentielles pour la FAG.
Introduction
L’apparition de l’échographie comme technique d’exploration du corps s’est vite tournée vers l’exploration cardiaque, puisqu’à son apparition, et notamment au début des années 50, avant l’angiocardiographie, il n’existait encore aucun moyen d’étudier le fonctionnement des ventricules cardiaques et de leurs valves.
La technique et la technologie évoluent avec le temps et ont conduit aujourd’hui à des machines complexes et complètes, vendues par différents constructeurs. GE HealthCare propose de larges gammes variées d’échographes, à l’ergonomie et aux fonctionnalités variant selon les spécialités de médecine visées. Ces machines s’accompagnent de leurs sondes, qui changent aussi d’aspect et de mode de fonctionnement selon la finalité désirée et le type d’examen réalisé [1].
De plus, les récentes lois et décisions politiques en France conduisent le système de santé national vers une simplification et une réorganisation vers les soins de proximité avec un virage ambulatoire comme mesure phare depuis plusieurs années. Cela pousse les constructeurs de dispositifs médicaux (DM) à proposer des solutions et des produits favorisant les soins ambulatoires, et les médecins à développer de nouvelles pratiques et s’y adapter. Dans ce contexte, on peut se demander comment l’échographie s’est-elle implantée en cardiologie interventionnelle, et comment la miniaturisation d’un DM peut-elle transformer le parcours du patient ?
La sonde pour échographie transoesophagienne (ETO) 6VT est un exemple de DM qui s’adapte à ces nouvelles pratiques, puisque de nombreux médecins la remplacent aujourd’hui par son homologue la 9VT, plus fine, plus légère et plus tolérable par le patient. En tant qu’ingénieur d’applications en échographie Cardiovasculaire et Point of Care, j’ai pu voir de nombreux examens dans différents services, et voir concrètement les apports de l’utilisation de la petite sonde par rapport à sa grande sœur. Pour répondre à cette problématique, je vais détailler dans ce rapport le principe de l’échographie cardiaque et de l’échographie transoesophagienne (ETO) en liant la littérature à mon expérience terrain, tout en me focalisant sur la mini-sonde ETO 9VT de General Electric HealthCare.
Chapitre I : L'échocardiographie par GE HealthCare
I. GE HealthCare et l'échographie
a. Un leader mondial de l'imagerie médicale
General Electric HealthCare (GEHC) est une entreprise indépendante de technologies médicales, spécialisée dans l’imagerie. Elle produit et commercialise principalement de larges gammes de dispositifs médicaux d’imagerie, de produits de contrastes en imagerie médicale et de radiopharmaceutiques. A la suite d’une longue histoire d’évolution, d’acquisitions et d’investissements, l’entreprise GE se développe pour proposer fin 2022 de nombreuses filiales, telles que GE Aerospace, GE Power, GE Finance ou GE Healthcare. Cette dernière est donc fondée en 1994, sous le nom de GE Medical Systems, après de nombreuses acquisitions et beaucoup d’investissements en R&D, principalement autour de l’imagerie médicale, en Amérique du Nord et en Europe.
D’après le Syndicat National de l'Industrie des Technologies Médicales (SNITEM), GEHC fait partie des 3 acteurs majeurs (avec Philips et Siemens Healthineers) qui détiennent les 2/3 du marché de l’imagerie médicale en France, pour un marché qui représente plus d’un milliard d’euros, avec entre 4 et 5% de croissance annuelle [2]. Cette position dominante se renforce avec son leadership sur les DM d’intelligence artificielle (IA), puisque l’entreprise se place en tête de la liste des DM d’IA de la Food and Drugs Administration (FDA) en 2023 pour la deuxième année consécutive (58 DM au total) [3]. GEHC se place donc en leader sur le marché de l’imagerie médicale, qui continue de croître annuellement en France et dans le monde.
Présente dans plus de 160 pays, pour une base installée de plus de 4 milliards de produits et solutions, GEHC permet la prise en charge de plus d’un milliard de patients chaque année. GEHC travaille avec plus de 51 000 collaborateurs dans le monde, dont 1800 ingénieurs d’applications et en R&D, qui se répartissent en quatre divisions : Imagerie, Echographie, Patient Care Solutions (PCS, Monitorage d’anesthésie-réanimation) et Pharmaceutical Diagnostics (PDx).
En janvier 2023, GEHC devient indépendante. Ce spin-off, fruit d’une décision stratégique, lui offre plus de libertés et de souplesse et de nombreux avantages. En effet, quitter ce conglomérat américain qu’est GE permet à GEHC de se concentrer davantage sur les marchés clés et d’accélérer l’innovation. Cette liberté d’action offre à l’entreprise une flexibilité dans sa prise de décision, de manière autonome et plus rapide, un accès plus facile aux capitaux pour les investissements et une culture d’entreprise plus agile.
Ainsi, GEHC propose des produits à tous les stades du parcours patient : prévention, diagnostic, traitement et suivi. Cela comprend les appareils d’imagerie lourde tels que la tomodensitométrie (TDM), l’imagerie par résonnance magnétique (IRM) ou la tomographie par émission de positons (TEP), les différentes gammes d’échographes et l’échographe ultraportable, des moniteurs patients et des ventilateurs de soins intensifs, quelques produits de contrastes en imagerie par rayons X et IRM et, enfin, de nombreuses solutions informatiques de gestion des soins et d’optimisation du parcours patient (différentes solutions notamment pour la gestion et l’optimisation des données patients, l’IA pour l’analyse des images médicales…).
b. La division Ultrasons
D’après Statista, l’échographie représente avec la radiographie conventionnelle plus de 60 millions d’actes par an en France, constituant la majorité des actes d’imagerie médicale, contre 3,5 millions pour l’ensemble des autres modalités d’imagerie. L’échographie représente alors en France un marché d’environ 300 millions d’euros, et devient un examen indispensable dans de nombreuses spécialités de médecine, incluant la gynécologie-obstétrique, la cardiologie, la radiologie ou l’anesthésie. La croissance de la population, son vieillissement, l’augmentation des maladies chroniques et de la demande en imagerie sont les principaux facteurs responsables de la croissance du marché future. De plus, l’échographie permettant une visualisation rapide et simple, non irradiante et non invasive des patients commence à se répandre à de nouvelles spécialités de médecine, comme les urgences [4]. Le développement de la technologie a permis aujourd’hui de proposer des gammes ultraportables, très simples à manipuler, qui s’adapte à ces spécialités nouvelles et à toutes les utilisations. Enfin, de nouvelles possibilités avec l’imagerie 3D/4D, l’intelligence artificielle et une excellente qualité d’image offrent de nombreux paramètres puissants dans le pronostic de nombreuses maladies, notamment en cardiologie.
Positionnement des gammes
La division ultrasons de GEHC se distingue de ses concurrents, puisqu’elle propose plusieurs gammes de produits spécialisés, qui s’adaptent aux besoins des praticiens. Certaines gammes ont été développées chez GE après l’acquisition d’autres petites entreprises. C’est le cas de la gamme Voluson, après l’acquisition de Kretztechnik en 2001 ou de la gamme des Vivid qui fait suite à l’acquisition de Vingmed en 1998. L’acquisition plus récentes de BK Medical a offert à GE de nouvelles technologies de sondes et de solutions logicielles, accentuant leur position de leader sur le marché. Plus globalement, le marché de l’échographie mondiale est caractérisé par quelques grosses acquisitions par les grandes entreprises qui le dominent aujourd’hui, plaçant à sa tête GEHC, suivi par Philips, Fujifilm puis Canon (Annexe 1). La gamme Logiq quant à elle, a été la première à être développée par GEHC, suivie plus récemment par la gamme des Venue, qui a été conçue pour être simple d’utilisation et dédiée aux spécialités de PoC.
La diversité des produits de GEHC lui permet de couvrir un large éventail de segments de marché, avec des solutions dédiées à de nombreuses spécialités médicales. Cette stratégie présente des avantages indéniables, en offrant aux professionnels de santé des outils adaptés à leurs besoins spécifiques, mais ces avantages font aussi les faiblesses de l’entreprise : GEHC ne propose pas actuellement de produit aux fonctionnalités multiples capable de s'adapter à des utilisations variées. Dans le contexte actuel où les déserts médicaux s’intensifient, les médecins se réunissent souvent dans des structures polyvalentes comme les maisons médicales, soutenus par les politiques récentes (Ma Santé 2022), avec des spécialités variées et complémentaires. L’entreprise ne propose alors pas un produit qui se positionne correctement dans ces contextes et qui puisse basculer d’une spécialité médicale à une autre facilement, et on se retrouve en difficulté face aux concurrents qui vendent des produits plus polyvalents.
Dans le contexte de la gamme cardiovasculaire (CVUS), les produits Vivid sont spécifiques de la cardiologie, mais ne sont pas toujours adaptés à la médecine vasculaire. Ainsi, un cardiologue utilisera un Vivid, dont l’ergonomie et les modes et options sont spécifiques à la spécialité, et un angiologue trouvera son compte avec un Logiq, qui montre de meilleures performances pour l’étude des vaisseaux (meilleur Doppler couleur, B-Flow…). Cependant, un Logiq ne sera pas forcément adapté à un service qui comprend des cardiologues et des angiologues ; un Vivid serait idéal, mais la moins bonne performance en vasculaire nous mettrait en difficulté face aux concurrents. De la même manière, en urgences, dans un service où l’échographie a des utilisations très variées, la machine positionnée dans ces services peut changer en fonction des besoins des médecins. Malgré tout, la place de leader mondial des DM d’imagerie ultrasonore est permise grâce aux larges gammes de produits très performants et dédiées à différentes spécialités :
- Voluson est spécifique à la gynécologie. Les nombreux Voluson de la gamme proposent différents modes 2D, doppler et 3D aidés de nombreux outils d’intelligence artificielle pour les examens de gynécologie et d’obstétrique, notamment le suivi des grossesses, l’hysterosonographie, le comptage des follicules ou les biopsies échoguidées (figure 1).
Figure 1 : Voluson S10 Expert BT22 [52]
- La gamme Versana concerne les soins primaires. C’est une gamme basée sur les Logiq dans un format plus versatile et moins onéreux, donc plus accessible. Les Versana sont très peu vendus en France, mais plutôt dans les régions du monde où les moyens sont moindres et les besoins moins spécifiques qu’en France (figure 2).
- Logiq est spécifique à la radiologie. La grande polyvalence de la machine la rend également accessible et utilisée dans d’autres spécialités de médecine, comme en anesthésie-réanimation ou en angiologie. Ainsi, les Logiq proposent les différents modes 2D et Doppler ainsi que l’élastographie, pour la visualisation des organes tels que la thyroïde, le foie, les muscles… (figure 3).
- Venue, une gamme nouvelle et développée par GEHC, est une machine simplifiée pour les spécialités de PoC. Les Venue sont sous la forme d’un écran tactile, légers et facilement mobilisable, simples d’utilisation. Point of Care (qui se traduirait par « au lit du malade » en français) est une approche de l’échographie utilisée dans différentes spécialités qui n’ont pas forcément de gamme dédiée telle que Vivid ou Voluson, et pour lesquelles l’échographe vient au lit du patient. Cela concerne un large panel de spécialités, mais principalement les urgences, l’anesthésie-réanimation ou les soins intensifs. La gamme présente 3 produits : le Venue Fit, le Venue Go et le Venue, qui diffèrent principalement par la taille de l’écran, l’autonomie de la batterie et le nombre de ports de sondes (figure 4).
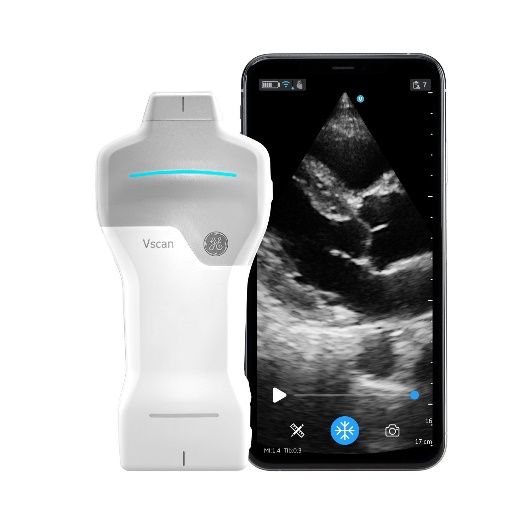
- Vscan Air est également une gamme dédiée au PoC : c’est l’échographe ultraportable. Vscan Air SL (sonde Sectorielle et Linéaire) et CL (Convexe et Linéaire) sont les deux frères de la gamme, qui ne sont que des sondes qu’on connecte par Bluetooth à un smartphone ou une tablette. Très simple d’utilisation, les Vscan sont des appareils qu’on range dans sa poche et qu’on connecte à son téléphone portable, qu’on utilise donc facilement dans de nombreuses spécialités, incluant la cardiologie, l’anesthésie réanimation, les urgences et la médecine générale (figure 5).
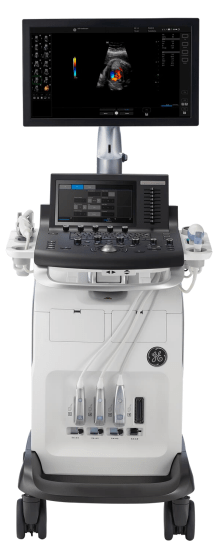
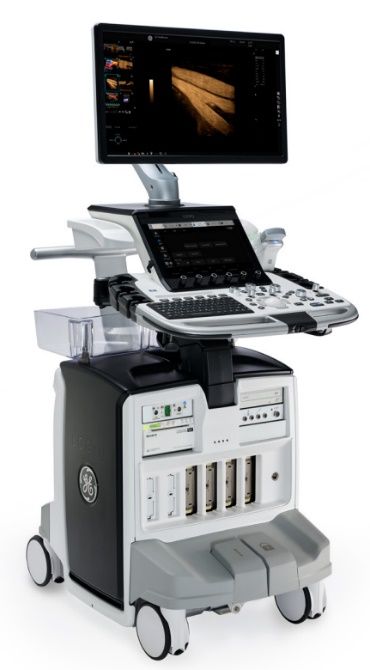
- Vivid est la gamme de cardiologie. Elle se décline en 4 lignes de produits commercialisés aujourd’hui : les Vivid T, IQ, S et E. Tous répondent aux besoins des cardiologues tant en ergonomie qu’en fonctionnalité. Les Vivid T sont le format compact de la gamme, et les S représentent la ligne premium. Les Vivid E sont la version expert des échographes de cardiologie avec un panel d’options et de fonctionnalités large et complet et des technologies avancées. Enfin, les Vivid IQ sont au format portable et présentent des fonctionnalités similaires aux T et S avec plus de mobilité (figure 6).
La gamme Vivid
En tant qu’ingénieur d’applications PoC et CVUS, je travaillais principalement avec des Vivid et Venue, et aussi et en moindre mesure des Logiq et les Vscan. Mon activité tournait donc autour de ces systèmes, et principalement des machines complexes que sont les Vivid.
Dans la gamme Vivid, les technologies diffèrent en fonction de l’échographe. C’est l’architecture du formateur de faisceau qui influe sur la qualité d’image et fait la différence dans le positionnement des machines dans la gamme. Les T8 et T9 Matrix utilisent la technologie du TruScan héritier de l’ancien Vivid E9, qui fut longtemps le haut de gamme de l’échocardiographie. Miniaturisé et amélioré, le TruScan est aujourd’hui adapté aux Vivid T. Les Vivid S70 et S70 Dimension et les Vivid IQ quant à eux utilisent le formateur de faisceau cSound, la nouvelle génération de cette technologie. Enfin, les E90 et E95 ont une architecture cSound améliorée, la cSound adapt, offrant l’option Hybrid, améliorant la qualité globale de l’image. Les machines utilisant cSound comme architecture de formateur de faisceau voient également leur connecteur de sonde évoluer : les connecteurs RS deviennent des connecteurs D. Cette nouvelle connectivité offre une meilleure transduction du signal ultrasonore et donc une meilleure image. Ainsi, plus on monte dans la gamme, meilleure est l’image de l’échographe.
Le choix d’une machine dépend ensuite des besoins du médecin et des options et fonctionnalités qui l’intéressent, qui varient en fonction de la machine, mais aussi des sondes compatibles. Aujourd’hui, la sonde cardiaque adulte de référence est la sonde phased-array matricielle M5Sc. La disposition matricielle des cristaux transducteurs des ultrasons offre une meilleure qualité d’image, une plus grande profondeur de pénétration et une meilleure résolution spatiale. Cette sonde n’est pas compatible avec les T8, sur lesquels l’ancienne version est utilisée, la 3Sc. D’autres sondes ne sont pas compatibles sur toutes les machines, telles que la sonde volumique 4Vc qui permet d’obtenir des images multiplans et 4D en échographie transthoracique (ETT), qui n’est compatible qu’à partir du S70, ou les sondes pour ETO 6VT et 10T qui ne sont compatibles qu’à partir du S60, ou enfin la sonde 9VT qui fait l’objet de ce rapport de stage, qui n’est compatible qu’avec le E95.
Enfin, des options logicielles ne sont pas compatibles sur toutes les machines, notamment les modules de strain AFI (Automated Function Imaging) du VD et OG (en plus de l’AFI VG, qui est disponible sur toutes les machines) et les outils de reconnaissance automatique 2D et du spectre Doppler (AI auto-measure 2D/Doppler) indisponible sur le T8, le travail myocardique qui n’est compatible que sur les E90 et 95 et d’autres options d’optimisation de la 4D sur les E90 et 95.
La gamme Vivid convient donc parfaitement aux cardiologues, tant dans l’ergonomie globale de l’appareil et celle du logiciel, avec les mesures adaptées personnalisées et organisées selon l’activité des médecins dans la spécialité, que dans la présence des options uniques et spécifiques à la cardiologie, telles que le calcul de la fraction d’éjection automatique, le module de strain myocardique, ou la visualisation 4D du cœur en ETT ou ETO.
II. L’imagerie par ultrasons pour étudier le cœur
a. Anatomie
En cardiologie, l’échographie permet d’étudier le cœur tant sur le plan anatomique que fonctionnel. La première chose qu’on voit en plaçant la sonde sur le cœur est une image bidimensionnelle de sa structure, il est donc nécessaire de connaître l’anatomie cardiaque avant d’étudier le cœur par échographie. Le cœur, à la forme d’une pyramide et dont l’apex pointe vers la gauche, se situe dans le thorax, entre les poumons, derrière le sternum. Sa fonction de pompe est permise grâce à ses cellules myocardiques musculaires, permettant ainsi de faire circuler le sang oxygéné vers tous les organes, soit près de 8000 litres de sang par jour. Le cœur se divise en deux parties et 4 cavités : le cœur droit, composé de l’oreillette droite (OD) et du ventricule droit (VD), qui permet la petite circulation, et le cœur gauche, composé de l’oreillette gauche (OG) et du ventricule gauche (VG). Ensuite, différents vaisseaux relient les cavités : les veines caves supérieure (VCS) et inférieure (VCI) s’abouchent dans l’oreillette droite et y apportent le sang non oxygéné, l’artère pulmonaire sort du ventricule droit pour conduire le sang aux poumons, les veines pulmonaires, au nombre de 4, s’abouchent dans l’oreillette gauche et y conduisent le sang oxygéné sortant des poumons, et, enfin, le sang est envoyé dans la circulation générale par le ventricule gauche dans l’aorte (figure 7) [5][6].
Le système cardiovasculaire est une boucle fermée, dont la circulation est à sens unique. Pour garantir cette bonne circulation, des valves dans les cavités du cœur permettent d’éviter tout reflux ou mauvaise circulation du sang dans l’organe : l’oreillette gauche et le ventricule gauche sont séparés de la valve mitrale, l’oreillette droite et le ventricule droit sont séparés de la valve tricuspide, la valve aortique se trouve au départ de l’aorte, et la valve pulmonaire au départ de l’artère pulmonaire [7]. Toutes les valves possèdent 3 feuillets, sauf la valve mitrale, dont la forme fait penser à la mitre de l’évêque, qui en possède 2 (figure 8) [8]. La rétention de ces valves, permettant la coaptation et l’étanchéité, et ainsi au sang de ne circuler que dans un sens prédéfini, est permis par les muscles papillaires des parois ventriculaires, reliés aux valves par les piliers et les cordages. Enfin, le cœur est approvisionné en sang grâce aux artères coronaires qui le parcourent, et qui quittent l’aorte à sa base, au niveau du sinus aortique, au nombre de 2. Il existe également une petite cavité dans l’oreillette gauche, l’auricule, où le sang peut stagner et où peuvent se former des caillots.
La circulation intracardiaque est donc permise et régulée par la contraction régulière et involontaire du cœur, la disposition des valves, et les différences de pression entre les cavités. Elle a lieu en plusieurs étapes successives :
- Le sang pénètre OD par les VCS et VCI, qui se contracte et pousse le sang vers le VD ;
- VD se contracte et envoie le sang aux poumons par l’artère pulmonaire ;
- OG reçoit le sang oxygéné par les veines pulmonaires, se contracte et pousse le sang vers VG ;
- VG se contracte et envoie le sang dans la circulation générale, qui remonte au cœur par VCS et VCI (figure 9).
La contraction des cœurs droit et gauche est simultanée [5].
b. L’ETT et ses limites
Il existe trois voies d’abord par échographie pour examiner le cœur : l’échographie transthoracique (ETT), l’échographie transoesophagienne (ETO) et l’échographie intracardiaque (ICE pour Intra Cardiac Echo). La première échographie réalisée chez le patient est l’échographie transthoracique. Indolore, non invasive, rapide, l’ETT permet de vérifier le bon fonctionnement du cœur et en examiner les structures. Il existe plusieurs voies d’accès au cœur en ETT, offrant différentes vues du cœur : on le regarde principalement par la voie para-sternale grand axe (dans l’axe longitudinal du cœur) ou petit axe (dans l’axe transversal du cœur), ou apicale (offrant une vue à 5, 4, 3 ou 2 cavités selon l’orientation de la sonde), et plus rarement par voie sous-costale ou sus-sternale (figure 10) [9].
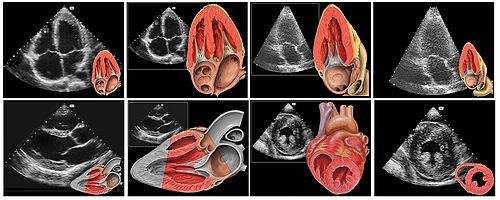
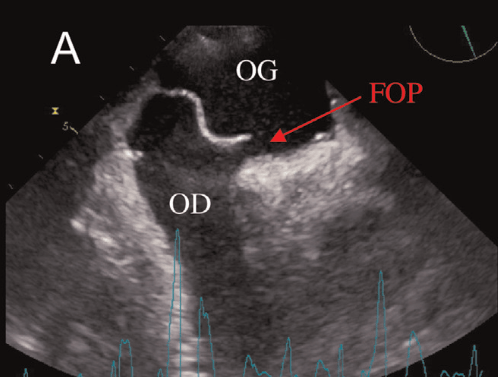
Le patient est en décubitus latéral gauche, le bras gauche derrière la tête et le bras droit le long du corps. Une fois l’anatomie cardiaque en mémoire, on repère facilement les anomalies, telles que les cardiomyopathies hypertrophiques (CMH) ou dilatées (CMD), les épanchements myocardiques ou les cardiopathies congénitales. On observe alors le cœur en 2D et on fait différentes mesures sur le VG ou l’aorte en fonction des besoins. Le mode 2D permet aussi d’observer les valves, repérer les bicuspidies ou quadricuspidies sur les valves habituellement tricuspides, d’observer la calcification et la bonne ouverture/fermeture des valves, identifier les valvulopathies, mais aussi diagnostiquer les malformations cardiaques, telles que le foramen ovale perméable (FOP) avec l’utilisation d’un produit de contraste. En vue apicale, la mesure du Strain du VG, ou du pourcentage de raccourcissement systolique du myocarde entre la systole et la diastole, associé à la fraction d’éjection du VG, offre des valeurs importantes pour le pronostic des CM ou le suivi des patients sous chimiothérapie (figure 11).
D’autres modes s’ajoutent au bidimensionnel et permettent de compléter l’examen, notamment les différents modes Doppler. Le Doppler couleur, entre autres permet de voir la direction du flux sanguin à l’image, et ainsi de détecter les éventuelles fuites au niveau des différentes valves cardiaques, signes d’insuffisance valvulaire. Les Doppler pulsé et continu ajoutent plus d’informations en mesurant les vitesses des flux. S’affichent alors des courbes dont on peut avoir une première impression visuelle, et sur lesquelles on mesure différents paramètres, tels que la pente, la vitesse maximale ou l’intégrale des courbes. Toutes ces données communiquent des informations sur l’état du cœur du patient et l’éventuel pronostic d’une maladie cardiaque [10].
L’ETT permet de voir le cœur sous de nombreux angles et communique des informations très importantes sur l’état du patient. Cependant, elle présente ses limites dans la visualisation plus poussée des structures :
- Chez les patients obèses ou présentant une Bronchopneumopathie Obstructive (BPCO) ou différentes pathologies pulmonaires, il est difficile d’obtenir une image de bonne qualité à cause de l’air ;
- Le champ de vision est réduit, et l’image du cœur droit peut être difficile à obtenir ;
- Il est difficile de voir l’aorte ascendante ou la face postérieure de l’OG en vues habituelles ;
- Les valves ne sont pas visibles sous tous leurs angles.
c. L’ETO pour une visualisation fine des structures
L’ETO offre une visualisation plus fine des structures que l’ETT ne permet pas toujours de voir. C’est une méthode semi-invasive et désagréable, puisqu’on fait passer par l’œsophage du patient une sonde relativement épaisse, pour la faire descendre jusqu’à avoir une image du cœur. L’œsophage étant en contact direct postérieur à l’OG, la sonde est au plus proche du cœur et permet d’avoir une meilleure résolution d’image et une image plus détaillée, pour un plan inversé par rapport à l’ETT. De nombreux constructeurs proposent aujourd’hui des sondes ETO, GE HealthCare en propose principalement 4 : la 6T, la 10T (micro-sonde, pour la pédiatrie), et les nouvelles sondes volumiques 6VT (figure 12) et 9VT.
En exploration fonctionnelle, l’ETO est indiquée pour l’évaluation valvulaire, l’examen des cavités ou la recherche d’un thrombus [11]. En effet, il est courant que des thrombus se forment dans l’auricule gauche, phénomène fréquent en cas de troubles de l’arythmie comme la fibrillation atriale, et plus rarement en cas de sténose mitrale, dont les complications sont graves, pouvant entraîner une embolisation systémique ou l’obstruction de l’orifice mitral [12]. L’examen est relativement rapide et n’a pas besoin de sédation du patient. L’anesthésie générale est requise pour les longues interventions, car le geste est très désagréable, à laquelle on ajoute souvent l’anesthésie locale par xylocaïne au fond de la gorge. Le rôle de l’anesthésiste est alors essentiel en ETO en cardiologie interventionnelle. En chirurgie interventionnelle, l’ETO est alors indiquée pour le guidage en plus des arceaux à rayons X dans des cas de remplacement ou réparation valvulaires, de fermeture de communication inter-atriale ou interventriculaire ou du foramen ovale perméable.
L’ETO est très efficace dans la visualisation des structures cardiaques, mais elle reste contre-indiquée dans quelques cas, notamment si le patient à une tumeur ORL ou s’il a eu une chirurgie ORL ou œsophagienne récente, ou en cas d’irradiation médiastinale. De plus, l’ETO peut engendrer de nombreuses complications, qui restent rares, mais dont le risque n’est pas nul, notamment une perforation de l’œsophage, une hémorragie, une odynophagie ou une lésion dentaire. Ainsi, des précautions avant l’examen doivent être prises : le patient doit être à jeun et coopérant, et un cale-dent lui est donné, permettant aussi d’éviter les morsures potentielles de la sonde [13].
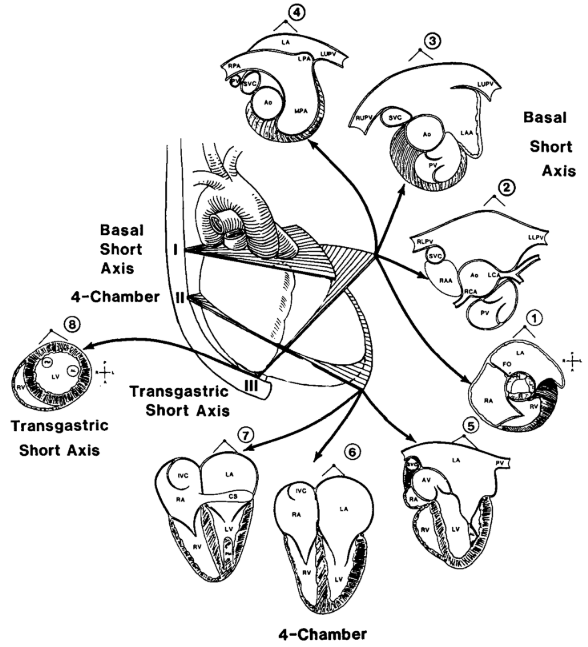
Il existe alors plusieurs vues du cœur, différentes des vues classiques d’ETT, schématisées en figure 8 : une vue aorte-artère pulmonaire (I), une vue 4 cavités à (II), et une vue trans-gastrique à (III). L’angulation de la sonde, grâce aux commandes qui sont disponibles directement sur la sonde ou sur l’échographe, permet ensuite, en fonction du positionnement de la sonde, d’observer différentes structures du cœur. De plus, la possibilité d’avoir une image en 3 ou 4 dimensions ainsi que d’obtenir des images multi-coupes offre au médecin plus de possibilités dans l’observation des structures. En effet, obtenir une image en 4D du cœur permet de naviguer plus facilement au sein du volume, et d’obtenir des coupes qu’il est habituellement impossible à obtenir en 2D [14].
d. L’ETO en cardiologie interventionnelle
La cardiologie interventionnelle grâce à la voie percutanée
En 1964, Charles Dotter, un radiologue américain, réalise la première dilatation d’une artère périphérique, et la cardiologie interventionnelle nait. Les évolutions technologiques depuis plus de 40 ans ont permis à la cardiologie de développer des techniques de plus en plus sophistiquées, faisant d’elle une spécialité rigoureuse et complexe. Elles ont permis à Andreas Gruentzig, un cardiologue allemand, en 1977, de réaliser la première angioplastie coronaire transluminale, et à Jacques Puel, cardiologue français, 9 ans plus tard, d’implanter le premier stent coronaire chez l’Homme. La cardiologie interventionnelle intègre les actes médicaux de cardiologie pratiqués par voie endovasculaire, par l’introduction d’instruments chirurgicaux à l’intérieur d’un vaisseau sanguin, généralement la veine fémorale, pour atteindre les cavités cardiaques. Ces techniques mini-invasives influent énormément sur le confort des patients puisqu’elles permettent d’éviter les chirurgies à cœur ouvert et les sternotomies dans la majorité des cas, qui entraînent une cicatrisation longue et douloureuse, nécessitant de la rééducation, et elles permettent de prendre en charge de nombreux patients jusque-là inopérables [15].
La révolution se poursuit en 2002, avec la première réalisation d’une implantation percutanée d’une prothèse valve aortique (TAVI) par Alain Cribier, un cardiologue français, et la première implantation d’un pacemaker miniaturisé sans chirurgie en 2013 en France [16]. La miniaturisation des DM en cardiologie devient indispensable et a révolutionné la spécialité, en donnant une place très importante à la cardiologie interventionnelle dans la prise en charge de millions de patients chaque année, pour diverses indications, et améliorer le confort et la qualité de vie de ces patients par la même occasion [17].
La démocratisation du TAVI pour la valve aortique a rapidement permis de développer des DM relativement similaires pour le traitement des valves mitrale et tricuspide, notamment le MitraClip et le TriClip de la société Abbott Vascular. Ces dispositifs permettent le traitement des insuffisances mitrale et tricuspide par voie percutanée, en rapprochant les feuillets entre eux pour en rétablir la coaptation [18]. Les indications à la cardiologie interventionnelle en alternative à la chirurgie s’agrandissent régulièrement et permettent la prise en charge de nombreux patients pour lesquels la chirurgie n’est plus possible, en raison de la sévérité de leur état. Les avantages de la voie percutanée ne sont plus à prouver : confort pour le patient, gain de temps et de ressources en réduisant le besoin d’hospitalisation, rétablissement plus rapide du patient… Des précautions sont tout de même à prendre en compte chez le patient avant de procéder à l’intervention, pour laquelle il existe plusieurs risques à la ponction des artères : hémorragie, perturbation du système cardiaque ou risque d’accident vasculaire cérébral (AVC), entre autres. Le risque d’AVC est d’1% pour toute procédure interventionnelle et reste tout de même inférieur à celui observé à la suite des chirurgies du cœur [19]. La rythmologie interventionnelle continue aussi progresser, avec les ablations des troubles du rythme, et la cardiologie interventionnelle plus globalement s’accompagne du développement de l’imagerie.
L’imagerie en cardiologie interventionnelle
Préalablement à l’intervention, l’imagerie médicale est nécessaire pour le diagnostic et l’évaluation de la fonction cardiaque. L’ETT est la technique de première intention, comme technique non invasive, non irradiante et simple à mettre en place, dans le diagnostic des valvulopathies, ou dans l’étude de la fonction cardiaque : l’échographie de stress est l’examen échographique à l’effort du patient ou sous stress pharmacologique (dobutamine par exemple). L’échographie de stress permet alors d’identifier l’étiologie d’une ischémie ou de différents troubles cardiaques. De la même manière, l’imagerie par scintigraphie, la résonnance magnétique nucléaire ou la tomographie par émission de positons (PET) permettent d’évaluer la fonction cardiaque sous stress. La TDM offre également une image très détaillée du réseau coronaire et de l’anatomie cardiaque grâce à des résolutions spatiale et temporelle importantes. Enfin, différentes combinaisons de modalités d’imagerie permettent d’améliorer le diagnostic grâce à des images plus précise en alliant l’anatomie et l’évaluation fonctionnelle, telle que la combinaison TEP et IRM.
Durant l’intervention, la fluoroscopie et l’ETO sont indispensable dans le guidage et le suivi des interventions percutanées des valvulopathies. La fluoroscopie est indiquée dans la réalisation de plusieurs procédures, en particulier l’angioplastie coronarienne : la technique permet de suivre le parcours des artères coronaires, de diagnostiquer les sténoses et de suivre la mise en place du stent. Un cathéter est remonté jusqu’au réseau coronaire, et la production de rayons X par le fluoroscope couplée au produit de contraste injecté par le cathéter permet d’observer les artères sur un écran en temps réel pendant l’intervention. Dans le cas des valvulopathies, les deux techniques d’imagerie couplées permettent une grande précision dans le repérage et le placement des prothèses, précision indispensable pour une intervention réussie [11].
Indications de l’ETO en cardiologie interventionnelle
La place de l’échographie transoesophagienne est devenue indispensable en cardiologie interventionnelle. Ses indications sont peu nombreuses, mais les interventions n’auraient pas lieu si elles n’étaient pas accompagnées du guidage par ETO. Principalement, ce sont les traitements des valvulopathies par voie percutanée par réparation ou et les fermetures du foramen ovale perméable (FOP).
Une insuffisance valvulaire, mitrale ou tricuspide par exemple, correspond à un défaut de coaptation des feuillets de la valve et donc à l’absence d’étanchéité. Ainsi, elle ne remplit pas entièrement sa fonction, puisqu’elle n’empêche plus le sang de prendre la mauvaise direction en repassant par la valve. Ces insuffisances peuvent être dues à différentes causes, le plus souvent une pathologie intrinsèque ou une distorsion de la valve par dilatation de l’anneau valvulaire. Le pronostic de la maladie dépend de plusieurs facteurs, notamment de la fonction du VG et de l’étiologie de l’insuffisance valvulaire : elle peut être physiologique, ou discrète et asymptomatique, nécessitant une surveillance sans traitement. En revanche, une insuffisance valvulaire symptomatique (dyspnée, fatigue, asthénie, palpitations… dans le cas de la valve mitrale) évoluera vers l’insuffisance cardiaque et des troubles du rythme, ou une fibrillation auriculaire dans le cas de l’insuffisance tricuspide. La réparation ou le remplacement de la valve devient alors nécessaire [20] [21].
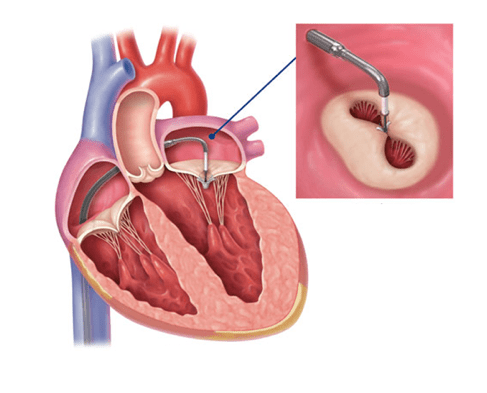
La réparation valvulaire concerne les valves mitrale et tricuspide. Elle est indiquée quand l’annuloplastie et la chirurgie sont irréalisables ou présentent trop de risque. Elle a lieu par voie percutanée en faisant monter un guide et un cathéter au cœur par l’artère fémorale, pour l’injection de produit de contraste de fluoroscopie, ainsi qu’un dispositif, souvent le MitraClip ou le TriClip de la société Abbott, qui permet d’apporter une prothèse valvulaire jusqu’au cœur. Le MitraClip établit une connexion entre les feuillets postérieur et antérieur de la valve mitrale, en retenant ces feuillets entre ses bras et en les pinçant, pour ensuite les rapprocher en se refermant. Le clip est alors placé au niveau de la fuite, entre les feuillets, et les maintient en place, annulant la fuite [22] (figure 14).
Le principe du TriClip est relativement similaire, pour une procédure plus complexe, puisque la valve est formée de 3 feuillets. Le guidage par échocardiographie transoesophagienne est indispensable à la procédure, pour visualiser la valve, repérer les feuillets, suivre le clip, le placer correctement, étudier la fuite, et vérifier le placement correct du clip en fin d’intervention. L’ETO 3D offre alors aux médecins une vue bien plus complète de la valve en question, offrant plus d’information, et l’obtention d’un volume leur permet d’y naviguer à souhait et ainsi observer la valve sous plusieurs angles. D’autres options permettent également de faciliter l’intervention, telle que la possibilité d’obtenir une image multi-coupe, sous plusieurs angles, en temps réel, afin de mieux placer le clip au centre de la fuite [24].
Le TAVI n’est généralement pas concerné par l’ETO, puisque l’observation des feuillets n’est pas nécessaire pendant l’intervention. De plus, d’expérience au bloc de cardiologie interventionnelle, de nombreux médecins affirment que l’échographie gênerait l’intervention, et que la fluoroscopie est suffisante, parfois l’ETT. Cependant, j’ai pu aussi assister à plusieurs interventions de mise en place de TAVI durant lesquelles l’ETO était pratiquée : l’image par échographie permet de s’assurer du bon placement de la valve. Ce type d’intervention ne nécessite donc habituellement pas d’ETO, mais les nouvelles possibilités de l’échographie, ainsi que la miniaturisation des sondes et la facilitation de son application pourraient changer les pratiques.
Le foramen ovale (FO) perméable quant à lui est une communication entre les deux oreillettes, OG et OD. Présent physiologiquement chez le fœtus, le FO se referme par une membrane après la naissance. Il permet normalement au sang d’éviter le passage par le cœur droit qui est inutile au fœtus, après son passage par le placenta. Le FO devient pathologique par sa persistance : il reste perméable chez près d’une personne sur quatre, à cause de l’absence ou la non-complétion de la fermeture du foramen, et se résulte par la possibilité d’un shunt inter-atrial. Le FOP est diagnostiqué par ETT ou ETO, avec utilisation d’un produit de contraste échographique. Une solution de microbulles est injectée par voie intra-veineuse, augmentant l’échogénicité des tissus qu’elle traverse, et permettant alors de mettre en évidence la communication entre les oreillettes. Les complications d’une persistance du FOP peuvent être notamment la migration de caillots, dont les conséquences peuvent être l’AVC ou l’infarctus du myocarde [25]. Lorsque le traitement par anticoagulants n’est pas suffisant, la fermeture interventionnelle peut être envisagée, sous certaines conditions. La procédure percutanée repose sur le placement d’un DM, appelé ombrelle, au niveau du FOP, rétablissant l’étanchéité entre les deux cavités [26].
Enfin, une procédure courante en cardiologie interventionnelle, pour laquelle l’ETO est requise est la Fermeture d’Auricule Gauche (FAG). Chez les patients souffrant de Fibrillation Atriale (FA), cette procédure permet notamment de prévenir les risques d’AVC [26].
Chapitre II : Vieillissement de la population, déserts médicaux, augmentation des dépenses : un contexte en évolution
III. L’état du système de santé français
a. Organisation
Le système de santé français fait face à de nombreux changements démographiques, sociaux et économiques. L’Organisation Mondiale de la Santé le définit comme « l’ensemble des organisations, des institutions, des ressources et des personnes dont l’objectif principal est d’améliorer la santé ». On trouve alors en France parmi les acteurs qui y interviennent les offreurs de soins, les producteurs de biens et services en santé comme l’industrie pharmaceutique, les institutions publiques, les financeurs et les bénéficiaires. Sa direction se décline de manière hiérarchique, avec le ministère chargé de la santé au niveau national, soumis aux lois et objectifs votés par le Parlement, et les Agences Régionales de Santé (ARS). D’autres institutions interviennent aussi dans le conseil de ces dernières et la gestion du système de santé, telles que le Haut Conseil de la Santé Publique (HCSP), ou l’Agence Nationale d’Appui à la Performance des établissements de santé et médico-sociaux (ANAP). Enfin, la cour des comptes participe au contrôle de ces institutions par la gestion des finances de ce système de santé [27]. De nombreux facteurs influent sur les différents acteurs du système de santé, dont la direction doit prendre en compte les changements afin de continuer à fonctionner de manière optimale et à répondre aux besoins de l’ensemble de la population.
b. Une démographie qui évolue
En 2017, le Premier Ministre Edouard Philippe parlait de « vieillissement de la population donc plus de maladies chroniques ; l’aspiration des nouvelles générations de médecins à rechercher un meilleur équilibre entre vie privée et professionnelle ; et surtout la démographie médicale déclinante ». L’espérance de vie augmente, l’incidence des maladies chroniques augmente, et les dépenses de santé en France suivent difficilement.
En effet, malgré une faible baisse en 2020 durant l’année du COVID, l’espérance de vie à la naissance est croissante depuis plusieurs décennies, passant de 75,4 ans en 1985 à 82,3 ans en 2020 en France [28]. De plus, la prévalence des maladies chroniques passe de 14,6% en 2008 à 17,8% en 2021 [29]. La pyramide des âges change aussi, à cause du vieillissement de la population (d’après l’INSEE, 19,6% de la population avaient plus de 65 ans en 2018, contre 19,2% un an auparavant et 18,8% en 2016 [30]).
c. Des dépenses en santé en croissance constante
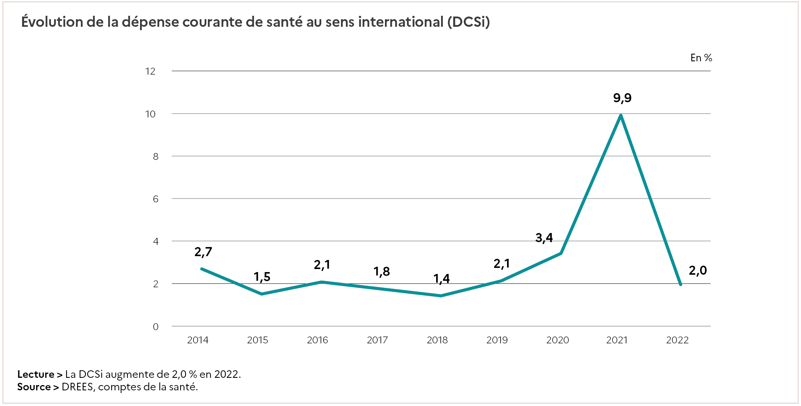
Les dépenses en santé augmentent alors en réponse à ces changements, et à la volonté de d’offrir une couverture universelle de qualité optimale. La part de la richesse nationale consacrée à la santé en France est la plus importante des dépenses de la protection sociale, faisant de notre pays l’un des plus dépensiers en santé. Cette part importante et cette augmentation dynamique est sous l’effet de nombreux facteurs, notamment démographiques comme l’augmentation de l’espérance de vie, ou l’amélioration des prestations [31]. Accentuée depuis la crise de COVID, cette part de la richesse nationale, comptabilisée comme Dépense Courante en Santé au sens international (DCSi) correspondait en 2021 à 12,3% du produit Intérieur Brut (PIB), contre 11,2% en 2019, et elle est représentée à 75% par la Consommation de Soins et Biens Médicaux (CSBM). La CSBM regroupe tout ce qui est destiné au traitement direct des malades, c’est-à-dire les soins hospitaliers et ambulatoires, les transports sanitaires, les médicaments et dispositifs médicaux… Les 25% restant de la DCSi correspondent aux dépenses liées aux soins de longue durée des personnes handicapées ou âgées en établissement, aux indemnités journalières versées par l’Assurance Maladie en raison d’un arrêt de travail, aux subventions au système de soin, aux dépenses de recherche médicale et aux formations des professionnels de santé, aux dépenses pour la prévention et aux coûts liés à la gestion du système de santé [32]. La CSBM s’élève à 235,8 Milliards d’euros en 2021, soit 8,9% du PIB, et la DCSi continue d’augmenter chaque année (figure 16). Cette hausse s’explique principalement par le prix des soins hospitaliers et les volumes de ventes de médicaments [33].
Ces dépenses importantes et leur croissance constante participent au déficit dans les comptes publics et à l’intensification de la dette publique en France. En effet, les administrations de Sécurité Sociale représentent 10,6% de la dette publique, soit 300,1 milliards d’euros. Ce déficit dû à la Sécurité Sociale est sujet à débat depuis de nombreuses années, puisque la Sécurité Sociale n’a pas été excédentaire depuis 2001. La mise en place en 1996 de l’Objectif National des Dépenses d’Assurance Maladie (ONDAM), un indicateur de maîtrise des dépenses de santé, voté chaque année par la loi de financement de la Sécurité Sociale a eu pour but de fixer les plafonds d’emprunts des organismes de Sécurité Sociale et propose un plan de gestion des dépenses annuelles en fonction des recettes. Ainsi, depuis 2010, le budget était respecté, jusqu’à la crise sanitaire de 2020 où les dépenses ont largement dépassé le remboursement des prestations [34].
d. Des inégalités d’accès aux soins
« Nous manquons de médecins » est une phrase qui revient régulièrement au cœur de nos discussions. L’inégalité de répartition du personnel soignant et des ressources médicales, ainsi que la diminution du nombre de paramédicaux amplifient les problèmes d’accès aux soins. Le ministère des solidarités et de la santé affirmait en 2022 que le nombre de médecins baisse fortement, et que l’accès aux soins pour tous et partout sur le territoire est au cœur des préoccupations des Français [35]. Le problème est aussi sujet de nombreux débats, et la loi immigration de 2023 en est la preuve en proposant de diminuer l’accès aux soins pour les étrangers en situation irrégulière [36].
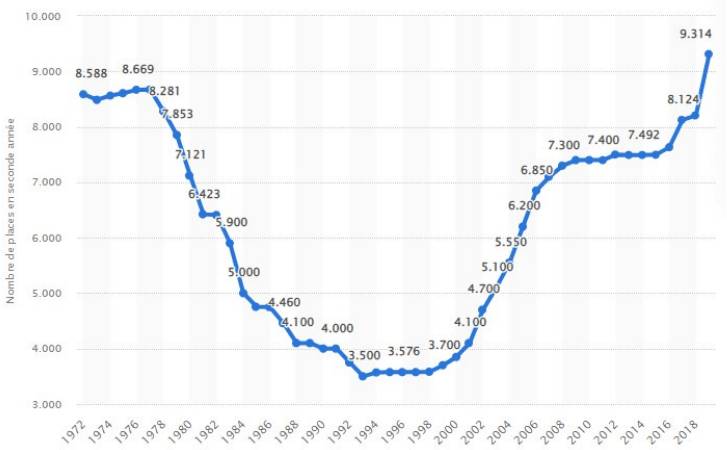
L’évolution du numerus clausus (NC) est en partie responsable : le nombre de nouveaux médecins aujourd’hui ne compense pas les départs en retraite, pour une population française qui ne cesse d’augmenter. Faisant sa seconde apparition en 1971 (la première date de la seconde guerre mondiale, le NC servait alors à limiter le nombre d’étudiants juifs pouvant passer à l’année supérieure d’études), il fait suite au début de la gratuité des études, avec pour but de bien gérer les dépenses dans la formation des étudiants et garder une gestion optimale du système hospitalier, mais aussi de maintenir un prestige de la formation. Le premier quota de places ouverts pour le passage en deuxième année était alors de plus de 8000, très loin de la volonté de l’Ordre des Médecins et du Syndicat Autonome des Enseignants de Médecine (SAEM) qui estimaient « qu’il ne faut pas former plus de 4000 nouveaux médecins par an ». Progressivement et à partir de 1976, après l’émission d’une circulaire du ministère de l’éducation nationale, le numerus clausus diminue jusqu’à atteindre un minimum de 3500 places en 1993 (figure 17), sans analyse précise des besoins médicaux, et surtout sans prise en compte des facteurs démographiques changeant et du vieillissement de la population [37].
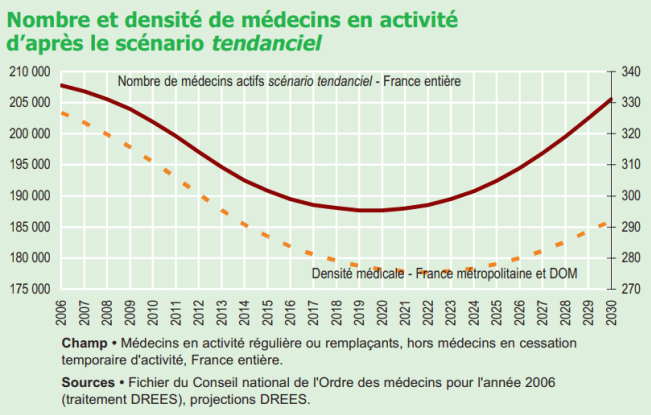
C’est cette baisse du nombre d’étudiants admis en deuxième année de médecine à la suite de l’instauration du numerus clausus qui est responsable de la diminution du nombre de médecins aujourd’hui, relativement à la population grandissante. La tendance s’inverse dès 1994 pour faire face au départ en retraite des nombreux médecins précédents, mais il faudra attendre 2030 pour retrouver une densité médicale optimale (figure 18). Cette tendance à s’inverser est une prédiction de la Direction de la Recherche, des Etudes, de l’Evaluation et des Statistiques (DREES) de 2007, qui part de l’hypothèse que la population devrait croître de 10% entre 2006 et 2030 [38].
Au nombre de médecin diminuant s’ajoute la répartition des spécialités inégale lors des Epreuves Classantes Nationales (ECN) : chaque spécialité ne voit pas le même nombre de médecins formés chaque année. De plus, ce nombre de place évolue, et en anesthésie-réanimation en particulier, 500 anesthésistes étaient formés en 1985 contre 90 en 2000. Cela a entraîné une baisse drastique du nombre de médecins spécialistes en anesthésie-réanimation, dû au nombre de sortie de fonction (principalement dues à des départs à la retraite) plus important que le nombre d’entrées [38]. Cependant, en se basant sur des prédictions du nombre de départs et d’entrées chaque année, et sur le nombre d’anesthésistes formés chaque année qui est remonté à 307 en 2015 (grâce à l’augmentation du numerus clausus de la spécialité en 2009), les nombreuses statistiques menées par le Centre national de gestion des praticiens hospitaliers et des personnels de direction de la fonction publique hospitalière (CNG) estime un retour à un solde positif du nombre d’anesthésistes en 2022. Ainsi, les effectifs de praticiens hospitaliers à temps plein en anesthésie réanimation qui sont en baisse constante depuis plusieurs années, devraient atteindre un minimum en 2022 à environ 3600 spécialistes, puis remonter à plus de 4000 en 2030. Cet effectif prévu est toujours insuffisant en termes de densité et de besoins, et cela se fait ressentir dans de nombreux établissements de santé : il est commun de voir des hôpitaux ou établissements de santé manquer d’anesthésistes et dépendre d’eux pour l’optimisation de leur activité, en l’occurrence dans la région qui m’est attribuée, le nord et le grand-est.
En parallèle du nombre d’anesthésiste évoluant, les pratiques médicales de la spécialité ont changé, avec l’augmentation des actes d’anesthésie, et leur intervention en chirurgie, dans les maternités, aux urgences et pour les endoscopies digestives. A cela s’ajoute la réduction du temps médical disponible par la mise en place du repos de sécurité post-garde et l’augmentation des honoraires qui ont induit une réduction du temps de travail [37].
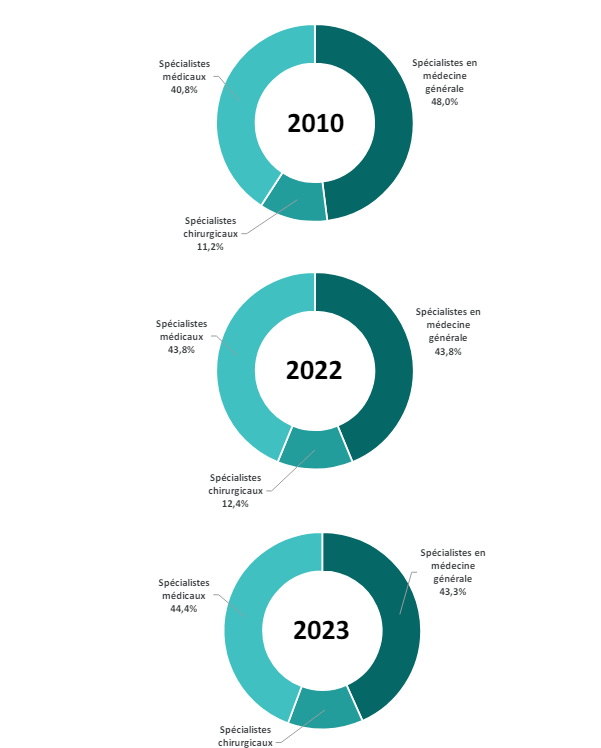
Enfin, la présence de déserts médicaux en France se fait ressentir : plus de 5,4 millions de Français n’ont pas de médecin traitant, et les inégalités territoriales sont importantes. D’après le rapport de la DREES dans le rapport de l’Assemblée nationale début 2022, 11,6% des Français vivraient dans un désert médical. La répartition des médecins de spécialité médecine générale (MG) et des autres spécialités hors MG change : la proportion des spécialistes hors MG augmente aux dépens des spécialistes en MG (figure 19).
Cette répartition ne comble pas les territoires à faible densité de médecins, où les inégalités restent importantes : le déficit de médecins spécialistes hors MG reste important dans de nombreuses régions (figure 20), malgré une meilleure répartition depuis quelques années [39].
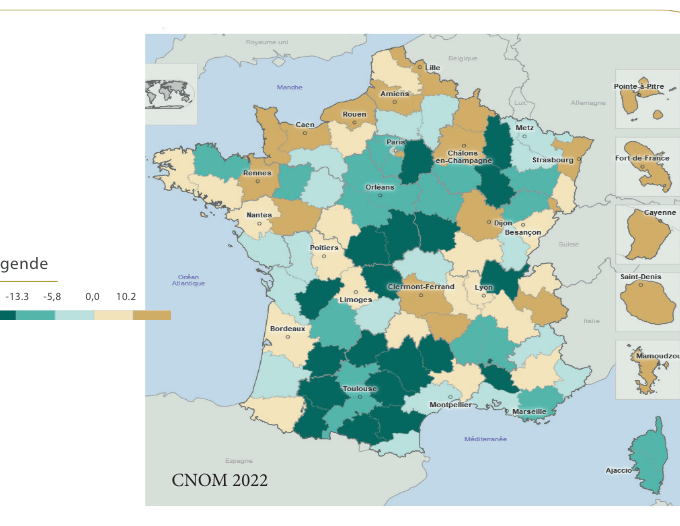
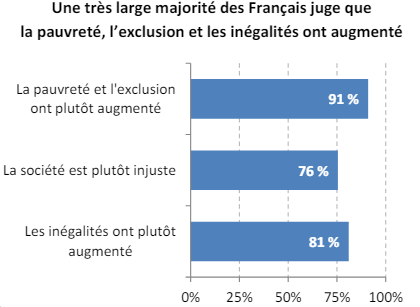
Les inégalités d’accès aux soins sont renforcées, les délais de prise en charge peuvent être importants et entraîner l’aggravation de l’état de santé des patients, la qualité des soins baisse et surtout la satisfaction et la confiance de la population et du personnel médical envers leur système de soins diminuent. En effet, d’après le « baromètre d’opinion » publié par la DREES en 2015, « une large part des Français estime qu’il y a eu une hausse des inégalités, de la pauvreté et de l’exclusion », et « plus de 40% pensent que leur situation est plus difficile que celle de leurs parents » [40]. Un rapport de l’Institut Français d’Opinion Publique (IFOP) de 2022 confirme la confiance de la majorité des Français dans leur système de santé, mais que ces mêmes Français soulignent le manque de personnel soignant et les difficultés d’accès aux soins sur l’ensemble du territoire. L’avis de la population et leur peur pour le futur qui s’ajoute à tous les problèmes économiques, démographiques et sociaux auquel fait face le système de santé français conduisent à de nombreuses mesures et lois pour améliorer la situation et prévenir au mieux les problèmes futurs [41].
IV. Les stratégies nationales de santé
Ces changements dans la démographie française et dans la démographie médicale, ainsi que l’augmentation de l’endettement et des dépenses de santé sont progressivement pris en compte. De nombreuses mesures sont mises en place par le gouvernement avec le temps afin d’optimiser le système de santé français : depuis 1991, les réformes de santé se multiplient dans le cadre de la Stratégie Nationale de Santé (SNS), émise par le ministère chargé de la santé, fixant des objectifs prioritaires pour cinq ans (Annexe 2). Par ailleurs, les soins en ambulatoire représentent une solution en faveur de la régulation des coûts et d’un meilleur accès aux soins. En ce sens, le « virage ambulatoire » est officialisés dès les textes de 1991, avec pour but d’améliorer la qualité de prise en charge et de confort des patients [42].
a. Les réformes pour améliorer le système national de santé
La loi de modernisation du système de santé français (Loi n°2016-41)
Le ministère des Affaires Sociales et de la Santé affirme dans un rapport que « notre système de santé laisse subsister d’importantes inégalités et n’est pas préparé à l’évolution des besoins de la population ». Il met alors en place la réforme de 2016, la loi de modernisation du système de santé français, avec pour but de rassembler les acteurs de la santé autour d’une stratégie partagée, autour de trois axes d’amélioration :
- Le renforcement de la prévention ;
- La réorganisation autour des soins de proximité à partir du médecin généraliste, avec, entre autres, l’annonce du « virage ambulatoire » ou la relance du Dossier Médical Partagé (DMP) ;
- Le développement des droits des patients avec un renforcement de la démocratie sanitaire.
Dans la continuité, la SNS 2018-2022 repose sur la prévention, la lutte contre les inégalités sociales et territoriales d’accès à la santé, la pertinence et la qualité des soins, et le soutien à la recherche. Ces objectifs nationaux sont déclinés à l’échelle régionale au niveau des Agences Régionales de Santé (ARS) en projet régionaux de santé (PRS).
La loi ma santé 2022
La loi Ma santé 2022, annoncée par le président de la République Emmanuel Macron en septembre 2022, propose des réponses aux différents défis et changements auxquels fait face le système de santé du pays, tant dans les inégalités d’accès aux soins que dans la répartition de la démographie médicale ou dans l’optimisation des dépenses de santé.
Cet « engagement collectif » a pour but une fois de plus de réorganiser les soins entre la médecine de ville et les spécialistes, avec la généralisation des Communautés Professionnelles Territoriales de Santé (CPTS) et des Maisons de Santé Pluriprofessionnelles (MSP), regroupant personnels médicaux et paramédicaux, et offrant une meilleure coordination des soins et une prise en charge globale des patients. Les objectifs ici sont d’offrir une meilleure coordination des soins et une prise en charge plus globale des patients, de mieux répartir l’offre de soins. L’offre hospitalière est repensée pour délocaliser les soins primaires aux établissements de proximité, et, par conséquent, de s’adapter au vieillissement de la population et à l’augmentation des maladies chroniques, et de participer au désengorgement des urgences. L’hôpital n’est alors plus le centre mais une étape de la prise en charge des patients, et leur parcours est fluidifié. De plus, la lutte contre l’inégalité d’accès aux soins primaires est soutenue par l’encouragement du développement de la télémédecine, permettant aux patients éloignés des centres de santé de consulter un médecin plus facilement [43].
La loi Ma Santé 2022 a aussi prévu sa réponse à la baisse du nombre de médecins : les études de santé sont revues de la première à la sixième année d’études. En 2021 a eu lieu la fin du numerus clausus, pour la mise en place d’un numerus apertus (nombre ouvert), qui permettrait d’accepter plus d’étudiants en deuxième année d’études de médecine. Le nombre de places n’est plus fixé par les ministères mais par les universités elles-mêmes. Ainsi, 13 050 étudiants supplémentaires seraient prévus de 2021 à 2025 par rapport à la période de 2016 à 2020. De plus, les lieux de formations seraient étendus aux déserts médicaux, afin de prévenir le surplus d’étudiants en stage d’externat par médecin et par service, et de sensibiliser dès le début des études à l’installation dans ces régions. Enfin, la loi a eu pour projet d’en finir avec la voie royale et sélective d’accès aux spécialités médicales : l’ECN fut remplacé par l’Examen Dématérialisé National (EDN) en 2021. L’EDN est nouveau par la meilleure valorisation et répartition des coefficients des expériences cliniques de l’externe et de son parcours, et un meilleur accompagnement de l’externe dans le choix de ses études d’interne, ainsi que la hiérarchisation des connaissances à maîtriser pour les épreuves théoriques de début de sixième année. Ainsi, le but serait de faciliter la spécialisation des étudiants dès le début de leur parcours, et de mieux répartir les médecins spécialistes sur l’ensemble du territoire [43] [44].
Enfin, la loi apporte son soutien aux projets d’innovation en chirurgie ambulatoire. L’Etat a notamment lancé un appel à projet « accompagner le développement de la chirurgie ambulatoire par des projets d’innovation en chirurgie ambulatoire ».
b. L’encouragement au virage ambulatoire
Dans un contexte où le besoin en anesthésie pour les actes chirurgicaux et interventionnels augmente et où le manque de spécialistes en anesthésie-réanimation est important, le virage ambulatoire se présente comme une solution idéale pour répondre à cette problématique. Il faciliterait l’organisation de ces actes en réduisant le temps des anesthésistes requis pour un patient, les rendant plus disponibles pour d’autres actes, réduirait les durées d’hospitalisation et les coûts d’hospitalisation par la même occasion, et améliorerait le confort du patient grâce à une prise en charge plus rapide et moins contraignantes. Cependant, sa mise en place est complexe, et doit s’accompagner d’une évolution des pratiques.
La chirurgie ambulatoire en France
Le mode de prise en charge ambulatoire correspond à la prise en charge des patients en moins de douze heures, sans nécessité d’hospitalisation. Elle est définie par la Haute Autorité de Santé en 2012 comme « une chirurgie programmée et réalisée dans les conditions techniques nécessitant impérativement la sécurité d’un bloc opératoire, sous une anesthésie de mode variable, suivie d’une surveillance postopératoire permettant, sans risque majoré, la sortie du patient le jour même de son intervention » [45]. En pratique, c’est une intervention chirurgicale qui permet la sortie du patient en moins de douze heures.
Sur l’ensemble de la chirurgie, d’après une enquête menée par l’International Association Ambulatory Surgery (IAAS), le taux de chirurgie ambulatoire en France est de 36% contre plus de 50% dans plusieurs pays du nord de l’Europe [45]. D’après Visuchir, l’outil mis à disposition par l’Assurance Maladie présentant des données sur les pratiques chirurgicales, ce taux atteint 62,8% en 2022, représentant près de 4 millions de séjours, et, mise à part la Guyane (35%), toutes les régions dépassaient les 60%. La marge de progression reste importante puisqu’on estime encore 1,21 million d’actes chirurgicaux potentiellement transférables en ambulatoire, ce qui permettrait d’atteindre un taux de plus de 80%. Ce taux dépend du type d’acte réalisé et de la spécialité médicale concernée. En effet, la chirurgie en ophtalmologie était à plus de 90% en ambulatoire contre 44% en urologie en 2022 [46].
La notion du virage ambulatoire comme objectif des politiques de santé a commencé à émerger lors des débats de la SNS de 2013. Les différentes mesures mises en place depuis ont pour objectif de rattraper le retard de la France par rapport aux autres pays européens sur le taux de chirurgie ambulatoire, mais aussi de répondre aux nombreux défis sociaux et financiers évoqués plus tôt. En ce sens, la loi de 2016 évoque d’une part la réduction des hospitalisations conventionnelles au profit d’hospitalisations de jour, et d’autres part la substitution des soins hospitaliers par des soins médicaux et paramédicaux en ville. Plus tard, la loi ma santé 2022 annonçait l’objectif de porter à 70% le taux de chirurgie ambulatoire en 2022 : comme évoqué précédemment, il n’est pas atteint, mais a grandement progressé depuis plusieurs années, et présente toujours un potentiel d’augmenter [42]. Différentes mesures sont mises en place à cet effet, telles que la mise en place d’un tarif unique, entre les séjours de chirurgie ambulatoire et ceux présentant le degré le plus faible de sévérité en hospitalisation conventionnelle, pour des interventions chirurgicales pour lesquelles étaient observé, selon l’instruction en vigueur du ministère, « un contenu médical similaire entre ces niveaux et une prise en charge réalisable en ambulatoire ». De plus, les seuils de durée de séjour en hospitalisation conventionnelles en deçà desquels les tarifs étaient minorés de 50% ont été supprimés [42]. De leur côté, les sociétés savantes émettent des recommandations afin de guider et rassurer les praticiens sur la qualité et la sécurité des actes ambulatoires et leurs avantages [47].
Avantages et limites de la chirurgie ambulatoire
Ces mesures sont mises en place car il existe des avantages à la chirurgie ambulatoire sur plusieurs plans. Pour le patient, elle réduit l’inconfort grâce à une prise en charge plus rapide (chez soi est toujours plus agréable qu’un lit d’hôpital) et moins contraignante, et réduit le risque d’infection nosocomiales et associées aux soins puisqu’il augmente avec la durée d’hospitalisation. La chirurgie ambulatoire permet également une meilleure organisation des services de chirurgie avec une optimisation des conditions de travail et un gain de temps considérable. Enfin, d’un point de vue financier, et c’est ce qui fait de cette mesure un point phare des différentes SNS qui l’évoquent, la chirurgie ambulatoire mobilise moins de ressources que la chirurgie avec hospitalisation conventionnelle. En effet, les frais d’hébergement et de restauration sont moindres, la quantité de soins et d’examens complémentaires est diminuée, des lits sont libérés pour les patients plus lourds, moins de matériel médical est nécessaire, la planification est plus simple et plus rapide, et les complications et réhospitalisations sont moins courantes [48].
Malgré les avantages indéniables, la chirurgie ambulatoire doit répondre à certains critères et ne peux pas être appliquée dans tous les cas [45]. En particulier, le patient ne doit pas présenter de comorbidités, doit être en bonne condition physique, afin de réduire le risque de complications, et son contexte social doit être stable afin de pouvoir être correctement accompagné après l’intervention. De plus, alors que les avantages cités précédemment pourraient laisser penser que durant une crise épidémique telle que la crise du COVID, la chirurgie ambulatoire serait mise en avant, le constat est paradoxal : 80% des prises en charge en ambulatoires ont été déprogrammées contre 58% des chirurgies avec hospitalisation conventionnelle, chiffres dus à une méconnaissances des apports de la chirurgie ambulatoire [47]. Enfin, tous les actes chirurgicaux ne sont pas réalisables en ambulatoires. Ces quelques limites restent moindres en comparaison des avantages que la chirurgie ambulatoire apporte, et que la SNS met en avant depuis quelques années en France, et les avancées technologiques en termes de DM permettent de faciliter la réalisation de nombreux actes chirurgicaux en ambulatoire.
Chirurgie ambulatoire et cardiologie interventionnelle
La cardiologie interventionnelle permet de réaliser des procédures sans passer par une chirurgie à cœur ouvert. Ces procédures n’étaient pas possibles par le passé, mais l’évolution des technologies et techniques permettent de faciliter le parcours patient en rendant l’opération mini-invasive. Alors, quand le contexte et les conditions cliniques le permettent, certaines procédures chirurgicales sont transmises à la cardiologie interventionnelle. Or, alors que la cardiologie interventionnelle représente plus de 5% des séjours chirurgicaux et interventionnels, moins de 10% des 400 000 séjours en cardiologie interventionnelle ont eu lieu sans nuit d’hospitalisation en 2017. La cardiologie interventionnelle représente alors un potentiel important pour atteindre les 70% prévus par le plan Ma Santé 2022, et rattraper le retard sur les objectifs [49].
Chapitre III : La mini-sonde ETO de GE HealthCare : une innovation pour la chirurgie ambulatoire
V. La mini sonde
L’objectif de l’ETO en cardiologie interventionnelle est donc de guider l’intervention, mais aussi de sécuriser la ponction transseptale, c’est-à-dire le passage du cathéter de l’OD à l’OG. Le risque est de perforer les zones péricardiques ou l’aorte, et possiblement entraîner un AVC, une tamponnade voire une mort subite. L’ETO, au-delà de ce guidage, permet de s’intéresser à d’autres paramètres plus précis, comme la mesure de la taille de la déhiscence en cas de fermeture de CIA, ou l’évaluation de la fuite concernée en cas de réparation de valve.
Aujourd’hui, pour ces interventions chez l’adulte, c’est la sonde 6T (2D) ou la 6VT (3D/4D) qui sont utilisées. Les sondes 10T (2D) et 9VT (3D/4D) sont les sondes ETO pédiatriques. On appelle aussi la 10T micro-sonde, et la 9VT la mini-sonde, puisque ces dernières voient leur utilisation chez l’adulte se démocratiser dans les quelques indications de l’ETO en cardiologie interventionnelle. En 2022 commence la commercialisation de la mini-sonde ETO, la 9VT. Cette dernière révolutionne encore l’ETO en cardiologie interventionnelle, puisqu’elle complète les avancées permises par la micro-sonde, en offrant la possibilité d’obtenir des images en plusieurs dimensions.
La pointe de la micro-sonde de 5,2mm, soit presque 2 fois moins que sa grande sœur, offre une bien meilleure tolérance chez le patient. De nombreuses études sont publiées depuis quelques années appuyant les bénéfices de la sonde pour le patient, ajoutés à la qualité d’image et à la simplification de l’intervention. Alors que, très récemment et avant le début de la production des sondes ETO volumiques pour la pédiatrie, c’est la sonde 10T qui présentait son potentiel en cardiologie interventionnelle adulte, elle n’était encore que peu démocratisée, car la qualité d’image n’était pas encore assez bonne, et la possibilité d’obtenir une image volumique n’était pas encore là. Ce sont les deux inconvénients qui se présentaient à la sonde et qui limitaient donc son utilisation chez l’adulte. Malgré ces problèmes, le volume de vente de la 10T continuait de croître et les preuves de son efficacité s’accumulaient. La nouvelle sonde 9VT sortie plus tard répondit à tous ces problèmes : son excellente qualité d’image et la possibilité d’obtenir des volumes à plusieurs dimensions offrent des avantages indéniables à la sonde adulte classique dans de nombreuses indications de l’ETO en cardiologie interventionnelle. Son intérêt a été principalement mesuré pour les FOP et les FAG, et de nombreuses études ont été relayées à ces sujets.
a. Des procédures sans anesthésie générale pour le confort du patient
L’ensemble des médecins et des patients que j’ai pu interroger l’affirment : la tolérance de la micro-sonde est excellente. Une étude d’impact réalisée en interne chez GE montre l’efficacité de la sonde sur ce point sur des cohortes de 20 patients par procédure et par type de sonde. Cette meilleure tolérance qui est avérée simplifie déjà l’intervention du point de vue du patient et de l’anesthésiste : les interventions qui auparavant nécessitaient 3 jours d’hospitalisation, une anesthésie générale, beaucoup de brancardage et un passage en service de soins post interventionnels, n’en requiers plus qu’un. En effet, la taille de la sonde classique oblige l’anesthésie générale, les risques dus à cette anesthésie augmentent, de nombreux personnels paramédicaux sont mobilisés, et, surtout, le patient n’est pas conscient de l’intervention qu’il subit. La mini-sonde permet alors de ne pas avoir à recourir à l’anesthésie générale, pour une insertion de sonde d’environ 24 minutes pendant l’intervention [50]. Le déroulement de l’intervention a alors évolué, et les praticiens se voient attribués de nouvelles tâches : le cardiologue échographiste prend le temps d’expliquer la démarche au patient éveillé, le produit anesthésique local est placé dans la bouche, puis un second est vaporisé au fond de sa gorge, le cale-dent est placé et l’échographiste passe la sonde dans la bouche du patient. Le plus dur est alors franchi pour le patient. Les échanges entre les différents praticiens continuent alors pour la bonne réalisation de l’intervention, et le positionnement de la sonde est modifié en temps réel pour obtenir des vues idéale, grâce aux commandes de flexion et rotation de la sonde. L’intervention se finit rapidement, et une ETT est réalisée après avoir retiré la 10T pour vérifier le bon état du péricarde.
L’inconfort de la sonde est donc pallié par l’anesthésie local, l’intervention est réalisée rapidement et efficacement, la collaboration entre les praticiens permet un travail d’équipe efficace, le patient est satisfait, et ressort le jour-même de l’intervention. Enfin, les objectifs de performance sont atteints : la médecine ambulatoire est favorisée, les ressources sont économisées et l’activité évolue. Cette nouvelle procédure pour l’intervention implique que la présence d’un anesthésiste n’est plus nécessaire, ce qui pallie le manque d’anesthésiste évoqué au chapitre II. Néanmoins, un anesthésiste pourra toujours intervenir en cas de bascule vers l’ETO classique si besoin, ou l’intervention peut être facilement reprogrammée. Ce taux de conversion d’anesthésie locale à générale reste minime, d’après l’étude menée par GE. Enfin, des ressources telles que le curare sont économisées, et peuvent être mobilisées pour d’autres interventions. Durant la pandémie de COVID, ces économies ont permis de pallier le manque d’approvisionnement, et de continuer l’activité en cardiologie interventionnelle.
La suppression de l’étape d’anesthésie générale a aussi modifié l’activité des praticiens de manière plus générale : le service de cardiologie interventionnelle augmente son activité et son efficacité, et les anesthésistes se recentrent sur d’autres. Il n’y a plus besoin de visite préanesthésique pour le patient, des lits d’hospitalisations se libèrent et laisse la place pour d’autres patients. Les patients quittent souvent l’hôpital de jour 4 à 6 heures après leur intervention, et peuvent rentrer chez eux. Une infirmière les appelles le lendemain pour un contrôle, et une ETT de contrôle est réalisée 6 mois après l’intervention.
Enfin, d’après mes discussions avec des échographistes, aucune complication imputable à la micro-sonde ou la mini-sonde n’a été répertoriée. La meilleure appréhension de l’intervention par le patient est justifiée, puisqu’elle s’accompagne d’une réduction de tous les risques et toutes les contraintes qu’implique l’anesthésie générale. Pour les patients ayant déjà fait de l’ETO auparavant, voir la mini-sonde est très rassurant.
b. Des économies budgétaires
Les changements dans la pratique et dans la stratégie thérapeutique dus à la miniaturisation de la sonde impliquent des résultats positifs sur les aspects de santé et du parcours patient, mais aussi sur l’aspect financier. En effet, des économies sont effectuées grâce à la réduction de l’utilisation de produits anesthésiants, de la mobilisation du temps disponible du personnel, du taux d’occupation des lits d’hospitalisation et de toutes les dépenses associées (repas, soins…) et des délais d’attente, avec un volume d’activité plus important. Les frais de santé du patient sont fortement diminués, et les coûts globaux sont optimisés également pour l’hôpital et la Sécurité Sociale.
Les DM impliqués dans ces interventions sont aujourd’hui totalement remboursés, comme les MitraClip ou TriClip, ou les Amplatzer PFO Occluder de Abbott Medical. La base de remboursement de l’anesthésie locale s’élève à 96,50 € pour ces interventions. Le reste à charge pour les patients est très faible, et les coûts en termes d’anesthésie sont fortement diminués. Cette optimisation de l’activité hospitalière encourage les établissements à se munir d’une mini-sonde ETO pour favoriser la prise en charge des patients pour FAG et FOP en ambulatoire, et répondre ainsi aux exigences de l’Etat dans le but d’atteindre le taux d’ambulatoire fixé comme objectif. En 2019, on compte en effet 3 150 actes de fermeture de FOP, soit sept fois plus qu’en 2016, et ce nombre est principalement dû à l’augmentation de l’activité grâce à la facilitation de l’acte avec la micro-sonde [51].
c. Les axes d’amélioration
Cette bascule vers l’ambulatoire ne repose pas seulement sur la miniaturisation de la sonde : c’est, d’après de nombreux médecins que j’ai pu interroger, la sécurité du patient et son confort qui restent prioritaires. Toutes les procédures de cardiologie structurelle interventionnelle ne peuvent pas encore être prises en charge par l’ambulatoire. Le temps important nécessaire pour certaines interventions ne permet pas de basculer vers l’ambulatoire : même si la sonde est mieux tolérée, la garder trop longtemps dans l’œsophage est désagréable pour le patient et peut laisser des séquelles. De plus, certaines interventions doivent être suivie par une surveillance du patient plus accrue, puisqu’elles peuvent impliquer plusieurs conséquences chez le patient. C’est le cas des fermetures de CIA, où le risque d’embolisation de prothèse est important, et qui nécessitent une surveillance clinique et rythmologique pendant 48. La bascule vers l’ambulatoire est alors difficile dans un tel contexte.
Cependant, l’arrivée très récente de la 9VT permet de faciliter ces interventions avec une meilleure qualité d’image, et la possibilité de naviguer dans des volumes. La sécurité des actes est améliorée grâce à une précision plus accrue, permise par la 4D. c’est une option qui était fortement attendue par de nombreux praticiens : une combinaison de la micro-sonde et de la sonde classique volumique. Cette dernière version de la sonde ETO offre les mêmes possibilités que la 6VT, pour une qualité d’image quasi similaire. La 4D augmente la précision de l’acte et réduit les risques d’erreur, puisque le guidage est facilité et optimal, en temps réel. Enfin, son diamètre à peine plus grand que celui de la sonde classique reste moins désagréable pour le patient et permet les interventions en ambulatoire.
A l’avenir, l’ambulatoire pourrait être proposé également aux interventions plus complexes, telles que les réparations mitrales ou tricuspide. Cela implique le besoin d’augmenter l’efficacité, afin de réduire le temps d’insertion de la sonde dans l’œsophage pour réduire l’inconfort du patient. De plus, de nouvelles indications sont envisagées pour un remboursement de FAG, comment le cardiologue Dr Nicolas AMABILE a exposé dans un webinar au Collège National des Cardiologues des Hôpitaux en 2021 (figure 22).
VI. Le rôle d’ingénieur d’application
a. Un métier essentiel
L’ingénieur d’application est un expert de son produit. Il participe à la gestion de la base installée. Il fait l’intermédiaire entre le praticien, expert clinique, le vendeur, le technicien, et la machine. Il forme les utilisateurs et futurs utilisateurs à l’utilisation de la machine et aux nouvelles techniques qui se développent régulièrement. Il participe au développement du produit en étant chaque jour à ses côtés et en face des médecins, ains qu’en observant et en participant à l’évolution des pratiques. Il est pro-actif et répond aux besoins des médecins en configurant les appareils selon leurs besoins. L’environnement chez GEHC facilite cette implication dans la clinique et la formation des utilisateurs, tant sur le plan pratique de l’échographie que clinique, avec l’organisation régulière des Septimus et de formations ou workshop sur l’ensemble du territoires, accessibles à tous les médecins.
Ce rôle est alors indispensable en imagerie médicale, et il est voué à l’être d’autant plus dans le futur. Des nouvelles pratiques comme celle de cardiologie interventionnelle guidée par les mini-sondes ETO sont permises par la collaboration entre les médecins chercheurs et les entreprises comme GE HealthCare, par l’intermédiaire notamment des ingénieurs d’application. Il reste l’interface entre le monde médical et technologique, et le contact humain du médecin.
Enfin, il joue un rôle important aussi dans la vente des machines, puisqu’il organise et participe aux démonstrations. Le choix du médecin ne se joue pas que dans le logo affiché sur la machine ou ses options, mais aussi dans le service qu’il obtiendra après avoir acquis l’échographe. Avant l’achat, que le médecin passe par un appel d’offre ou non, il est essentiel de lui montrer toutes les fonctionnalités de l’appareil et ce que lui apportera d’acheter telle machine ou une autre. C’est un des rôles essentiels de l’ingénieur d’application qui ne pourra, selon moi, jamais être remplacé. Le contact avec le client est indispensable, puisque l’ingénieur d’application doit convaincre le futur client. Une fois de plus, être client chez GE HealthCare ne se limite pas qu’à la possession d’une machine : il sera accompagné de l’ingénieur d’application pour ses formations, pour la configuration de son appareil, il aura accès à de nombreux worshop et webinars, et un service client toujours disponible.
b. L’ingénieur d’applications dans le futur
Bien que de nombreux outils soient développés régulièrement, facilitant certaines missions de l’ingénieur d’applications, l’ingénieur d’application évoluera mais ne disparaîtra pas. Parmi ces outils, il y a l’application à distance qui existe depuis quelques années, qui permet à l’équipe à distance de prendre en main la machine et d’effectuer tous les réglages possibles d’un ingénieur d’applications à distance, réduisant ainsi, quand c’est possible, les besoins de déplacements, et permettant au médecin d’avoir les réglages dont il a besoin au plus vite. Ensuite, le choix des machines pour une démonstration sera bientôt facilité par l’anticipation des besoins du médecin, grâce à un outil en ligne qui permettrait de faire une demande et de personnaliser la machine selon ses envies. Enfin, un outil comme Verisound Fleet permet de gérer toute une flotte de machines au niveau de leur préréglages d’imagerie, et d’analyser l’activité des échographes (les modes utilisés, les types d’examens réalisés…) pour étudier l’évolution des pratiques et s’adapter aux besoins.
Conclusion
L’échocardiographie est indispensable à l’étude de la structure et de la fonction cardiaque. L’ETO s’est rapidement implantée en cardiologie interventionnelle grâce à l’évolution rapide de la technologie et des possibilités qu’elle offre, notamment l’imagerie 3D/4D. Elle permet de guider le cardiologue interventionnel lors des chirurgies percutanées dans plusieurs indications, telles que la fermeture de FOP ou la FAG, ou les réparations de valve.
L’état du système de santé français qui s’est longtemps dégradé connaît progressivement un renouveau grâce aux stratégies nationales de santé depuis quelques années, qui ont imposé des objectifs et entraînés différentes lois et directives pour l’améliorer, en particulier la volonté d’un « virage ambulatoire ». Ainsi, ces objectifs sont relativement atteints, petit à petit, et l’innovation technologique y participe grandement.
La miniaturisation de la sonde ETO participe grandement à ce virage ambulatoire dans une spécialité qui se base encore beaucoup sur les hospitalisations conventionnelles dans la prise en charge de ses patients. Elle améliore la performance des services de cardiologie interventionnelle en réduisant les besoins en ressources matérielles, financières et humaines. Les économies sont considérables sur tous ces points, et le parcours du patient est grandement facilité, avec une prise en charge rapide et aux risques réduits.
La mini-sonde 9VT offre de nouvelles possibilités, depuis sa commercialisation en 2022, grâce à l’imagerie volumique qu’elle propose. Ainsi, les indications pourraient s’élargir à de nouveaux cas cliniques et de nouvelles pathologies à traiter. En clair, le champ des possible reste vaste dans l’innovation en cardiologie interventionnelle et en ETO.
J’ai pu écrire ce rapport grâce à toutes les études et tous les articles que j’ai lu, mais aussi grâce à mon expérience en tant qu’ingénieur d’applications ultrasons cardiovasculaire. J’ai pu découvrir le métier en travaillant avec les meilleures machines du marché, dans un environnement riche, et au contact des médecins tous les jours. J’ai pu apprendre beaucoup, tant sur la technologie que sur la pratique clinique, et enrichir mes propos des témoignages que j’ai pu récolter et des expériences que j’ai vécues. J’ai très apprécié travailler avec mon équipe, dans un tel environnement, et j’ai encore beaucoup à apprendre durant mes deux mois de stages restants, durant lesquels je vais également pouvoir ouvrir les nombreuses portes qui s’ouvriront à moi, dans un domaine très vaste.
Bibliographie
[1] E. Inge, K. Lindström. “The History of Echocardiography.” Ultrasound in Medicine & Biology 30, no. 12 (2004): 1565–1644. https://doi.org/10.1016/S0301-5629(99)00056-3.
[2] « L’imagerie en France : état des lieux ». Consulté le 28 mai 2024. [En ligne]. Disponible sur : https://www.snitem.fr/presse/limagerie-en-france-etat-des-lieux/.
[3] « FDA publishes list of AI-enabled medical devices | UW Radiology ». Consulté le 28 mai 2024. [En ligne]. Disponible sur : https://rad.washington.edu/news/fda-publishes-list-of-ai-enabled-medical-devices/.
[4] M. Gautier. « L’imagerie médicale en France ». Statista. Consulté le 28 mai 2024. [En ligne]. Disponible sur : https://fr.statista.com/themes/3959/l-imagerie-medicale-en-france/.
[5] « Anatomie et physiologie. » Centre Hospitalier Universitaire Vaudois.. Consulté le 29 mai 2024. [En ligne]. Disponible sur : https://www.chuv.ch/fr/transplantation/cto-home/patients-et-familles/coeur/anatomie-et-physiologie.
[6] « Le fonctionnement du cœur ». Fédération Française de Cardiologie. Consulté le 29 mai 2024. [En ligne]. Disponible sur : https://www.fedecardio.org/je-m-informe/le-fonctionnement-du-coeur/.
[7] F.H. Netter. Atlas d’anatomie humaine. 7e éd. Issy-les-Moulineaux : Elsevier Masson, 2019.
[8] « Anatomy Tutorial - Cardiac Valve Nomenclature | Atlas of Human Cardiac Anatomy ». Consulté le 29 mai. [En ligne]. Disponible sur : https://www.vhlab.umn.edu/atlas/anatomy-tutorial/cardiac-valve-nomenclature.shtml.
[9] Pamela S. et al. « ACCF/ASE/ACEP/ASNC/SCAI/SCCT/SCMR 2007 Appropriateness Criteria for Transthoracic and Transesophageal Echocardiography ». Journal of the American College of Cardiology 50, no 2 (10 juillet 2007) : 187‑204. https://doi.org/10.1016/j.jacc.2007.05.003.
[10] « Echocardiographie doppler transthoracique : principales indications et conditions de réalisation ». Texte court du rapport d’évaluation technologique. HAS, mai 2012.
[11] L. Davin, R. Dulgheru, S. Marchetta, P. Lancellotti. « Imagerie non invasive et cardiologie interventionnelle ». Rev Med Liege, no 74 (2019): 10‑16.
[12] A. Raghavendrarao, S. Kumar, K. Balamurugan. « Left Atrial Ball Thrombus ». Indian Journal of Thoracic and Cardiovascular Surgery 23, no 1 (1 mars 2007) : 34‑35. https://doi.org/10.1007/s12055-007-0008-7.
[13] "Echographie transoesophagienne", 2018. https://www.youtube.com/watch?v=v9-cecdwVw4.
[14] Bijoy K. Khandheria et al. « Transesophageal Echocardiography : Technique, Anatomic Correlations, Implementation, and Clinical Applications ». Mayo Clinic Proceedings 63, no 7 (juillet 1988) : 649‑80. https://doi.org/10.1016/S0025-6196(12)65529-3.
[15] P. Lancellotti. « L’odyssée de la cardiologie interventionnelle ». Rev Med Liege, no 74 (2019) : 1‑4.
[16] « Comment le cœur fonctionne-t-il ? », 19 septembre 2018. [En ligne]. Disponible sur : https://www.chu-rouen.fr/services/cardiologie/valves-cardiaques/fonctionnement-du-coeur/.
[17] « Dossier spécial - Prise en charge percutanée des patients valvulaires, où en sommes-nous ? » Consulté le 29 mai 2024. [En ligne]. Disponible sur : https://www.cardio-online.fr/Actualites/2021/Dossier-special-prise-en-charge-percutanee-des-patients-valvulaires-ou-en-sommes-nous.
[18] « MITRACLIP ou clip mitral : la réparation mitrale percutanée ». ICPS (blog). Consulté le 29 mai 2024. [En ligne]. Disponible sur : https://icps.fr/cardiologie-interventionnelle/dispositif-mitraclip/.
[19] « TAVI - Valve aortique percutanée à l’ICPS ». ICPS (blog). Consulté le 29 mai 2024. [En ligne]. Disponible sur : https://icps.fr/cardiologie-interventionnelle/le-tavi/.
[20] Édition professionnelle du Manuel MSD. « Insuffisance mitrale - Troubles cardiovasculaires ». Consulté le 29 mai 2024. [En ligne]. Disponible sur : https://www.msdmanuals.com/fr/professional/troubles-cardiovasculaires/valvulopathies/insuffisance-mitrale#Traitement_v938929_fr.
[21] « Insuffisance tricuspidienne - Troubles cardiovasculaires ». Edition professionnelle du Manuel MSD. Consulté le 30 mai 2024. [En ligne]. Disponible sur : https://www.msdmanuals.com/fr/professional/troubles-cardiovasculaires/valvulopathies/insuffisance-tricuspidienne.
[22] T. Murashita. « Collaboration between Interventional Cardiologists and Cardiac Surgeons in the Era of Heart Team Approach ». Interventional Cardiology. InTech, 2017. https://doi.org/10.5772/67788.
[23] « MitraClip - Chirurgie cardiaque - Clinique Saint-Augustin, Bordeaux ». Consulté le 30 mai 2024. [En ligne]. Disponible sur : https://www.chircard-iac.com/interventions/mitraclip/.
[24] Gammie, James S., Michael W. A. Chu, Volkmar Falk, Jessica R. Overbey, Alan J. Moskowitz, Marc Gillinov, Michael J. Mack, et al. « Concomitant Tricuspid Repair in Patients with Degenerative Mitral Regurgitation ». The New England Journal of Medicine 386, no 4 (27 janvier 2022) : 327‑39. https://doi.org/10.1056/NEJMoa2115961.
[25] Mauran, P. « Accident vasculaire cérébral ischémique : la place du foramen ovale perméable et de sa fermeture percutanée ». Archives des Maladies du Coeur et des Vaisseaux - Pratique 2020, no 292 (novembre 2020): 14‑20. https://doi.org/10.1016/j.amcp.2020.09.002.
[26] Swiss Medical Network. « Cardiologie interventionnelle ». Consulté le 2 juin 2024. [En ligne]. Disponible sur : https://www.swissmedical.net/fr/cardiologie/cardiologie-interventionnelle.
[27] « Définition et acteurs du système de santé français ». Vie Publique. Consulté le 2 juin 2024. [En ligne]. Disponible sur : https://www.vie-publique.fr/fiches/37853-definition-et-acteurs-du-systeme-de-sante-francais.
[28] « Espérance de vie à 65 ans ». OCDE. Consulté le 2 juin 2024. [En ligne]. Disponible sur : https://doi.org/10.1787/da7ad49f-fr.
[29] « Mieux connaitre et évaluer la prise en charge des maladies chroniques : lancement de l’enquête PaRIS en septembre 2023 ». Direction de la recherche, des études, de l'évaluation et des statistiques. Consulté le 30 mai 2024. [En ligne]. Disponible sur : https://drees.solidarites-sante.gouv.fr/communique-de-presse/mieux-connaitre-et-evaluer-la-prise-en-charge-des-maladies-chroniques.
[30] Insee. « Population par âge − Tableaux de l’économie française ». Consulté le 30 mai 2024. [En ligne]. Disponible sur : https://www.insee.fr/fr/statistiques/3303333?sommaire=3353488.
[31] Vie publique. « Quelle est la part de la richesse nationale consacrée à la santé ? ». Consulté le 30 mai 2024. [En ligne]. Disponible sur : https://www.vie-publique.fr/fiches/37910-quelle-est-la-part-de-la-richesse-nationale-consacree-la-sante.
[32] Vie publique. « Acteurs du financement de la dépense de santé ». Consulté le 30 mai 2024. [En ligne]. Disponible sur : https://www.vie-publique.fr/fiches/37909-acteurs-du-financement-de-la-depense-de-sante.
[33] « Les dépenses de santé en 2022 - Résultats des comptes de la santé ». Direction de la recherche, des études, de l’évaluation et des statistiques. Consulté le 4 juin 2024. https://drees.solidarites-sante.gouv.fr/publications-communique-de-presse-documents-de-reference/panoramas-de-la-drees/les-depenses-de.
[34] "Définition ONDAM (Objectif national des dépenses d’assurance maladie)". Vie Publique. Consulté le 4 juin 2024. [En ligne]. Disponible sur : https://www.vie-publique.fr/fiches/37919-definition-ondam-objectif-national-des-depenses-dassurance-maladie.
[35] « Lutter contre les déserts médicaux ». Ministère du travail, de la santé et des solidarités, Consulté le 12 juin 2024. [En ligne]. Disponible sur : https://sante.gouv.fr/archives/masante2022/lutter-contre-les-deserts-medicaux/.
[36] « L’accès aux soins des étrangers en situation irrégulière en France. Une analyse critique des projets de réforme de l’aide médicale de l’État ». Fondation Jean-Jaurès. Consulté le 12 juin 2024. [En ligne]. Disponible sur : https://www.jean-jaures.org/publication/lacces-aux-soins-des-etrangers-en-situation-irreguliere-en-france-une-analyse-critique-des-projets-de-reforme-de-laide-medicale-de-letat/.
[37] Claude Ecoffey, Pontone Silvia. « Démographie médicale en anesthésie-réanimation : causes et conséquences ? », 2017.
[38] Lenglart, Fabrice. « Quelle démographie récente et à venir pour les professions médicales et pharmaceutique ? » Les dossiers de la DREES, no 76, mars 2021.
[39] Arnault, François. « Atlas de la démographie médicale en France ». Conseil National de l’Ordre des Médecins, 2022.
[40] « Les Français sont satisfaits du système de soins, mais restent inquiets de la montée de la pauvreté et de l’exclusion ». DREES, février 2015.
[41] IFOP. « Le regard des Français sur le système de santé français ». Consulté le 12 juin 2024. [En ligne]. Disponible sur : https://www.ifop.com/publication/le-regard-des-francais-sur-le-systeme-de-sante-francais/.
[42] « Le virage ambulatoire du système de santé : de nouvelles transformations à engager, en ville comme à l’hôpital ». Cour des Comptes, 2018, 172‑202.
[43] Laetitia. B, Pauline. J, Laetitia. B, et Pauline. J. « Ma santé 2022 : un engagement collectif ». Ministère du travail, de la santé et des solidarités. Consulté le 12 juin 2024. [En ligne]. Disponible sur : https://sante.gouv.fr/archives/masante2022/.
[44] « La réforme des ECN ». Consulté le 13 juin 2024. [En ligne]. Disponible sur : https://www.conference-cartesia.fr/reforme-ecni.
[45] Haute Autorité de Santé. « Ensemble pour le développement de la chirurgie ambulatoire ». HAS. Consulté le 13 juin 2024. [En ligne]. Disponible sur : https://www.has-sante.fr/jcms/c_1241930/fr/ensemble-pour-le-developpement-de-la-chirurgie-ambulatoire.
[46] « Visuchir : les faits marquants des pratiques chirurgicales en 2022 issus de la lettre Visuchir n°1 », 14 juin 2023. [En ligne]. Disponible sur : https://www.ameli.fr/oise/etablissement/actualites/visuchir-les-faits-marquants-des-pratiques-chirurgicales-en-2022-issus-de-la-lettre-visuchir-ndeg1.
[47] « Virage ambulatoire : pour un développement sécurisé ». Rapport de l’HCSP. Paris : Haut Conseil de la Santé Publique, 1 juin 2021. https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=1078.
[48] Mahieu, Arrantxa, et Nadine Raffy-Pihan. La chirurgie ambulatoire en France : bilan et perspectives. Paris : CREDES, 1997.
[49] Cardiologie Pratique. « Virage ambulatoire en rythmologie interventionnelle - Quelles interventions, quels patients, quelle organisation ? », 16 mars 2017. https://www.cardiologie-pratique.com/rythmologies/article/virage-ambulatoire-en-rythmologie-interventionnelle-quelles-interventions-quels.
[50] Sanchis, Laura, Ander Regueiro, Pedro Cepas-Guillén, Marta Sitges, Xavier Freixa. « First experience of left atrial appendage occlusion using a 3D mini transoesophageal echocardiographic probe with conscious sedation ». EuroIntervention 18, no 17 (avril 2023) : 1460‑61. https://doi.org/10.4244/EIJ-D-22-00921.
[51] J.-M, Aubry P., Brochet E. , Nguyen C. , Abtan J. , Garbarz E. , Juliard. « À qui proposer une fermeture de foramen ovale perméable ? » Réalités Cardiologiques, 27 mars 2022. https://www.realites-cardiologiques.com/2022/03/28/a-qui-proposer-une-fermeture-de-foramen-ovale-permeable/.
[52] « GE Healthcare | Accueil ». Consulté le 1 juin 2024. [En ligne]. Disponible sur : https://www.gehealthcare.fr/.
Annexes