IDS059 - Confiance et sécurité dans les examens de biologie médicale. Usage de la norme ISO 22870 spécifique à la biologie délocalisée.
DOI mémoire
https://doi.org/10.34746/jhxh-ge44Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteure

Contact
Citation
A rappeler pour tout usage : G. GOSSIN, « Confiance et sécurité dans les examens de biologie médicale. Usage de la norme ISO 22870 spécifique à la biologie délocalisée », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de stage, juillet 2020, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids059/ ; https://doi.org/10.34746/jhxh-ge44
Article publié
Suite à ces travaux, un article a été publié : ID interne : 2020_10_idsap
Résumé
Le management de la qualité est une notion essentielle d’une démarche qualité fiable et solide. Il permet aux organisations de satisfaire les besoins de leurs clients et de renforcer la performance de leur système en se basant sur un système de management conforme et compétent. Pour cela, la norme ISO 22870 spécifique aux examens de biologie médicale délocalisée, associée à la norme ISO 15189, offre aux laboratoires de biologie la possibilité d’instaurer un climat de confiance entre service de soins et laboratoires en respectant les exigences relatives au management et à la technique. L’utilisation d’outils appropriés permet d’être efficace et efficient sur la gestion d’un projet à long terme.
En effet, ces outils (outil d’autodiagnostic et grille d’audit) sont proposés pour guider les laboratoires dans leur démarche d’accréditation. Ils permettent de statuer sur l’existant et de cibler rapidement les axes d’améliorations à apporter.
Ce mémoire a pour objectif de proposer une démarche qualité au laboratoire du CHU d’Angers souhaitant déposer le dossier de demande d’accréditation selon la norme ISO 22870.
Abstract
Quality management is an essential notion of a reliable and strong quality approach. It allows organizations to meet the needs of their customers and increase the performance of their system based on a compliant and competent management system. For this, the ISO 22870 standard specific to delocalized examinations, associated by the ISO 15189 standard, offers biology laboratories the possibility of establishing a climate of trust between care service and laboratories by respecting the requirements relating to management and to technique. The use of appropriate tools makes it possible to be effective and efficient on a long term project.
Indeed, these tools are offered to guide laboratories in their accreditation process. They make it possible to decide on what already exists and quickly target areas for improvement.
The aim of this thesis is to propose a quality approach to the laboratory of the CHU of Angers wishing to submit the accreditation request file according to ISO 22870 standard.
Téléchargements

Ce mémoire propose une approche méthodique pour aider les laboratoires à obtenir l'accréditation selon la norme ISO 22870.
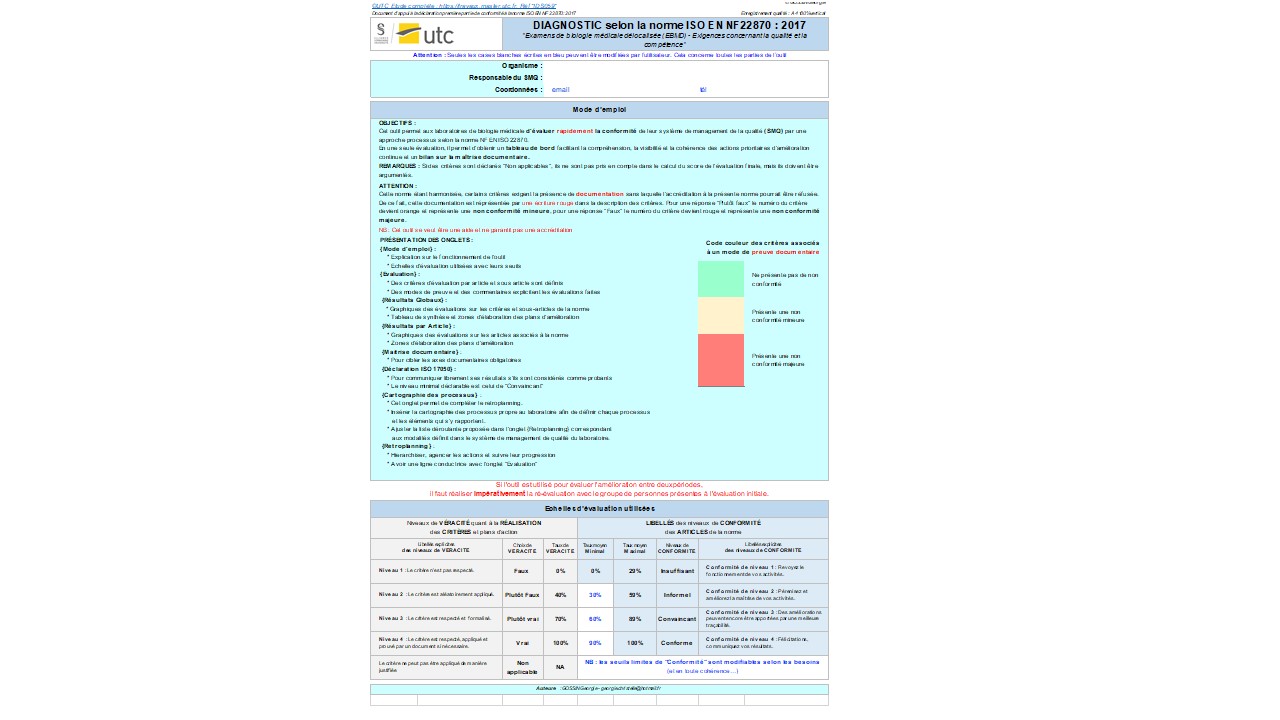
Cet outil d'autodiagnostic permet au laboratoire de biologie de s'évaluer selon la norme ISO 22870.

Cet outil est une grille d'audit afin de réaliser un état des lieux dans les services de soins pour répondre aux exigences de la norme ISO 22870.
Mémoire complet :
Confiance et sécurité dans les examens de biologie médicale.
Usage de la norme ISO 22870 spécifique à la biologie délocalisée.
Introduction
La biologie médicale joue un rôle majeur dans le diagnostic, le dépistage, le suivi de maladies ou encore le traitement délivré au patient.
L’automatisation et la miniaturisation des Dispositifs Médicaux à Diagnostics In Vitro (DMDIV) ont favorisé l'amélioration des performances concernant notamment la disponibilité, l'adaptabilité et la flexibilité des automates et la rapidité du rendu de résultats. Cette biologie au lit du patient permettant aux cliniciens une prise en charge thérapeutique adaptée aux besoins du patient dans un contexte d’urgence.
La quantification économique de la biologie délocalisée repose notamment sur les ressources humaines (gestion des maintenances, formation du personnel soignant, résolution de pannes, gestion des stocks), les réactifs et consommables, la métrologie et les logiciels informatiques, propre à chaque laboratoire selon les dispositions appliquées. Le but étant l’optimisation des coûts/recettes/efficience. L’efficience est le rapport entre le nombre d’examens de biologie délocalisée effectués et les ressources humaines nécessaires pour assurer l’activité de biologie délocalisée.
L’enjeu clinique est de garantir les mêmes exigences de fiabilité et de sécurité sur le rendu du résultat qu’en biologie conventionnelle.
La mise en place de l’assurance qualité au sein des établissements publics est obligatoire, elle concerne aussi bien l’ensemble de l’établissement via la certification HAS que le laboratoire à travers l’accréditation.
La restructuration des laboratoires de biologie médicale (LBM) en France a induit une diminution de structures de « LBM multi-sites ». Cette restructuration a été rapide dans le secteur libéral et de façon plus progressive dans le secteur public avec la mise en place des Groupements Hospitaliers de Territoire (GHT)[3]. Dans ce contexte de distanciation des laboratoires par rapport aux patients et prescripteurs, la biologie délocalisée est source de développement. Le 02/09/2019, la Ministre de la Santé annonçait la volonté de déployer la biologie délocalisée dans le secteur privé pour désengorger les urgences du secteur publique[4].
La décision thérapeutique immédiate choisie face à l’interprétation des résultats impose que la qualité des examens de biologie délocalisée soit équivalente pour tout patient quel que soit le lieu de réalisation de l’analyse.
La biologie délocalisée est régie par l’ordonnance 2010-49[5] portant réforme à la biologie médicale, encadrée par la norme ISO 22870 relative aux exigences de la biologie délocalisée conjointement utilisée à la norme ISO 15189 relative aux exigences des laboratoires de biologie médicale. En l’absence d’accréditation selon la norme ISO 22870 fixée au 01 mai 2021 par la loi n°2020-734, article 23 [6], l’activité de biologie délocalisée est suspendue. L’alternative envisageable est le report des analyses centrées au laboratoire impliquant une réorganisation du service. L’augmentation du temps de réponse analytique peut entraîner une prise en charge du patient différée et induire une perte de chance thérapeutique pour le patient (ex : marqueurs cardiaques).
Avant-Propos
Mon stage s’est déroulé au CHU d’Angers, au sein du Pôle de Biologie et Pathologie. La mission qui m’a été confié est la gestion du projet d’accréditation des appareils de biologie délocalisée effectuant les « Gaz du Sang » selon la norme ISO 22870.
Mon mémoire consiste à vous présenter les différentes étapes de l’élaboration du projet et les outils utilisés en vue de l’évaluation sur site réalisée par le COFRAC.
Une partie des résultats obtenus au sein du laboratoire d’Angers sont annexés afin d’être utiles à l’ensemble des laboratoires effectuant de la biologie délocalisée.
Acronymes
- COFRAC : Comité Français d’Accréditation
- EBMD : Examens de Biologie Médicale Délocalisée
- EN : Norme Européenne
- FORM : Formulaire
- INF : Document d’information
- GTA : Guide technique d’accréditation
- IBS : Institut de Biologie en Santé
- ISO : International Standard Organisation
- LBM : Laboratoire de Biologie Médicale
- NF : Norme française
- REF : Document de références
- SH : Santé Humaine
- SMQ : Système management de la qualité
Lexique
- Accréditation : Reconnaissance formelle de compétences à la réalisation d’activités.
- Amélioration continue : progression de façon régulière.
- Audit : processus documenté permettant la vérification des pratiques, procédures ou exigences.
- Ecart critique : Relevé d’une non-conformité des exigences ayant une incidence sur la fiabilité du résultat.
- Ecart non-critique : Relevé d’une non-conformité des exigences n’ayant pas une incidence sur la fiabilité du résultat.
- Manuel Qualité : Manuel qui décrivant les spécificités relatives au système de management de la qualité d’un organisme.
- Norme : Une norme est un document approuvé par un organisme reconnu et qui fournit des recommandations dans un domaine spécifique.
- Portée d’accréditation : « Enoncé formel et précis des activités pour lesquelles le laboratoire demande l’accréditation ou est accrédité. L’ensemble des informations regroupe la nature des activités, la nature des échantillons biologiques, le type d’examens, la description des principes de méthodes, la référence des méthodes et procédures employées »[1].
- Politique Qualité : « Ensemble des intentions et instructions d’un laboratoire relatives à la qualité, telles qu’exprimées formellement par la direction du laboratoire »[2].
- Processus : Ensemble d’activités liées ou en interaction qui transforment des éléments d’entrée en éléments de sortie.
- Qualité : « Aptitude d’un ensemble de caractéristiques intrinsèques à satisfaire des exigences »[2].
I. Contexte et enjeux
1. Milieu : La biologie au sein du CHU d’Angers
a. Présentation générale et chiffre clés
Situé en Maine-et-Loire, le Centre Hospitalier Universitaire d’Angers doit son patrimoine architectural aux constructeurs du XIIème siècle.
Une période de croissance de 1968 à 2015 (création de dix bâtiments et d’une extension) laisse entendre que le CHU d’Angers est « une ville dans une ville ». En effet, l’établissement est réparti sur 36 hectares.

Le CHU d’Angers [7] a trois missions principales ; l’offre de soins, l’enseignement et la recherche.
- L’offre de soins :
Neuf pôles (le dernier entrant en date au 01 janvier 2020) hospitalo-universitaires qui comportent 60 services cliniques et biologiques (1400 lits et places, environ 195000 patients/an),
Une filière santé maladies rares BRAIN TEAM avec
48 centres pour les maladies rares
1 centre de référence pour la Sclérose Latérale Amyotrophique (SLA)
1 centre de ressources pour la mucoviscidose
1 centre de ressources autisme Pays de la Loire,
Une activité dynamique de greffe (208 en 2018),
Un plateau technique de pointe.
- L’enseignement :
Médical et maïeutique (médecin, pharmaciens et sage-femme) en lien avec la faculté de Santé,
Paramédical avec six instituts de formations (environ 630 étudiants).
- La recherche
209 enseignants-chercheurs
771 publications dans la base mondiale PUBMED
1081 programmes d’essai cliniques
26 familles de brevets en cours en 2018
Le CHU d’Angers est un employeur régional majeur. En 2019, il comptait environ 1200 médecins et pharmaciens ainsi qu’environ 5200 personnels non médicaux, 81% représentant des personnels de soins [7].
En 2019, avec 526M€ de dépenses d’exploitations comprenant les dépenses du personnel, les dépenses médicales, pharmaceutiques, hôtelières, générales ainsi que les amortissements et frais financiers et 19,4M€ d’investissement le CHU d’Angers connaît un retour à l’équilibre financier ce qui permettra l’investissement dans des projets de grandes envergures dont un qui devra faire l’objet d’un examen au Comité interministériel de Performance et de la Modernisation de l’offre de soins (COPERMO) [8].
Dans l’objectif de répondre aux enjeux médicaux et aux nouveaux modes de prise en charge des patients, le CHU d’Angers projette, notamment la création du nouveau pôle Technique Urgences, le bâtiment regroupant les activités de gériatrie et de soins de rééducation ou encore la demande de labellisation, prévue en mai 2020 par l’Agence Régionale de Santé (ARS) pour l’unité de soins intensifs neuro vasculaires.
De plus, pour répondre à la loi « Ma santé 2022 », le CHU d’Angers, établissement support au sein du Groupement de Territoire Hospitalier (49) fera la demande du label « hôpitaux de proximité » en 2020 pour ses dix établissements membres [8].
b. L’Institut de Biologie en Santé (IBS)

Construit en 2011 afin de permettre la centralisation des laboratoires, l’Institut de Biologie en Santé regroupe un Plateau de Biologie Hospitalière (PBH) du CHU ainsi qu’un Institut de Recherche et d’Ingénierie de la Santé (IRIS) de l’université d’Angers [9]. Ce groupement est une synergie pour la mutualisation des compétences et l’économie de moyens.
Le pôle biologie-pathologie est constitué :
De quatre départements (biologie des agents infectieux et pharmacotoxicologie, biochimie-génétique, hématologie-immunologie et pathologie tissulaire et cellulaire),
D’un site unique de Réception Centralisée des Examens Biologiques (RCEB) en lien direct avec un Plateau Technique Automatisé (PTA),
D’une plateforme de biologie et médecine moléculaire,
D’un Centre de Prélèvements et de Consultations Spécialisées (CPCS).
Ces différentes composantes du pôle sont sous la direction d’un chef de pôle, d’un cadre supérieur de santé ainsi que d’un cadre de gestion et sont en collaboration avec la cellule achats, la cellule informatique, la cellule qualité et métrologie.
Focus :
- Réception Centralisée des Examens Biologiques (RCEB)
L’acheminement des prélèvements au sein du CHU est réalisé via 14 lignes de pneumatique fiabilisant le transport des échantillons et garantissant leurs traçabilités depuis le service de soins. En amont, 90% des demandes d’examens sont effectuées à travers la prescription connectée.
Cette réception centralisée mobilise environ 20 ETP techniciens sur une plage horaire allant de 6h45 à 21h15, la nuit étant assurée par l’interne de garde et les techniciens de nuit du plateau technique automatisé.
- Plateau Technique Automatisé (PTA)
Le plateau technique regroupe les analyses d’hématologie cytologie et hémostase, de biochimie, de virologie, de sérologie et d’immunologie. La chaîne robotisée, où sont connectés trois centrifugeuses, des automates d’analyses et une armoire de stockage, permet de limiter les étapes manuelles et d’effectuer un gain temps technicien qui pourra être déployé sur un autre secteur. Le plateau est ouvert en permanence afin de garantir la continuité des soins et mobilise environ 20 ETP techniciens. Au sein du plateau technique automatisé, une équipe dédiée de techniciens en collaboration avec les biologistes gère l’activité de biologie délocalisée.
2. Matière : Les examens de biologie médicale délocalisée au sein du CHU d’Angers
Un examen est dit de biologie délocalisée lorsque son résultat peut engendrer une décision thérapeutique urgente. A titre d’exemple, l’analyse des gaz du sang est d’une part une urgence médicale (pronostic vital qui peut être engagé) et d’autre part une urgence technique (facteurs environnementaux ayant une incidence sur le résultat du patient).
En 2019, le nombre d’examens réalisés au sein du pôle de biologie était de 4 681 000. Les examens de biologie représentant un dixième de l’ensemble des examens (435 349). Sont énumérés dans un examen de biologie médicale délocalisée ; le gaz du sang (pH, pO2 et pCO2) et toutes autres analyses dosées et mesurées sur les automates de biologie délocalisée (le ionogramme (sodium, potassium et chlorure), le calcium ionisé, le glucose, les lactates, la bilirubine, la créatinine, l’hémoglobine totale et la cooxymétrie).
- Les automates
Le pôle de biologie-pathologie possède un parc de 8 automates destinés à la réalisation de la biologie délocalisée répartis sur 8 services différents. Ces automates sont référencés dans la Gestion de Maintenance Assistée par Ordinateur (GMAO) et suivent un programme de maintenance selon les préconisations du fournisseur.
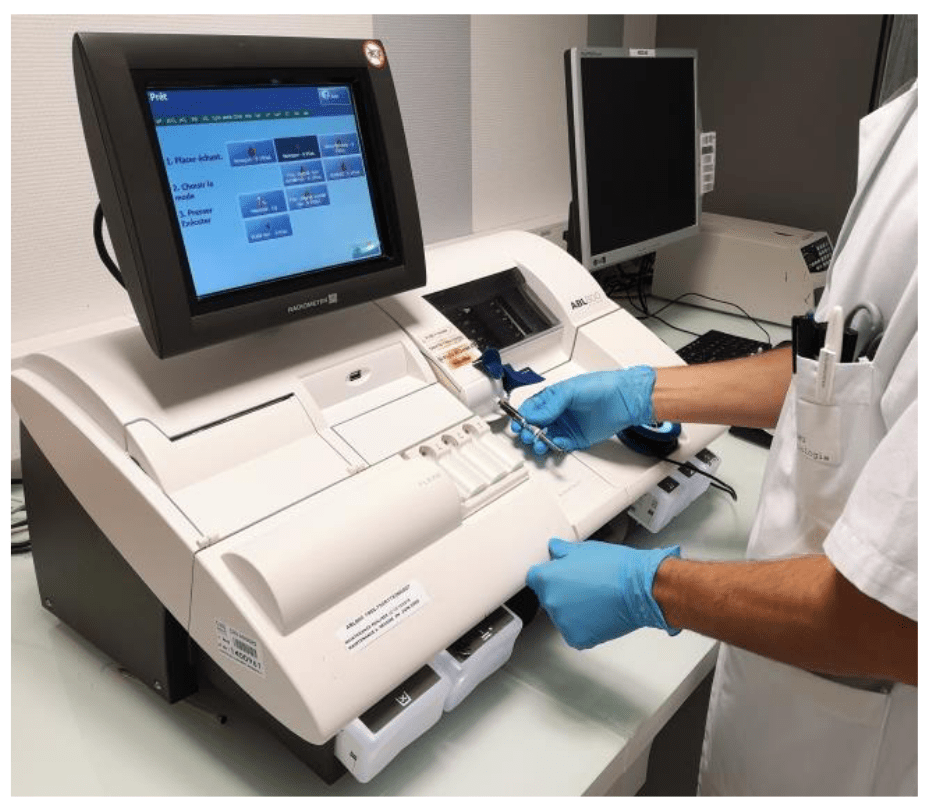
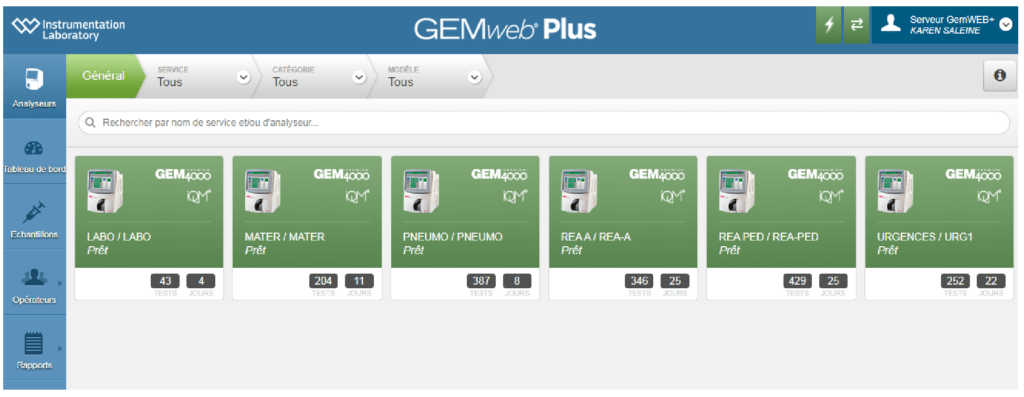
Le laboratoire a fait le choix de travailler sur des ABL 800 (Figure 3) de la société Radiometer (3 automates) et sur des GEM 4000 (Figure 4) de la société Werfen (5 automates) connectés à un concentrateur respectivement Aqure et GemWebplus.

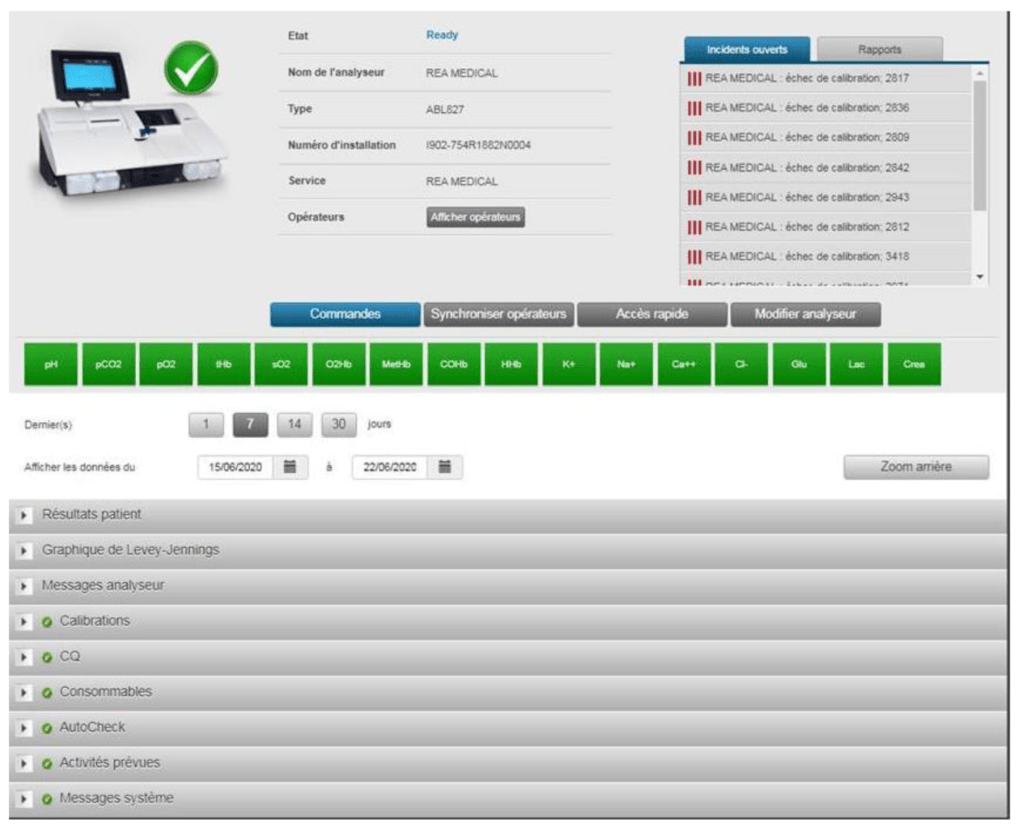
Le concentrateur permet au laboratoire de gérer à distance les automates situés dans les services. Il sert également à valider la formation du personnel par la réalisation d’un quizz permettant d’obtenir ses identifiants opérateurs (Figure 5 et Figure 6). Actuellement, quatre techniciens référents des gaz du sang se partagent les missions de formation, de gestion de pannes et de gestion des Contrôle Interne de Qualité (CIQ) sous la supervision d’un biologiste responsable des examens de biologie médicale délocalisée suppléé par un second biologiste.
- Les analyses mesurées
La réalisation d’un gaz du sang doit s’effectuer par ponction artérielle à l’aide d’une seringue contenant de l’héparine comme anticoagulant. Le test d’Allen doit obligatoirement être réalisé avant toute ponction afin de vérifier la suppléance de l’artère ulinaire [10].
La qualité du prélèvement a une incidence directe sur la fiabilité des résultats. La température du patient et son état d’oxygénation sont deux facteurs à prendre en compte et à renseigner lors de la réalisation de l’analyse sur l’automate afin que certaines valeurs d’analyses (pH, pCO2, pO2) soient corrigées [11].
L’identification du patient est obligatoirement renseignée sur l’échantillon avant analyse.
Une fois le prélèvement réalisé, la vérification pré-analytique est indispensable. En effet, la présence de bulles d’air ou de caillots dans l’échantillon ainsi qu’une sédimentation ou une hémolyse sont des facteurs qui peuvent entraîner des résultats erronés. De plus, la durée de conservation limitée de l’échantillon doit être respectée afin de garantir le résultat obtenu.
Le prélèvement artériel permet au clinicien d’obtenir différentes informations sur l’état de santé du patient selon les analyses mesurées :
- Les gaz du sang
La « gazométrie » comporte les analyses suivantes : le pH, la pression partielle en oxygène (pO2) et la pression partielle en gaz carbonique (pCO2).
L’exploitation de la gazométrie permet d’effectuer une analyse sur l’équilibre acido-basique (pH) du patient ainsi que sur l’état de l’oxygénation du sang (pCO2, pO2 et SO2 : Saturation en oxygène).
- Les électrolytes et métabolites
Les électrolytes comprennent les concentrations en sodium ionisé (cNa+), en potassium ionisé (cK+), en chlorure ionisé (cCl-) et en calcium ionisé (cCa++).
L’exploration de l’équilibre hydro-électrolytique se réalise à l’aide du dosage de ces électrolytes.
Les métabolites regroupent les concentrations en D-Glucose (cGlu), en L(+)-Lactate (cLac), de bilirubine totale (cBil) et de créatinine (cCrea).
La glycémie permet d’apprécier l’état d’équilibre glycémique du patient, notamment dans le cas particulier d’un coma diabétique.
Le dosage des lactates est un indicateur de souffrance tissulaire : manque ou absence d’oxygène. Une hyperlactatémie est un signe de gravité.
La bilirubine, produit de dégradation de l'hème est notamment dosée chez le nourrisson afin de vérifier et d’effectuer la présence ou le suivi d’un ictère.
L’analyse de la créatinine est utilisée pour mesurer l’activité rénale ainsi que le fonctionnement musculaire.
- L’oxymétrie
L’oxymétrie ou co-oxymétrie est composée d’un ensemble d’analyses : la concentration de l’hémoglobine totale (ctHb), la saturation en oxygène (SO2), la fraction d’oxyhémoglobine dans l’hémoglobine totale (FO2Hb), la fraction de carboxyhémoglobine dans l’hémoglobine totale (FCOHb), la fraction de désoxyhémoglobine dans l’hémoglobine totale (FHHb), la fraction de méthémoglobine dans l’hémoglobine totale(FMetHb).
Certaines sont les reflets de l’état de transport d’oxygène dans le sang et d’autres permettent de concourir au diagnostic d’état pathologiques liés à l’augmentation de ces fractions. (COHb, MetHb)
| Principes de mesure | Analytes |
| Potentiométrie directe | pH, pCO2, Na+, K+, Cl-, Ca++ |
| Spectrophotométrie | tHb, SO2, FO2Hb, FCOHb, FHHb, FMetHb, Créatinine |
| Ampérométrie | pO2, lactate, glucose |
Tableau 1 : Tableau des principes de mesure des analyses effectuées sur les automates délocalisés (source : auteure)
Note : Dans la suite de ce mémoire, l’appellation « gaz du sang » regroupe toutes les analyses sus-citées.
- Bénéfices et limites de la biologie délocalisée
Des études et sondages [12], [13] ont permis de lister les bénéfices et les limites de l’utilisation de la biologie délocalisée.
| Bénéfices | Limites |
| Limite les contraintes liées au transport d l’échantillon | Coût de la biologie délocalisée (3 à 20x plus élevée qu’un examen de biologie classique) |
| Réduction du délai de rendu du résultat du prélèvement au médecin prescripteur (<5min) Diagnostic précoce, décision thérapeutique rapide (réalisation d’une opération en fonction du résultat des marqueurs cardiaques) | Temps (mise en place des examens, maintenance journalière, hebdomadaire, mensuelle) Validation différée du résultat par le biologiste (en cas de résultat erroné, possibilité d’une prise en charge non adaptée) |
| Favorise et améliore la communication entre les services cliniques et le laboratoire (prestation de conseil, formation du personnel par le laboratoire...) | Exigences en termes de qualité (formation, habilitation maintien des compétences, nombre d’intervenants >200, rotation du personnel soignant dans les services cliniques) |
| Volume d’échantillon réduit (95µl) | Analyse en doublon car contrôlée en biologie classique = multiplication des coûts |
| Fluidité du service (notamment Urgences) | |
Tableau 2 : Tableau regroupant les bénéfices et les limites de la biologie délocalisée (source : auteure)
La biologie délocalisée est une biologie dite « au lit du patient ». Il est indispensable pour son bénéfice, de garantir la performance de la méthode. Les données doivent être reproductibles et indépendantes de la variabilité inter-opérateurs.
3. Moyen : l’accréditation, intérêts de la réglementation
a. Définition
L’accréditation est définie comme « une procédure selon laquelle un organisme faisant autorité fournit une reconnaissance formelle de la compétence d’une personne, d’un organisme à réaliser des activités spécifiées d’évaluation de la conformité » [14].
Suite à des relevés de non-conformités des laboratoires [15], [16], la biologie médicale s’est vu être réformée. L’ordonnance 2010-49 ratifiée à la loi 2013-442 impose aux laboratoires d’être accrédités selon l’ISO 15189 avant le 01 novembre 2020 [6] sous peine de cessation d’activités [17].
La norme ISO 15189 –Laboratoires de biologie médicale - Exigences concernant la qualité et la compétence- est une norme internationale, obligatoire pour l’ensemble des laboratoires. Elle spécifie les exigences relatives au management et à la technique [2].
La biologie délocalisée est soumis à la norme ISO 22870 –Examens de biologie médicale délocalisée (EBMD) – Exigences concernant la qualité et la compétence- [18] à utiliser conjointement avec la norme ISO 15189.
b. Intérêts et bénéfices de l’accréditation
L’accréditation permet d’instaurer un climat de confiance entre patients, prescripteurs et laboratoires de par :
- Une reconnaissance de compétences du laboratoire, fondée sur l’évaluation des pratiques par des pairs
- La garantie de la fiabilité des examens,
- La qualité dans les prestations offertes par le laboratoire,
- En favorisant le dialogue clinico-biologique,
- En diminuant le nombre de non-conformité [12], [19], [20].
Ces différents éléments permettent de renforcer la crédibilité du laboratoire et d’apporter des réflexions afin de garantir l’amélioration continue et de tendre vers le progrès pour de nouveaux projets.
c. Le Comité Français d'Accréditation (COFRAC)
Association fondée en 1994, le Comité Français d’Accréditation est l’unique organisme en France autorisé à délivrer l’accréditation aux laboratoires. L’organisation de l’association se présente sous quatre sections ; la section « certifications », « laboratoires », « inspections » et « santé humaine » [21].
Le processus d’accréditation des laboratoires de biologie médicale est géré par la section « santé humaine ».
La mission principale du COFRAC est « de s’assurer de la compétence et de l’impartialité́ des organismes d’évaluation de la conformité́ (OEC), généralement désignés comme organismes de "contrôle" » [21]. Pour se faire, le COFRAC dispose d’équipes d’auditeurs qualiticiens et techniques aux compétences ciblées, afin de fournir une description la plus précise des pratiques au sein de chaque laboratoire [22].
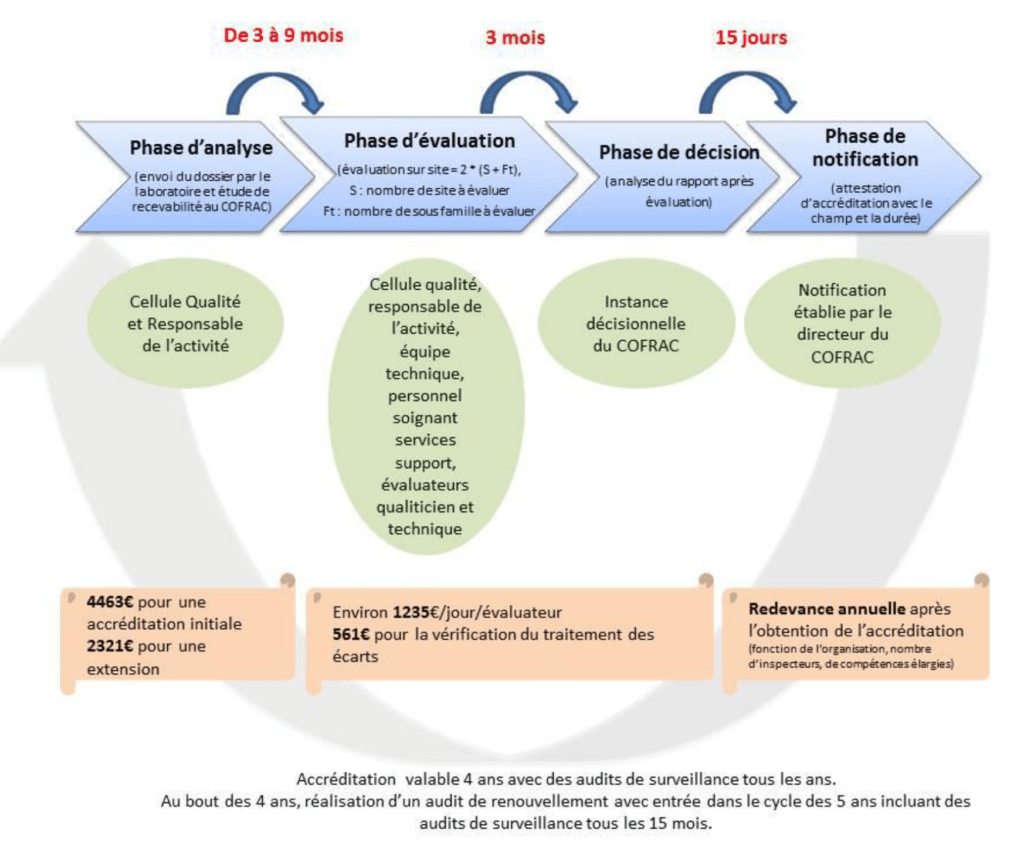
- Cycle d’évaluation
Le COFRAC a établi une périodicité des évaluations d’un laboratoire [23].
Un audit initialement réalisé permet l’obtention, selon les exigences de la norme, d’un certificat d’accréditation valable quatre ans durant lesquels sont réalisés des audits dits de surveillance, avec une « évaluation allégée » annuelle garantissant la pertinence de la conformité du certificat.
A l’issue de ces quatre ans, est réalisé un audit de renouvellement permettant au laboratoire d’entrer dans le cycle d’accréditation de cinq ans avec des audits de surveillance effectués tous les quinze mois.
- Les phases de l’accréditation
L’obtention de l’attestation d’accréditation du COFRAC est le résultat final d’un nombre d’étapes à respecter au préalable. Quatre phases distinctes sont à respecter [17] :
-La phase d’analyse (envoi du dossier de demande d’accréditation par le laboratoire et étude de la recevabilité du dossier)
-La phase d’évaluation (programmation et réalisation de l’audit sur site aboutissant à un rapport)
-La phase de décision (analyse du rapport au sein d’une instance décisionnelle)
-La phase de notification (délivrance d’une attestation d’accréditation si avis favorable de la commission)
L’attestation mentionne le périmètre (la portée) et la durée de validation de l’accréditation.
- La phase d’évaluation
L’équipe d’évaluateurs COFRAC est composée d’un évaluateur qualiticien en charge d’évaluer le système de management de la qualité et d’un évaluateur technique en charge d’évaluer les compétences techniques [24].
L’évaluation consiste à :
-examiner la pertinence des exigences de la norme ISO 22870, en terme organisationnel et technique
-de vérifier l’application de ces dispositions
-d’examiner l’adéquation des moyens du laboratoire pour réaliser les analyses
-d’évaluer la maîtrise de la compétence du personnel.
Le laboratoire peut s’aider de référentiels et guides technique d’accréditation tels que le SH REF 02 « Exigences pour l’accréditation selon les normes NF EN ISO 15189 et NF EN ISO 22870 » ou encore le SH GTA 01 « Guide technique d’accréditation en biologie médicale ».
Lors de l’audit, les évaluateurs sont en capacité de relever des écarts aux exigences. Deux types d’écarts peuvent être notés, des écarts critiques pouvant avoir une influence sur le résultat du patient et des écarts non critiques.
En cas de notifications d’écart, le laboratoire doit fournir, dans un délai de quinze jours après la réunion de clôture un plan d’actions à appliquer dans les six mois si l’écart est non critique et dans les trois mois si l’écart est critique [23].
4. Main d’œuvre : la biologie délocalisée ; une multidisciplinarité
Les examens de biologie médicale délocalisée sont soumis à la réglementation de la loi du 30/05/2013 [25] et de l’article L6211-1 du Code de la Santé Publique [26] .
La norme ISO 22870 –Examens de biologie médicale délocalisée- Exigences concernant la qualité et la compétence- fournit les exigences spécifiques aux examens de biologie médicale délocalisée, privilégie un management mutualisé clinico-biologique en imposant notamment la création d’un comité consultatif et un comité disciplinaire ayant respectivement leurs propres missions.
La biologie délocalisée regroupe donc un ensemble de corps médicaux et paramédicaux (Figure 8) pour assurer une prise en charge optimale du patient.
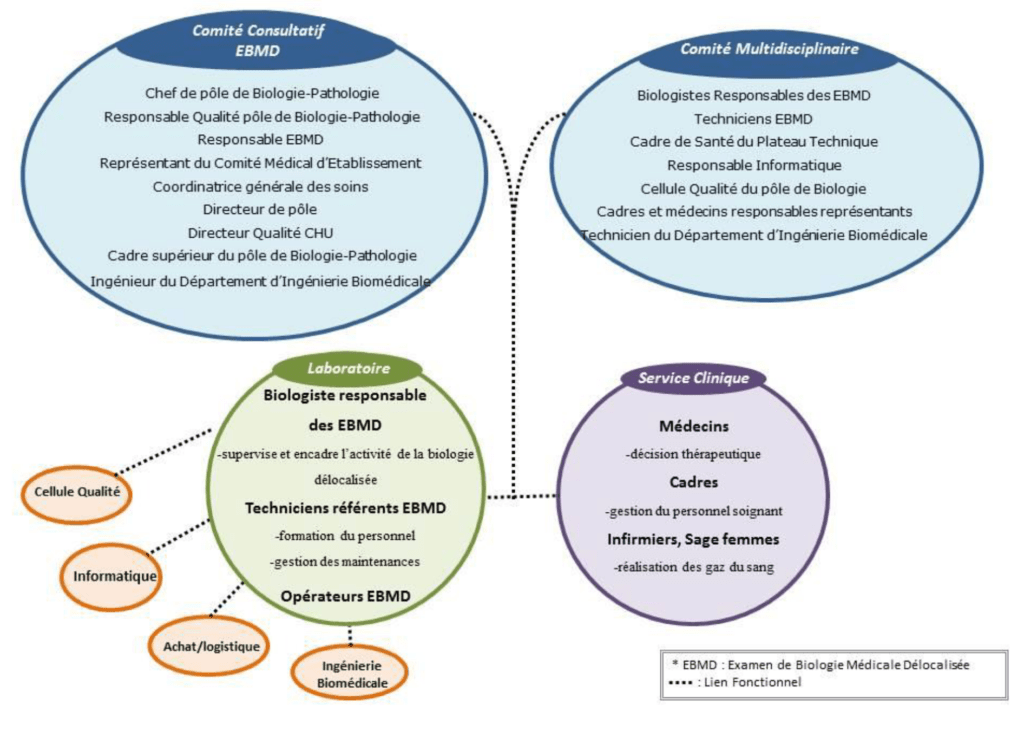
La composition de l’organigramme est comme suivie :
- Le comité consultatif (regroupant les professionnels de la santé) est responsable de la définition du domaine d’utilisation des examens de biologie médicale délocalisée.
- Le groupe multidisciplinaire d’encadrement (représentants du laboratoire, membres de l’administration, des équipes cliniques) est responsable du champ d’utilisation des examens délocalisés.
Le cadre d’utilisation, les missions et les responsabilités de chacun sont définis dans des contrats clinico-biologique (Annexe 1)
- Au sein du laboratoire, les responsabilités et tâches de chaque acteur sont décrites dans une fiche de fonction (Annexe 2, Annexe 3). Le laboratoire est en charge d’assurer la qualité analytique au travers des maintenances et des Contrôles Internes et Externes de Qualité. Il est en charge de la formation du personnel soignant et de son maintien de compétences pour garantir la sécurité sur les rendus de résultats.
- Au sein du service clinique, les catégories de professionnels de santé habilités à réaliser la phase analytique en dehors d’un laboratoire de biologie médicale sont fixées par arrêté du ministre chargé de la santé [27]. Le service s’engage à respecter les spécifications du laboratoire pour préserver la conformité du prélèvement entrainant le rendu d’un résultat fiable au clinicien.
- Les services support :
La cellule qualité met en place la politique qualité via un Système de Management de la Qualité et s’assure en permanence qu’il réponde aux exigences normatives et qu’il s’améliore de façon continue.
Le service informatique s’assure de la continuité de rendu de résultats entre les logiciels du laboratoire, du fournisseur et du service clinique. La qualification informatique des systèmes est exigée par la norme ISO 22870.
La cellule achat/logistique a la responsabilité de mettre en œuvre le processus « achat » des consommables et réactifs dans le respect des procédures du laboratoire ou du service clinique, de l’établissement et des marchés publics.
L’ingénierie biomédicale est en charge de la gestion du parc des équipements de la biologie délocalisée, la gestion des maintenances et de la métrologie.
Cette multidisciplinarité engendre une complémentarité intrinsèque des disciplines permettant de répondre aux besoins de chaque partie dans l’objectif de proposer une solution adaptée aux besoins du patient, ainsi que d’avoir une approche collaborative lors de la résolution de problème.
5. Méthode : Planification dynamique stratégique
Pour augmenter la capacité d’action de l’équipe, une démarche qualité est appliquée et se déroule comme suit :
- Choisir la méthode d’amélioration continue : proposition d’une planification dynamique stratégique (PDS)
- Résoudre la problématique à l’aide d’outils qualité
- Exploiter les expériences d’autres hôpitaux (audit croisé)
- S’appuyer sur les référentiels mis à disposition tels que le SH REF 02 ou le guide d’accréditation
- Obtenir une reconnaissance via la norme ISO 22870
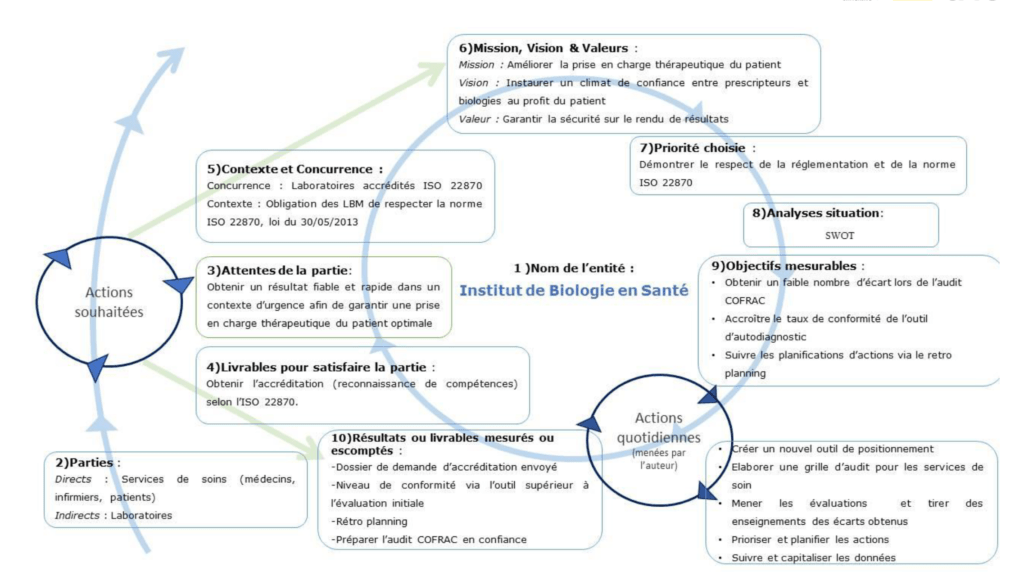
La planification dynamique stratégique est un outil d’amélioration continue permettant d’expliciter le sens d’une activité, de communiquer en un coup d’œil afin de faire comprendre l’essentiel pour aboutir aux livrables escomptés. Elle formalise le sens de l’organisation en répondant aux questions « pour qui et pourquoi » (mission de l’établissement).
La planification dynamique stratégique suit une ligne directrice pour concentrer les efforts et obtenir rapidement des gains.
Les objectifs mesurables permettent d’évaluer la progression des actions entreprises et de poursuivre dans la bonne direction.
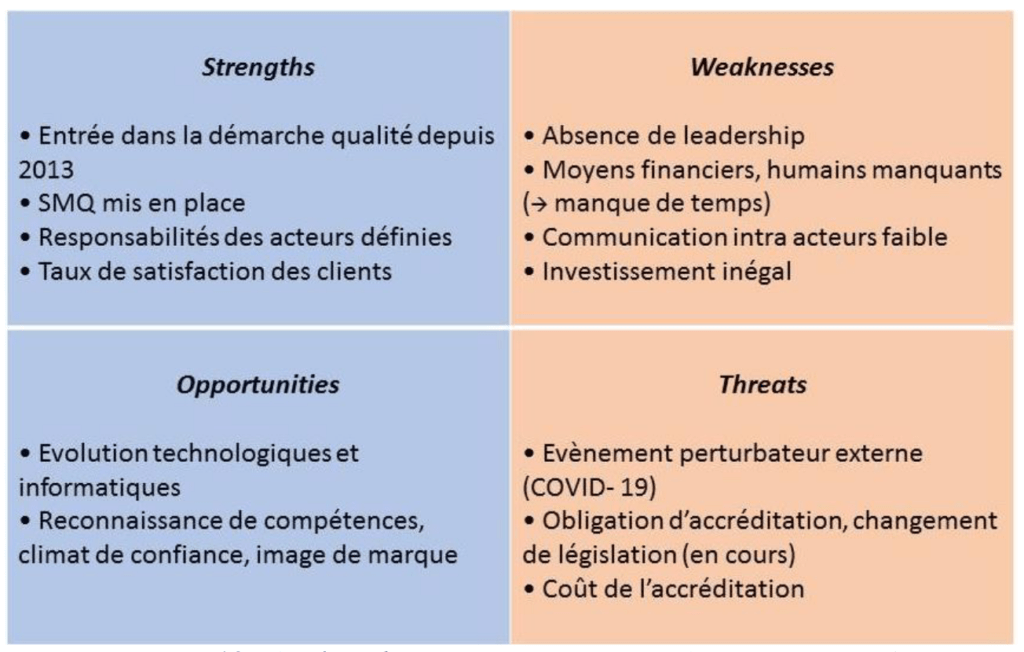
L’analyse des risques liés à la résolution du problème est synthétisée selon une matrice SWOT :
II. Bénéfices des outils proposés
Le laboratoire est entré dans la démarche d’accréditation depuis 2013 selon la norme ISO 15189. L’un des objectifs pour l’année 2020 est de déposer le dossier de demande d’accréditation selon l’ISO 22870 courant premier trimestre afin d’obtenir une visite sur site du COFRAC d’ici la fin de l’année.
L’apport d’une démarche qualité augmente la capacité d’action de l’équipe dans le temps. Il existe de nombreuses méthodes pour piloter la résolution d’une problématique. Les critères de choix de la méthodologie (robustesse, confiance sur l’ascendance et l’objectivité des actions d’améliorations) ont abouti à utiliser une méthode nommée « 4A » : Analyser, Agencer, Agir et Améliorer. Cette méthode est appropriée lorsque le laboratoire de biologie médicale est en cours de démarche d’accréditation.
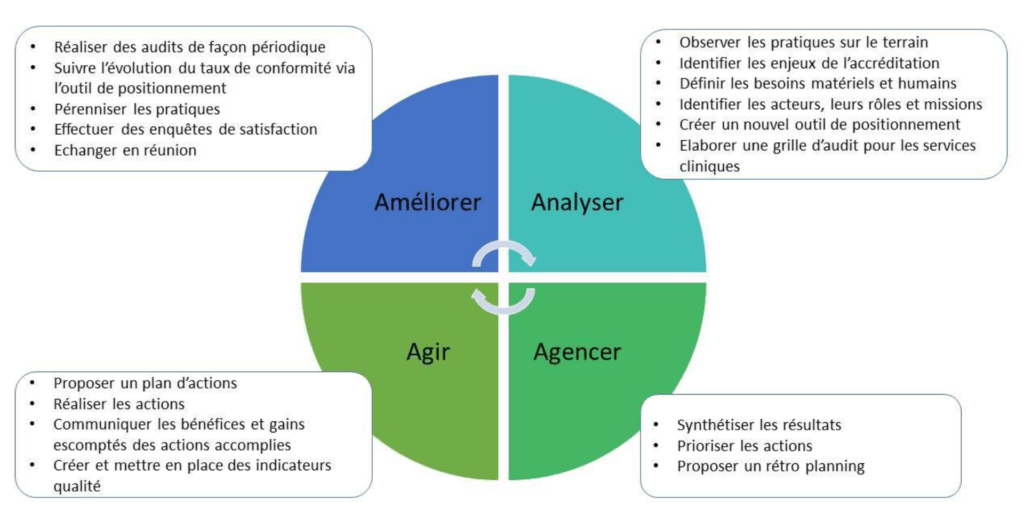
1. Un outil de positionnement et une grille d’audit pour analyser en temps réel
L’un des objectifs de cette phase est d’évaluer les connaissances du personnel sur les enjeux de l’accréditation de la biologie délocalisée ainsi que de connaître les différentes interactions qui existent entre les acteurs afin de cibler au mieux leurs rôles et implications au sein de la démarche.
La seconde partie de la phase repose sur l’analyse de la situation existante. Pour se faire, deux outils sont utilisés :
- Un nouvel outil de positionnement, créé sur la base de l’outil de positionnement selon la norme ISO 15189 [28] ainsi que l’outil d’évaluation mis à disposition par le COFRAC [29].

L’outil regroupe l’ensemble des exigences de la norme à respecter concernant le système de management de la qualité ainsi que les exigences techniques.
La subjectivité des cinq niveaux de choix de véracité (faux, plutôt faux, plutôt vrai, vrai et non applicable) impose que l’évaluation doit être réalisée par le même groupe de personnes afin d’obtenir une cohérence d’interprétation si l’outil est utilisé comme suivi d’amélioration.
La biologie délocalisée fait intervenir le personnel soignant de chaque service clinique, il est donc primordial d’effectuer un « état des lieux » au sein du service clinique dans l’objectif de vérifier les bonnes pratiques, les exigences environnementales à respecter et de favoriser les échanges entre personnel soignant et personnel du laboratoire.
- Pour ce faire, une grille d’audit (Annexe 4) sous forme de tableau est proposée permettant de questionner les services sur leurs pratiques et de tracer les éléments manquants ou les améliorations à apporter pour satisfaire à la réglementation.
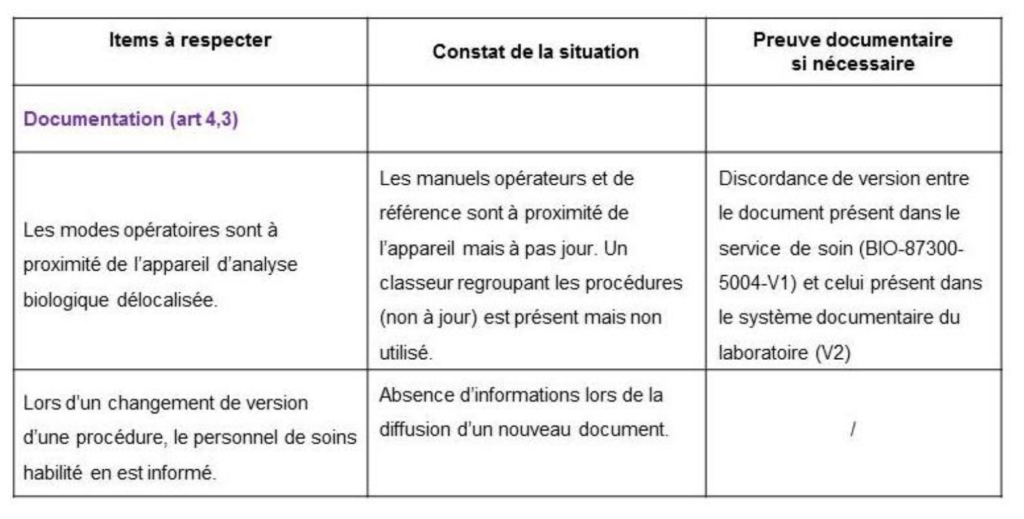
L'usage de ectte grille est définit en première page de ce document. Cette grille est à compléter et ajuster selon les pratiques du laboratoire.
2. Agencer : des graphes radars pour prioriser les actions à mener
a. L’outil de positionnement et la grille d’audit
Les graphes radars (Figure 14) de l’outil de positionnement et la synthèse des données sur les services de soins (Annexe 6) permettent de grouper et de lister un ensemble de tâches à effectuer.
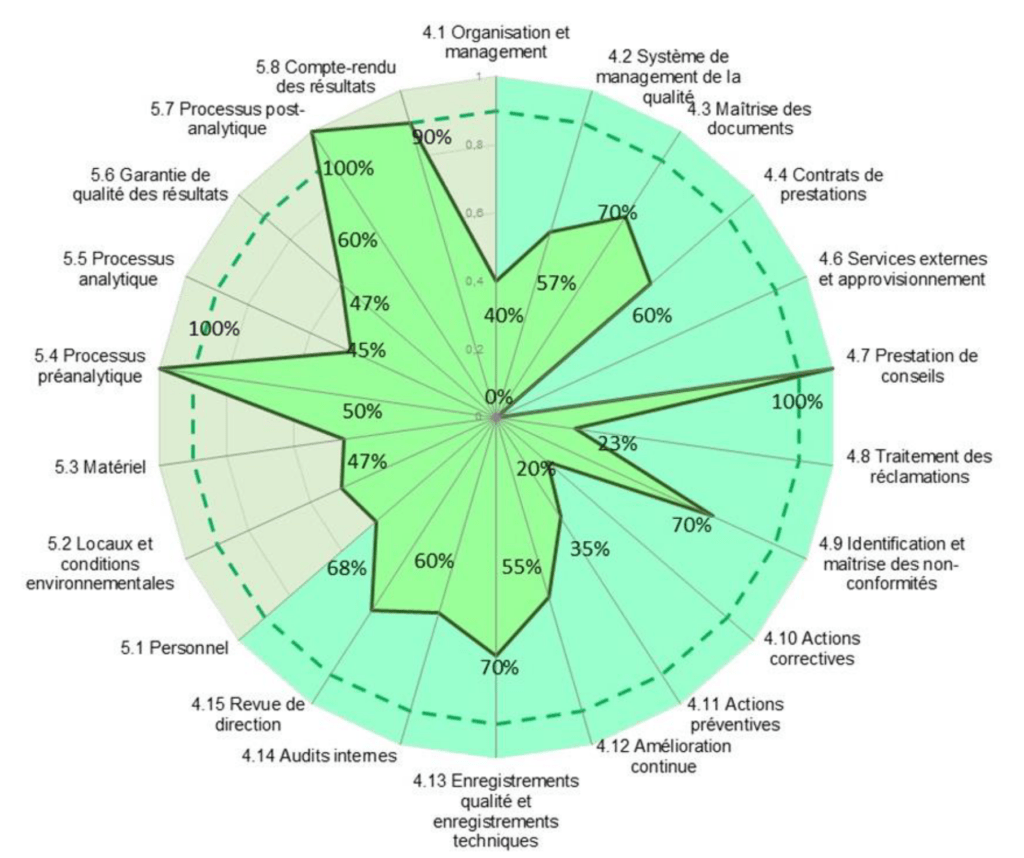
Le graphe radar met en évidence les axes d’amélioration à apporter en priorité, le taux de conformité obtenu à chaque article est noté. La Figure 14 montre l’ensemble des taux de conformité obtenus après évaluation.
Des graphes radars spécifiques à chaque article sont également disponibles. Les résultats obtenus montrent que le taux de conformité pour l’article 4 est de 55% contre 52% pour l’article 5 (Annexe 7). Il n’est donc pas noté de disproportion entre les exigences concernant le système de management de qualité et les exigences techniques.
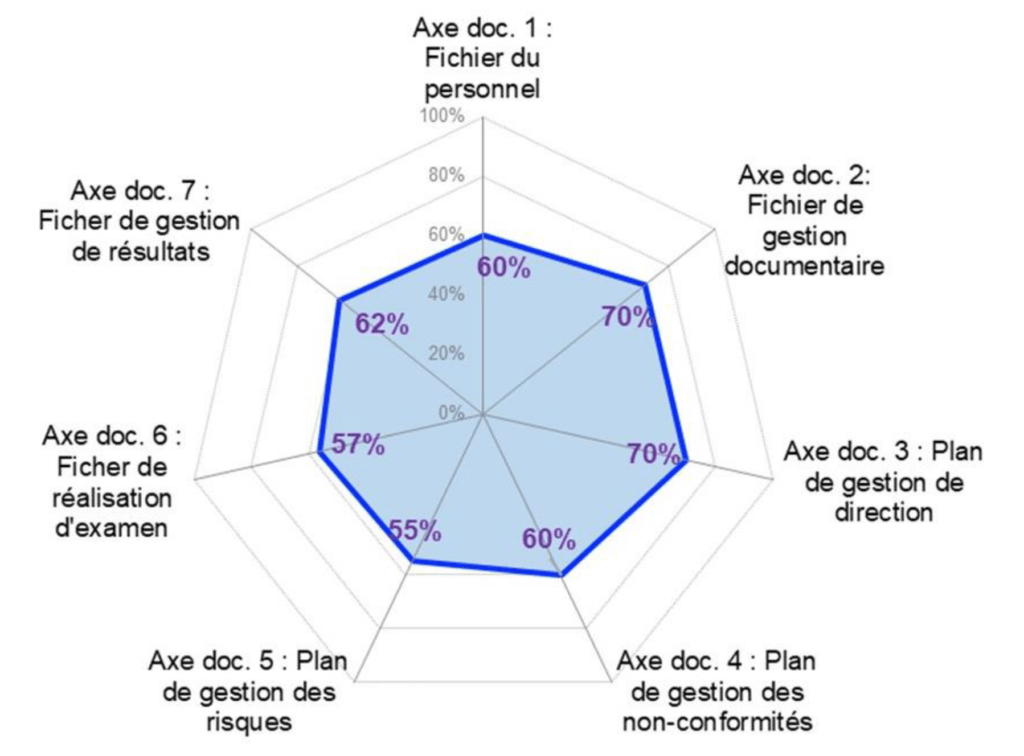
Une représentation graphique concernant la maîtrise documentaire (Figure 15) est également disponible dans l’outil de positionnement. Les différentes preuves documentées à apporter pour satisfaire aux exigences sont groupés en axe documentaire. Le taux de conformité est calculé de façon automatique et permet d’orienter le laboratoire sur la complétude de leur maitrise documentaire (ex : taux compris entre 40% et 60%, le libellé incrémenté est : « consolider la rédaction »).
De plus, une auto déclaration selon la norme 17050 – Evaluation de la conformité- Déclaration de conformité du fournisseur-[30] est mise à disposition du laboratoire justifiant la réalisation de l’évaluation via l’outil de positionnement.
La synthèse des données obtenues via l’outil de positionnement ainsi que la grille d’audit dans les services cliniques est ensuite travaillée de façon à hiérarchiser les actions à entreprendre.
b. Le retro planning
La mise en place d’un retro planning est proposée pour permettre :
- De grouper et classer l’ensemble des tâches à réaliser (selon la personne, le processus ou la date)
- D’avoir une ligne conductrice sur les objectifs à atteindre dans un délai imparti
- D’ajuster au besoin les directives et de prendre des décisions correctives si nécessaires
La proposition du retro planning associé à l’outil de positionnement permet de définir l’implication de chaque personne compétente à la réalisation des actions à mener. Sur ce retro planning, les éléments suivants y sont caractérisés (Figure 16) :
- Le processus concerné
- L’action à mettre en place ainsi que les personnes compétentes à la réalisation de la tâche
- Une échéance à respecter
- L’évaluation de l’objectif à atteindre
- L’état d’avancement des actions à mener
Une cartographie des processus, propre au laboratoire permet de classer les actions. Cette cartographie est composée de trois processus divisés en sous processus :
- Le processus de management (M) qui englobe les sous processus de planification, réalisation, vérification et amélioration
- Le processus de réalisation (R) qui comporte les phases pré-analytique, analytique, post-analytique et la biologie délocalisée
- Le processus support (S) découpé selon les 5M : Main d’œuvre, Milieu, Matériel, Matière et Méthode.
L’ensemble des exigences de l’article 4 de la norme ISO 22870 appartient au processus de management. A contrario, les exigences de l’article 5 concernant la technique regroupent les processus de réalisation et de support.

Ce retro planning est révisé en réunion de suivi toutes les trois semaines par l’ensemble du personnel et y sont appréciées les avancées ainsi que les suggestions.
3. Agir
Les données croisées de l’évaluation via l’outil de positionnement ainsi que la grille d’audit ont permis d’extraire les axes prioritaires d’améliorations qui suivent :
- Mettre à jour la documentation
- Du système de Management de Qualité (à réaliser par la cellule qualité)
- Définir les responsabilités et missions de chaque acteur
- Élaborer le plan qualité spécifique à la biologie délocalisée
- Élaborer la fiche processus
- Définir la gestion documentaire dans les services
- Formaliser les contrats clinico-biologiques
- Consolider la synthèse des données dans la revue de direction
- Du système de Management de Qualité (à réaliser par la cellule qualité)
- Des compétences du personnel (à réaliser par les techniciens compétents en accord avec le biologiste responsable de l’activité)
- Revoir les grilles d’habilitations du personnel soignant
- Renforcer le suivi de formation du personnel soignant
- Statuer sur les responsabilités des opérateurs et sécuriser l’accès de façon globale et identique pour l’ensemble du personnel soignant (à voir en instance décisionnelle)
- S’assurer des bonnes conditions environnementales (à réaliser par le service biomédical)
- Disposer l’appareil délocalisé dans un endroit adapté
- Effectuer le suivi métrologique avec le suivi de la température ambiante, et le suivi des enceintes réfrigérées
- Effectuer les vérifications analytiques (à réaliser par les techniciens compétents et le biologiste responsable de l’activité)
- Procéder à la vérification de méthode de chaque appareil et compléter les SH FORM 43
- Réaliser le suivi des CIQ de manière exhaustive
- Avoir des EEQ pour l’ensemble des analyses mesurées sur les automates
- Revoir et compléter la gestion et traçabilité des panne
- Améliorer la gestion des stocks et réactifs (à réaliser par la cellule achat, en accord avec le laboratoire et le service logistique)
- Homogénéiser la gestion des stocks au sein des services de soins
- Diminuer le surstockage des réactifs au sein des services
- Centraliser les commandes sur un unique logiciel
- Assurer la distribution des réactifs selon les exigences du fournisseur
Des groupes de réflexion sont régulièrement mis en place pour chaque axe défini afin de cibler les personnes compétentes à accomplir la tâche pour augmenter l’efficacité et l’efficience du projet.
Les réunions de suivi permettent d’échanger et d’apprécier les corrections apportées et nécessaires sur l’avancement des objectifs à atteindre.
Une fois l’action réalisée et approuvée par l’ensemble des personnes concernées, la preuve d’accomplissement de la tâche est inscrite dans le retro planning et permet la clôture du critère ciblé.
L'estimation du temps personnel consacré à la gestion de la biologie délocalisée n'a pu $etre combinée. Une étude réalisée au laboratoire de biochimie, hôpitaux civils de Colmar [31] donne une idée approximative donne du temps nécessaire.
4. Améliorer pour diminuer les dysfonctionnements
L’amélioration continue consiste à réduire le nombre de dysfonctionnement d’un processus, l’insatisfaction du client et les risques engendrés pour le patient.
Pour y parvenir, différents moyens et supports existent :
- Les audits intra ou inter-laboratoire
Une stratégie d’audit interne permet d’évaluer à des intervalles réguliers l’ensemble des sites de biologie délocalisée.
En 2016, le laboratoire d’Angers a été audité par le CHRU de Tours dans le cadre de leur accord d’audit croisé selon les normes ISO 15189 et 22870. Le compte rendu d’audit comporte cinq écarts non critiques pour l’évaluation de la biologie délocalisée ainsi que des axes d’améliorations concernant l’évaluation du système de management de la qualité. Sur les cinq écarts non critiques relevés, trois restent à solder et un à consolider.
- L’outil de positionnement
L’outil de positionnement initialement proposé pour effectuer l’évaluation est également utilisable comme outil d’amélioration. En effectuant une réévaluation du taux de conformité via l’outil, le laboratoire se rend compte des avancées et des lacunes restantes. - La grille d’audit des services
De la même façon que l’outil de positionnement, un suivi des pratiques au sein des services peut être réalisé suivant une périodicité définie afin de pérenniser les bonnes pratiques et de corriger le nécessaire. - L’enquête de satisfaction (Annexe 8)
La proposition d’une enquête de satisfaction établit par le laboratoire au profit des services de soins permet de centraliser les éléments nécessitant une amélioration. Cette enquête favorise l’enregistrement du retour d’informations des utilisateurs des appareils délocalisés. - Les indicateurs de qualité
Le laboratoire a mis en place des indicateurs de qualité. Outil de mesure sur la survenue d’un évènement (ici le nombre de panne des appareils délocalisés), ou du suivi de performance analytique (conformité des Évaluations Externes de la Qualité). - La revue de direction
La revue de direction, planifiée tous les ans, permet au laboratoire de revoir de façon périodique l’efficacité de son système de management de la qualité. Elle synthétise le bilan d’activité de la biologie délocalisée et aborde l’ensemble des items à respecter selon la norme ISO 22870 (résultats d’audits, retours patients/médecins, actions correctives, indicateurs qualité, évaluations fournisseur...).
L’ensemble de ces ressources favorise l’amélioration continue du laboratoire.
Le progrès se pilote de façon progressive et dynamique.
Perspectives et Conclusion
Faisant suite au rapport Ballereau du 23 septembre 2008 [16], la volonté d’entrer dans la démarche d’accréditation selon la norme ISO 22870, spécifique à la biologie délocalisée a débuté notamment via l’habilitation du personnel soignant lors de l’installation de nouveaux automates en 2009.
En 2013, le laboratoire a choisi dans un premier temps de se mettre en conformité selon la norme ISO 15189 seulement. La biologie délocalisée nécessite une approche différente de la biologie conventionnelle de par la réalisation de l’analyse au sein du service. Elle peut concerner plusieurs sous famille (biochimie, hématologie, virologie…). La perception de cette activité est parfois variable par les biologistes au sein du même laboratoire. La qualité et l’obligation d’accréditation dans les services de soins sont parfois peu connues et peuvent être perçues comme une contrainte. Les cliniciens sont fréquemment démarchés par des sociétés commerciales externes pour l’installation de petits automates pour des mesures rapides de paramètres (installation dans les services d’urgences, les camions SAMU ou hélicoptères ...). Les biologistes en lien avec le service biomédical doivent alerter les services cliniques sur les contraintes réglementaires et financières engendrés par ces fausses bonnes solutions en mettant en avant notamment la moindre qualité analytique.
Il existe également une confusion entre la certification, HAS [32] notamment qui implique l’ensemble de l’établissement ou certification ISO 9001[33] de certains secteurs du CHU, et l’accréditation. Le niveau d’exigence imposé par l’accréditation n’est pas toujours correctement compris.
L'apport des outils proposés offre un aspect opérationnel avec une mise en œuvre facile pour un apport de gain escompté : obtenir l'accréditation selon la norme ISO 22870.
L'accréditation est bénéfique pour le patient. Elle est source de fiabilité et de sécurité dans les résultats rendus aux prescripteurs pour optimiser la prise en charge thérapeutique du patient.
Le dynamisme de l’équipe vise à donner confiance sur la poursuite des actions à mener pour obtenir l’accréditation. Cette reconnaissance de compétences instaure un climat de confiance entre les laboratoires et prescripteurs au bénéfice du patient.
De évènements ont freiné la démarche d’accréditation 22870 du CHU d’Angers comme par exemple :
- L’accréditation n’a pas été initialement définie comme un objectif prioritaire par les instances décisionnelles, d’où une lenteur dans la continuité de la démarche débuté en 2009.
- L’absence de dimensionnement des effectifs nécessaires à l’activité de biologie délocalisée (10% de l’activité globale de biologie médicale) résulte de la sous-estimation de l’importance de l’accréditation.
- Un point important relevant du Code de la Santé Publique doit faire l’objet d’une décision directionnelle. Ce point a été abordé dans plusieurs comité de pilotage mais n’a, jusqu’alors pas donné lieu à un statut définitif.
Le non positionnement de la direction peut engendrer un signalement auprès de l’Agence Régionale de Santé ainsi que le relevé d’un écart critique par le COFRAC. L’activité de la biologie délocalisée pourrait être suspendue. Une réorganisation au sein du laboratoire et des services de soins devra être envisagée. - Les difficultés de la gestion documentaire déployée à l’ensemble de l’établissement avec des logiciels différentes.
Les interactions humaines entre les différentes disciplines sont un élément essentiel pour favoriser l’amélioration des pratiques. Les échanges entre service de soins et laboratoire permettent de comprendre les difficultés et points de vue de chacun dans l’unique objectif de sécuriser le résultat pour garantir la prise en charge du patient de façon optimale.
Au commencement de ce mémoire, la date fixée pour obtenir 100% des examens de biologie médicale accrédités était au 1er novembre 2020. La crise sanitaire concernant le COVID-19 a engendrée la parution le 17 juin 2020 de la loi n° 2020-734 [6]. L’article 23 de la loi 2020-734 vient modifier l’article 7 de l’ordonnance 2010-43 relative à la biologie médicale [34]. Les changements majeurs sont les suivants :
- Abrogation de la date du 1er novembre 2020 remplacée par la date du 1er mai 2021.
- L’accréditation ne concerne plus les examens réalisés par le laboratoire mais les lignes de portée [1] .
- Le 100% concernant initialement les examens se rapporte à la totalité d’ouverture des lignes de portée
Au
laboratoire du CHU d’Angers, seule la ligne de portée concernant les examens de
biologie délocalisée est à ouvrir. L’envoi du dossier de demande
d’accréditation pour cette ligne est prévu pour le second semestre de l’année
2020.
Références bibliographiques
[1] “SH-REF-08 : Expression et évaluation des portées d’accréditation.” Edition COFRAC, https://www.cofrac.fr, Jun. 2019.
[2] “NF EN ISO 15189 - Laboratoires de biologie Médicale - Exigences concernant la qualité et la compétence.” Edition Afnor, www.afnor.org, Dec. 2012.
[3] Ministère des Solidarités et de la Santé, “LOI n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé - Article 107,” Ed. Legifrance, Paris, www.legifrance.gouv.fr, Jan. 2016.
[4] Ministre de la Santé, “Prononcé le 9 septembre 2019.” Sep. 09, 2019, Available : https://solidarites-sante.gouv.fr.
[5] Ministère des Solidarités et de la Santé, “Ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale.” Ed. Legifrance, Paris, www.legifrance.gouv.fr, Jan. 15, 2010.
[6] “LOI n° 2020-734 du 17 juin 2020 relative à diverses dispositions liées à la crise sanitaire, à d’autres mesures urgentes ainsi qu’au retrait du Royaume-Uni de l’Union européenne,” Ed. Legifrance, Paris, www.legifrance.gouv.fr, Jun. 2020
[7] “Présentation du CHU Angers,” CHU-ANGERS. https://www.chu-angers.fr/
[8] A. Renard, “Bilan 2019 et perspectives 2020,” Jan. 2020, [Online]. Available : www.chu-angers.fr.
[9] Parresia, “L’Institut de Biologie en Santé au CHU d’Angers,” EDP Biol., 15janvier 2013, Available : http://www.edp-biologie.fr/.
[10] F. Becker, “Test de Allen,” vol. 25, no. 3, p. 208, Mar. 2008, doi : MV-07-2000-25-3-0398-0499-101019-ART78.
[11] B. Tremey and B. Vigué, “Les variations thermiques modifient les paramètres des gaz du sang : quelles conséquences en pratique clinique ?,” Ann. Fr. Anesth. Réanimation, vol. 23, no. 5, pp. 474–481, May 2004, doi : 10.1016/j.annfar.2004.01.017.
[12] A. Lobies, “La biologie délocalisée : point de vue de certains professionnels de santé et de l’impact sur le parcours de soins,” UGA UFRP - Université Grenoble Alpes - UFR Pharmacie, Thèse d’exercice de pharmacie-, Nov. 2019. [Online]. Available : https://dumas.ccsd.cnrs.fr/dumas-02366051.
[13] K.-L. Vu, “Validation de méthode des gaz du sang en biologie délocalisée dans le cadre de l’accréditation selon la norme ISO 22870,” Thèse, Université Claude Bernard - Lyon 1 Faculté de Pharmacie Institut des sciences pharmaceutiques et biologiques, 2015.
[14] “NF EN ISO/IEC 17000 Evaluation de la conformité -Vocabulaire et principes généraux.” Nov. 2004, Available : https://www.iso.org/.
[15] F. Lalande, I. Yeni, and C. Laconde, “La biologie médicale libérale en France : bilan et perspectives, Rapport de l’IGAS.” Apr. 2006, [Online]. Available : https://solidarites-sante.gouv.fr.
[16] M. Ballereau, “Rapport pour un projet de réforme de la biologie médicale,” Ministère de la Santé, de la Jeunesse, des Sports et de la Vie associative, Sep. 2008. [Online]. Available : https://solidarites-sante.gouv.fr.
[17] “Obtenir l’accréditation : le processus de A à Z | COFRAC - Comité français d’accréditation.” https://www.cofrac.fr/
[18] “NF EN ISO 22870 - Examens de biologie médicale délocalisée (EBMD) - Exigences concernant la qualité et la compétence.” Edition Afnor, www.afnor.org, Mar. 2017.
[19] P.-G. Claret, X. Bobbia, and J.-E. De La Coussaye, “Biologie délocalisée,” SFMU-Société Fr. Médecine Urgence, no. 68, 2014.
[20] F. Harris, “La biologie délocalisée : vers une légalisation encadrée,” Ecole Nationale de la Santé Publique, 2004.
[21] “Qui sommes-nous ? | COFRAC - Comité français d’accréditation.” https://www.cofrac.fr/
[22] “Organigramme COFRAC.” Edition COFRAC, https://www.cofrac.fr.
[23] “SH REF 05 : Règlement d’accréditation.” Edition COFRAC, https://www.cofrac.fr, Jun. 2019.
[24] “INS REF 05 : Réglement d’accréditation.” Edition COFRAC, https://www.cofrac.fr, Jul. 01, 2019.
[25] Ministère des Solidarités et de la Santé, “LOI n° 2013-442 du 30 mai 2013 portant réforme de la biologie médicale,” Ed. Legifrance, Paris, www.legifrance.gouv.fr, May 2013.
[26] “Code de la santé publique- Article L6211-1.” https://www.legifrance.gouv.fr/
[27] Ministère des Solidarités et de la Santé, “Arrêté du 13 août 2014 fixant les catégories de professionnels de santé autorisés à réaliser des prélèvements d’échantillons biologiques aux fins d’un examen de biologie médicale et la phase analytique de l’examen de biologie médicale en dehors d’un laboratoire de biologie médicale ainsi que les lieux de réalisation de ces phases,” Ed. Legifrance, Paris, www.legifrance.gouv.fr, aout 2014.
[28] G. Gossin, M. Guillerm, and J. Ping, “La qualité au sein des laboratoires de biologie médicale selon l’ISO 15189 v2012,” Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositif Médical et Affaires Règlementaires (DMAR), Mémoire de projet, https://travaux.master.utc.fr, puis “IDS” Réf n°IDS038, Jan. 2020.
[29] “Un nouvel outil d’auto-évaluation pour les activités de biologie médicale délocalisée.” Edition COFRAC, Available : https://www.cofrac.fr/.
[30] “NF EN ISO/CEI 17050-2 - Évaluation de la conformité - Déclaration de conformité du fournisseur - Partie 2 : documentation d’appui.” Editions Afnor, Paris, www.afnor.org, Apr. 01, 2005,
[31] C. Elong et al., “Estimation du temps personnel de laboratoire nécessaire pour gérer l’activité de biologie délocalisée selon la norme NF EN ISO 22870 aux hôpitaux civils de Colmar,” Ann. Biol. Clin., vol. 76, no. 5, p. 41, sept-oct, doi : 10.1684/abc.2018.1371.
[32] “Certification HAS,” Haute Autorité de Santé. https://www.has-sante.fr/
[33] “ISO 9001 : certification du management de la qualité - AFNOR Certification.” https://certification.afnor.org/
[34] “Ordonnance n° 2010-49 relative à la biologie médicale,” Ed. Legifrance, Paris, www.legifrance.gouv.fr, JORF n°0012 du 15 janvier 2010 page 819.
Liste des annexes
Annexe 1 : Contrat clinico-biologique
Annexe 2 : Responsabilités et tâches du biologiste responsable des examens de biologie médical délocalisée
Annexe 3 : Responsabilités et tâches du technicien référent des examens de biologie médicale délocalisée
Annexe 4 : Grille d'audit d'un service de soins
Annexe 5 : Exemple d'auto-déclaration selon la norme ISO 17050
Annexe 6 : Compte rendu des états des lieux réalisés au sein des services de soins
Annexe 7 : Résultats obtenus de l'outil de positionnement selon la norme ISO 22870
Annexe 8 : Enquête de satisfaction pour les services de soins