IDS091- Déploiement des exigences du règlement 2017/745 : Etiquettes et notices d'utilisation
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteure

BOUSHABA Salma
Contact
Citation
A rappeler pour tout usage : S.BOUSHABA « le déploiement des exigences du règlement 2017/745 en termes d'étiquetage et de notices réglementaires », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de stage, réf n° IDS091, juillet 2021, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids000/
Résumé
Depuis 1998, le secteur des dispositifs médicaux a été régit par la directive 93/42/CEE, un texte qui contient les points nécessaires pour garantir la performance et la sécurité des produits mis sur le marché de l’EU, en mettant en place, sous forme d’articles et annexes, un socle commun en adéquation avec la circulation libre des DMs.
Actuellement et depuis Mai 2017, ce secteur passe par une période de transition suite au remplacement de la directive 93/42/CEE par le règlement européen 2017/745. Ce règlement vient pour unifier l’ensemble des acteurs des dispositifs médicaux du marché européen sous un texte complet qui suit le contexte technologique actuel. Ainsi, les exigences du règlement 2017/745 amélioreront la transparence et la traçabilité au niveau de l’Europe et permettront une meilleure surveillance après la commercialisation du dispositif médical.
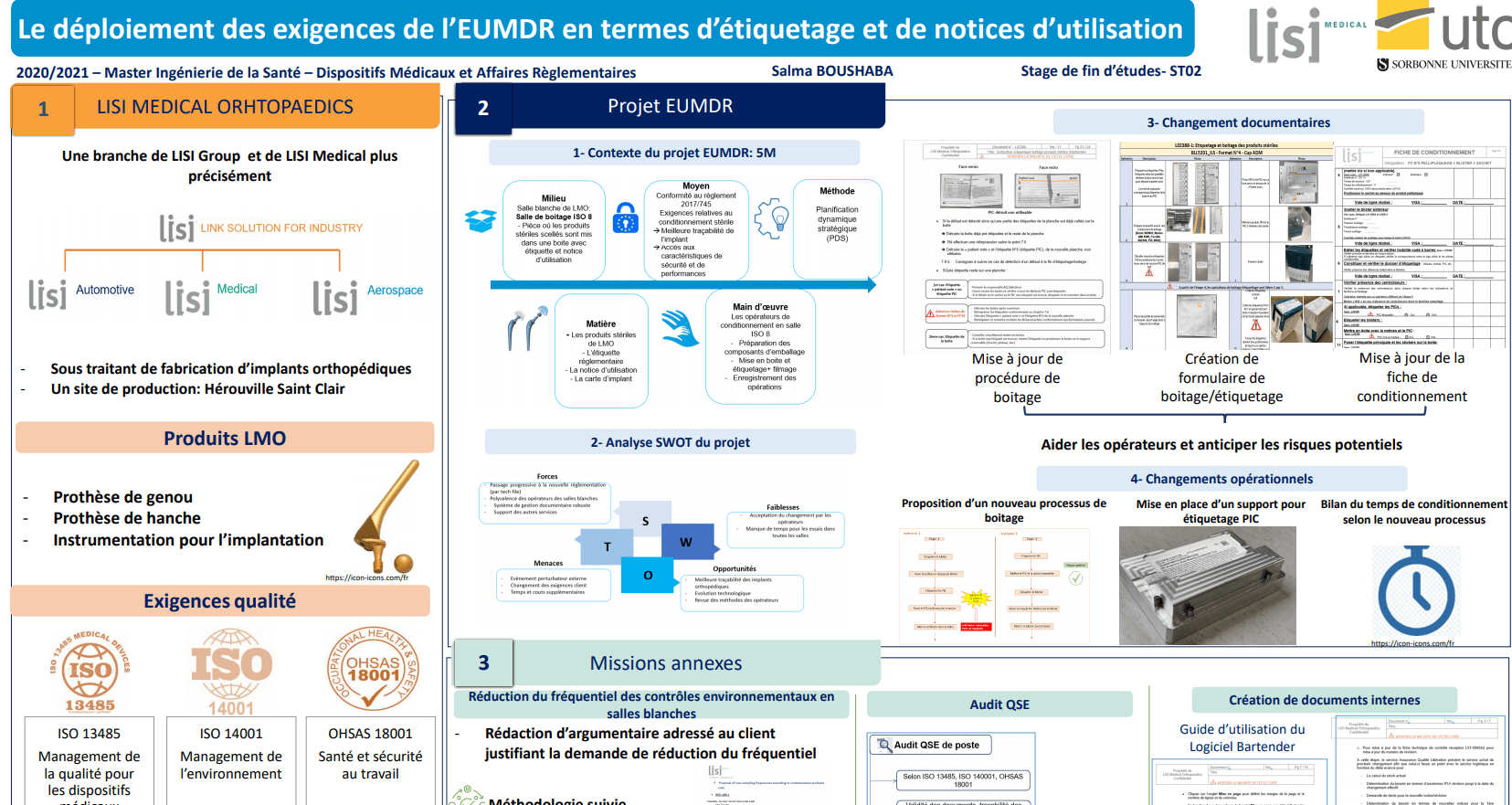
La société Lisi Medical Orthopaedics à son rôle, comme étant sous-traitant d’implants et d’instrumentation pour la chirurgie orthopédique, s’est vue confrontée, à se conformer à cette nouvelle réglementation, pour pouvoir continuer à commercialiser ses produits.
La mission a été donc d’accompagner le service assurance qualité libération pour déployer les nouvelles exigences en termes d’étiquetage et de notices réglementaires dans le processus de conditionnement des produits stériles.
Ce mémoire d’intelligence méthodologique a pour objectif de présenter la méthodologie suivie pour la mise en place d’un nouveau processus de conditionnement secondaire et la mise à jour des documents internes de l’entreprise. D’autres missions annexes seront aussi détaillées dans la suite de ce mémoire.
Abstract
Since 1998, the medical devices sector has been governed by Directive 93/42/EEC, a text that contains the points necessary to guarantee the performance and safety of products placed on the EU market, setting up, in the form of articles and annexes, a common base in line with the free circulation of DMs.
Currently and since May 2017, this sector is going through a transition period following the replacement of the 93/42/EEC directive by the European regulation 2017/745. This regulation comes to unify all the actors of the medical devices of the European market under a complete text that follows the current technological context. Thus, the requirements of Regulation 2017/745 will improve transparency and traceability at the European level and allow for better post-marketing surveillance of the medical device.
The company Lisi Medical Orthopaedics in its role, as a subcontractor of implants and instrumentation for orthopaedic surgery, was faced with, to comply with this new regulation, to be able to continue marketing its products.
The mission was therefore to accompany the quality assurance department in the deployment of the new requirements in terms of labeling and regulatory notices in the packaging process of sterile products.
The objective of this methodological intelligence brief is to present the methodology followed for the implementation of a new secondary packaging process and the update of the company's internal documents. Other related tasks will also be detailed in the rest of this thesis.
Poster téléchargeable