IDS123 - Place de l'imagerie spectrale en scanner
Catégories
Mots-clés
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs





Contacts
- Cyriane CANADA : cyriane.canada@gmail.com
- Flora DUBUC : flora.dubuc@gmail.com
- Sylvia EL KHOURY : selkhoury29@gmail.com
- Louis ROUSSEL : roussel.louis@yahoo.fr
- Jean-Yves SINNAS : jeanyves.sign@gmail.com
Citations
A rappeler pour tout usage : C. CANADA, F. DUBUC, S. EL KHOURY, L. ROUSSEL, J-Y. SINNAS, "Place de l'imagerie spectrale en scanner", Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Master Ingénierie de la santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de projet, réf n° IDS123, janvier 2022. https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids123 ; https://doi.org/10.34746/xdd3-8r93
Remerciements
Pour les recherches et la rédaction de ce projet, nous souhaitons remercier M. Jérôme PRAT, ingénieur support technique chez Philips, pour son partage d’expérience, ses conseils, et le temps qu’il nous a accordé.
Nous remercions également M. Pol-Manoël FELAN, enseignant à l’UTC, pour son suivi et son aide tout au long du semestre. Par ailleurs nous remercions nos responsables de filière, Mme Isabelle CLAUDE et M. Jean-Mathieu PROT ainsi que M. Gilbert FARGES, responsable de l’enseignement « Ingénierie de projet » et Mme Béatrice KONIG, responsable veille et recherche documentaire à l’UTC, pour l’encadrement et les retours qu’ils nous ont faits tout au long du projet.
Résumé
L’imagerie médicale a beaucoup évolué et est désormais très utilisée à des fins de diagnostics, mais aussi de suivi et de traitement de pathologies. L’une des dernières technologies mise en place est le scanner spectral, qui consiste à utiliser différentes énergies pour obtenir des images caractéristiques des tissus. Cette technologie, bien qu’innovante, n’est pas encore adoptée par tous les établissements de soins, car son intérêt reste à démontrer.
Ce rapport met en évidence les différentes technologies existantes et leurs fonctionnements, les différentes applications possibles de l’imagerie spectrale et ses avantages par rapport à l’imagerie en scanner conventionnel, mais aussi les enjeux économiques, de santé publique et la place de l’imagerie spectrale dans un GHT.
Abstract
Medical imaging has evolved tremendously over the last decades and is now an essential part of the diagnosis and treatment of several pathologies. One of the most recent innovations is the IQon Spectral CT by Phillips, which uses multiple types of energy in order to obtain high-quality tissue imaging. However, this cutting-edge technology isn’t implemented by all health institutions yet.
This paper highlights the different co-existing technologies as well as their function. Moreover, this report will underline the potential applications of the IQon Spectral CT in addition to its advantages over the conventional scanner. Finally, the economical and public health challenges will be discussed along with the new Spectral CT position with regard to hospital groups.
Liste des abréviations
- AVC : Accident Vasculaire Cérébral
- CHU : Centre Hospitalier Universitaire
- CT : Computer Tomography
- FOV : Field Of View
- GHT : Groupement Hospitalier de Territoire
- HAS : Haute Autorité de Santé
- IRM : Imagerie par Résonnance Magnétique
- keV : Kilo-électrons Volt
- kV : Kilo Volt
- MBq : Mégabecquerel
- mGy : milligray
- NRD : Niveau de Référence de Dose
- PACS : Picture Archiving and Communication System
- PDL : Produit Dose Longueur
- PCR : Polymerase Chain Reaction
- PDC : Produit De Contraste
- TDM : tomodensitométrique
Téléchargements

Durée vidéo : 3min20
Mémoire complet :
Place de l’imagerie spectrale en scanner
Introduction
L'imagerie médicale est une technologie médicale qui a montré son utilité et ses preuves dans l'histoire de la médecine et qui ne cesse d'évoluer. En 1895, Mr Wilhelm Röntgen, physicien allemand découvre les rayons X en manipulant un tube de Crookes. Au cours de ces travaux, il demande à sa femme de positionner sa main entre le tube et l’écran : il réalise la première radiographie [1].
Depuis, l’imagerie médicale a beaucoup évolué et est désormais très utilisée à des fins de diagnostics, mais aussi de suivi et de traitement de pathologies. Son spectre est large puisqu’elle contient plusieurs modalités, telles que le scanner, très utilisé pour l’obtention d’images anatomiques. Mais comme dans tout autre technique, une bonne qualité d’images reste le principal objectif à atteindre. Certaines innovations peuvent être effectuées afin d’améliorer les performances et la qualité des images obtenues. L’une des dernières technologies mise en place est le scanner spectral, qui consiste à utiliser différentes énergies pour obtenir des images caractéristiques des tissus. Apparue en 2005, cette technologie suscite l’intérêt des établissements de soins.
Les deux questions suivantes se posent donc : comment l’imagerie spectrale permet de répondre aux besoins des patients et des médecins ? Quel est l’apport de l’implantation d’un scanner spectral au sein d’un centre hospitalier vis-à-vis des autres modalités ?
Ce mémoire de projet sera rédigé afin d’aider les établissements de santé à prendre leur décision sur leur choix d’intégrer un scanner spectral au sein de leur institution. Pour y répondre, il est pertinent d’étudier le principe physique du scanner spectral ainsi que ses applications. Puis, il sera abordé les enjeux que ce type d’imagerie implique, avant de finir par le plan d’actions mis en place pour mener à bien ce projet.
Partie 1 : Principe et intérêt de l’imagerie spectrale
1.1. Physique du scanner spectral
Comme S.A. Si-Mohamed et al. la décrivent : “L'imagerie tomodensitométrique (TDM) conventionnelle est la méthode d'imagerie en coupe disposant actuellement de la meilleure résolution spatiale et de la plus grande rapidité d'acquisition” [2].
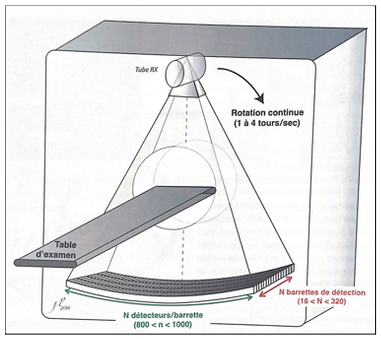
Un scanner est doté d’un émetteur de rayons X et d’un détecteur, situés à l’opposé l’un de l’autre (figure 1). Le patient est positionné sur une table mobile qui avance dans un anneau circulaire contenant le tube à rayon X. Le tube effectue des rotations au sein de l’anneau en même temps que le déplacement automatique de la table d’examen. D’autres composants sont présents, notamment un collimateur qui permet de déterminer l’épaisseur de coupe et de focaliser les photons incidents sur le patient mais aussi des détecteurs qui réceptionnent des photons incidents.
Figure 1 : Configuration d’un scanner standard [3]
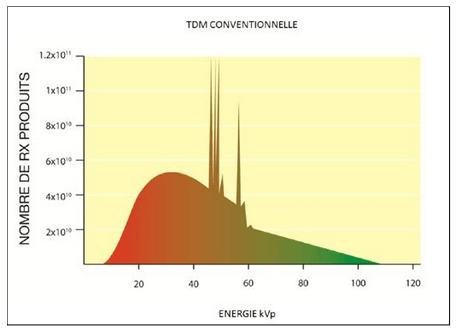
Son principe est la mesure de l’atténuation moyenne sur un spectre d’émission (figure 2) dont l’énergie maximale est définie en amont de l’examen. Le faisceau de rayons X est atténué par le patient en fonction des tissus traversés et de l’énergie de chacun des photons.
Le spectre résultant est mesuré par le détecteur qui intègre chacun de ces rayons X, indépendamment de leur énergie, afin de donner une atténuation moyenne.
En abscisse du spectre en figure 2 se trouve l’énergie des photons en kilo-électrons volt (keV) : environ 10 à 110 keV. Les unités keV et kVp (pic du kilovoltage) ne seront pas différenciées donc keV = kVp (kVp est le voltage maximum émis par le tube sur le faisceau et keV est l'énergie cinétique des électrons qui se déplacent).
Sur ce spectre, l’énergie maximale observée est d'environ 120 keV. Cela signifie que les électrons ont été accélérés à une tension maximale de 120 kV et qu’une infime proportion des photons produits auront l’énergie maximale de 120 keV. En effet, lors de la programmation d’un examen TDM, en choisissant une tension maximale de 100 kV, l’énergie moyenne du faisceau sera de 70 keV. C’est pour cela que l’on parle de faisceau polychromatique (= faisceau poly-énergétique)[3], on passe d'un faisceau énergétique polychromatique à un faisceau énergétique monochromatique virtuel.
En ordonnée est indiqué le nombre de photons (= rayons X) produits.
Figure 2 : Spectre d’énergie des rayons X en scanner conventionnel [4]
Il est désormais important de s’intéresser à l’atténuation des rayons X. À ce sujet, Jérôme Prat (spécialiste en scanner spectral chez Philips) détaille : “En scanner conventionnel, le spectre de rayons X émis par le tube est atténué en traversant le patient en raison de deux interactions microscopiques, la diffusion Compton et l'effet photo-électrique, dont les proportions dépendent de l'énergie des rayons X et de la composition des tissus.”[5].
L’effet photoélectrique se produit prioritairement lors de l’utilisation de basses énergies tandis que l’effet Compton intervient principalement à hautes énergies[3].
L’atténuation des rayons X est principalement dépendante “du milieu traversé, c'est-à-dire de son coefficient d’atténuation µ”[3]. Ce coefficient est constitué “presque exclusivement d’une composant photoélectrique et d’un composant de diffusion Compton”[6].
Plus simplement, l’atténuation totale (µ) pour une énergie donnée (E) possède une composante correspondant à l’effet Photoélectrique (µP(E)) et une composante liée à la diffusion Compton (µC(E)). (figure 3)
Figure 3 : Formule du coefficient d’atténuation pour une énergie donnée [5]

Toujours concernant ce coefficient d’atténuation, une publication d’Alvarez et Macovski[6] a permis de montrer qu’il était possible de modéliser ces deux composantes (µP(E) et µC(E)).
Pour chacune d’elles, les chercheurs ont identifié :
- une fonction de l’énergie (surlignée en bleu sur la figure ci-dessous), indépendante du matériau
- un coefficient (surligné en rouge sur la figure ci-dessous), dépendant du matériau [7].
Figure 4 : Modèle d’Alvarez et Macovski [5]

Ce modèle permet de différencier la partie dépendante de l’énergie, de la partie dépendante du matériau.
L’énergie spectrale se base sur le fait que chaque matériau possède une paire de coefficients liés à l’effet Photoélectrique (ap) et à l’effet Compton (ac) spécifique.
A partir de cette modélisation, la mesure à 2 énergies différentes (E1 et E2) permet de calculer les coefficients ap etac , propres à chaque tissu. En effet, on obtient deux équations (figure 5) à deux inconnus dont :
- les composantes µ(E1) et µ(E2) sont connues car elles correspondent à l’atténuation totale mesurée,
- les composantes fp(E1), fp(E2), fC(E1) et fC(E2) sont également connues car elles dépendent de l’énergie utilisée et,
- les coefficients ap et ac sont inconnus car spécifiques au matériau traversé.
Figure 5 : Équation à deux inconnues permettant de mesurer les coefficients ap et ac (spécifiques d’un matériau), d’après la modélisation d’Alvarez et Macovski [5]
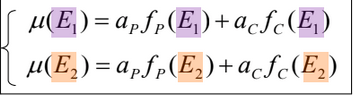
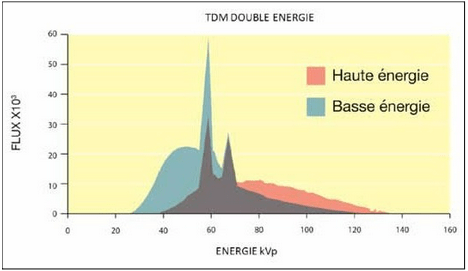
En pratique, pour chaque pixel de l’image, l’atténuation est mesurée à 2 énergies différentes : une tension basse à 80 kV et une haute à 140 kV, afin d’estimer les 2 types d’interactions responsables de l’atténuation des rayons X et dont les proportions sont caractéristiques de chaque tissu (figure 6).
Figure 6 : Spectre d’énergie des rayons X en scanner spectral, différenciant les hautes énergies des faibles énergies [4]
Grâce à cela, le scanner spectral permet d’analyser la structure anatomique de la zone étudiée (images d’un scanner standard) mais également d’analyser la composition d’un élément contenu dans la zone étudiée (images spectrales). Dans sa thèse datant de 2017, Julien Henrion précise que 2 types de données seront extraites grâce à un logiciel dédié en mode double énergie à émission (pas applicable en détection spectrale) [8] :
- des images mono énergétiques en contraste virtuel (40 à 140 kV) par extrapolation des données obtenues à 80 et 140 kV, semblables à des images obtenues lors d’un TDM conventionnel (figure 7)
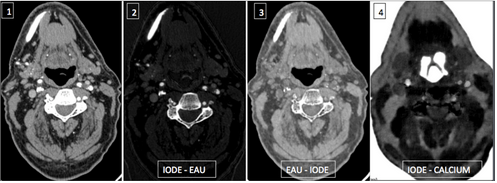
- des images de décompositions matérielles permettant des superpositions et/ou des soustractions d’iode, calcium et os. (figure 8)
Figure 7 : Images mono-énergétiques virtuelles de 40 à 140 ke reconstruites à partir des images 80 et 140 kV [8]

Figure 8 : Images reconstruites virtuellement d’un examen injecté des carotides internes [8]
1 : Image reconstruite mono-énergétique à 60 keV
2 : Image de l’iode avec soustraction de l’eau
3 : Image de l’eau avec soustraction de l’iode : image virtuelle sans injection
4 : image de l’iode avec soustraction de calcium
L’imagerie spectrale est donc une technique récente, permettant d’obtenir des images grâce à l’atténuation des rayons X obtenue à deux énergies différentes.
1.2. Historique et principe des différentes techniques d’imagerie spectrale
La composition d’un scanner spectral est similaire à celle des scanners conventionnels. Cependant, certains composants supplémentaires et modifications structurelles lui ont été appliqués afin d’obtenir des images de meilleure qualité.
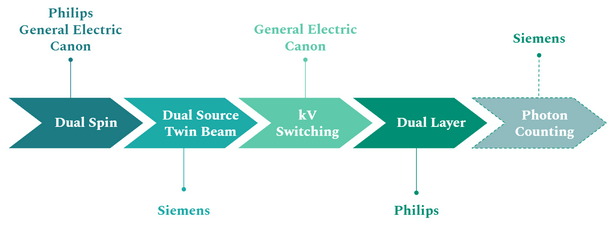
Les fabricants ont développé des scanners spectraux basés chacun sur une technologie différente. Ces variabilités sont notamment observées au niveau de l'émetteur ou du détecteur des rayons X. Ces différentes techniques peuvent donc être classées en deux catégories :
- L’imagerie scanner à double énergie, où les modifications sont effectuées sur le tube à rayon X pour permettre une acquisition en biénergie
- L’imagerie scanner à détection spectrale, qui consiste à la séparation des énergies sur le détecteur et non pas l’émetteur.
1.2.1. Imagerie scanner à double énergie
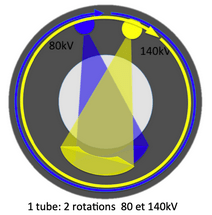
La première technologie spectrale, Dual Spin, a été implantée sur les scanners conventionnels avec un principe simple : on effectue une première rotation à bas kV (80 kV), puis une seconde rotation à haut kV (140 kV), donnant un décalage temporel supérieur à 1 seconde (figure 9). Cette solution est encore proposée par Philips, Canon et General Electric.
Figure 9 : Dual Spin[8]
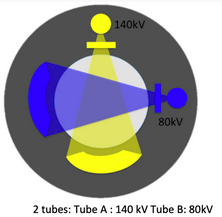
Les premiers appareils avec une réelle possibilité d’imagerie spectrale ont été conçus en 2005, avec un appareil à double tube (Dual Source) développé par Siemens. Cette seconde technologie consiste à utiliser deux sources de rayons X formant un angle droit l’une par rapport à l’autre. Il est alors possible d’utiliser deux énergies différentes sur chacun des tubes, et la filtration des deux tubes peut être changée afin de modifier la différence d’énergie entre ces deux spectres. Plus il y a de différence entre les énergies, meilleure sera l’analyse spectrale (figure 10).
Figure 10 : Dual Source[8]
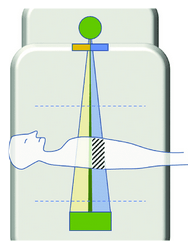
L’autre solution qu’a proposé Siemens avec la technologie Twin Beam en 2017, est d’utiliser une seule source de rayons X et des filtres permettant de diviser le faisceau de rayons X de 120 kV en un spectre de rayons X de haute et basse énergie avant qu'il n'atteigne le patient (figure 11).
Figure 11 : Twin Beam[9]
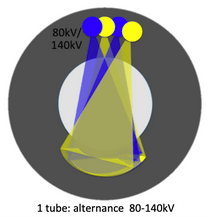
Par la suite, General Electric propose en 2011 une technologie kV Switching. Cette technique d’imagerie spectrale, vise à émettre des faisceaux de rayons X en alternant très rapidement les deux niveaux d’énergie (80 kV et 140 kV). De cette manière, deux atténuations peuvent être mesurées de façon quasi simultanée. Mais un des inconvénients de cette innovation est le léger décalage temporel et angulaire entre les deux mesures[10]. Cette solution a également été proposée dernièrement par Canon (figure 12).
Figure 12 : kV Switching[8]
1.2.2. Imagerie scanner à détection spectrale
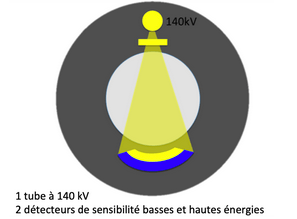
En 2017, Philips sort le modèle IQon Spectral CT. Son détecteur à double couche permet la séparation des basses et des hautes énergies à la sortie du patient (figure 13). Cette technologie très récente, permet à travers un tube d’émettre un rayonnement X à 100, 120 ou 140 kV, et le détecteur sépare automatiquement l’énergie du faisceau grâce à sa composition formée de deux couches de détection l'une sensible aux bas kV et l'autre aux hauts kV.
Figure 13 : Dual Layer[8]
Dans l’avenir, l’objectif est de développer des détecteurs à comptage photonique. Cette technologie prévoit de discriminer les photons d’un point de vue énergétique, permettant d’assurer une décomposition spectrale parfaite et donc une sélectivité matérielle plus précise (figure 14). L’image obtenue promet alors une meilleure résolution spatiale et sans bruit électronique, puisque chacun des photons est directement transformé en signal électrique. Siemens a d’ailleurs lancé le premier scanner spectral photon-counting le 18 novembre 2021 [11], [12].
Figure 14 : Schéma d’un détecteur à comptage photonique[11]
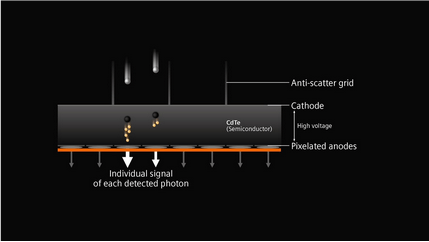
Figure 15 : bilan des différentes techniques d’imagerie spectrale [source auteur.e.s]
Les différentes techniques d’imagerie spectrale sont donc apparues au fil du temps à partir de 2005, et ne cessent d’évoluer, notamment avec le Photon Counting apparu tout récemment.
1.3. Avantages et inconvénients des techniques d’imagerie spectrale
Chacune des techniques citées précédemment ont le même objectif : produire des images spectrales. Cependant, leurs différences de caractéristiques techniques ne les destinent pas à la même utilisation. Dans le tableau 1 ci-dessous sont présentés les avantages et inconvénients de chacune de ces technologies [5], [13] :
Tableau 1 : Avantages et inconvénients de chacune des technologies
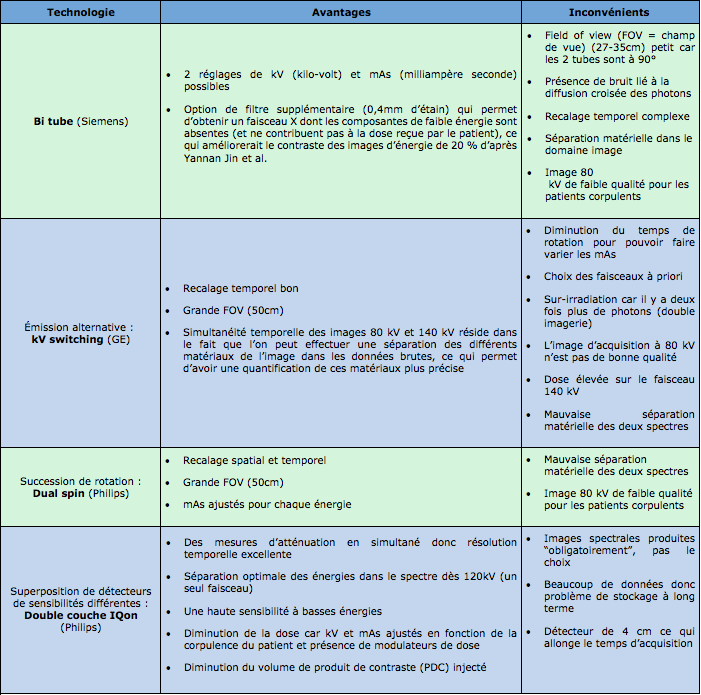
Ces technologies sont donc utilisées différemment, mais elles possèdent toutes des cartographies de post-traitement similaires, comme présentées dans la partie suivante.
1.4. Les différentes cartographies en scanner spectral
En post-traitement, le professionnel de santé est capable de visualiser les images acquises en scanner spectral avec différentes cartographies qui peuvent être juxtaposées ou fusionnées, et permettent d’améliorer le diagnostic. L’interprétation des images peut se faire avec les cartographies suivantes, dont les résultats dépendent de la technologie employée. Un focus est fait ici sur l’IQon Spectral CT de Philips [14] :
- Cartographie monoénergétique (MonoE) (figure 16) : cette cartographie permet de simuler un faisceau de 40 à 200 keV en détection spectrale. En bas keV, elle permet de rehausser le contraste tissulaire et iodé, ainsi que de réduire significativement la charge d’iode. En haut keV, elle permet une réduction des artéfacts.
Figure 16 : Exemple de cartographie MonoE
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
- Cartographie de densité d’iode et d’iode sans eau (figure 17): cette cartographie fait appel à un algorithme de deep learning qui supprime le bruit et met en évidence le signal de l’iode uniquement. Elle permet de quantifier la concentration d’iode dans les régions d'intérêt ROI. Cette carte est souvent comparée à la carte monoénergétique à 40 keV.
Figure 17 : Exemple de cartographie de densité d’iode et iode sans eau
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
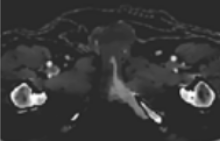
- Cartographie VNC ou “virtuel sans contraste” (figure 18) : elle permet à partir d’une séquence injectée d’obtenir virtuellement une image non injectée par décomposition des matériaux eau/iode. Pour extraire les informations sans contraste de la partie injectée, il suffit de supprimer la carte de l’iode.
Figure 18 : Exemple de cartographie VNC
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
- Cartographie Z effectif (figure 19) : cette cartographie permet de caractériser les voxels à partir du numéro atomique (Z) effectif et de la densité électronique. Elle sépare les différentes matières sur l’image comme les tissus (pathologiques ou non).
Figure 19 : Exemple de cartographie de densité électronique
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
- Cartographie CaSupp, ou carte de suppression de Calcium (figure 20) : comme son nom l’indique, c’est une carte qui permet de visualiser une image virtuelle sans calcium. Tous les voxels de calcium sont substitués par des voxels équivalents sans atténuation calcique.
Figure 20 : Exemple de cartographie de suppression de Calcium
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
- Cartographie d’Acide Urique (figure 21): à partir de cette carte la présence d’acide urique peut être visualisée au niveau des articulations.
Figure 21 : Exemple de cartographie d’acide urique
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
- Carte densité électronique (figure 22): cette carte met en évidence l’effet Compton diffusé par les tissus, et permet de déterminer le pourcentage de la densité électronique de chaque voxel en le comparant à celui de l’eau. Elle permet également de réhausser le contraste dans les séries non injectées.
Figure 22 : Exemple de cartographie densité électronique
[Source : Double couche #12, le magazine de l’IQon, Cas cliniques, Jérôme Prat, Philips]
Ces différentes cartographies ont donc un réel intérêt pour l’interprétation des résultats et le diagnostic.
Afin de mieux comprendre l’utilité de ces cartographies dans la prise en charge du patient, les applications du scanner spectral sont détaillées dans la partie suivante.
Partie 2 : Applications cliniques et parcours patient
Même si l’innovation en imagerie médicale prend une part importante sur beaucoup de points, la place du patient l’est tout autant. En outre, le scanner spectral propose des avantages pour le patient comme [15] :
- Une réduction de la quantité d’iode injectée de 50% (l’image monochromatique permet un contraste optimisé) trouve son intérêt pour les patients présentant des insuffisances rénales (réduire au maximum l’injection de produit de contraste iodé)[16],
- Une détection ou élimination de contraste dans une zone dense,
- Une meilleure fiabilité du diagnostic,
- Une réduction des artéfacts d’un matériel métallique.
Toutefois, il ne faut pas négliger les inconvénients que peut engendrer la technologie de détection spectrale au scanner pour le patient. Entre autres, une augmentation de la dose d’irradiation comparée au scanner conventionnel malgré l’utilisation du logiciel de réduction de dose. Ou encore, l’apparition d’artéfacts autres que métalliques, due à la technologie spectrale (IQon Spectral CT) qui n’est pas présente lors d’autres examens d’imagerie médicale (par exemple l’IRM et le scanner conventionnel). Enfin, le dernier inconvénient du scanner spectral est le temps de traitement des images qui peut être long[17]. Le professeur Philippe Douek Chef du pôle de radiologie des Hospices de Lyon a d'ailleurs évoqué cet inconvénient lors de son interview pour le magazine double couche de l’IQon de Philips. Les radiologues rencontrés à l'Hôpital Saint-Louis dans le cadre de cette étude ont également partagé le même point de vue sur cette technologie.
Cette partie étudie l’impact du scanner spectral sur plusieurs types d’applications, par rapport aux autres imageries fréquemment utilisées. Dans ces applications sont indirectement incluses celles liées aux urgences, avec notamment un focus sur la Covid-19.
2.1. Oncologie
Les cancers représentent la première cause de mortalité chez l’homme en France. En 2018, 382 000 nouveaux cas ont été recensés [18].
Le scanner spectral permet la détection précoce de cancers. Il est possible de discriminer les couches tissulaires sur des masses tumorales d’un scanner normal en fonction de la captation d’iode. Les lésions sont mieux identifiées grâce aux données multiparamétriques.
Pour certaines maladies types tumeurs pancréatiques, les signes indirects étaient auparavant vus au scanner conventionnel dans un premier temps, puis un examen complémentaire comme l’IRM était réalisé, ce qui pouvait être contraignant pour le patient. En effet, un examen complémentaire nécessite des délais et potentiellement des coûts supplémentaires pour le transport des patients. Des frais engendrés par la sécurité sociale peuvent également s’ajouter avec la monopolisation du personnel hospitalier (brancardier, manipulateur, médecin), des frais d’hospitalisation, etc.
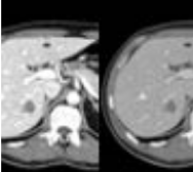
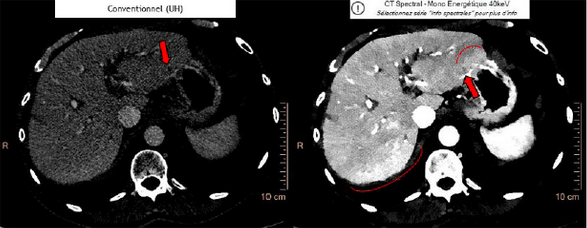
Maintenant que la lésion est identifiée plus rapidement et que le scanner est d’emblée spectral, le diagnostic peut être plus rapide [19]. L’image ci-dessous montre ces lésions en fonction du type de scanner. Dans cette étude réalisée avec l’IQon de Philips, les petites lésions avec le scanner spectral sont bien mieux identifiées ( figure 23 image de droite), qu’avec le scanner conventionnel ( figure 23 image de gauche).
Figure 23 : Métastases de tumeurs pancréatiques[19]
La combinaison des modalités d’imagerie est également intéressante. En effet, selon le type de cancers, l’IRM peut être combinée à un scanner spectral [19]. Avant de savoir si le patient peut être opéré, le médecin peut demander une résonance. Cette résonance est ensuite suivie d’un scanner spectral pour explorer les métastases mais aussi d’autres éléments comme l’axe vasculaire, qui est important pour décider de la chirurgie.
Afin de poursuivre cette comparaison de plusieurs modalités dans le diagnostic des cancers, une étude réalisée sur les métastases du cancer du sein est analysée. L’étude a été réalisée grâce à l’IQon Spectral CT de Philips sur 182 patientes et compare l’IRM, le scanner conventionnel et le scanner spectral [20].
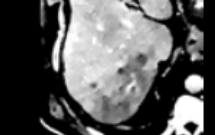
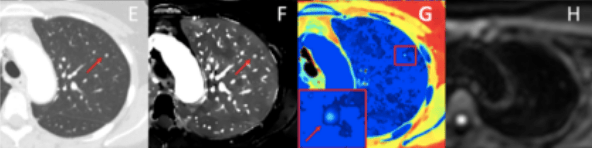
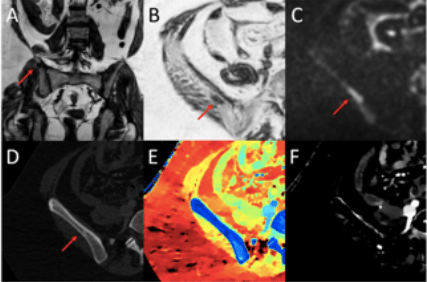
L’étude montre que les performances de diagnostic et de sensibilité sont plus élevées avec le scanner spectral que l’IRM et le scanner conventionnel. De plus, les ganglions lymphatiques et les nodules pulmonaires sont mieux observables avec le scanner spectral, comme le montrent les images ci-dessous. L’exemple est donné sur une patiente ayant des métastases pulmonaires. La lésion est trop petite pour être identifiée en scanner conventionnel (figure 24 image E), et est invisible en IRM (figure 24 image H), alors qu’en scanner spectral (figure 24 images F et G), le nodule est bien identifié et est considéré comme une métastase[20].
Figure 24 : Patiente avec métastase pulmonaire dans le lobe supérieur gauche[20]
E : Image en mode conventionnel
F : Image en mode spectral avec cartographie densité d’iode
G : Image en mode spectral avec cartographie Z effectif
H : IRM, séquence de diffusion b200
En revanche, l’exemple ci-dessous montre une métastase osseuse, bien visible en IRM (figure 25 images A, B, C), mais très peu visible en scanner conventionnel ( figure 25 image D) et pas du tout en scanner spectral (images E et F)[20].
Figure 25 : Patiente avec métastase osseuse[20]
A : IRM, vue coronale en T1
B : IRM, vue axiale en T1
C : IRM, séquence de diffusion b800
D : Image en mode conventionnel
E : Image en mode spectral avec cartographie Z effectif
F : Image en mode spectral avec cartographie densité d’iode
En conclusion, le scanner spectral s’impose de plus en plus comme l’IRM dans le diagnostic des cancers. En fonction du type de cancers, l’IRM et le scanner spectral peuvent être combinés, ou bien réalisés de manière indépendante.
Utilisé seul, le scanner spectral permet au patient de subir moins d’examens, donc un gain de temps. En effet, un examen spectral dure environ 10 min, contre 15 à 30 min pour l’IRM. De plus, l’attente pour un rendez-vous pour une IRM est de l’ordre 30 jours à 1 mois et demi, alors qu’un examen en scanner spectral est beaucoup plus rapide (environ 1 semaine à 1 mois).
2.2. Neurologie
En imagerie cérébrale, le diagnostic est posé grâce aux images d’iode pour visualiser le rehaussement iodé d’une part, et les images sans contraste pour supprimer le signal d’iode d’autre part.
De plus, les images sans contraste permettent de mettre en évidence l'étendue de la lésion ischémique par rapport aux images conventionnelles, ainsi que les plages de remaniement hémorragique [2].
Le suivi à la suite d’une thrombectomie est parfois compliqué car la différenciation entre l’iode et le sang lié à l’hémorragie est difficile.
L’utilisation de la cartographie d’iode permet de différencier les deux composants, comme le montrent les images de la figure 26 réalisées grâce à l’IQon de Philips :
Figure 26 : Contrôle d’une diverticulite douteuse [15]
Image A : Imagerie conventionnelle
Image B : Image d’Iode sans eau
Image C : Image virtuelle sans contraste
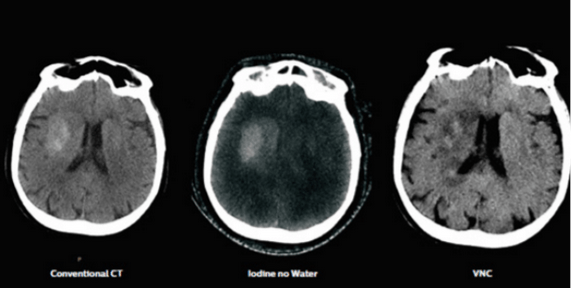
Dans le magazine “Double couche” numéro 4 édité par Philips, le Professeur Emmanuel Coche responsable du département de radiologie de l’hôpital universitaire Saint Luc près de Bruxelles, qui est un des premiers établissements en Europe à installer un IQon Spectral CT dans le service d’urgence, précise que le scanner spectral est utilisé pour la recherche l’AVC hyperaigu. On compte en France environ 140 000 AVC par an[21].
En revanche, pour les situations d’urgence cérébrale, l’IRM reste la modalité la plus préconisée[15], [22].
2.3. Embolies pulmonaires
L’embolie pulmonaire est une pathologie qui touche les poumons et doit être traitée dans les plus bref délais. Il s’agit d’une migration d’un embole (caillot sanguin) dans l’arbre artériel pulmonaire qui provoque une oblitération brutale proximale et/ou distale des vaisseaux artériels pulmonaires.
Il existe plusieurs modalités d’imagerie médicale qui permettent de poser un diagnostic positif ou négatif. Ces différentes modalités sont :
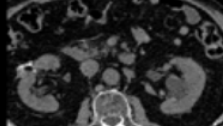
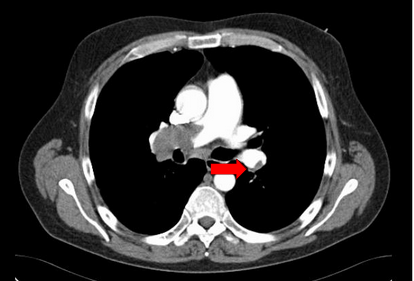
L’angio-scanner thoracique : il s’agit d’un examen TDM standard avec injection de produit de contraste (PdC) (figure 27). C’est un examen de première intention pour le diagnostic positif. Sa sensibilité est excellente pour les embolies pulmonaires proximales (diminue pour les distales). Concernant la radioprotection-patient, un examen de scanner thoracique conventionnel pour une indication d’embolie pulmonaire a un PDL (Produit Dose Longueur) d’environ 475 mGy.cm (milliGray par centimètre) pour un adulte[23].
Figure 27 : Angio scanner thoracique en coupe axiale d’une embolie pulmonaire[24]
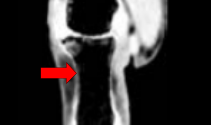
La scintigraphie pulmonaire de ventilation et de perfusion : c’est un examen de deuxième intention (figure 28). Elle est réservée en cas de contre indication à l’angio-TDM. L’image ci-dessous met en évidence les zones touchées par l’embolie (flèches rouges) :
Figure 28 : Scintigraphie pulmonaire de perfusion et de ventilation visualisant une embolie pulmonaire [image libre de droit]
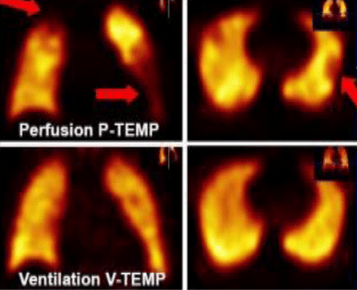
Pour une scintigraphie pulmonaire de perfusion au technétium 99m, la NRD (Niveau de Référence Diagnostique) qui a été définie est de 225 MBq (MégaBecquerel) à injecter au patient[25].
Le scanner spectral (IQon Spectral CT): il permet d’améliorer la détection des embolies grâce à la répartition de l’iode au sein du volume scanné. Il permet également de mieux voir les artères pulmonaires avec une quantité réduite de produit de contraste.
Les avantages du scanner spectral par rapport aux autres modalités d’imageries sont donc :
- Une meilleure visibilité des vaisseaux artériels (proximaux ou distaux) avec moins de produit de contraste que lors d’un angio-scanner. Par exemple, pour un scanner spectral, il faut 30 centimètres cubes (cc = mL) de pdc dont la concentration est plus élevée qu’un scanner conventionnel, pour lequel il faut 80 cc de pdc[26].
Cela aura un impact direct pour le patient car l’injection de produit de contraste iodé n’est pas anodine pour le corps humain. Il existe beaucoup d’effets secondaires au produit de contraste (allergies, insuffisances rénales, etc…), ce qui démontre l’intérêt de limiter sa quantité injectée tout en gardant une bonne qualité d’image.
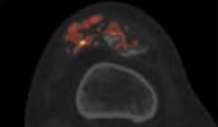
- La possibilité de faire une reconstruction avec une cartographie Z effectif. Ce mode spectral couleur permet d’observer les problèmes d'irrigation pulmonaire [27] que l’on verrait normalement en scanner conventionnel avec injection de produit de contraste ou en scintigraphie pulmonaire de perfusion, comme observés sur la figure 29 :
Figure 29 : Différentes cartographies au scanner spectrale pour l’embolie pulmonaire[27]
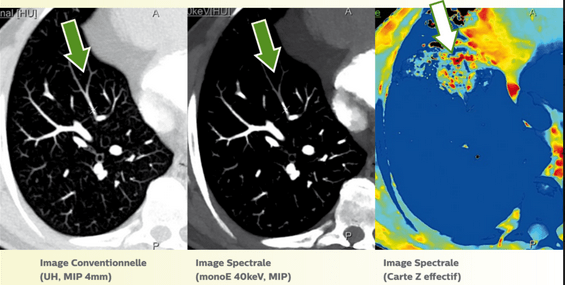
L’embolie pulmonaire est une pathologie à prendre en charge en urgence et pour le moment, le scanner est la modalité la plus adaptée pour cette indication. L’avantage du scanner spectral est la pluralité des informations récoltées pendant l’acquisition et en post-traitement d’image. C’est-à-dire que ces informations peuvent aider le radiologue dans son interprétation en vue de limiter le nombre d’examens supplémentaires (comme la scintigraphie pulmonaire pour préciser le diagnostic) et par conséquent, avoir un impact positif sur la radioprotection-patient (cumul de dose) ainsi qu’une réduction du parcours patient.
L’impact du scanner spectral pour le parcours patient concerne l’utilisation d’autres modalités en complément. Dans le cas de l’utilisation du scanner conventionnel, le patient peut faire d’autres examens complémentaires comme une scintigraphie pulmonaire si le diagnostic n’est pas concluant au scanner. Avec le scanner spectral, le patient a un seul examen qui permet d’avoir un diagnostic clair et précis, ce qui réduit grandement le parcours de soins du patient et son déplacement au sein des centres hospitaliers (du service d’imagerie au service de médecine nucléaire).
2.4. Cas de la Covid-19
Durant la crise sanitaire, les hôpitaux dotés de scanners spectraux ont pu les exploiter pour diagnostiquer leurs patients. Le virus covid-19 est un virus qui cause des dégâts essentiellement au niveau des poumons. Au début de la pandémie, il était difficile de diagnostiquer les patients touchés par ce virus.
Le Centre Hospitalier de Charleville-Mézières, GHT Nord Ardennes, possède le scanner spectral IQon Spectral CT de Philips. Lors d’une interview, le Docteur Philippe Mateu, chef de service de réanimation de ce centre hospitalier, précise que l’IQon Spectral CT était un outil de diagnostic très utile durant cette crise sanitaire, surtout pour les patients asymptomatiques qui n’expriment pas de symptômes relatifs à ce virus mais qui sont porteurs.
A travers cette technologie, ils arrivent à repérer les lésions pulmonaires très importantes sur ce type de patients mais également sur les patients présentant des troubles respiratoires. Pour le GHT du Nord Ardennes, le scanner IQon Spectral CT a été une aide au diagnostic durant cette crise, il leur a permis de repérer les zones qui ne pouvaient pas être ventilées et qui risquaient de se fibroser.
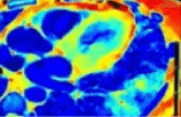
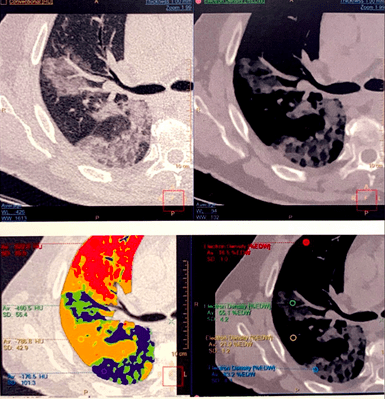
Le pourcentage d’atteinte du covid-19 pour un patient est mieux déterminé avec les cartographies à densité électronique obtenues en post-traitement d’un examen réalisé sur un scanner spectral IQon Spectral CT que sur une image obtenue à la suite d’un examen effectué avec un scanner conventionnel.
Ce pourcentage exprime le volume pulmonaire atteint par cette maladie. Dans la figure 30, le volume pulmonaire atteint par la covid-19 est représenté par différentes couleurs sur les cartographies à densité électronique. Chacune d’entre elles, correspond à un pourcentage qui permet au radiologue de définir le grade de la maladie :
Figure 30 : Imagerie spectrale par cartographie densité électronique colorimétrique montrant les pourcentages de volume pulmonaire atteint par la covid-19
[Source : Magazine double couche 10, Philips]
De plus, comparée à l’imagerie conventionnelle, cette carte à densité électronique permet de mieux visualiser le verre dépoli, son atténuation est meilleure. Le verre dépoli correspond à une zone dense du parenchyme pulmonaire[28].
Il s’avère que sur toutes les images de scanner des malades SARS Cov 2 il est possible de repérer des plages de verre dépoli[29].
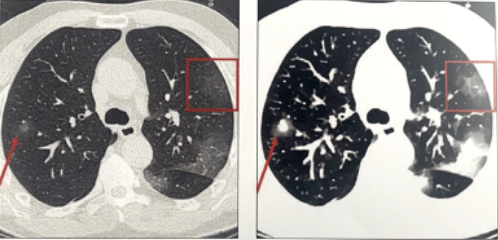
Dans la figure 31, deux images représentant les poumons sont illustrées, une a été réalisée avec un scanner conventionnel et l’autre avec un scanner spectral. L’image de gauche (image conventionnelle) montre les opacités de verre dépoli diffuses périphériques bilatéraux. L’image de droite (densité électronique) montre des opacités du verre dépoli plus étendues et plus visibles que celles de l’image de gauche. Les flèches rouges et la zone encadrée mettent en évidence ces deux lésions :
Figure 31 : Imagerie conventionnelle et spectrale montrant les plages de verre dépoli
[Source : Double Couche 1, le magazine de l’iQon, Philips]
Le Centre Hospitalier de Charleville-Mézières, n’est pas le seul à avoir remarqué l’intérêt du scanner spectral durant la pandémie. L’Hôpital privé d’Antony a également trouvé que l’usage du scanner spectral pour les imageries d’urgence des thorax des patients Covid était pertinent pour une détection précoce de la maladie [30], [31].
Durant la pandémie, le scanner thoracique a joué un rôle très important dans la prise en charge des patients atteints de la covid-19. L’HAS a également appuyé cet argument en publiant une fiche intitulée “Réponses rapides dans le cadre de la COVID-19 Place du scanner thoracique”. Le scanner était très utilisé pour diagnostiquer et suivre l’évolution des lésions pulmonaires des patients ayant des détresses respiratoires sévères. Cependant, il n’est pas utilisé pour dépister les patients, il est nécessaire de faire un test PCR avant. Si ce dernier est positif et que les malades possèdent des signes graves de la maladie à ce moment, un examen au scanner est effectué. En effet, le scanner conventionnel à basse dose sans injection est recommandé pour estimer l’étendu et la sévérité de l’atteinte pulmonaire. A la suite de cet examen, si les symptômes lors du suivi sont aggravés, un scanner thoracique avec injection peut être recommandé pour mieux observer les infections respiratoires sévères[32].
Mais comme dit précédemment, l’examen du thorax au scanner spectral rapporte plus de précisions et une meilleure visualisation des verres dépolis et du pourcentage de volume pulmonaire atteint. Au centre hospitalier de Charleville-Mézières, le chef de service de réanimation, le Docteur Philippe Mateu, et le Docteur Philippe Cart, chef de pôle du service d’imageries médicales, précisent dans le double couche 10 du magazine de l’IQon Spectral CT, que le scanner spectral était très efficace pour le diagnostic de ce virus mais qu’ils se sont rendu compte de son potentiel tardivement. En effet, au tout début de la pandémie, les résultats des tests PCR étaient établis très lentement et les patients asymptomatiques étaient difficilement diagnostiqués. Grâce aux images obtenues sur le scanner spectral, ils ont pu rapidement repérer les patients atteints de la Covid-19, ce qui a permis une prise en charge plus rapide. De plus, ils soulignent que l’ARS a également approuvé que cette technologie est une aide au diagnostic en plus des tests PCR. Les examens effectués sur le scanner spectral pour chercher les personnes touchés par ce virus se font avec injection de produit iodé de 15 et 30 cc. Actuellement, le Centre Hospitalier de Charleville Mézière procède par un test PCR et de sérologie pour dépister les patients atteints de la Covid-19. Si le patient a effectué au préalable un examen au scanner spectral et que des lésions pulmonaires caractéristiques de ce virus ont été repérées, il est déclaré positif à la Covid-19. Les deux chef de service de réanimation et d’imagerie médicale ont signalé durant l’entretien qu’ils avaient eu des patients possédant des tests négatifs mais une image spectrale de leur thorax typique de la Covid-19[31].
Cela montre que les tests PCR sont efficaces mais parfois pas très fiables, le scanner spectral joue un rôle central dans la prise en charge des patients il permet de vérifier plus précisément la présence de symptômes caractéristiques de ce virus. Il est donc important que les établissements de santé possédant cette technologie, intègre dans la prise en charge des patients atteint de la Covid-19 un examen sur le scanner spectral.
2.5. Urologie
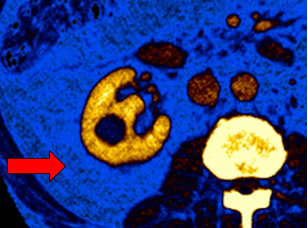
Pour les patients possédant des calculs rénaux, il est difficile de déterminer leurs compositions chimiques avec un examen sur le scanner conventionnel. Par contre, le scanner à détection spectrale a montré un réel intérêt dans la caractérisation des calculs rénaux, en déterminant le type de calculs, grâce à des techniques de post-traitements sur le rapport des basses et hautes énergies et à la comparaison entre les différentes cartographies (Mono-E et iodine)[33].
Le scanner spectral permet d’aider les médecins quant au choix du traitement adéquat pour le patient : une intervention invasive pour les calculs de cystine, de brushite ou d’oxalate de calcium monohydraté ou une administration médicamenteuse pour les calculs d’acide urique[34].
La cartographie monoE ci-dessous (Figure 32) montre un calcul ainsi que sa localisation. La cartographie iodine (Figure 33) va permettre de superposer des images à l'iode codées par la couleur chez un patient atteint d'un kyste rénal. Elle fournit une visualisation directe à code couleur de la teneur en iode dans l'image. Le manque d'intensité du signal d'iode dans le kyste est observé, dénotant l'absence d'amélioration du contraste et donc de caractériser sa composition.
Figure 32 : Conventionnel non-amélioré[35]
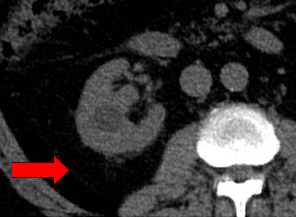
Figure 33 : Imagerie spectrale avec cartographie iodine[35]
Comme vu dans cette partie, le scanner spectral montre un réel intérêt pour certaines pathologies (oncologie, embolies pulmonaires, Covid-19…), mais est encore en cours d’études pour d’autres (maladies cardio-vasculaires et cérébrales). Il peut être utilisé seul ou avec d’autres types d’imagerie.
Cette liste d'applications est non exhaustive et ne fera qu’augmenter avec l’implantation de scanners spectraux dans les hôpitaux.
Partie 3 : Place du scanner spectral en imagerie
3.1. Place des différentes technologies de scanners en GHT
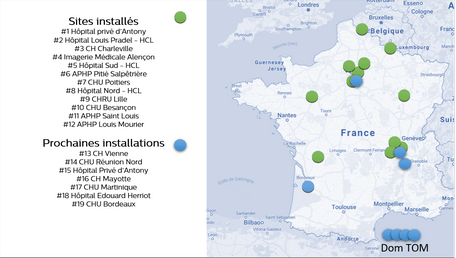
En France, 17 IQon Spectral CT de Philips sont actuellement installés en GHT, notamment à Paris, Lille, Lyon, Besançon… De prochaines installations sont planifiées pour les hôpitaux de Bordeaux, Mayotte, et la Martinique. La figure 34 montre une cartographie des IQon Spectral CT implantés en France :
Figure 34 : Cartographie montrant les IQon Spectral CT installés en France
[Source : Documentation Philips]
Deux visites de services d’imagerie médicale et une publication dans le magazine Double Couche de Philips ont permis d’apporter des informations complémentaires sur la place du scanner spectral dans les hôpitaux.
L’hôpital Saint Louis de Paris utilise le scanner spectral depuis moins d’un an. Leur choix s’est orienté vers l’IQon Spectral CT de Philips car l’imagerie est d’emblée spectrale et il peut être intégré avec le PACS. L’hôpital a décidé d’acheter un scanner spectral pour le diagnostic des cancers, des embolies pulmonaires et les urgences. L’équipe médicale a déclaré que, grâce à ce scanner, les IRM réalisées pour des découvertes fortuites peuvent être évitées. Elle réalise environ 50 scanners par jour.
Une publication dans le magazine Double Couche de Philips a révélé que le scanner spectral IQon Spectral CT implanté au CHU de Lille a été une vraie avancée[36]. Ce scanner est présent dans les services d’imagerie digestive et endocrinienne, génito-urinaire et imagerie de la femme, ainsi que d’imagerie ORL. Le CHU possède ce scanner depuis 2 ans ou moins selon les services. Comme l’hôpital Saint Louis, leur choix s’est porté sur l’IQon Spectral CT car l’imagerie spectrale permet une parfaite simultanéité comparée aux autres techniques, et est d’emblée spectrale. Selon le CHU de Lille, l’intérêt est réel pour le patient, notamment avec la réduction du volume de contraste injecté. Les médecins l’utilisent beaucoup pour l’oncologie.
Le CHU a observé un surcoût de l’ordre de 20% par rapport à un scanner haut de gamme conventionnel et a déclaré que ce surcoût était presque invisible pour un médecin, comparé au gain apporté sur chaque examen.
Au CHU d’Amiens, l’imagerie spectrale est disponible depuis 10 ans. Elle n’était pas beaucoup utilisée au début, notamment à cause des difficultés médicales, comme le manque d’habitude aux cartographies et la nécessité plus importante de post-traitement. Le passage à l’imagerie spectrale a été motivé principalement par son application en oncologie, et tous les examens d’imagerie viscérale passent désormais par le scanner spectral. Néanmoins, l’utilisation reste médecin dépendant, ce qui signifie que si le médecin ne souhaite pas l’utiliser, l’examen ne se déroulera pas en spectral. Par exemple, les radiologues n’utilisent pas l’imagerie spectrale en cardiologie car ils n’y voient pas de réel intérêt.
Le CHU est équipé par la technologie kV Switching de General Electric. Ce choix s’est décidé en partie car le reste du service est équipé d’appareils General Electric, le personnel était donc déjà habitué aux interfaces de ce fabricant.
Les applications de l’appareil vont dépendre de l’architecture du CHU : si le scanner spectral est destiné à l’ambulatoire ou l’urgence. De plus, l’imagerie spectrale n’a pas pris la place d’autres modalités (échographie, IRM, …), en partie car il est trop compliqué de changer les habitudes de travail, d’où l’importance d’un travail conjoint entre fabricant et utilisateur.
Ainsi, environ 20% des scanners sont réalisés en spectral pour une utilisation ambulatoire (environ 40 examens par semaine, soit 2000 par an pour un appareil). Ce pourcentage est plus faible en urgence, car ils ne l’utilisent quasiment que dans les cas d’embolies pulmonaires.
Ces entretiens et cette publication montrent donc bien l’intérêt du scanner spectral dans différents services d’un GHT. Chaque hôpital choisit donc la technologie qui lui sert le plus en fonction des pathologies traitées.
3.2. Enjeux de santé publique
Le scanner à détection spectrale (IQon) est une technologie et modalité innovante en imagerie médicale. L’impact de cette nouvelle technologie est non négligeable pour qu’un établissement de santé garde une certaine attractivité et par rapport aux innovations qu’il propose. Cette attractivité se fait au niveau des professionnels de santé, que ce soit pour les médecins séniors ou encore les internes, avec un intérêt particulier pour la recherche.
De plus, l’Institut National du Cancer préconise dans la “stratégie décennale de lutte contre les cancers 2021-2030” que :
“Les innovations en imagerie médicale et médecine nucléaire devront également être encouragées. Dans ce cadre, l’imagerie spectrale comme perspective d’amélioration de la pertinence de l’acte scanographique pourra faire l’objet d’évaluations.[...] Des programmes de recherche seront mis en place sur ces différentes modalités de prise en charge, associant l’ensemble des professionnels. Et, le cas échéant, différents leviers pourront être mobilisés : des mécanismes d’incitation/désincitation financière des établissements de santé, des instructions des pouvoirs publics aux structures”[15]. Ceci montre un intérêt de la part de l'État d’intervenir sur les innovations en santé et leur implication dans ce domaine.
Si une aide financière est proposée aux établissements de santé de la part de l’état, cela permettrait d’intégrer le scanner spectral plus facilement dans tout type d’établissement hospitalier voir clinique.
3.3. Enjeux financiers : les établissements de santé
Les Centres Hospitaliers Universitaires (CHU) permettent souvent d'ouvrir la voie aux nouvelles technologies coûteuses. En effet, pour les appareils comme celui-ci, ce sont souvent les CHU, ayant un budget plus important, qui vont pouvoir démontrer les avantages de tels dispositifs à d'autres centres hospitaliers. De plus, la présence de ces appareils au sein des CHU leur permet de publier des travaux de recherche, et donc d'obtenir de la visibilité et de la réputation auprès de leurs pairs.
Il est néanmoins nécessaire de prendre le projet bien en amont et un travail doit être fait avec les radiologues pour expliquer tous les changements cliniques et techniques qu'apportent ce type d'appareil.
Du point de vue financier, il faut réserver un budget pour l’acquisition d’un scanner spectral. Un scanner spectral coûte en effet deux fois plus cher qu’un scanner conventionnel (de 500 k€ pour un scanner conventionnel à 1,2 millions d’€ pour la gamme premium du scanner spectral) [37]. Il est alors parfois nécessaire d'aller chercher un budget ailleurs qu'au CHU, par exemple auprès de la région. D'autre part, les groupes privés tels que les cliniques, sont souvent freinés à l'achat pour des raisons économiques.
En outre, un examen faisant appel à la technologie spectrale sera remboursé au même titre qu’un examen au scanner conventionnel, c’est-à-dire remboursé à 70% par la Sécurité sociale et le reste à charge par la mutuelle du patient après remboursement par l’Assurance Maladie [38]. Cela aura alors un impact pour les établissements de santé privés mais aussi publics car le prix d’achat d’un scanner spectral est plus élevé qu’un scanner standard, alors que le montant remboursé est le même.
La moyenne nationale de délai d’attente pour un rendez-vous de scanner conventionnel est de l’ordre de 30 jours [39]. En sachant que le scanner spectral permet de réduire le temps d’acquisition comparé au scanner conventionnel, l’hypothèse est émise que le délai d’attente pour un rendez-vous au scanner (en fonction de l’indication) peut être réduit. Entre autres, le délai d’attente recommandé pour un examen en imagerie médicale est de 20 jours d’après l’Institut National du Cancer pour un meilleur diagnostic.
L’un des autres aspects financiers est le coût global qu’amène le scanner spectral. En effet, avec l’exemple de l’IQon Spectral CT de Philips, réaliser un scanner spectral génère 10 000€ d’économies par an dans les flacons de contraste, puisque le patient reçoit moins de produit de contraste [40].
Les bénéfices du scanner spectral pour la suite seraient potentiellement supérieurs à 55 000 à 100 000 dollars par an selon les études [41]. Ceci s’explique par l’utilisation du scanner spectral pour réduire le parcours patient et donc éviter des examens supplémentaires et coûteux (voir moins d’hospitalisation). Un équilibre financier sera alors recherché entre le prix initial et le coût global apporté par le scanner spectral.
De ce fait, l’intérêt des GHT et établissements de santé se portera principalement sur le coût global qui aura un impact plus important sur le long terme.
Conclusion
Le scanner spectral est une technologie innovante et qui ne cesse d’évoluer. Au début basée sur l’imagerie à double énergie, où l’innovation se basait sur le tube à rayons X par l’émission de deux faisceaux d’énergies différentes ; et plus récemment sur le détecteur, par la séparation des énergies.
Le scanner spectral comporte bon nombre d’avantages pour les professionnels de santé comme pour le patient. Ses cartographies et fonctions multiparamétriques sont un vrai atout pour la recherche de pathologies parfois complexes.
En fonction du type de pathologies, le scanner spectral peut être préconisé ou pas, selon ce que le médecin recherche. Il peut également être combiné à d’autres types d’imagerie comme l’IRM ou le scanner conventionnel (exemple de l’oncologie). Utilisé seul, il permet un gain en termes de coûts mais aussi en termes de temps, à la fois pour le patient et pour l’hôpital.
Par ailleurs, les différents types de scanners à double énergie ne sont pas toujours employés de la même manière en fonction des GHT. En revanche, les GHT ont tous fait le choix de cette technique pour une la même application : l’oncologie, pour la recherche de métastases et de lésions. De plus, leur principale motivation quant au choix de ces technologies est la réduction de la dose pour le patient.
Concernant les GIE, celui d’Imagerie Médicale d’Alençon (IMA) possède l’IQon Spectral CT de Philips version premium depuis décembre 2018. Cette acquisition a été possible grâce à leur partenariat avec le Centre Hospitalier Intercommunal Alençon-Mamers. Avoir cette technologie au sein de l’IMA leur a permis de suppléer le scanner conventionnel de l’hôpital en cas de panne ou de maintenance, diminuant ainsi les délais d’attente[42].
Le scanner spectral est donc une technologie prometteuse ne cessant d’innover, notamment avec le premier scanner spectral photon-counting sorti en novembre 2021 par la société Siemens, permettant de discriminer les photons et d’assurer une décomposition spectrale parfaite [11].