IDS125 - Aide à la Compréhension Du Processus D'Accès Au Remboursement Des Dispositifs Médicaux
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs



Contacts
- Yousra BOUTAROUAIT : yousra.b.21@hotmail.fr
- Yamina RIDA : mina.rida54@gmail.com
- Pricilla FUTU VIMPI NAZOMBO pricillavimpi@hotmail.fr
Citation
A rappeler pour tout usage : Yousra BOUTAROUAIT, Yamina RIDA, Pricilla FUTU VIMPI NAZOMBO, « Aide à la Compréhension Du Processus D'Accès au Remboursement Des Dispositifs Médicaux », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Projet, https://travaux.master.utc.fr/, réf n° IDS125, https://doi.org/10.34746/myjd-ap40 , janvier 2022, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids125
Article publié
Suite à ces travaux, un article a été publié : ID interne : 2022_06_idsap
Résumé
Pour lutter “contre” la Maladie, le système de Santé français peut s’appuyer sur un financement précieux, celui des cotisations et contributions sociales ainsi que les impôts collectés par l’Etat. Ce financement, principale ressource du remboursement couvert par la Sécurité Sociale, permet d’améliorer l’accessibilité et la qualité des soins que perçoivent les patients et de leur faire débourser une somme moindre.
Toutefois, tous les DM ne bénéficient pas de cette prise en charge. Pour qu’un DM soit remboursé, il est nécessaire que son inscription sur la Liste Produits & Prestations Remboursés (LPPR) ait été validée par le ministère de la Santé et des Solidarités. Pour que sa décision soit la plus juste possible, il est assisté par plusieurs instances qui s'occupent d’évaluer les demandes de remboursement que déposent les fabricants.
Ce mémoire étudie dans cette optique les démarches à effectuer par un fabricant qui chercherait ce remboursement, notamment en expliquant ses différentes phases ainsi que les éléments permettant son obtention.
De cette étude, un guide interactif d’aide à la compréhension du processus d’accès au remboursement des dispositifs médicaux a été créé. Celui-ci contient les données synthétisées présentes dans ce mémoire et deux logigrammes interactifs récapitulant le processus global de remboursement d'un dispositif médical.
Abstract
In order to fight "against" disease, the French health system can rely on valuable funding from social security contributions and taxes collected by the State. This funding, the main resource for reimbursement covered by Social Security, makes it possible to improve the accessibility and quality of care received by patients and to have them pay less.
However, not all medical devices are covered by this system. In order for a medical device to be reimbursed, its inclusion on the List of Reimbursed Products and Services must be approved by the Ministry of Health.
To ensure that its decision is as fair as possible, it is assisted by several bodies that assess the reimbursement applications submitted by manufacturers.
In this context, this paper examines the process to be undertaken by a manufacturer seeking reimbursement, notably by explaining the various phases of the process and the criteria for achieving this reimbursement.
From this study, an interactive guide to understand the reimbursement process of a medical device has been created. This one contains the synthesized data presented in this report and two interactive flowcharts that summarize the overall reimbursement process for a medical device.
Téléchargements

Mémoire
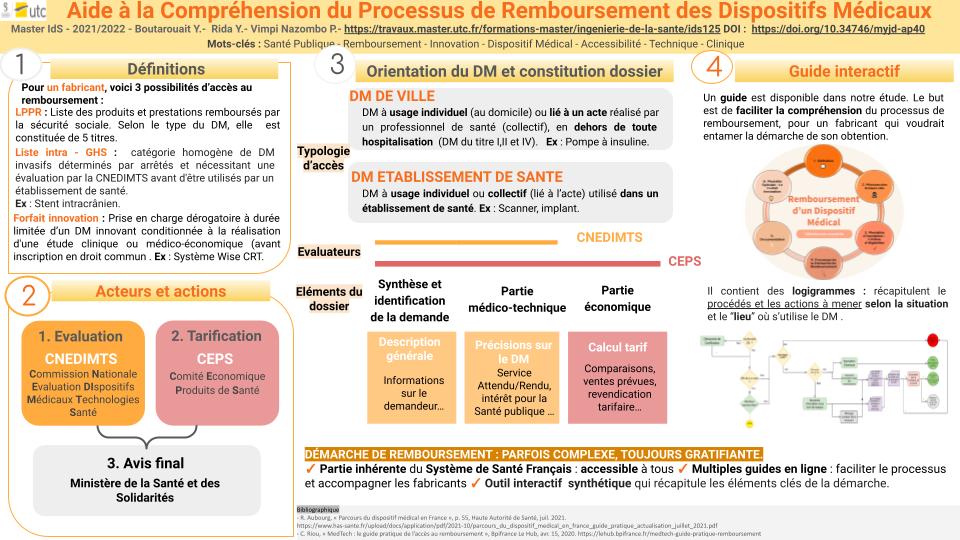
Poster

PDF Interactif
Mémoire complet
Aide à la compréhension du processus d'accès au remboursement des dispositifs médicaux
Remerciements
Tout d'abord, nous tenons à exprimer nos sincères remerciements envers l’entreprise, sans qui ce projet n’aurait pas vu le jour : en particulier, le Directeur Général et la Chargée des Affaires Réglementaires et Assurance Qualité, qui nous ont accordé de leur temps et leur confiance. Leurs conseils avisés ainsi que leur investissement nous ont procuré motivation et envie de mener à bien cette étude dont le thème était nouveau et très intéressant pour nous.
Nos plus vifs remerciements également à M. Jean-Matthieu Prot, responsable du Master Ingénierie de la Santé, à l'Université de Technologie de Compiègne, qui nous a soutenu et conseillé tout au long du semestre sur ce sujet.
De même, Mme Isabelle Claude, responsable du Master Ingénierie de la Santé, et M. Gilbert Farges, enseignant-chercheur du Master Ingénierie de la Santé, pour leurs analyses avisées.
Nous remercions également toute l’équipe pédagogique de l’UTC, ayant participé de près ou de loin à notre projet.
Pour finir, nous remercions notre entourage, nous ayant accompagné et supporté moralement tout le long de nos études.
Liste des acronymes
- ANSM : Agence Nationale de la Sécurité du Médicaments et des dispositifs médicaux
- AP-HP : Assistance Publique - Hôpitaux de Paris
- ASA : Amélioration du Service Attendu
- CEESP : Commission Evaluation Economique et de Santé Publique
- CEPS : Comité Economique des Produits de Santé
- CHU : Centre Hospitalier Universitaire
- CNAM : Caisse Nationale de l’Assurance Maladie
- CNEDIMTS : Commission Nationale d'Evaluation des Dispositifs Médicaux et des Technologies de Santé
- DM : Dispositif Médical
- DMI : Dispositif Médical Implantable
- EUDAMED : European Database on Medical Devices
- GMED : Groupement pour l’Evaluation des Dispositifs Médicaux
- HAS : Haute Autorité de Santé
- IUD : Identification Unique d’un Dispositif
- LNE : Laboratoire National de Métrologie et d’Essai
- LPPR : Liste des Produits et Prestations Remboursés
- ON : Organisme Notifié
- SA : Service Attendu
- SED : Service d’Evaluation des Dispositifs
- SR : Service Rendu
- SNITEM : Syndicat National de L'Industrie des Technologies Médicales
- URSSAF : Union de recouvrement des cotisations de sécurité sociale et d'allocations familiales
Glossaire
- Audit : Analyse menée par un ou plusieurs experts, avec un œil impartial sur un aspect précis de l'entreprise.
- Dispositif Médical : “Tout instrument, appareil, équipement, logiciel, implant, réactif, matière ou autre article, destiné par le fabricant à être utilisé, seul ou en association, chez l'homme pour l'une ou plusieurs des fins médicales” et mentionné dans le RDM 2017-745.
- Documentation technique : Élément majeur faisant preuve de la conformité des dispositifs médicaux aux exigences et de justifier ainsi le marquage CE.
- EUDAMED : Base de données européenne des dispositifs médicaux.
- Évaluation clinique : Données cliniques après utilisation réelle du dispositif ou d'un équivalent du DM devant prouver le respect des exigences générales du règlement.
- Fabricant : Une personne physique ou morale qui fabrique ou remet à neuf un dispositif ou fait concevoir, fabriquer ou remettre à neuf un dispositif, et commercialise ce dispositif sous son nom ou sous sa marque.
- GMED : Organisme Notifié français.
- Investigation clinique : Toute investigation systématique impliquant un ou plusieurs participants humains destinée à évaluer la sécurité ou les performances d'un dispositif.
- Marquage CE : Marquage réglementaire et obligatoire pour la mise sur le marché d’un dispositif médical en Europe.
- Métrologie : Science de la mesure.
- Organisme Notifié : Organisme désigné par chaque État membre de l’union européenne. Il est responsable de l’évaluation de la conformité du dispositif médical et de la délivrance du marquage CE.
- Produit innovant : Produit nouveau et sans exemplaire sur le marché.
- Règlement européen des Dispositifs Médicaux 2017/745 : Règlement du parlement européen et du conseil, relatif aux dispositifs médicaux et entré en vigueur le 26 mai 2021.
- Service Attendu : Service clinique répondant aux besoins des professionnels de santé et des patients. Il se mesure à l’amélioration clinique de l’état du patient.
- SNITEM : Organisation professionnelle française représentant l'industrie du secteur des dispositifs médicaux.
- Système de Management de la Qualité : Activités établies dans un organisme, qui permettent de définir, mettre en œuvre et revoir la politique stratégique et les objectifs qualité.
Introduction
« La fraternité n’est qu’une idée humaine, la solidarité est une idée universelle », Victor Hugo, (Proses philosophiques, L’âme ,1860-1865)
Pour lutter contre l’un des plus grands risques chez l’Homme, « la Maladie », la France s’est dotée, à l'instar de nombreux pays, d’un système de santé. Officiellement créé en 1945, il est défini par l’Organisation Mondiale de la Santé (OMS), comme "l’ensemble des organisations, des institutions et des ressources dont le but est d’améliorer la santé (…). Les systèmes de santé remplissent principalement quatre fonctions essentielles : la prestation de services, la création de ressources, le financement et la gestion administrative" [1].
Basé sur la solidarité, son financement provient de deux sources principales : les cotisations et les contributions sociales, collectées par l'Union de Recouvrement des Cotisations de Sécurité Sociale et d'Allocations Familiales (URSSAF), représentent plus de 90 % des ressources de la Sécurité sociale et une partie des impôts collectés par l’Etat (environ 9%) [2].
L’un des principaux objectifs de ce financement est d’améliorer l’accessibilité et la qualité des soins des adhérents. Dans ce cadre, le remboursement des soins a un rôle majeur.
La Liste des Produits et Prestations Remboursable (LPPR), utilisée pour classer les dispositifs médicaux (DM) remboursables par l'Assurance Maladie, couvre désormais environ 2 millions de produits (chiffre de juin 2021) allant du simple pansement, aux lits médicalisés, en passant par les seringues, les lecteurs de glycémie, les défibrillateurs ou encore les équipements médicaux (Ameli)
Les dépenses de l’Assurance Maladie associés au remboursement de ses dispositifs médicaux et les prestations inscrits à la LPPR sont de fait en constante évolution : d’une valeur de 8,41 Milliards d’euros en 2016, les dépenses ont constamment augmenté jusqu’à atteindre 9,49 Milliards d’euros en 2019 [3].
Associé à l’évolution du chiffre d’affaires du secteur des DM (DM en général, dentaires, optiques, DM in vitro …), étant passé de 23 milliards d’euros en 2013 (selon l’Inspection Générale des Affaires Sociales), à 30 milliards d'euros en 2019 (SNITEM), ces indicateurs chiffrés permettent de mettre en évidence l’impact que les DM ont dans le secteur de la Santé et des soins.
Dans l'optique où, de plus en plus de fabricants demandent la prise en charge de leurs DM par l’Assurance Maladie, de 129 nouveaux DM sur 276 évalués en 2019 à une évolution en 2017 de 171 nouveaux DM sur 276 évalués [4], il est intéressant de définir ce qu’est un remboursement, ses enjeux pour les différents acteurs et les démarches à effectuer par les fabricants pour l’obtenir.
Partie I - Procédure de remboursement en France
1. Préambule : Un accès au remboursement conditionné par une réglementation rigoureuse
Commercialiser un produit n’est pas une tâche aisée. En parallèle avec les étapes à réaliser pour avoir accès au marché européen (marquage CE), les fabricants doivent également se pencher sur la question de son remboursement par l’Assurance Maladie. Dans le cadre d’une commercialisation en France, cela permet l’obtention d’une diffusion optimale du produit au sein du territoire (notamment via des recommandations par les praticiens (pharmaciens, médecins…)).
Dans la mesure où la commercialisation du produit n’implique pas une prise en charge systématique, pour être pris en charge par la collectivité, les « données relatives au bénéfice clinique et à la place dans la stratégie thérapeutique » attendues, auront un impact crucial.
Dans cette optique, la HAS préconise de commencer cette démarche de remboursement le plus tôt possible, idéalement dès la phase de développement, en prenant notamment en compte les attentes des évaluateurs afin d’économiser du temps et des ressources.
Il ne faut cependant pas oublier que chaque étape est indispensable et les demandeurs, aussi bien fabricants que industriels, ne doivent en délaisser aucune. Par ailleurs, au vu des données requises par la HAS, cette démarche ne doit pas être trop précoce pour ne pas entraver les chances du produit d’y avoir accès.
Cadre réglementaire
L’accès sur le marché des DM est conditionné par le respect du Règlement Européen 2017/745, entré en vigueur en mai 2021 en remplacement notamment de la directive 93/42/CEE [5].
L’intérêt qu’apporte les normes sont [6] :
- De définir de façon plus précise ce qu’est et ce qu’on considère être un DM « Tout instrument, appareil, équipement, logiciel, implant, réactif, matière ou autre article, destiné par le fabricant à être utilisé, seul ou en association, chez l’Homme pour l’une ou plusieurs des fins médicales précises suivantes (…) et dont l’action principale voulue dans ou sur le corps humain n’est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de tels moyens » (ANSM)
- De définir les exigences essentielles que les DM doivent respecter pour être commercialisés sur le marché, en termes de sécurité et de performances, ainsi que les procédures à mettre en place pour les respecter.
La prise en charge ou non dans le cadre d’une demande de remboursement est conditionnée par la commission d’évaluation unique à chaque État membre.
En France, la CNEDiMTS (Commission Nationale d’Evaluation des Dispositifs Médicaux et des Technologies de Santé) est la commission de la HAS qui évalue notamment les DM à usage individuel et les prestations associées en vue d’un remboursement.
Son fonctionnement et ses missions sont soumis au respect du règlement intérieur de la HAS et de décrets tels que décrits dans les conditions de prise en charge, Articles L165-1 à L165-13 , du CSS (code de sécurité sociale) (Légifrance) [7].
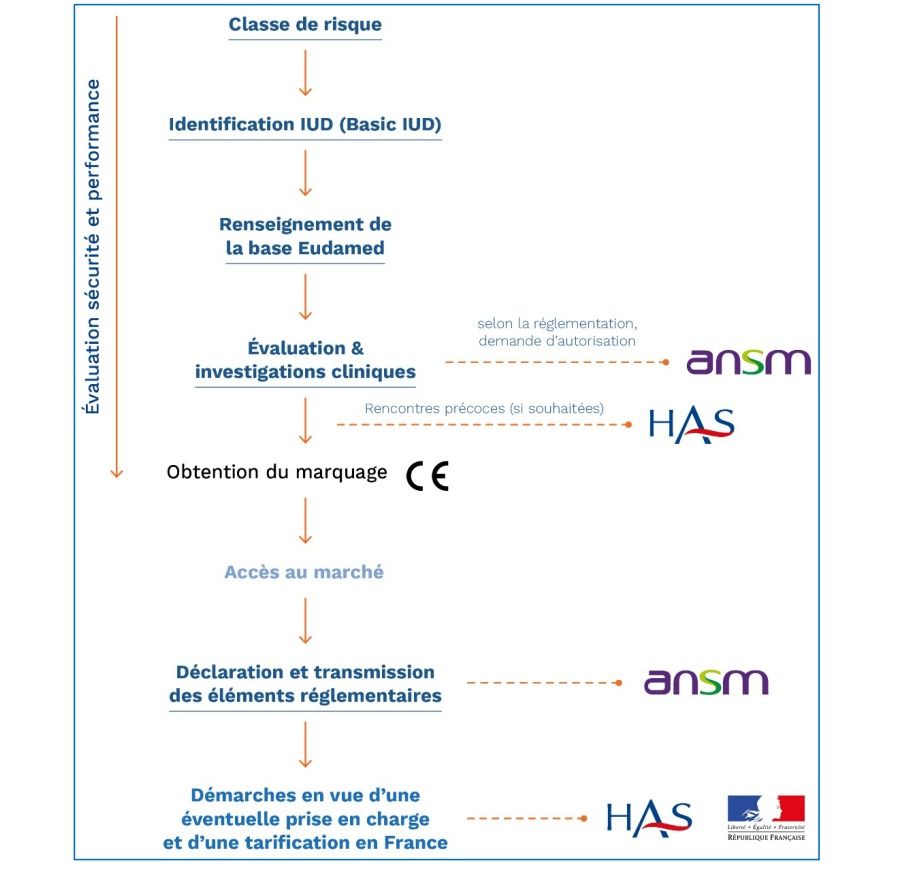
Accès au marché [8]:
Afin d’accéder au marché, un DM se doit d’être conforme à des exigences concernant la sécurité et la performance lors de son utilisation. Pour vérifier cette conformité, une évaluation est réalisée par des ON ( Organismes Notifiés ). En effet, la majeure partie des DM étant classé risque II ou supérieur sur l’échelle de risque apportée par le nouveau règlement (2017/745), les fabricants ont l'obligation de se faire auditer par un organisme extérieur. L’évaluation se base sur plusieurs critères tels que la destination ou encore la classe de risque et intègre un audit du SMQ (système de management de la qualité), un contrôle de la documentation technique ou encore une évaluation des essais cliniques dans le cadre où une procédure de remboursement a été entamée.
Dans le cadre où l’audit serait validé, le marquage CE, attestant la conformité du DM, est apposé sous la responsabilité du fabricant. Puis le DM est enregistré sur la base de EUDAMED (European Database on Medical Devices) permettant sa surveillance après sa mise sur le marché et le fabricant peut ensuite le commercialiser sur le marché européen. Ci-dessous (figure 1), le schéma simplifié et récapitulatif des étapes cités précédemment pour accéder au marché des DM, disponible dans le guide des pratiques des DM de la HAS publié en 2017 (version 4 - 2020).
Figure 1 : Accès sur le marché : évaluation pour un DM [18], (source : Guide pratique 2020 Remboursement HAS)
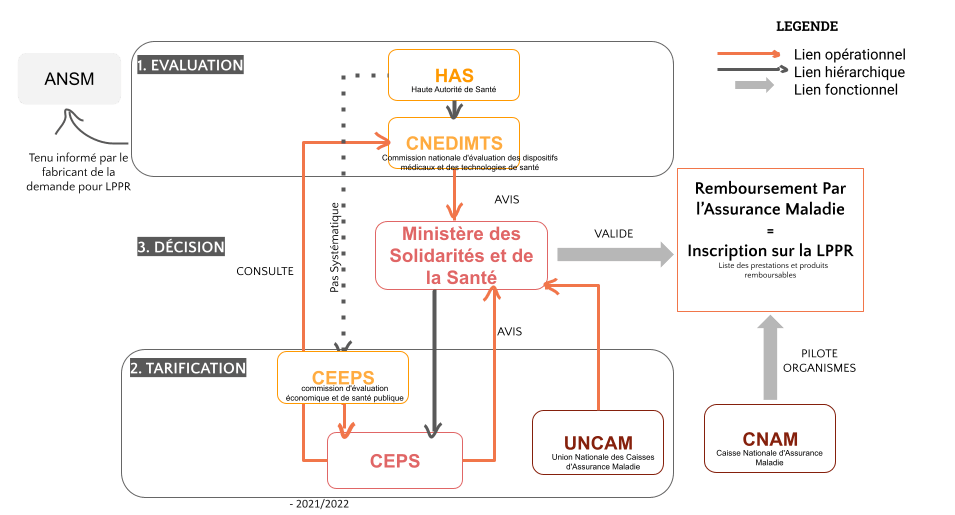
2. Présentation et définition des organismes de prise en charge des remboursements
Plusieurs organismes ont un impact sur la prise en charge et le remboursement des DM.
Dans cette partie, seront présentées les fonctions principales des organismes majeurs (sur une échelle nationale) ainsi que leurs liens fonctionnels et hiérarchiques dans le cadre d'un remboursement via la LPPR (figure 2) :
ANSM → “L’Agence nationale de sécurité du médicament et des produits de santé est l’acteur public qui permet, au nom de l’État, l’accès aux produits de santé en France et qui assure leur sécurité tout au long de leur cycle de vie”. Acteur majeur du système de santé, ses missions visent à satisfaire les besoins des patients et garantir leur sécurité.
L’une de ses missions principales est de permettre l’accès à des produits innovants, notamment grâce à ses procédures d’autorisation adaptées à chaque stade de la vie des produits (DM et médicament) avant et après leur mise sur le marché.
Il s'assure également que les produits de santé disponibles sur le marché français soient “sûrs, efficaces, accessibles et bien utilisés” [9].
Ministère de la Santé et des Solidarités [10] → Il vise à organiser les plans de préventions et soins, les axes dans la recherche et l’innovation en Santé.
Ses missions touchent un large domaine tels que celui des familles, retraités, ou encore de l'enfance.
Dans ce cadre, ses compétences incluent :
- D’établir des règles concernants les régimes et de gérer les organismes de Sécurité Sociale et les organismes complémentaires
- De préparer et de suivre l’exécution de la Loi de Financement de la Sécurité Sociale (PLFSS)
- D’élaborer des programmes luttant contre la pauvreté et l’exclusion sociale
- D’établir une politique de développement d’économie sociale et solidaire
Il intègre dans son organisation la DGCS (Direction Générale de la Cohésion Sociale) ayant pour missions de “ concevoir, piloter et évaluer les politiques publiques de solidarité, de développement social et de promotion de l’égalité, afin de favoriser la cohésion sociale et le soutien à l’autonomie des personnes ” et d’assurer "la préparation et le suivi de l’objectif national des dépenses d’assurance maladie (ONDAM) pour le secteur médico-social” (source : gouvernement.fr) et la DSS ( direction de la sécurité sociale) dédiée à la prévention des risques.
HAS → La Haute Autorité de Santé évalue l’efficience et l’impact budgétaire que peuvent avoir les produits et technologies de santé “innovants” et pouvant avoir un impact majeur sur les dépenses de l’Assurance maladie. Son rôle est donc d'évaluer les médicaments, DM et actes professionnels en vue de leur remboursement
CNEDIMTS → Commission spécialisée de la HAS, sa visée première est de formuler des recommandations et de rendre des avis concernant entre autres les demandes de remboursement des DM à usage individuel et les prestations associées (d'hospitalisation). Elle examine également le bon usage des DM et des technologies de santé.
Par ailleurs en apportant une clarification, aux pouvoirs publics, sur les décisions vis à vis du remboursement elle contribue à améliorer “ la qualité des pratiques professionnels et des soins (apportés) aux patients” [11].
CEESP → Service intégré à la HAS, le rôle de la commission d’évaluation économique et de santé publique, est de rendre un avis économique “sur le fondement de l’analyse critique que réalisent les services concernés” ,dont le service d'évaluation des dispositifs (SED), à partir du dossier ayant été déposé par le fabricant. En plus de cet avis d’efficience, elle fait également des recommandations de santé publique et évalue des stratégies. Crucial, cet avis permet de s’assurer que les pouvoirs publics prennent en compte la mesure d’intérêt, qu’apporte une stratégie de soins ou d’un produit de santé, à la société ( has-sante) [12]. La CEESP n'intervient pas systématiquement.
Elle fait suite à deux revendications de l’industriel :
- ASMR de niveau I,II ou III
- Produit susceptible d'avoir un impact majeur sur les dépenses d’assurance maladie, avec un chiffre d’affaires supérieur ou égal à 20 millions d’euros, ou sur “l’organisation des soins, les pratiques professionnelles ou les conditions de prise en charge des malades” [13].
CEPS → Placé sous l’autorité conjointe des ministres de la Santé, de l'Économie et de la Sécurité sociale, le Comité Economique des Produits de Santé à pour rôle premier de fixer la tarification des DM à usage individuel et les prestations associées [14]. En cas de revendication, la CEEPS lui transmet l’avis économique qu'elle a validé, avis dont il prendra compte pour négocier le tarif du DM.
Les tarifs sont fixés préférentiellement avec les entreprises commercialisant les produits mais peuvent également être fait avec leurs représentants.
Le CEPS contribue également, par ses propositions, à la définition de la politique économique des produits de santé.
CNAM → La Caisse Nationale d’Assurance Maladie, communément appelée Assurance Maladie, a un rôle stratégique au niveau national. C’est un établissement public administratif qui agit dans la prévention des maladies et dans la coordination de ses différentes branches [15]. Elle agit dans l’intérêt général d’accès aux soins et participe à l’amélioration du système.
Une liste est retrouvée au sein de cet organisme : la Liste des Produits et Prestations Remboursables (LPPR). Elle est consultable par tous et permet de retrouver des DM pour traiter des pathologies, pour l’aide à la vie ou encore des Dispositifs Médicaux Implantables (DMI). Cette liste contient également les dates de fin de prise en charge [16] .
UNCAM → Créée en 2004, l’Union nationale des caisses d’assurance maladie, regroupe les trois principaux régimes d’assurance maladie : le régime général, la Mutualité sociale agricole (MSA) et le régime social des indépendants (RSI).
Elle a pour missions principales de définir les prestations admissibles au remboursement et le taux de prise en charge associé.
Comme la CEPS, elle fournit également des propositions au gouvernement et au parlement [17].
Figure 2 : Principaux acteurs du Remboursement Français à l’échelle nationale - Description des étapes principales du traitement de la demande d’accès au remboursement d’un DM sous la LPPR (source : auteurs)
3. Critère d’évaluation du remboursement
Pouvoir rembourser son dispositif médical pour un fabricant est l’opportunité de propager sur le territoire sa technologie. Des parcours sont à prendre en compte pour pouvoir assurer le bon déroulé de ce remboursement. Des parcours sont à prendre en compte pour pouvoir assurer le bon déroulé de ce remboursement. En effet, selon où il sera utilisé, la démarche à effectuer pour obtenir le "remboursement" du dispositif ne sera pas la même.
Figure 3 : Type de Prise en charge [18].
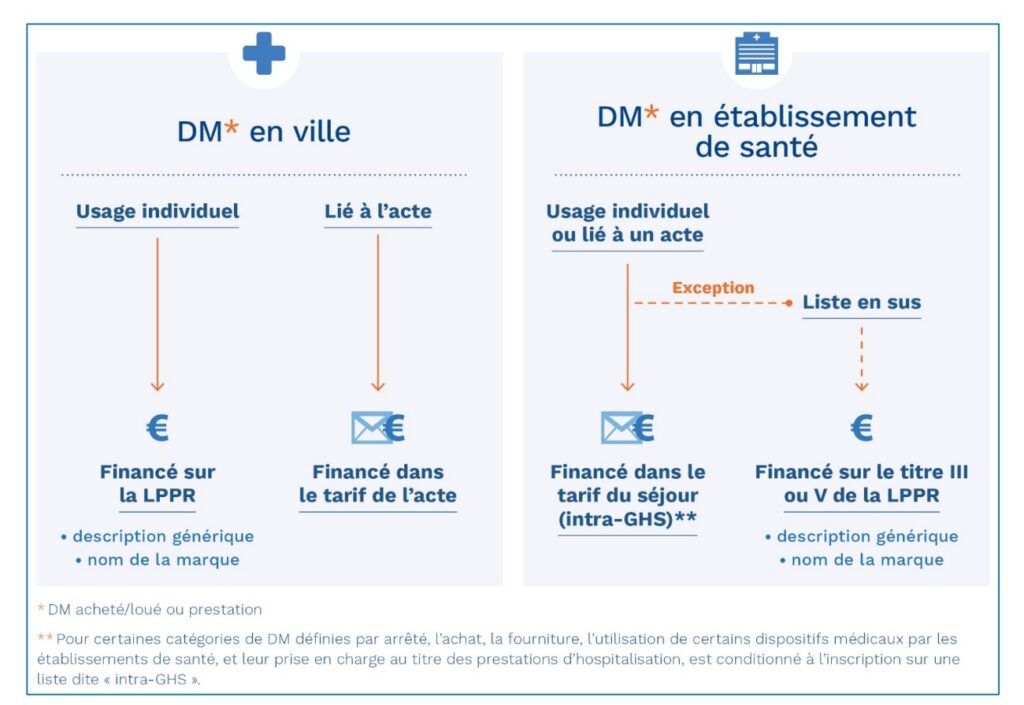
La principale différence entre les “DM en ville” et les “DM en établissement de santé” est que les premiers sont généralement utilisés par les patients à leur domicile, là où les second impliquent une hospitalisation.
Les pansements, bandes de contention et lecteurs de glycémie sont quelques exemples de DM en ville que prend en charge l’assurance maladie.
Les stimulateurs cardiaques et les implants cochléaires sont quelques exemples de DM qu’on peut retrouvés en établissement de santé.
Il est important de noter que si le remboursement des DM en ville se fait au patient, celui des DM en établissement de santé se fait aux établissements même. Dans ce cadre, il est plus communément employé le terme de financement.
A titre d’information la grande majorité des DM individuels utilisés dans les établissements de santé ont leur prise en charge assurée par le GHS (groupe homogène de séjours) de l’hôpital même, à raison d’une prise en charge forfaitaire qui couvre, jusqu’à un certain montant, “une partie des frais occasionnés par la mise à disposition de l'ensemble des moyens nécessaires à l'hospitalisation du patient” [19]. Dans la mesure où le fabricant n’est pas impliqué dans cette démarche, ce travail ne traitera pas ce sujet. Seule la liste intra-ghs qui concerne certains DM utilisés en établissement de santé et la liste en sus, seront abordés de façon brève.
En ville l’inscription nécessite de faire, dans un premier temps, une demande d’inscription sur la LPPR (Liste des Produits et Prestations Remboursés), retrouvée au sein de l'Assurance Maladie. L’entrée dans cette liste permet en outre le financement des DM à usage individuel (communément appelé DM en ville) et, moins fréquemment, de certains DM présents dans les établissements de soins. Cette différence est à bien prendre en compte car les modalités changent selon l’utilisation de ce DM (figure 3). En effet l’usage du DM seul et l’usage du DM lié à l’acte selon les conditions où il est exploité n’entraîne par la même prise en charge.
Terminologie :
DM à Usage Individuel : Dispositifs "personnel" dont le remboursement (suite inscription à la LPPR) se fait par l’assurance maladie ou via le GHS (contexte d'hospitalisation). Pour quelques DM d’établissement de santé qui appartiennent à cette catégorie , le "financement" des DM ne peut s’effectuer qu'à condition qu'ils appartiennent à la liste intra-GHS. La liste de ces DM (dispositifs stériles notamment) est établie, dans le domaine public, par les commissions médicales d’établissement (CME) des établissements publics de santé.
DM à Usage Collectif : Dispositif réutilisable dont le coût de financement est compris dans l’acte professionnel réalisé (en ville et à l’hôpital).
DM lié à l’acte : Ces DM sont soit intégrés à celui d’un acte médical (DM en ville) et inscrits dans la CCAM (classification commune des actes médicaux) soit “financés” par le séjour hospitalier (DM en établissement de santé), pour les patients hospitalisés, au quel cas le financement est basé selon le principe de tarification à l’activité.
GHS : Le GHS est une tarification du GHM (groupe homogène de malade) prenant compte, pour chaque patient, “la pathologie traitée, le mode de prise en charge, les soins prodigués” [20] . Celle-ci est déterminée chaque année par le ministère de la santé.
LPPR : Liste des prestations et produits remboursables, qui précise les caractéristiques du DM et éventuellement la prestation nécessaire à sa bonne utilisation. Elle est décomposé en plusieurs parties significatives :
- Titre I : DM pour traitements à domicile, aides à la vie, aliments et pansements ;
- Titre II : Orthèses et prothèses ;
- Titre III : Dispositifs médicaux implantables, implants et greffons tissulaires d’origine humaine ;
- Titre IV : Véhicules pour handicapés physiques ;
- Titre V : Dispositifs médicaux invasifs non éligibles au titre III de la LPPR.
Liste en Sus : Plus rare , les DM de cette liste sont financés, à part de celle des autres DM utilisés dans les établissements de santé : en sus des prestations d’hospitalisation (hors GHS). C'est-à-dire en suppléments comparés aux tarifs standards accordés. Cette liste concerne les DM onéreux jugés innovants et dont les apports bénéfiques sont majeurs (ministère de la santé).
L’inscription à cette liste nécessite que le dispositif soit également inscrit à la LPPR (Titre III ou V). Un fabricant qui y est déjà inscrit n’a aucune démarche supplémentaire à effectuer : les établissements de santé décident ou non d’utiliser le dispositif et donc de son inscription sur cette liste.
Liste Intra-GHS : Pour certains DM des établissements de santé, le financement par les tarifs des prestations d’hospitalisation (achat et utilisation compris dans les prestations hospitalières), est conditionné par une inscription sur la liste intra-ghs. Une catégorie homogène de produits pour laquelle ce type d’évaluation est requis (définie par arrêté) définit les DM concernés.
Celle-ci décrit les catégories homogène de DM invasifs déterminés par arrêtés et nécessitant une évaluation par la CNEDIMTS avant d'être utilisés par un établissement de santé. Il existe 5 catégorie selon le type de DM (source : solidarites-sante.gouv) :
- DM implantables destinés au traitement par voie vaginale du prolapsus des organes pelviens ;
- DM implantables destinés au traitement par voie vaginale de l’incontinence urinaire ;
- DM destinés au traitement par voie haute du prolapsus des organes pelviens ;
- Stents intracrâniens pour diversion de flux (flow diverter) ;
- Dispositifs de thrombectomie ( + stents retrievers, systèmes de thrombo-aspiration & cathéters guide à ballonnets spécifiques à la thrombectomie)
Cette liste est mise à jour à jour dès lors qu’un DM subit des modifications, qu’un nouveau DM y est inscrit, ou radié.
L’inscription des DM concernés s’effectuera sous la ligne générique, ou sous de nom de marque en absence de celle-ci, selon les modalités déterminées pour chaque catégorie. La HAS a publié en janvier 2022 un guide d’aide pour le dépôt de ce dossier.
4. Inscription sur la LPPR
A. Demande de Remboursement
La demande de remboursement s’effectue de manière dématérialisée avec un dossier en ligne. Le fabricant fait sa demande d’inscription sur la LPPR soit avec une description générique de son produit soit sous nom de marque. En parallèle, une déclaration auprès de l’ANSM doit être faite avec le code d’inscription LPPR, pour notifier cette volonté de remboursement. Toute demande est entreprise par le fabricant ou par le distributeur, l’industriel ne reçoit les codes que lorsque celle-ci a été accordée.
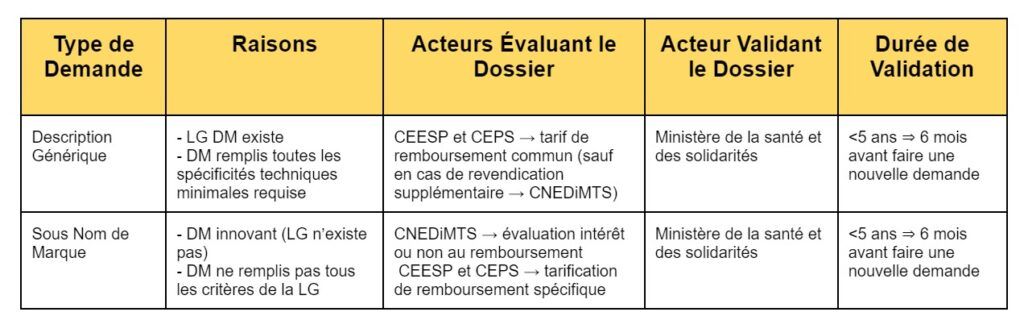
- La description générique :
Cette description associe, à un type de produit, des spécifications techniques et des indications minimales précises que tout DM, pour bénéficier d’une inscription sous cette dénomination, doit respecter. Il est de la responsabilité de l'industriel d’estimer si son DM répond ou nom aux spécifications minimum requises.
S’il l'estime il peut, en faisant sa demande, exprimer son souhait d’avoir un code individuel (identification du produit sur la LPPR). Ici la CEPS, qui donne son avis, et le ministère de la santé sont les deux acteurs qui agissent.
L’inscription sous cette dénomination sous-entend que le DM est connu du marché (ex : prothèse de hanche). Dans ce cadre le CNEDIMTS évalue le DM qu’en cas de revendication : dossier complet envoyé à la CNEDiMTS et dans certains cas à la CEESP (cf partie I.2 : Présentation et définition des organismes de prise en charge des remboursement).
- Inscription sous nom de marque (commercial) :
Réservé au cas où la description générique n’est pas possible, pour les produits tel que ceux ayant un caractère innovant et unique (impact possible des dépenses de l’Assurance Maladie), ainsi que les produits ne respectant pas toutes les spécifications techniques minimales requises .
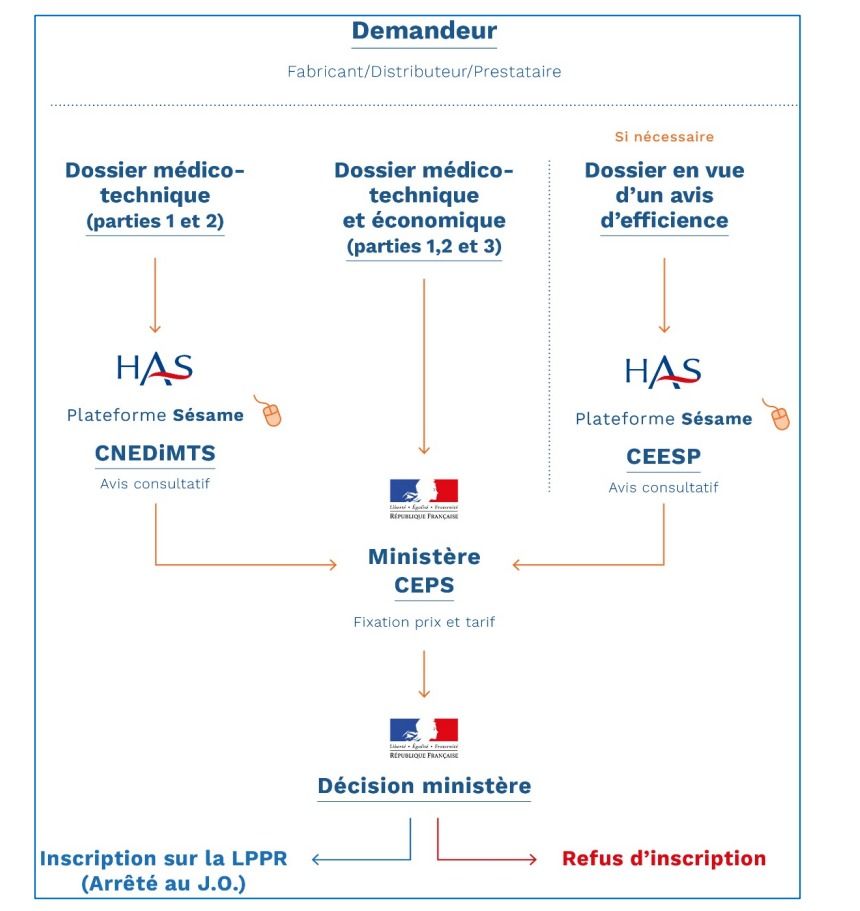
Un dépôt de dossier dématérialisé de demande de remboursement doit se faire auprès du Ministère des Solidarités et de la Santé (https ://medimeddm.sante.gouv.fr/). En parallèle, le demandeur envoie une copie électronique à la CNEDIMTS, qui évaluera la documentation clinique et technique, sur la plateforme SESAME (https ://sesame.has-sante.fr/portail/) et à la CEPS (ou CEEPS) qui évaluera, en cas d’avis positif de ce dernier, la tarification du DM (figure 4).
Figure 4 : Présentation des demandes de remboursement classique (source : auteurs)
A l’heure actuelle (2022), la CNEDIMTS peut changer ce statut d’inscription sous nom de marque/commercial par une inscription avec une description générique.
Cette inscription définitive sur la LPPR (figure 5) est décidée par le ministre chargé de la Santé après consultation de l’avis de la CNEDIMTS et de l’avis du CEPS. Cette inscription est valable 5 ans : passé ce délai, le fabricant doit renouveler une demande avec une échéance de 6 mois avant la fin de prise en charge par la LPPR. Si toutefois, durant ces 5 ans une évolution ou une innovation sur le produit remboursé apparaît, le fabricant peut relancer une demande sans attendre le délai de 5 ans.
Figure 5 : Inscription d’un DM sur la LPPR (source : Guide pratique Remboursement HAS [18]).
Pour évaluer si une nouvelle technologie peut bénéficier d’une prise en charge (ou non) et être ainsi remboursable (partiellement souvent), l’évaluation de la CNEDIMTS va reposer sur l’analyse des données issues d’études cliniques.
Celles-ci doivent permettre de répondre aux éléments cités ci-dessous :
- « Une détermination qualitative et/ou quantitative du besoin médical auquel répond le DM avec une détermination de la stratégie actuelle et la place du DM dans cette stratégie ou les modifications de la stratégie susceptibles d’être induites par ce dernier » ;
- Le rapport bénéfice/risque : l’analyse des données cliniques issues des études cliniques permet d’identifier les « éventuelles limites à leur extrapolation à la population susceptible d’être traitée par ce DM en situation courante d’utilisation », soit les mésusages possiblement réalisé par la population dans le cadre d’une utilisation, contraire à l’intention première du fabricant ;
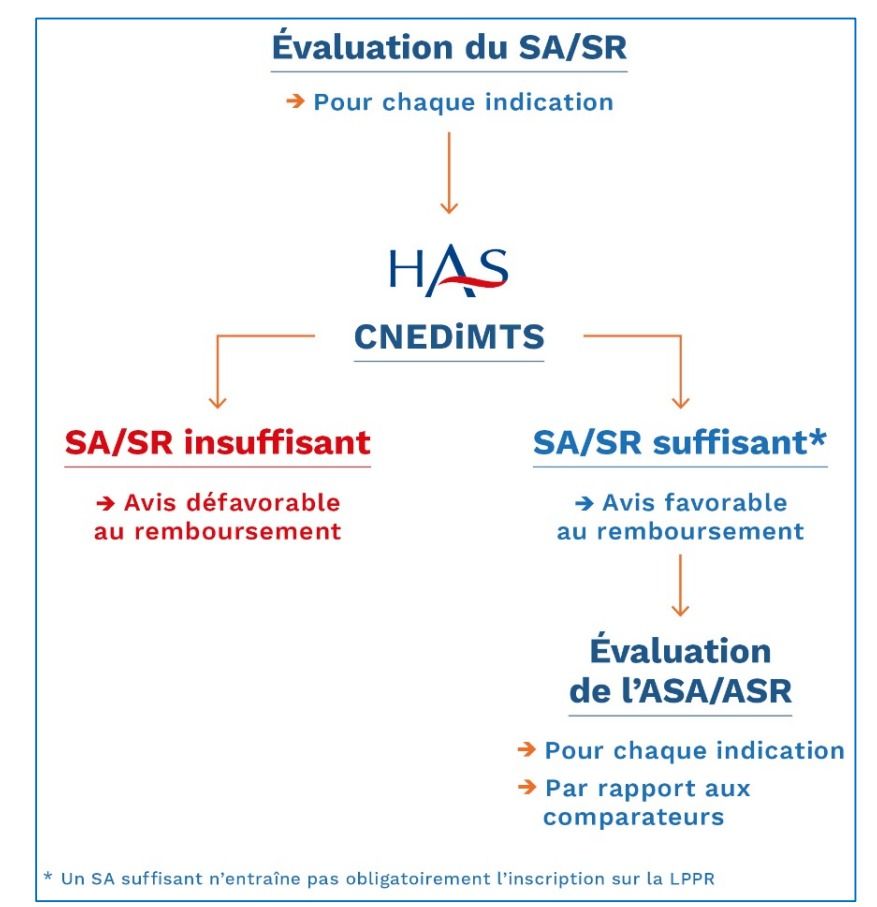
- De déterminer le Service Attendu (SA) qu’apporte le produit en cas de première inscription et le Service Rendu (SR) dans le cadre d’une réévaluation (figure 6);
- De faire une appréciation de l’Amélioration du Service Attendu (ASA) ou Rendue (ASR) par rapport à un comparateur, “ issu de la stratégie de référence, ou de la stratégie utilisée en pratique“, déterminant le niveau de référence de l’amélioration (absence, mineure, majeure, modérée ou importante). Celui-ci peut-être “un autre dispositif médical, inscrit ou non sur la LPPR, un produit, un médicament, une prestation, ou un acte admis ou non au remboursement” (solidarites-sante.gouv). Les 4 critères de comparaison choisi étant : l'efficacité et la sécurité apporter, le niveau de compensation d’un handicap, l’amélioration de la qualité de vie et la couverture d’un besoin non couvert jusque là.
Figure 6 : Schéma récapitulatif de l’évaluation du SA/SR et de l’ASA/ASR (Source : HAS-Santé [18] ).
Il est donc de la responsabilité du fabricant de fournir la documentation et les données issues des essais qui répondent à ces critères.
B. Dossier d'inscription : aspects et composition [20]
En amont d’un dépôt de dossier de demande de remboursement, le fabricant peut effectuer :
- Des rencontres précoces : questions qui concernent la méthodologie de l’étude clinique envisagée.
- Des rencontres pré-dépôt : pour la constitution ou la finalisation du dossier. Spécifiques aux DM, ce type de rencontres permet au fabricant d’avoir un accompagnement sur les aspects technico-réglementaires.
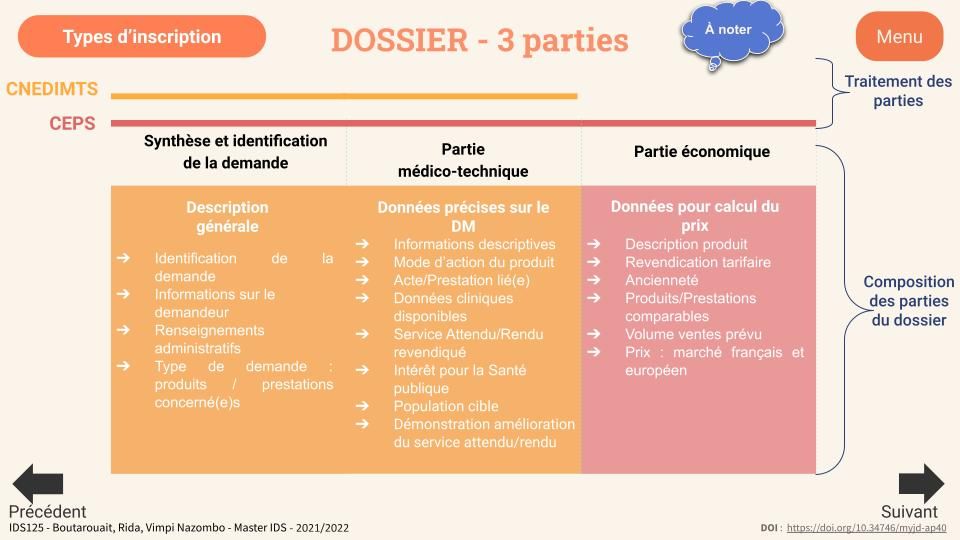
Composition du dossier :
Il contient plusieurs aspects pouvant être réparties en 3 parties générales :
1) Partie synthèse et identification de la demande
2) Dossier médico-technique
3) Dossier économique
Chacune des parties va être traitée par des acteurs réglementaires particuliers : la CNEDIMTS évalue la partie 1) et la partie 2), le CEPS les parties 1), 2) et 3). Si nécessaire, la CEESP peut également apporter un avis d’efficience pour le dossier (figure 7).
Où le déposer ?
- Pour le CEPS : l’intégralité du dossier est à déposer auprès de la plateforme MEDIMED du Ministère de la Santé et des Solidarités
- Pour la CNEDIMTS (et la CEESP) : à déposer via la plateforme SÉSAME de la HAS
A noter que le dossier à déposer sur les deux plateforme est identique : chaque organisme traite les différentes parties qui la concerne [13].
En parallèle, un code pour être inscrit sur la Liste des Produits et Prestations remboursés doit être demandé sur la plateforme : https://www.demarches-simplifiees.fr/commencer/codage-lpp
Figure 7 : Récapitulatif général du dossier de demande pour la CNEDIMTS (source : auteurs)
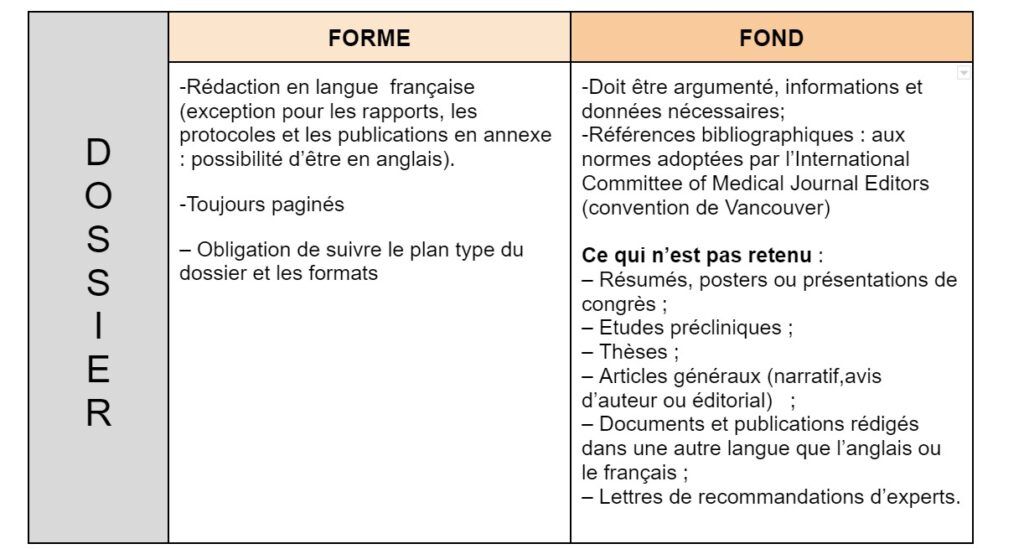
Modalités de dépôt (CNEDiMTS) (figure 8):
- La plateforme Sésame : le fabricant doit créer un formulaire qui lui permet la création d’un compte d’accès. Deux personnes maximum peuvent être désignées par l’entreprise pourront avoir accès et gérer le compte. Une fois le compte créé, des contributeurs (avec leurs propres identifiants et mot de passe). Ils auront ensuite la capacité d’accéder/de déposer/de suivre des dossiers au nom de l'entreprise.
- Besoin d’un numéro SIRET de l’entreprise ou du CNP. Également à joindre une attestation signée et tamponnée par son représentant légal pour les personnes mentionnées qui prouve la délégation afin d’être « gestionnaires de compte ».
- Consulter le statut d’un dossier sur la plateforme : temps réel son état d’avancement. A chaque changement de statut, une notification vous sera adressée par courriel (si activation de l’option)
- Le tarif ? Pour l’inscription, une taxe de 3 220 € est à payer par virement auprès de la Direction des Créances Spéciales du Trésor (DCST). Ce virement est à faire uniquement après transmission de l’accusé de réception fait par le service via la plateforme Sésame.
Composition du dossier CNEDIMTS :
Figure 8 : Présentation de la composition de chaque partie du dossier pour la CNEDIMTS (source : auteurs)
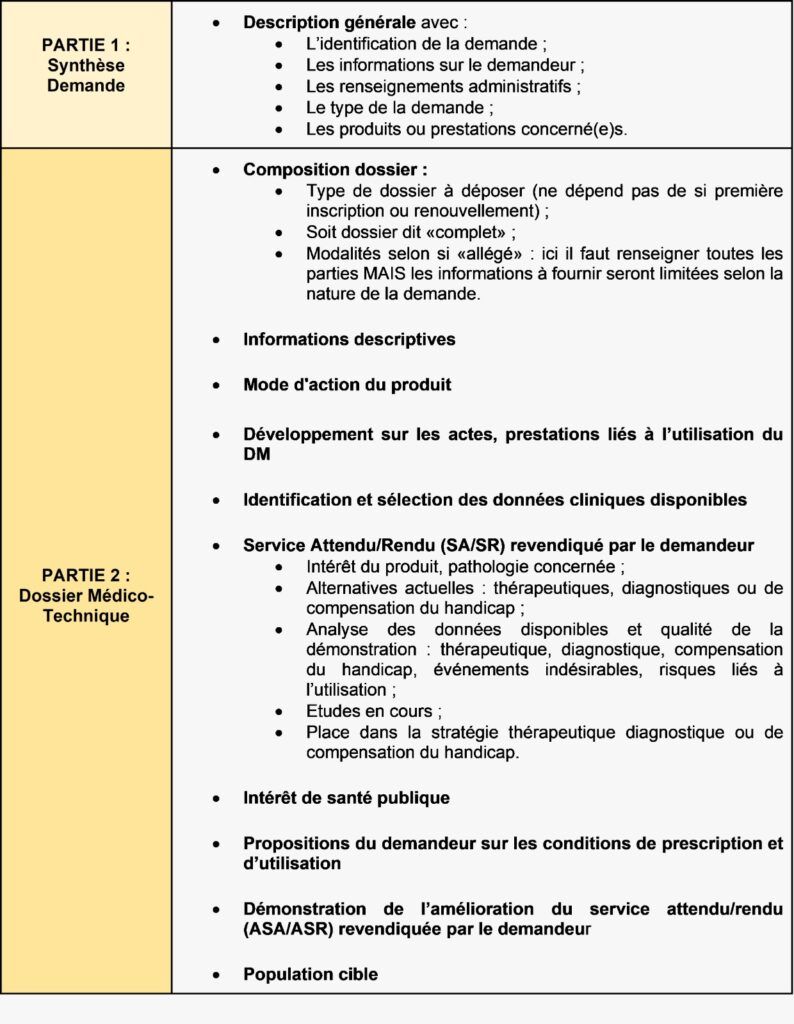
Il est précisé dans le guide “ LPPR : Dépôt d’un dossier auprès de la Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé ”, que des annexes sont à considérer dans le cadre de certains DM. Par exemple, l’ANNEXE VI qui précise les informations à joindre pour l’évaluation de l’acte associé à celle du DM.
5. Inscription sur la Liste Intra-GHS
Figure 9 : Inscription d’un DM sur la liste Intra GHS (source : Guide HAS 2022 Dispositifs médicaux financés dans les tarifs des prestations d’hospitalisation) [22]
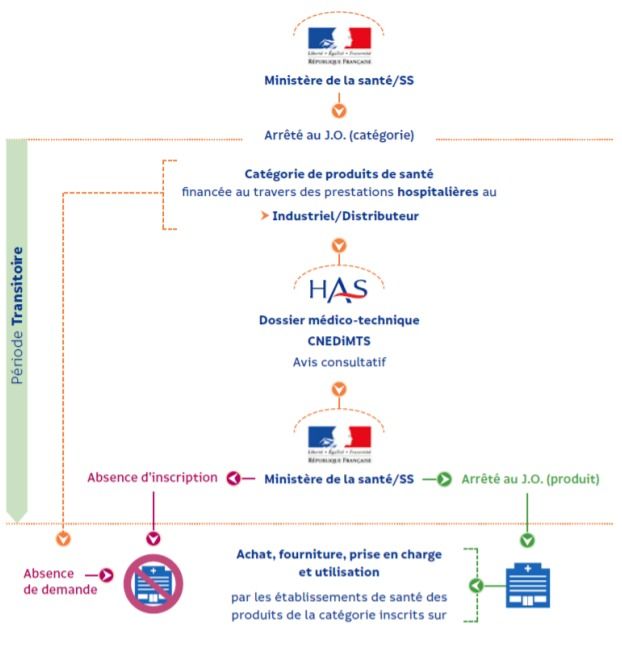
La procédure d’inscription d’un dispositif médical, utilisé dans un établissement de santé, sur la liste Intra - GHS diffère quelque peu de celle d’un DM de ville (inscription sur la LPPR) bien qu’elles présentent de nombreuses similitudes.
Figure 10 : Tableau comparatif LPPR - Liste Intra-GHS (source : auteurs)
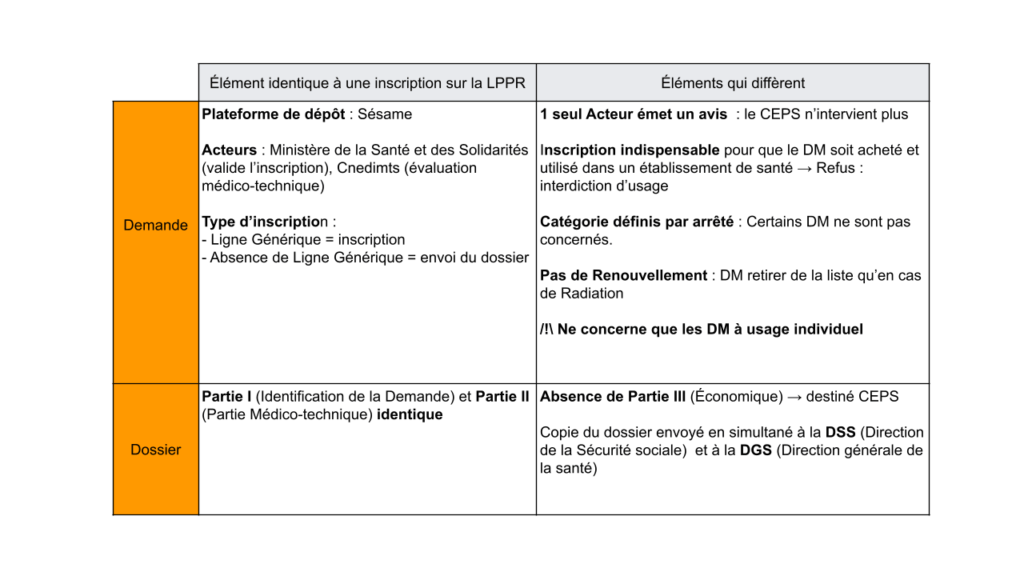
6. Zoom sur les DM dit innovants
La voie vers le remboursement semble très compliquée pour les fabricants : les voies d’accès sont souvent mal comprises, peu anticipées. Il est donc recommandé au fabricant de prendre en compte tous les aspects du DM dès sa conception dans le but d’une prise en charge future.
BPI France a mis en place un guide pour faciliter la compréhension d’un fabricant de DM innovant souhaitant un remboursement. Y sont précisés tous les types de voies possibles dont celle du forfait d’innovation [23].
Proposée par la HAS, c’est une prise en charge dérogatoire, transitoire et temporaire ayant pour objectif de faciliter l’accès aux technologies innovantes. L’étude réalisée dans ce cadre vise à apporter les données cliniques manquantes permettant d’appuyer la demande de remboursement réalisée ultérieurement.
L’évaluation du forfait innovation se fait sur 2 aspects principaux :
1. Le caractère innovant de la technologie. Le DM est éligible s'il répond à 4 critères [24] :
- « Nouveauté autre qu’une simple évolution technique par rapport aux technologies de santé existantes utilisées dans les indications revendiquées » ;
- « En phase précoce de diffusion (ne relève pas d’une prise en charge et n’a jamais été pris en charge spécifiquement par la collectivité dans les indications revendiquées)» ;
- « Les risques liés à l’utilisation ont été préalablement caractérisés » ;
- « L’objectif est soit de répondre à (…) un bénéfice clinique important, soit de réduire les dépenses de santé »
2. La pertinence de l’étude clinique / médico-économique proposée par le demandeur : afin de démontrer l’ intérêt technologique, la réalisation d’une étude clinique ou d’une étude de minimisation de coût est indispensable.
Points importants à souligner :
- Bien que le marquage CE ne soit pas obligatoire pour déposer la demande, il devra être obtenu avant le début des essais sur l’Homme ;
- Le protocole de l’étude proposée, obligatoirement comparative (sauf en cas d’absence de comparateur pertinent / pour raison éthique), fait partie intégrante du dossier de demande ;
- Le demandeur du forfait innovation est également le promoteur de l’étude ;
- Le suivi du déroulement de l’étude est assuré par le ministère chargé de la Santé.
Le guide “Forfait innovation : principes d’évaluation de la HAS “ datant de mai 2021, très complet, explique et récapitule la composition du schéma d’instruction entrepris par la CNEDIMTS. Il précise également les points du dossier à apporter dans le dossier “Forfait innovation” et rappel la possibilité d’un accompagnement notamment au travers de rendez-vous pré-dépôt et de rencontres précoces.
Dossier pour le Forfait innovation :
Les critères réglementaires sont les mêmes que ceux étudiés pour un dossier “classique”.
Ainsi le dossier doit reprendre les éléments d’un dossier classique (évaluation médico-clinique envoyer CNEDiMTS) auquel sont ajoutés :
- Les arguments justifiant de la conformité vis à vis des critères d’éligibilité ;
- Le “Projet complet de protocole d’étude conditionnant la prise en charge” ;
- Un Budget prévisionnel ;
- Déclaration attestant la communication des résultats de l’étude et l'accessibilité aux données.
La trame du dossier complet est disponible sur le site de la HAS : https://www.has-sante.fr/jcms/c_2035788/fr/forfait-innovation
Qui peut en bénéficier ?
Si sont censés pouvoir en bénéficier tous les fabricants ayant jugé leur DM (et DMDIV) comme “hors prise en charge de droit commun”, le processus est plus complexe en réalité.
L’issu avec ce forfait reste qu’à l’heure d’aujourd’hui c’est une voie d’accès encore très peu développée.
Malgré son objectif de de favoriser l’accès précoce à des technologies de rupture, les critères permettant d’en bénéficier étant trop restrictifs, il reste aujourd'hui très peu opérant. Depuis sa mise en place, seulement 12 dispositifs ont pu bénéficier de ce type de “remboursement”.
Partie II - Outil interactif pour la compréhension du processus d’accès au remboursement du dispositif médical
En France, les bénéfices apportés par une validation de demande de remboursement ne sont pas négligeables. C'est pourquoi, chaque année, le nombre de fabricants faisant la demande s’élève : entre 2013 et 2018 , dans le secteur des DM , le nombre de dispositifs pris en charge est passé de 65 000 à 80 000.
Face à cet enjeu majeur, c'est au fil de cette étude qu'un un outil interactif (figure 11) a été créé : sous format PDF, cet outil permet de mieux comprendre afin de mieux anticiper les étapes que le demandeur de remboursement de dispositif médical doit effectuer.
Figure 11 : Sommaire interactif présentant les différentes parties de l’outil (source : auteurs).
Véritable synthèse basée sur les nombreux guides de la HAS, cet outil présente notamment les éléments à fournir pour constituer le dossier de demande (figure 12) avec les différentes parties et acteurs afin de candidater à la demande de remboursement.
Figure 12 : Diapositive du guide reprenant les éléments les éléments essentiels constituant le dossier de demande d’accès au remboursement d’un DM (source : auteurs)
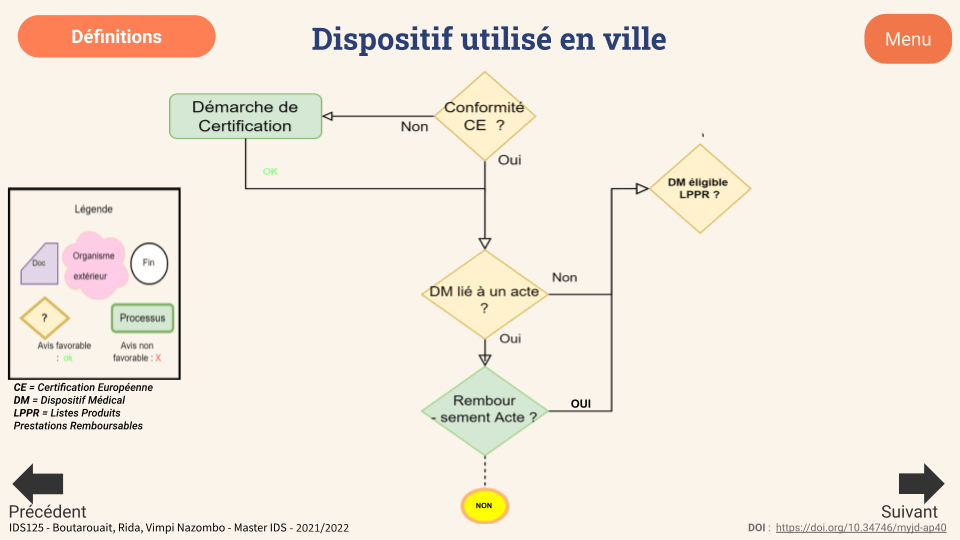
Cet outil comporte également des logigrammes (figure 13) qui se veulent simplificateurs de ces guides. Ils permettent de se situer vis-à-vis de l’avancée du demandeur et de connaître, en un coup d'œil, le parcours à suivre, les démarches à entreprendre, les différentes finalités (remboursement ou non) ainsi que les acteurs clés. Ces logigrammes ont été faits en se référant à d'anciens travaux effectués par la SNITEM [25].
Figure 13 : Diapositive de l’outil introduisant le début du logigramme pour un dispositif utilisé en ville : à l’aide de la légende, le lecteur/demandeur comprend chaque étape à suivre pour son parcours d’accès au remboursement (source : auteurs)
Pour résumer, la démarche de remboursement est un acte assez complexe pas toujours compréhensible par tous. Elle implique de nombreux acteurs et en fonction des finalités du DM (types, destination…), elle nécessite une variété de documents permettant de répondre à des critères déterminés.
Cependant, dans la mesure où ces apports ne sont pas négligeables, c’est une étape qui ne doit pas être redoutée par les industriels, raison pour laquelle les autorités publiques les invitent à se pencher sur cette démarche le plus tôt possible. C’est ainsi que l'outil interactif téléchargeable se veut utile dans cette démarche décisionnelle.
Conclusion
Partie intégrante du système de santé français, le “remboursement” des dispositifs médicaux, financé en majeur partie par la collectivité et l’Etat est un processus long, voire complexe, bien que non obligatoire, pas toujours facile à implémenter pour les fabricants.
Hors cet accès au remboursement représente un véritable enjeu : la prise en charge du dispositif, conditionnée par son inscription sur la LPPR (ou liste Intra-GHS) , permettrait aux fabricant, outre le gain monétaire apporter (argent) d'accroître la diffusion du dispositif sur le marché. En effet dans la mesure où en étant référencé, et/ou utilisé, par les professionnels de santé celui-ci gagnera en notoriété.
L’objectif visé en étudiant les modalité du processus de remboursement (définitions, présentation des acteurs clé, de son déroulé, de la documentation à fournir…), était de le synthétiser de façon clair et précise, de façon à ce qu’un fabricant puisse, en consultant ce travail et les livrables téléchargeable, avoir une idée claire de son déroulement.
Malgré les nombreuses ressources disponibles permettant d'expliquer les démarches à effectuer, leurs nombre fait qu’il n’est pas toujours facile de naviguer entre les différents référentiels et donc de s’y retrouver. Dans ce contexte, il est fortement suggéré, aux industriels, de prendre un rendez-vous de pré-dépôts. Son objectif : valider la démarche entreprise et éclairer les questionnements.
A noter que bien qu’il n’ait pas été abordé dans cet écrit, un autre type d’inscription, prévue par le code de la sécurité social (article 60 de la Loi n° 2014-1554 du 22 décembre 2014), “existe” : la description générique renforcée.
Son objectif : “permettre une traçabilité plus efficace et un meilleur contrôle du remboursement de DM considérés comme sensibles, actuellement inscrits par le fabricant sous description générique” [26].
Place intermédiaire entre la description générique et le nom de marque, ce type d’inscription exigera une déclaration de conformité aux spécifications techniques des descriptions génériques concernées, auprès de l’ANSM, établie par un organisme notifié.
L’arrêté précisant “la liste des dispositifs concernés, les spécifications techniques applicables, les phases transitoires (...), la liste des organismes compétents, ainsi que leur délai de réponse” n’ayant toujours pas été publié, il n’est pour l’instant (2022) toujours pas en application.
L’étude de son contexte et les problématiques qui lui sont liées pourrait faire lieu d’un mémoire à part entière.