IDS156 - Ingénieur d'application dans le management du rythme cardiaque au sein d'un établissement de santé
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteure

Contact
- Camille Marot : camille.marot1998@gmail.com
Citation
A rappeler pour tout usage : Camille MAROT, « Ingénieur d'application dans le management du rythme cardiaque au sein d'un établissement de santé », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Stage, https://travaux.master.utc.fr/, réf n° IDS156, juillet 2022, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids156/
Résumé
Le cœur est un des organes vitaux du corps humain. C’est un organe musculaire possédant 4 cavités qui se contractent de manière coordonnée, ce qui donne un rythme cardiaque efficace, fiable et constant. Néanmoins, une partie de la population, en particulier les personnes âgées, est concernée par des troubles du rythme cardiaque plus ou moins graves. Afin de gérer ces troubles et leurs conséquences sur les patients, des dispositifs médicaux ont été créés par différentes entreprises mondiales de management du rythme cardiaque (CRM). Ces entreprises fournissent des moyens de diagnostic et de traitements pour ces pathologies tels que des électrocardiogrammes ou, des dispositifs cardiaques implantables (stimulateurs cardiaques, défibrillateurs automatiques implantables et dispositifs de resynchronisation cardiaque). C’est à l’ingénieur d’application CRM que revient la responsabilité de restituer aux patients qui ont un cœur défaillant, un rythme normal, en programmant ces différents dispositifs implantables. Ce rapport de stage met en lumière mon évolution durant ces 6 derniers mois au cœur de la société MicroPort CRM et expose les missions ainsi que la composition des différentes journées d’un ingénieur d’application CRM. Dans cette entreprise, j’ai appris l’ensemble des maladies du rythme cardiaque traitées par MicroPort CRM ainsi que l’organisation et la programmation des différents dispositifs implantables conçus par celle-ci. Durant cette immersion professionnelle, j’ai également pris conscience de l’importance de ce métier dans la prise en charge des différents troubles du rythme cardiaque.
Mots-clés : Troubles du rythme cardiaque ; Diagnostic ; Traitement ; Cardiac Rhythm Management ; Dispositifs cardiaque implantable ; Ingénieur d’Application CRM
Abstract
The heart is one of the vital organs of the human body. It is a muscular organ with 4 chambers that contracts in a coordinated way, which provides an efficient, reliable and constant heart rhythm. Nevertheless, a part of the population, especially the elderly, is affected by more or less serious heart rhythm disorders. In order to manage these disorders and their consequences on patients, several global cardiac rhythm management (CRM) companies have created medical devices. These companies provide means for diagnosing and treating these pathologies, such as electrocardiograms and implantable cardiac devices (pacemakers, implantable automatic defibrillators and cardiac resynchronization devices). It is the responsibility of the CRM field engineer to advise the cardiologist on the operation of the various implantable devices and to adapt the settings according to his or her wishes. This internship report highlights my evolution during the last 6 months in the heart of the company MicroPort CRM and exposes the missions as well as the composition of the different days of a CRM field engineer. In this company, I learned about every cardiac rhythm disease treated by MicroPort CRM as well as the organization and programming of the various implantable devices designed by the company. During this professional immersion, I was also able to become aware of the importance of this profession in the management of the various cardiac rhythm disorders.
Keywords : Cardiac rhythm disorders ; Diagnosis ; Treatment ; Cardiac Rhythm Management ; Implantable cardiac devices ; CRM Field Engineer.
Téléchargements

Mémoire complet
Ingénieur d'application dans le management du rythme cardiaque au sein d'un établissement de santé
Remerciements
Je tiens tout d’abord à remercier mon tuteur de stage, M. Dominique Escande, et toute son équipe pour leur accueil au sein de MicroPort CRM. Je le remercie aussi pour l’ensemble des enseignements qu’il a mis à ma disposition, la confiance ainsi que les opportunités qu’il m’a accordées.
J’ai également une pensée particulière pour l’ensemble de l’équipe d’ingénieurs d’application CRM ; Sarah Renault, Jose Luis Villega, et les responsables commerciaux CRM ; Aurélie Euzet, Didier Huron et Guillaume Barondeau, qui m’ont formée et ont rendu cette expérience professionnelle chez MicroPort CRM très enrichissante. L’ensemble de leurs explications, de leurs formations ainsi que leurs conseils m’ont amenée à évoluer en compétence dans le domaine du management du rythme cardiaque et à mieux comprendre la mission d’un ingénieur d’application CRM. Je tiens également à les remercier pour la bonne intégration au sein de leur équipe et pour leur partage d’expériences.
Également, je remercie l’ensemble de l’équipe Business Unit ainsi que l’équipe Marketing qui ont su me transmettre leur expertise sur les différents produits de MicroPort CRM. Leur disponibilité et leur savoir-faire ont répondu à l’ensemble de mes interrogations.
Je suis reconnaissante envers l’ensemble des médecins et infirmières.ers pour leurs formations, leurs conseils, leur confiance ainsi que leur bienveillance à mon égard tout au long de ce stage. Ils m’ont permis de bien intégrer le métier d’ingénieur d’application CRM et de montrer mes capacités à exercer ce métier.
Je pense également à l’ensemble des personnes chez MicroPort CRM avec qui j’ai pu travailler, échanger et partager durant ce stage.
Finalement, je remercie toutes les personnes qui ont contribué au bon déroulement de mon stage, dont les ressources humaines, la scolarité de l’UTC dont Mme Isabelle Claude et M. Prot et en particulier Mme Murielle Dufresne qui m’a suivie durant ce stage et qui m’a conseillée lors de l’élaboration de mon rapport de stage.
Abréviations
- AIDA : Automatic Interpretation for Diagnosis Assistance
- ATP : Anti Tachycardia Pacing
- AV : Auriculo-Ventriculaire
- BAV : Bloc auriculo-ventriculaire
- Bpm : Battements par minute
- CRM : Cardiac Rhythm Management
- CRT-D ou CRT-P : Cardiac Resynchronization Therapy Defibrillator ou Pacemaker
- DAI : Défibrilateur Automatique Implantable
- DM : Dispositifs Médicaux
- ECG : Electrocardiogramme
- EGM : Electrocardiogrammes intracardiaque
- FA : Fibrillation Atriale
- FEVG : Fraction d’Ejection Ventriculaire Gauche
- FV : Fibrillation Ventriculaire
- IA : Ingénieur d’Application
- IC : Insuffisance Cardiaque
- ICD : Implantable Cardioverter Defibrillator
- NS : Nœud Sinusal
- NYHA : New York Heart Association
- OD : Oreillette droite
- PM : Pacemaker
- PSA : Programmeur et Analyseur de Stimulation
- SAM : Sleep Apnea Monitoring
- TSV : Tachycardie Supra-Ventriculaire
- TV : Tachycardie Ventriculaire
- VD : Ventricule Droit
- VG : Ventricule Gauche
- VCS : Veine Cave Supérieur
- VCI : Veine Cave Inférieur
Introduction
L’arrêt cardiaque, aussi nommé la mort subite, est évalué entre 50 et 100 arrêts cardiaques pour 100 000 personnes par an, touchant ainsi potentiellement en moyenne 40 000 personnes en France chaque année. Cependant, l'un des problèmes majeurs de l’arrêt cardiaque est qu’il n’est souvent précédé d'aucun symptôme externe apparent, avec un taux de survie d'environ 10 %. Le mécanisme de cette pathologie, provient fréquemment d’un trouble du rythme cardiaque ventriculaire (fibrillation ventriculaire ou tachycardie ventriculaire). De plus, toutes maladies cardiaques (cardiopathie) peuvent se compliquer et provoquer des arythmies supra-ventriculaires ou ventriculaires au cours de son évolution, et ainsi probablement conduire à un arrêt cardiaque. Ainsi, ces maladies sont la première cause de mortalité dans le monde [1]–[5].
Afin de répondre à cette problématique majeure de santé publique, l’entreprise MicroPort CRM développe et se spécialise dans les dispositifs médicaux de cardiologie traitant les troubles du rythme cardiaque. Cette société est pionnière dans le monde de la gestion du rythme du cœur et son siège est situé à Clamart en France. Ses principaux produits sont : les stimulateurs cardiaques, les défibrillateurs automatiques implantables et les dispositifs de resynchronisation cardiaque qui permettent de sauver des patients et d’améliorer leur qualité de vie [6]–[8]. Par conséquent, la prévention de cette problématique est un défi majeur ; l’indication de prévention primaire est pour les patients à haut risque mettant en jeu leur pronostic vital ou l’indication de prévention secondaire après l’apparition d’une mort subite ou d’une tachycardie ventriculaire syncopale. Il existe un grand risque de récidives pour les patients, et cela même s’ils sont correctement suivis et traités. C’est pour cela que l’implantation d’un dispositif cardiaque implantable est recommandé par un cardiologue stimuliste, aussi nommé rythmologue. Ainsi, c’est l’ingénieur d’application CRM spécialiste du domaine qui se chargera, sous la responsabilité du médecin, de la programmation [1], [9].
Au cours de mon master Ingénierie de le Santé (TBTS) à l’Université de Technologies de Compiègne, j’ai effectué un stage de 6 mois au sein de l’entreprise MicroPort CRM, en tant qu’Ingénieur d’Application CRM. J’ai choisi de m’orienter vers ce métier car j’ai toujours été passionnée par la cardiologie. Ainsi, ce rapport de stage retracera le métier d’un ingénieur d’application dans le management du rythme cardiaque (CRM) au sein d’un établissement de santé. Dans ce rapport j’explique l’histoire de MicroPort CRM et son environnement, le diagnostic et la gestion des différents troubles du rythme cardiaque, les dispositifs de management du rythme cardiaque ainsi que les missions et l’importance d’un ingénieur d’application CRM au sein d’un établissement de santé et enfin les apports de ce stage.
I. MicroPort CRM et son environnement
Fondé en 1998, le groupe MicroPort (MicroPort Scientific Corporation) est à la fois un développeur et un fabricant mondial de dispositifs médicaux (DM), dont le siège est basé à Shanghai, en Chine. L’objectif de MicroPort, est de « prolonger et remodeler » la vie des patients à l’aide de technologies médicales les plus avancées au monde. Ils ont une vision centrée sur le patient. C’est notamment pour cette raison que ce groupe commercialise plus de 300 produits dans différents domaines médicaux. Couvrant 10 disciplines médicales majeures, telles que la cardiologie interventionnelle, la gestion du rythme cardiaque (CRM = cardiac rhythm management), l’endovasculaire, l’angiographie médicale, l’électrophysiologie, la gestion chirurgicale cardiaque, la neurologie, le diabète, la radiologie interventionnelle et l’orthopédie, MicroPort se positionne comme l’un des leaders du marché. Ces différents produits sont utilisés dans plus de 11 000 hôpitaux dans le monde entier. Environ 70% des revenus de cette entreprise sont produits en dehors du marché chinois. La section MicroPort CRM fait partie du groupe MicroPort. Celle-ci est primordiale puisqu’en 2020 ce segment CRM a été la deuxième plus grosse activité du groupe [10]–[12].
A. MicroPort CRM : une entreprise pionnière dans le domaine du CRM
La société, aujourd’hui nommée MicroPort CRM, a vu le jour dans les années 1960 et avait pour nom à cette époque : ELA médical. Son évolution a marqué le domaine du CRM au cours des dernières décennies de développement technologique et thérapeutique. Leur savoir-faire consiste à traiter des cœurs qui battent à un rythme trop lent (bradycardie) avec des stimulateurs cardiaques, ou des cœurs qui battent trop rapidement (tachycardie) avec un défibrillateur automatique implantable afin de rétablir un rythme cardiaque normal. Les innovations constantes ont permis à ces dispositifs médicaux d’être miniaturisés et transformés en de réels implants intelligents et embarqués, ayant la capacité de réguler chaque battement du cœur en fonction de l’état et de l’activité de chaque patient [12], [13].
Suite à plusieurs changements d’actionnaires, tout d’abord Sorin Group en 2004 puis LivaNova en 2015, la société est finalement devenue MicroPort CRM en 2018, avec le groupe MicroPort comme actionnaire principal [12], [13].
Actuellement, le siège de MicroPort CRM est situé à Clamart, en région parisienne. Elle compte 1155 salariés dans le monde dont 388 en France (chiffres de 2021). C’est aussi Clamart que les plus petits stimulateurs cardiaques et les défibrillateurs ayant la plus longue durée de vie du marché sont conçus et fabriqués dans la plus gigantesque « salle blanche » d’Europe (Figure 1) [12].

Figure 1 : Salle Blanche de MicroPort CRM de 2300m2 [13]
B. Localisation mondiale et division régionale en France
MicroPort CRM est présent en vente directe dans 17 pays tels que la Chine, les USA, le Canada, le Japon, l’Australie et 12 pays d’Europe (France, Italie, Espagne, Portugal…) [12].
L’organisation en France est divisée en quatre régions (Figure 2) : Paris-Ouest (bleu), Sud-Ouest (orange), Nord-Est (vert) et Sud-Est (jaune) (et la région DOM/TOM). Chaque région est gérée par un Directeur Régional (DR) qui manage une équipe composée de responsables commerciaux ainsi que d’Ingénieurs d’Application (IA) de sa région [12].
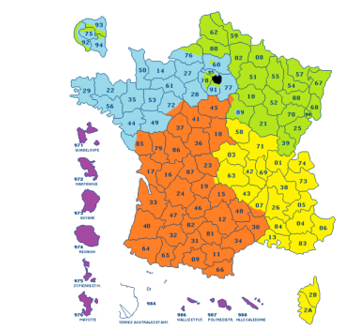
Figure 2 : Répartition des différentes régions chez MicroPort CRM [12]
Chaque ingénieur commercial possède une spécialité dans le CRM, soit en Bradycardie ou soit en Tachycardie. Ils ont de nombreux centres de dispositifs cardiaques implantables à leur charge. Les objectifs de ventes sont définis sur un an par les directeurs régionaux, de vente et marketing. Puis ils sont redistribués entre les vendeurs des différentes régions [12].
C. MicroPort CRM : Business et Investissements
Les activités commerciales de MicroPort CRM représentent environ 28% des revenus de MicroPort. En 2020, leurs revenus globaux étaient de 649 millions de dollars. Soit, environ 182 millions de dollars pour MicroPort CRM dont 90 millions de dollars provenant de la France [12].
Il est bon de notifier que le marché français du pacemaker en 2021 s’est élevé à environ 80 mille poses dont 20 mille poses de la marque MicroPort CRM. Pour ce qui est du marché du défibrillateur automatique implantable en 2021, il s’est élevé à environ 15 mille poses dont 2 mille poses de la marque MicroPort CRM [12].
MicroPort CRM fait partie des cinq plus grands fabricants mondiaux de dispositifs médicaux de management du rythme cardiaque. A ce jour, ses principaux concurrents sont Medtronic, Boston Scientific, Biotronik et Saint Jude Medical racheté par Abbott [14].
Cette société se démarque des autres concurrents grâce à leurs algorithmes performants et leurs innovations telles que :
- Le SafeR qui permet de préserver une bonne conduction auriculo-ventriculaire et de limiter au maximum la stimulation ventriculaire,
- La première technologie au monde d’IRM qui permet d’ajuster automatiquement les paramètres du pacemaker lorsqu’il est sous un champ magnétique,
- Le plus petit pacemaker double chambre du marché (8 cm3),
- Le SonR : système unique qui repose sur un capteur incorporé dans une sonde, qui optimise la resynchronisation cardiaque automatiquement lors d’insuffisance cardiaque.
L’activité CRM de MicroPort comprend :
- Des stimulateurs cardiaques - Pacemakers (PM)
- Des Défibrillateurs Automatiques Implantables (DAI)
- Des dispositifs médicaux de Thérapie de Resynchronisation Cardiaque (CRT = Cardiac Resynchronization Therapy)
- Des sondes de stimulations et de défibrillations
- Les programmateurs et moniteurs/transmetteurs domestiques
- Des enregistreurs ECG ambulatoires de longue durée, Holter ECG (Spider Flash), et des logiciels d’analyse d’ECG
La fabrication de ces différents produits s’effectue sur 4 sites de production ; dont Clamart (France) pour les circuits électroniques, Saluggia (Italie) pour l’assemblage des dispositifs, Santo Domingo (République Dominicaine) pour les sondes de stimulation et de défibrillation et Shanghai (Chine) pour l’assemblage de dispositifs pour le marché chinois.
Avec ces centres de R&D, MicroPort CRM est un acteur majeur de l’innovation dans ces domaines d’expertises, avec plus de 1000 brevets déposés par le groupe .En ce qui concerne les investissements, MicroPort en possède de multiples et effectue des recherches dans plusieurs secteurs thérapeutiques, notamment dans les maladies cardiaques de types structurelles, vasculaire périphérique ou aortique mais aussi dans la gestion du rythme du cœur, dans l’intervention cardiovasculaire, l’électrophysiologie etc…
II. Diagnostic et gestion des maladies du rythme cardiaque
Le cœur fait partie des organes vitaux qui participe au bon fonctionnement de l’ensemble du corps humain. Il s’agit d’un muscle qui possède une fonction électrique et mécanique, assurant une bonne circulation sanguine par des contractions qui sont rythmées. Il comporte deux compartiments (droit et gauche) qui ne communiquent pas ensemble mais qui fonctionnent de manière synchrone, tous deux constitués de 2 cavités, une oreillette et un ventricule, reliées par une valve et formant ainsi 4 cavités (Figure 3) [15].

Figure 3 : Structure anatomique du cœur sain [15]
Le compartiment de droite contient du sang désoxygéné, qui provient de différentes veines, et qui est envoyé dans la circulation pulmonaire par l’artère pulmonaire.
Quant au compartiment de gauche, le plus puissant, il contient le sang oxygéné par les poumons qui est envoyé dans la circulation systémique de façon à apporter les nutriments et l’oxygène afin de satisfaire les besoins métaboliques de tous le corps humain. Il est important de savoir que le tissu musculaire du ventricule gauche (VG) est bien plus développé que celui du ventricule droit (VD), et cela en raison du VG qui a besoin d’une plus grande force musculaire afin d’assurer une pression bien plus grande pour envoyer le sang oxygéné, dans l’ensemble du corps humain.
A. Physiologie du rythme cardiaque
La circulation sanguine est garantie par un cycle cardiaque rythmé, dont le cœur doit garantir quant à lui, un débit cardiaque le plus optimal possible. Ce qui veut dire, qu’il doit éjecter un volume sanguin à un rythme cardiaque bien définit afin d’assurer le bon fonctionnement du corps humain, soit, en moyenne 5 litres de sang par minute [16].
Au cours d’un cycle cardiaque, il est essentiel que les deux compartiments du cœur se contractent simultanément. Et pour cela, ce cycle se décompose en deux périodes, systole et diastole, qui se divisent en cinq phases très rythmées (Figure 4) [17] :
- Premièrement la période de systole ventriculaire (30%) comprend deux phases de contractions :
- Phase 1 : Une contraction isovolumétrique : elle commence à la fin de la phase de diastole ventriculaire et apparait au moment où les ventricules, VG et VD, sont pleins. Lors de cette phase, la pression intra-ventriculaire augmente, avec aucun changement de volume sanguin à l’intérieur, de façon à être supérieure à celle dans les oreillettes. De cette façon, les valves auriculoventriculaires (mitrale et tricuspide) se ferment et produisent un premier son (S1).
- Phase 2 : Une contraction isotonique : lors de cette phase, la pression intraventriculaire continue d’augmenter de façon à ce qu’elle devienne supérieure à la pression dans les artères. De cette façon, les valves sigmoïdes (aortiques et pulmonaires) s’ouvrent afin de chasser le sang dans la circulation sanguine rapidement puis à une vitesse qui décroit petit à petit.
- Deuxièmement la période de diastole ventriculaire (70%) comprend trois phases :
- Phase 3 : Relaxation isométrique : lors de cette phase, la pression intra-ventriculaire diminue de façon à ce qu’elle soit plus faible que celle dans les artères (aorte et pulmonaire). De cette façon, les valves sigmoïdes se ferment et produisent le deuxième son.
- Phase 4 : Remplissage ventriculaire : lors de cette phase, la pression intra-ventriculaire diminue de façon à être inférieur à celle des oreillettes ce qui ouvre les valves auriculo-ventriculaires. A ce moment un remplissage passif des ventricules commence.
- Phase 5 : Contraction auriculaire : lors de cette phase, le remplissage des ventricules devient actif ; la systole auriculaire expulse le sang restant dans les ventricules. Ainsi un nouveau cycle peut recommencer.
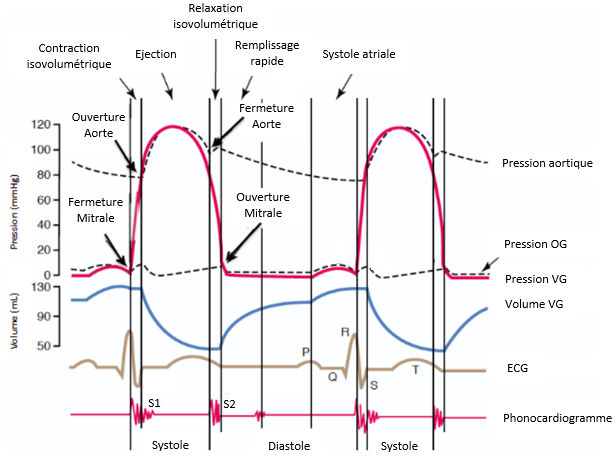
Figure 4 : Hémodynamique du cœur (Source : auteure)
Afin que ce cycle soit réalisé correctement, le cœur dispose d’un système électrique. En effet, la contraction du muscle cardiaque est associée à des modifications de type électriques nommées « dépolarisation », qui suivent un système de conduction. Ce système de conduction intracardiaque garantit que le muscle cardiaque, le myocarde, se contracte de manière continue et uniforme dans les cavités ventriculaires ou auriculaires. L’impulsion électrique dépolarisante (de l’ordre du millivolts), prend origine au niveau du nœud sinusal (NS), situé dans l’OD, et provoque la conduite d’un courant électrique le long des cellules du muscle cardiaque (cardiomyocytes), ce qui permet une contraction du myocarde. Il est possible de détecter ces modifications grâce à des électrodes collés sur la surface de la peau et de les observer sur un ECG (électrocardiogramme) [18]–[20].
Ainsi, le système électrique du cœur se décompose en plusieurs phases elles aussi rythmées (Figure 5)[20]:
- Phase 1 : Le nœud sinusal (situé dans l’oreillette droite) émet une impulsion, de ce fait le courant électrique ainsi généré se propage de cellules en cellules au niveau des oreillettes droite et gauche ce qui provoque leur dépolarisation et donc leur contraction. Ce phénomène de dépolarisation est observable sur un ECG et est représenté par l’onde P.
- Phase 2 : Par la suite, le nœud auriculo-ventriculaire est traversé par le courant électrique qui va continuer de se propager au niveau du faisceau de His et de ces branches (droite et gauche) jusqu’aux fibres de Purkinje. Ce système de conduction permet aux cellules ventriculaires de se dépolariser et donc de contracter les ventricules. Ce phénomène de dépolarisation est tout aussi observable sur un ECG et est représenté par le complexe QRS (ou onde R).
- Phase 3 : Cette phase représente la repolarisation de l’ensemble des cellules ventriculaires. Ce phénomène de repolarisation est observable sur l’ECG et est représenté par l’onde T.
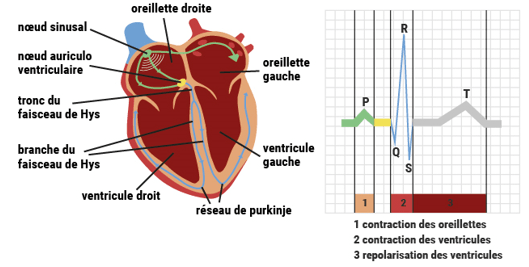
Figure 5 : Circuit électrique d'un cœur sain [19]
Il est essentiel de savoir, que chacune de ces cavités possède la capacité d’induire une dépolarisation de leurs cellules (extrasystole ventriculaire ou auriculaire). Si l’origine de cette dépolarisation ne provient pas du nœud sinusal, celle-ci peut provenir d’une zone où les cellules sont défaillantes. De plus, si le système de conduction du courant électrique est perturbé voir rompu, à ce moment-là le système de conduction peut prendre le relais à différents niveaux. En effet, le nœud auriculo-ventriculaire (nœud AV) peut être, lui aussi, un site électrogénique (40-60 battements par minutes), qui peut servir de soutien en cas de défaut du système électrique ou du système de conduction supérieur au ventricule. Les troubles de conductions situés sous le nœud AV peuvent être suppléer par le faisceau de His (40-60 battements par minutes) et le réseau de Purkinje (20-40 battements par minutes) et donc provoquer une dépolarisation des cellules ventriculaires et ainsi une contraction des ventricules. Cependant cette dépolarisation se fait à un rythme lent, nommé rythme d’échappement, puisqu’il n’est pas rythmé par le nœud sinusal, qui est le seul à pouvoir assurer un rythme physiologique constant.
Lors d’un rythme d’échappement, le débit cardiaque est impacté puisqu’il ne sera plus optimal pour fournir au corps l’oxygène, les nutriments et donc l’énergie adéquate. De ce fait ces troubles sont associés à une mortalité qui est nettement majorée et donc à ne surtout pas négliger [19].
B. Les troubles du rythme cardiaque et leurs diagnostics
Les symptômes des nombreux troubles du rythme et de la conduction cardiaque sont variés : la fatigue, l’étourdissements, les vertiges et les palpitations peuvent être l’un des signes avant-coureurs. Face à ces différents symptômes, le médecin peut recommander divers examens, afin de diagnostiquer un trouble du rythme cardiaque ou de conduction, tels que [21], [22] :
- L’électrocardiogramme (ECG) : cet examen consiste à observer la conduction des signaux électriques du cœur grâce à des électrodes disposées sur la peau du patient. Ainsi, le cardiologue peut interpréter le tracé qui ressort de l’ECG. Cependant, lorsque les troubles sont courts, variables ou apparaissent dans des situations spécifiques, alors il est essentiel d’effectuer des enregistrements de plus ou moins longue durée (heures, jours, semaines, années) à l’aide d’un Holter externe (Figure 6 : Spider Flash [23]) ou d’un Holter implantable.
- Le test d’effort : ce test consiste à analyser le rythme du patient, à l’aide d’un ECG, lors d’un effort physique lorsque celui-ci décrit des troubles apparaissant seulement à l’effort.
- Exploration électrophysiologique du cœur : cet examen s’effectue sous anesthésie locale. L’exploration permet d’enregistrer les signaux électriques du cœur à l’aide d’électrodes disposées dans le cœur. Cela permet d’analyser la conduction du signal électrique plus précisément.

Figure 6 : SpiderFlash [23]
Suite à la détection de troubles, divers bilans complémentaires sont effectués pour confirmer le diagnostic, tels que des analyses de sang afin de rechercher des anomalies pouvant favoriser l’arythmie, et un bilan cardiaque du malade en réalisant une échocardiographie du cœur afin d’évaluer les retentissements. D’autres examens supplémentaires peuvent être utiles afin de compléter le bilan général tels qu’une IRM cardiaque, une coronarographie etc… De plus, il est recherché la présence de facteurs de risque tels que du cholestérol, de l’hypertension artérielle, du diabète, du tabac, du surpoids etc… car ce sont des facteurs qui vont aggraver davantage les troubles cardiaques [21], [22].
Enfin, ces troubles sont parfois négligés car ils ne provoquent aucun signe évident. Leurs découvertes peuvent être fortuites lors d’un ECG effectué pour une autre raison. Cependant, en raison des nombreux symptômes associés aux différents troubles du rythme et de la conduction, l’origine cardiaque n’est pas toujours facile à identifier.
1. Bradycardie et troubles conductifs
La bradycardie est caractérisée par un rythme du cœur trop lent voir irrégulier du cœur, généralement inférieur à environ 50 battements par minutes (bpm). Lors d’un tel rythme, durant une activité normale ou une activité physique, le cœur n'est plus en mesure de fournir suffisamment de sang et donc d’oxygène à l'organisme. Ce genre de phénomène peut donc entraîner de la fatigue, des pertes de mémoire et une sensation d'évanouissement voir des syncopes. Il est aussi possible d’avoir des pauses cardiaques qui peuvent engendrer différents symptômes tels qu’une perte d’équilibre, ou une chute sans explication particulière, voire même une perte de connaissance provisoire [22]. Cette maladie possède différentes causes dont :
- Premièrement, elle peut être dû à une dysfonction du nœud sinusal (NS) qui, soit, réalise des pauses ou des arrêts spontanés (phénomène d’asystolie), soit, envoie des impulsions électriques trop lentement (bradycardie sinusale). En effet, une dysfonction sinusale engendre un problème au niveau de la dépolarisation cellulaire à l’origine de l’ensemble du circuit électrique ce qui conduit à un défaut de contraction des oreillettes. A ce moment, comme dit précédemment, c’est le système de conduction au niveau des ventricules qui peut prendre le relais (nœud AV, faisceau de His ou réseaux de Purkinje) [19].
- Deuxièmement, elle peut être due à des blocs auriculo-ventriculaires (BAV), au niveau du nœud AV, produisant un problème de conduction des oreillettes vers les ventricules. Il existe trois types de BAV :
- Le BAV de type 1 (BAV1) correspond à un allongement, régulier, du délai entre l’onde P et l’onde R (délai PR > 200 ms) [19], [24].
- Le BAV de type 2 (BAV2) se décompose en deux types [19] :
- Mobitz I : aussi nommé Wenckeback, correspond à un allongement progressif du délai PR avec une disparition ponctuelle du complexe QRS (perte de conduction aux ventricules)[25].
- Mobitz II : correspond à une disparition ponctuelle de l’onde QRS qui se traduit par une perte de conduction aux ventricules. Il y a donc, par exemple, deux ondes P pour un complexe QRS, aussi noté 2:1 [26].
- Le BAV de type 3 (BAV3) aussi nommé BAV complet, correspond à une désynchronisation totale entre les ondes P et les ondes QRS (Figure 7). Ce qui se traduit par un nœud AV désormais plus fonctionnel. A ce moment, comme dit précédemment, c’est le système de conduction au niveau des ventricules qui peut prendre le relais (faisceau de His ou réseau de Purkinje) [19], [27].
- Troisièmement, elle peut être due à des blocs de branches droit ou gauche, se caractérisant comme un trouble de la conduction dans les ventricules dans une des branches (droite ou gauche) du faisceau de His. Ce blocage peut être partiel (ralentissement du rythme cardiaque) ou complet (arrêt de l’influx électrique), anatomique (dû à une lésion de la branche) ou fonctionnel (aberration ventriculaire qui se traduit par une distribution non normale de l’influx électrique dans un ventricule [28]). De ce fait, lorsqu’il y a un bloc de branche, la dépolarisation du ventricule touché par le bloc est assurée par l’autre ventricule qui transmet à travers du tissu myocardique l’influx électrique. Ce phénomène prolonge donc la durée du complexe QRS qui est environ supérieure ou égale à 120ms et peut engendrer des désynchronisations entre les ventricules et par conséquent une insuffisance cardiaque [29].
- Enfin, elle peut être due à une incompétence chronotrope qui se traduit comme la non capacité d’accélérer le rythme cardiaque, afin de garantir les besoins métaboliques, lors d’exercices physiques par exemple. Autrement dit, le rythme du cœur peut ne pas réussir à atteindre la fréquence maximale qui est théorique ou du moins il est retardé. Cela peut être une incompétence chronotrope du NS, ou d’un rythme d’échappement lors d’un BAV III, ou d’une régulation inappropriée du nœud AV lors de troubles du rythme venant d’au-dessus du ventricule (supraventriculaire) [30].
Il convient toutefois, de mettre en avant que tous troubles de la conduction peuvent entraîner de nombreux symptômes, pouvant aller d’un simple vertige à une syncope. Ainsi, la gravité des troubles du rythme est indépendante des conséquences physiques du malade, qui dépendent en réalité du contexte ainsi que de l’activité de celui-ci lors de l’apparition des troubles conductifs [19].
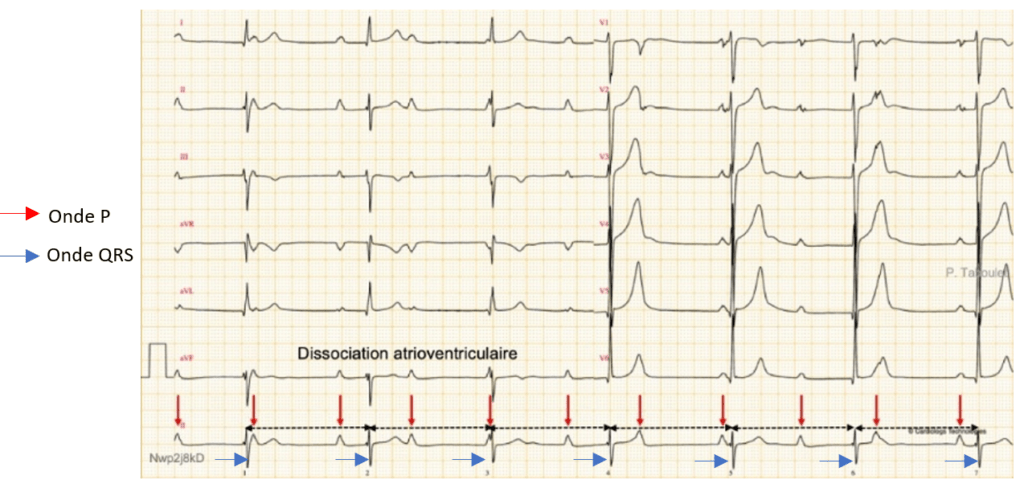
Figure 7 : BAV de type 3 – Echappement à QRS fins [27]
2. Tachycardies
La tachycardie est caractérisée par un rythme du cœur trop rapide, voire irrégulier, dépassant communément un rythme de 100 bpm au repos, et pouvant aller jusqu’à des fréquences très élevées (> 300 bpm). Lors de tachycardie avec des fréquences très élevées, le cœur bat tellement vite qu’il ne se contracte plus correctement afin de fournir du sang oxygéné dans tout le corps. Si ce rythme se prolonge dans le temps, cela peut engendrer des symptômes tels que des étourdissements, des palpitations cardiaques, des vertiges, pouvant aller jusqu’à la mort du patient si ce rythme persiste [22]. Ce genre de pathologie peut survenir dans les deux régions du cœur : soit au niveau supérieur nommé tachycardie supra-ventriculaire (TSV), soit au niveau inférieur nommé tachycardie ventriculaire (TV). De plus, il existe différents types de TSV et TV [19] :
- Les tachycardies supra-ventriculaires (TSV) :
- La tachycardie sinusale : est une accélération normale et progressive du rythme du cœur lors d’un exercice physique ou lors de stress.
- La tachycardie atriale : est une accélération soudaine du rythme de contractions des oreillettes (100-220 bpm) due à des extrasystoles auriculaires. Cette contraction n’est pas physiologique et peut donc conduire à un rythme du cœur anormalement rapide.
- Le Flutter atrial : est un rythme très rapide des oreillettes qui est conduit aux ventricules de manière régulière avec un niveau d’association N pour 1 (N :1) c’est-à-dire N onde P pour 1 onde QRS.
- La Fibrillation atriale (FA) : contraction anarchique des oreillettes, conduisant à une grande accélération de la contraction des oreillettes (>300 bpm). De ce fait, ce phénomène peut être conduit aux ventricules de manière anarchique et donc accélérer leur rythme. Cette pathologie est l’une des plus fréquentes avec une prévalence d’environ 1% dans la population française et plus de 10% pour les patients de plus de 80 ans en 2018 [31].
- Les tachycardies ventriculaires (TV) :
- La tachycardie ventriculaire (TV) : est une grande accélération, soudaine et régulière, du rythme de contractions des ventricules (100-230 bpm). Elle correspond au minimum à 3 extrasystoles ventriculaires. Il existe deux types de TV, celle focale et celle par ré entrée.
- Fibrillation ventriculaire (FV) : se définit comme étant le type de TV le plus dangereux puisque celle-ci entraine bien souvent la mort du patient. En effet, elle provoque une grande accélération, soudaine et anarchique, du rythme de contraction des ventricules (>250 bpm). Cette pathologie est présente chez 70% des patient en arrêt cardiaque [32].
Il est essentiel d’établir un traitement adapté pour chaque type de troubles car cela peut aider à prévenir l’apparition de certaines complications. Par exemple, si une fibrillation atriale n’est pas traitée, elle peut favoriser la formation de caillots sanguins, pouvant ainsi se déplacer vers le cerveau et créant un accident vasculaire cérébral (AVC) ou se déplacer vers une artère coronaire et créant ainsi un infarctus du myocarde. La tachycardie ventriculaire, elle aussi, doit être traitée au plus vite puisqu’elle peut être à l’origine d’un arrêt cardiaque et essentiellement si le patient a déjà fait un infarctus du myocarde. La fibrillation ventriculaire, quant à elle, conduit à une inefficacité intégrale de tout le cœur conduisant donc à un arrêt cardiaque. En cas de FV, il est donc très important de commencer la réanimation cardiaque en réalisant un massage suivi d’un choc électrique externe prodigué par un défibrillateur afin d’assurer la survie de la personne [22].
3. Insuffisance cardiaque
L’insuffisance cardiaque (IC) est un trouble du rythme ventriculaire qui découle de l’ensemble des anomalies structurelles ou fonctionnelles des ventricules dans l’éjection ou le remplissage du sang. De plus, cette pathologie est un « syndrome clinique » où les malades peuvent avoir des symptômes très caractéristiques tels qu’une sensation de fatigue, de manque d’énergie, d’essoufflements et même un excès de liquide dans le corps. En 2019, 2,3% de la population en France et 2% de la population en Europe serait atteinte d’une IC et jusqu’à 10% dans la population de plus de 65 ans. Ainsi, la France comptait plus d’un million d’IC. Chaque année, environ 70 200 décès sont associés à une IC et plus de 160 000 patients hospitalisés sont recensés. Quant à la mortalité, elle est de 30 à 40% à un an et de 60 à 70% à 5 ans. De plus, il est bon de mettre en lumière que la mortalité des patients possédant une insuffisance cardiaque est plus importante que la mortalité chez les patients cancéreux [33], [34].
L’expression de l’insuffisance cardiaque dépend de la sortie cardiaque aussi appelée en Anglais « Cardiac output » qui est égale au produit de la fréquence cardiaque par le volume à la fin du remplissage des ventricules. Elle dépend aussi de la Fraction d’Ejection Ventriculaire Gauche (FEVG) qui évalue la capacité du VG à se remplir et à éjecter du sang, évaluant ainsi la présence et la gravité de l’insuffisance cardiaque du patient (Tableau 1). La FVEG peut être mesurée par échocardiographie (le plus fréquemment), une IRM cardiaque, et une scintigraphie [35].
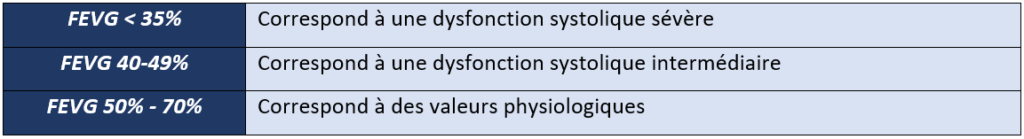
Tableau 1 : Valeurs pathologiques et physiologiques de la FEVG (Source : auteure)
De plus, l’insuffisance cardiaque est classée par la NYHA (New York Heart Association) qui exprime les limites du patient en termes de symptômes dû à son insuffisance cardiaque (Tableau 2).

Tableau 2 : Classes du NYHA (Source : auteure)
Enfin, pour confirmer l’insuffisance cardiaque chez un patient, un ECG, une imagerie par rayons X, une échocardiographie, et même des tests sanguins peuvent être effectués. Cependant, l’examen le plus utile est l’ECG car il permet de vérifier et de contrôler s’il y a la présence d’un défaut de conduction tels que des blocs AV, blocs de branches etc… qui seraient à l’origine d’une insuffisance cardiaque. Comme énoncé précédemment, il est vraiment essentiel d’établir un traitement adapté pour chaque type de troubles car ils peuvent provoquer voire aggraver une insuffisance cardiaque déjà existante.
C. Traitement : Gestion des troubles du rythme cardiaque
Les traitements peuvent varier en fonction du type de troubles du rythme cardiaque. En cas de tachycardie bénigne, les praticiens ont tendance à préconiser une modification hygiéno-diététique en commençant par l’arrêt du café ou de l’alcool qui sont des excitants, du repos, de l’exercice physique etc… Lors de cas plus graves, des médicaments peuvent être essentiels. Néanmoins, lors de troubles résistant aux médicaments, les patients peuvent se voir proposer une intervention chirurgicale afin de détruire, par ablation, les zones de cellules à l’origine de l’arythmie.
Cependant, il n’existe actuellement aucun traitement médicamenteux au long cours pour traiter la bradycardie, la tachycardie ou la fibrillation ventriculaire, qui sont des pathologies qui nous intéressent dans ce rapport, et qui de ce fait nécessitent la mise en place de dispositifs médicaux implantables actifs. Cependant, en cas d’urgence lors de fibrillation ventriculaire chez un patient, le traitement d’urgence est un choc électrique externe prodigué par un défibrillateur externe afin de pouvoir lui rétablir un rythme normal [21].
1. Principes des dispositifs médicaux implantables actifs dans le traitement des troubles
a) Pacemaker : Traitement de la bradycardie et des troubles conductifs
Il est recommandé, pour les patients de plus de 75 ans ayant un rythme lent (bradycardie), une incompétence chronotrope et souffrant de symptômes tels que des syncopes, d’avoir recours à un dispositif implantable. Ainsi, le traitement de la bradycardie et des troubles conductifs se réalise par l’implantation d’un boitier qui est un dispositif médical implantable actif, nommé stimulateur cardiaque, ou plus communément nommé pacemaker (PM). Le plus souvent implanté devant le muscle pectoral gauche, l'appareil remplira 4 fonctions maîtresse :
- Détecter les contractions musculaires cardiaques internes.
- Stimuler les cardiomyocytes afin d’engendrer une contraction musculaire lorsqu’elle n’est pas détectée.
- Accélérer le rythme cardiaque, par des stimulations plus rapides lors de la détection d’un effort physique réalisé par un patient atteint d’incompétence chronotrope.
- Collecter à long terme des données sur l’état des troubles électrique du cœur et sur les sondes implantées.
Afin d’assurer toutes ces fonctions le dispositif est connecté à une ou deux sondes (dépend de l’indication du patient) implantées dans le cœur. C’est via ces sondes que le cœur sera stimulé et/ou écouté. C’est au niveau du haut du dispositif, que les sondes sont fixées au connecteur et qu’elles peuvent fournir au boitier l’ensemble des données de stimulations et de détections, et donc par la même occasion l’état des troubles électriques du cœur du patient. Selon la cavité à détecter ou stimuler, le stimulateur cardiaque peut être un simple chambre, caractérisé par une seule sonde à l’intérieur du VD, ou un double chambre, caractérisé par une sonde de stimulation à l’intérieur du VD et une à l’intérieur de l’OD. De plus, le stimulateur cardiaque doit être configuré avec précision, de façon à traiter rigoureusement la pathologie du malade, à l'aide d'un programmateur de sa marque.
MicroPort CRM a conçu le plus petit pacemaker (8 cm3) double chambre du marché mondial du CRM (pacemaker ENO - Figure 8). La société possède une large gamme de stimulateur cardiaque simple chambre (1 sonde dans une cavité), ou double chambre (2 sondes dans deux cavités), chacun ayant des capacités spécifiques. Le choix du PM simple ou double chambre ou de la gamme est effectué par le médecin en fonction de la maladie du patient [36].

Figure 8 : Stimulateur cardiaque ENO [36]
Le dispositif implantable le plus complet dans la gamme de produit de stimulateur cardiaque est l’ALIZEA (Figure 9). Ce produit permet de maintenir de très bons suivis cliniques à distance. Il possède une très bonne longévité (13 ans) ce qui réduit donc les remplacements.

Figure 9 : Stimulateur cardiaque ALIZEA [37]
De plus, il possède des fonctionnalités de pointe, présentes uniquement dans les produits de MicroPort CRM tels que [37] :
- SafeR : Ce mode, créé par MicroPort CRM, permet de minimiser la stimulation du ventricule pour les patients qui ont une maladie sinusale ou pour ceux qui font des BAV, leur laissant donc une chance d’avoir une contraction spontanée des ventricules. Cela permet donc de préserver le muscle cardiaque. Puisque normalement, l’activation du VD commence avec une dépolarisation du septum interventriculaire. Cependant, lors d’une stimulation artificielle, le VD commencera sa dépolarisation à un autre endroit, ce qui peut être délétère pour le ventricule et donc conduire à une désynchronisation entre les deux ventricules.
- Surveillance de l’apnée du sommeil (Sleep Apnea Monitoring = SAM) : Un moniteur pour l’apnée du sommeil est présent dans le dispositif. L’apnée du sommeil est une maladie qui est sous détectée, de ce fait avec cet algorithme, durant la nuit le dispositif peut suspecter une apnée du sommeil et envoyer une alerte.
- AutoMRI : est un mode automatique qui permet de rendre, maintenant, les différents examens IRM beaucoup plus faciles et sûrs pour les malades porteurs d’un PM. En effet, lorsque ce mode est programmé par un cardiologue, il possède la capacité de paramétrer de façon automatique le dispositif lorsqu’il détecte qu’il est dans un champ magnétique et cela dans le but d’assurer la sécurité du porteur.
- Double capteur : fabriqué afin de moduler physiologiquement un rythme du cœur, en fonction de l’activité du porteur, en associant deux capteurs d’asservissement (R) : accéléromètre et ventilation minute. Ce mode a été conçu pour des patients atteints d’incompétences chronotropes.
- Surveillance à distance : cette fonctionnalité permet au patient d’être surveillé et suivi à distance, de façon à fournir des alertes si besoin et des rapports détaillés des enregistrements du dispositif.
L’ensemble de ces fonctionnalités sont utilisées chaque jour par l’IA CRM lors des implantations ou des consultations de suivis, il est donc essentiel pour lui de les maîtriser.
b) Défibrillateur : Traitement de la tachycardie
Il est recommandé, pour les patients de 60 - 70 ans ayant un rythme rapide (tachycardie), souffrant de rythmes cardiaques potentiellement mortels (FV) et risquant de faire un arrêt cardiaque, d’avoir recours à un dispositif implantable. Ainsi, le traitement de la tachycardie se réalise par l’implantation d’un dispositif médical, nommé défibrillateur automatique implantable (DAI). Ce boitier possède la capacité de prodiguer deux types de thérapies afin de restaurer un rythme physiologique lors d’épisodes de tachycardie :
- ATP (Anti Tachycardia Pacing) : ce type de thérapie, souvent effectuer en premier, a pour but de fournir une stimulation plus rapide que la fréquence de TV de façon à récupérer un rythme physiologique du cœur en « cassant » le circuit électrique qui accélérait celui-ci.
- Chocs : ce type de thérapie, effectué lors de FV ou lors d’échecs d’ATP, consiste à délivrer un ou plusieurs chocs électriques d’énergies variables ou non (en fonction du choix du médecin) afin de briser le système électrique chaotique, permettant ainsi de faire un « reset » des cellules musculaires cardiaques.
Ainsi, les DAI enregistrent l’activité électrique du cœur et traitent les troubles du rythme ventriculaire dangereux par des ATP ou des chocs électriques [14].
MicroPort CRM a récemment conçu un défibrillateur automatique implantable (DAI) nommé ULYS (Figure 10). Ce DM à la pointe de la technologie est disponible en simple chambre (SR) et en double chambre (DR) et a désormais une durée de vie plus longue que les dispositifs distribués par les concurrents. En effet, la longévité pour les DAI simple chambre peut durer jusqu’à 14,7 ans. De plus, il possède un volume de petite taille pour un DAI de 31 cm3 ce qui est pleinement accepté par les praticiens et les malades. Les DAI disposent des mêmes fonctionnalités qu’un pacemaker dans la gestion et le traitement de la bradycardie et de la détection de fibrillation atriale [38].

Figure 10 : Défibrillateur automatique implantable ULYS [38]
A la différence d’un pacemaker, un DAI va disposer en plus de zones de thérapies et d’algorithmes afin de traiter au mieux les différents types de tachycardie. MicroPort CRM a donc conçu un algorithme physiologique nommé PARAD +, qui a la capacité de discriminer les différentes origines des arythmies, soit ventriculaire, soit supraventriculaire, dans le but de réduire au maximum les thérapies jugées inutiles et inappropriées.
En effet, l’algorithme permet de ne pas traiter les tachycardies supraventriculaires (non traitable par des ATP ou des chocs). Les DAI de MicroPort possède aussi le mode BTO qui est un mode qui permet de chevaucher le traitement de la bradycardie et de la tachycardie en même temps. C’est-à-dire, que le DAI a la capacité de prendre en charge l’exercice physique du malade atteint d’incompétence chronotrope, donc d’accélérer son rythme, et en même temps il a la capacité de détecter une TV lente du patient [38].
c) CRT : Traitement de l’insuffisance cardiaque
Il est recommandé, pour les patients de 60 - 70 ans possédant une dysfonction systolique sévère, FEVG < 35 %, avec une insuffisance cardiaque, situé dans la classe NYHA de II à IV, et ayant une conduction intra-ventriculaire qui est longue (QRS > 120 ms), d’avoir recours à une thérapie de resynchronisation.
e traitement de l’insuffisance cardiaque se réalise donc par l’implantation d’un boitier qui est un dispositif médical implantable actif, nommé CRT (Cardiac Resynchronization Therapy). C’est un dispositif qui permet de resynchroniser les deux ventricules ensemble de façon à ce que la fraction d’éjection du patient augmente jusqu’à atteindre une valeur acceptable pour qu’il y ait une augmentation de la contractilité du VG. Pour cela, il est donc nécessaire de pouvoir stimuler le ventricule droit mais aussi le ventricule gauche, ainsi ce type de dispositif est un triple chambre, caractérisé par une sonde à l’intérieur de l’OD (sonde verte de la figure 11), une sonde à l’intérieur du VD (sonde jaune de la figure 11) et aussi une sonde dans la veine coronaire antérolatérale qui rejoint donc la surface du VG (sonde bleu de la figure 11)[39]. Un CRT, en plus d’avoir la fonction de resynchroniser le cœur du patient possède soit les fonctionnalités d’un défibrillateur (CRT-D) soit celles d’un pacemaker (CRT-P).
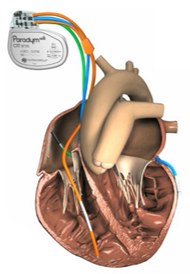
Figure 11 : Position des sondes d'un CRT dans le cœur [12]
MicroPort CRM a récemment conçu un CRT nommé GALI 4LV SONR (Figure 12). Ce DM à la pointe de la technologie permet de réduire de 35% les risques d’hospitalisation pour un cas d’insuffisance cardiaque, pour des patients qui sont optimisés avec une sonde SonR [39]. La longévité pour les CRT-D peut durer jusqu’à 10,9 ans. Il dispose des mêmes fonctionnalités qu’un DAI dans la gestion et le traitement de la bradycardie et de la tachycardie [39]. De plus, la sonde allant dans le VG possède un mode de stimulation sur plusieurs points (Multipoint Pacing) qui permet de capturer une zone nettement plus large du VG,

Figure 12 : CRT - GALI 4LV SONR [39]
Pour information, la sonde VG n’est pas directement implantée dans le ventricule gauche car aux vus des fortes pressions dans le VG celle-ci ne resterait pas fixée dans la cavité.
2. Principe de détection et de stimulation des dispositifs dans le traitement des arythmies
L’ensemble des différents dispositifs médicaux implantables actifs (PM, DAI et CRT) exploitent la fonctionnalité de détection, afin qu’un traitement efficace des différents troubles du rythme soit réalisé, par une thérapie de stimulation précise. Ces deux fonctionnalités, sont possibles grâce à des sondes et ont pour objectif de gérer au mieux les nombreuses pathologies.
Le principe de détection dans le traitement des arythmies est d’analyser le signal électrique du cœur et de fournir, par le dispositif, la réponse la plus appropriée. De ce fait, l’algorithme va constamment analyser et distinguer l’ensemble des évènements qu’il perçoit en utilisant des marqueurs. En fonction de ceux-ci et donc des événements, la réponse de l’algorithme s’adaptera et stimulera le cœur pour qu’il fonctionne de manière optimale. Pour discriminer les différents évènements, l’algorithme utilise deux critères que sont l’amplitude et la fréquence du signal détecté. La détection peut se faire de façon unipolaire (expliqué plus bas). Cependant elle présente des désavantages : elle peut conduire à la détection d’interférence provenant de l’extérieur du cœur tel que des myopotentiels ou tout simplement une écoute croisée (détection des signaux ventriculaire par la sonde atriale). Pour l’ensemble de ces raisons, ce type de détection est rarement utilisé, cela dépend vraiment du patient et de l’emplacement de la sonde. La détection bipolaire, quant à elle, est utilisée quotidiennement, en s’affranchissant des inconvénients cités [12].
Le principe de la thérapie de stimulation dans le traitement des arythmies est de stimuler le cœur du patient lorsque celui-ci ne se contracte pas. Cependant, stimuler quotidiennement le cœur du patient dépense énormément la batterie des dispositifs. Il est donc nécessaire de limiter au maximum l’énergie qui est fournis au cœur pour le contracter. Il faut donc trouver un équilibre entre la durée d’impulsion (ms) et la tension de sortie (V) de stimulation utilisée mais aussi avec le risque qui est encouru par le patient. Ces paramètres peuvent changer en fonction de la position et de l’état de la sonde, il est donc essentiel de prendre en considération ces facteurs et de savoir correctement régler les valeurs de sortie de stimulation afin que le traitement soit le plus optimal possible [12].
Les sondes de stimulation sont constituées de 3 parties : un connecteur fixé au dispositif, un corps de sonde qui est le conducteur de la stimulation et de la détection (et du choc électrique), et d’une ou deux électrodes (une électrode à l’extrémité et une bague) distale qui possèdent la capacité de détecter et de stimuler le muscle cardiaque. En fonction du nombre d’électrodes la sonde est soit unipolaire soit bipolaire (ou quadripolaire) ce qui conditionne le mode de stimulation et de détection [12].
Pour ce qui est la stimulation/détection unipolaire du myocarde (Figure 13), elle se fait entre l’électrode située à l’extrémité de la sonde (anode -) et le dispositif implanté (cathode +), cela forme donc un vecteur de stimulation/détection entre ces deux structures. Ce type de stimulation se voit plus aisément sur un ECG puisque des spikes (impulsion électrique) apparaissent devant les différentes ondes.
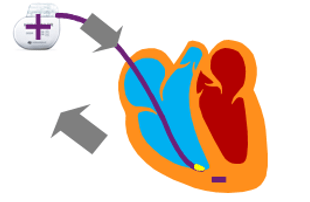
Figure 13 : Stimulation/ Détection unipolaire [12]
Cependant, comme énoncé précédemment, la stimulation unipolaire peut entrainer un risque de stimulation du muscle pectoral, certes non dangereux pour le malade, mais dangereux si à l’inverse la contraction du muscle pectoral est détectée ce qui aura des conséquences dramatiques puisque l’appareil sera leurré. Il détectera une contraction du muscle pectoral et non une contraction du cœur ce qui peut inhiber les thérapies de stimulation du cœur ou tromper des thérapies de tachycardies.
Pour ce qui est de la stimulation/détection bipolaire du myocarde (Figure 14), elle se fait entre les 2 électrodes distales de la sonde, plus particulièrement entre celle à l’extrémité de la sonde (anode -) et celle plus proche nommée bague (cathode +). Cela forme donc un vecteur de stimulation/détection entre ces deux structures. Avec ce type de sonde, il n’y aura pas de stimulation du muscle pectoral, cependant il sera plus complexe de visualiser les « spikes » à l’ECG.
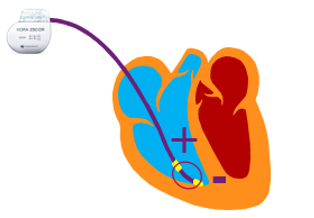
Figure 14 : Stimulation/ Détection bipolaire [12]
Il existe aussi un type de stimulation quadripolaire du myocarde, utilisé pour les thérapies de resynchronisation (CRT). En effet, ce type de stimulation permet d’avoir un plus large choix de vecteurs de stimulation.
De plus, il existe une codification internationale (NASPE/BPEG), composée de 3 à 4 lettres successives, qui permet de définir les différents modes de stimulation qui peuvent être programmés dans les différents dispositifs en fonction du nombre de cavité qu’ils stimulent/détectent (simple chambre, double chambre ou triple chambre) ou des différentes arythmies (Tableau 3) [12].
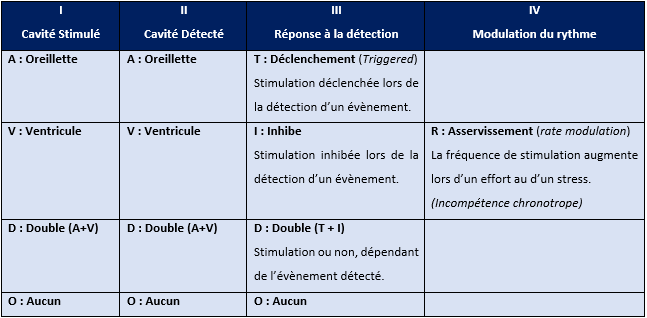
Tableau 3 : Explication des différents modes de stimulations (Source : auteure)
La 4ème lettre n’est pas obligatoire, ce mode R est ajouté pour les patients ayant une insuffisance chronotrope. Le dispositif va donc pouvoir, par la stimulation, augmenter puis diminuer la fréquence cardiaque en fonction de l’effort ou du stress du patient.
Les différents modes de stimulations sont à maîtriser parfaitement par l’ingénieur d’application CRM (Voir Annexe 1).
3. La télé cardiologie au service d’un suivis médical optimisé
Les nouveaux produits implantables (PM, DAI et CRT), conçu par MicroPort CRM, peuvent être connectés quotidiennement à distance aux médecins. Ils sont équipés d’une puce Bluetooth à faible consommation d’énergie, et sont suivis à distance, via à un transmetteur domestique sans fil qui utilise la 4G, sans que les patients aient besoin de retourner à l’hôpital. Ainsi, MicroPort CRM répond aux défis de notre époque [12].
Ce système de suivi clinique à distance est accessible, automatique, et facilite fortement les suivis, par un gain de temps, pour le cardiologue rythmologue qui a implanté le dispositif et pour le patient. Cela permet donc au médecin de réaliser une consultation du fonctionnement du dispositif implanté à distance, via un site internet sécurisé. Il peut ainsi analyser les pourcentages de stimulation et de détection des cavités, vérifier l’état des sondes et principalement vérifier si le patient fait des arythmies ou non, sans que celui-ci ait besoin de se déplacer dans un centre de cardiologie [40].
Si nécessaire, il peut utiliser le transmetteur pour adapter les traitements. Cependant, il est bon de rappeler que ce n’est en aucun cas un dispositif d’urgence [41].
Un transmetteur est conditionné pour communiquer avec le dispositif implanté du patient et pour transmettre l’ensemble des données récoltées, sous la forme d’un rapport, au centre qui suit le patient qui a été implanté, régulièrement, et de façon planifiée (le soir). Ces données concernent principalement le niveau de la pile du dispositif, l’état des sondes qui font le lien entre le dispositif et le cœur du patient, et d’éventuels troubles du rythme cardiaque (TV, FV) qui ont été détectés et traités (ou échec de traitement). Ainsi, s’il y a le moindre problème, le médecin pourra le savoir grâce à des alertes transmises, qui ont été détectées de façon automatique par le dispositif implanté selon les différents paramètres qui ont été définis à l’implantation par le médecin. Il pourra de ce fait, contacter le patient pour convenir d’une consultation en urgence de façon à ce que celui-ci est toujours un traitement et un suivi optimal [41].
MicroPort CRM, propose deux types de transmetteurs domestiques (Figure 15) :
- SmartView Connect : est un dispositif de suivi à distance afin de veiller sur l’ensemble des paramètres du stimulateur cardiaque qui a été implanté.
- SmartView Home Monitor : est un dispositif de suivi à distance afin de veiller sur l’ensemble des paramètres du défibrillateur automatique qui a été implanté.

Figure 15 : Transmetteur domestique : SmartView Connect (gauche) et SMARTVIEW Home Monitor (droite) [42]
III. Dispositifs de management du rythme cardiaque : les missions d’un Ingénieur d’Application CRM au sein d’un établissement de santé
Toutes ces connaissances techniques, précédemment exposées, sont à maitriser par un ingénieur d’application (IA) CRM. Il exerce avec précision et professionnalisme dans le domaine de la santé et plus particulièrement dans la cardiologie et rythmologie.
Relié à un Directeur Régional, un IA est donc formé théoriquement puis accompagné au sein des différents établissements de santé dans le but qu’il devienne un support technique, clinique et un point de contact privilégié des médecins, de l’équipe paramédicale mais aussi des patients. Pour cela il doit être accrédité, grâce à des formations théoriques en anglais de 4 semaines, et pratiques en salle d’opération, à valider, sur les produits de MicroPort CRM et les différents troubles du rythme cardiaque.
Suite à l’obtention de ses quatre accréditations, il pourra donc intervenir en toute autonomie lors des procédures de pose de stimulateur cardiaque, défibrillateur automatique implantable ou CRT au sein d’un établissement de santé.
C’est donc un spécialiste, un expert qui maîtrise toutes les complexités technologiques, techniques et cliniques se rapportant à une gamme de dispositifs médicaux implantables actifs, qui permettent de gérer les troubles du rythme. C’est en alliant toutes ces compétences qu’il peut ainsi assurer un soutien sans faille lors de ces interventions sur le terrain auprès du corps médical. L’IA est donc amené à travailler en étroite collaboration avec les médecins, l’équipe paramédicale et les patients.
L’ingénieur d’application doit disposer de qualités indispensables telles que l’adaptation à toutes situations, la pédagogie et l’observation afin d’être prêt à n’importe quelles épreuves. Il se déplace au sein des différents établissements de santé pour assister les médecins lors des implantations au bloc opératoire et lors des consultations à l’hôpital ou en cabinet pour assurer un ajustement optimal des dispositifs. De plus, c’est aussi lui qui assure la formation continue des médecins et de l’équipe paramédicale à l’utilisation et au fonctionnement de nouveau produit. Il est donc primordial pour lui de comprendre et de maitriser parfaitement l’ensemble des arythmies, des algorithmes et des modes de gestion des troubles du rythme ainsi que tous les temps opératoires des différentes procédures d’implantations des nombreux dispositifs. De plus, il doit connaître l’ensemble des erreurs de manipulation récurrentes de façon à reconnaitre l’évènement et donc anticiper en formant les médecins sur ces erreurs. Ainsi, l’IA possède une grande responsabilité lors des implantations et des consultations puisqu’il sera sollicité quotidiennement sur ces connaissances afin de conseiller le médecin lors de cas complexes de patients ou, sur demande, résoudre un problème technique ou clarifier le fonctionnement d’un algorithme. Pour finir, l’IA en salle d’opération peut contribuer à une réelle amélioration continue de l’ensemble des produits proposés par MicroPort CRM et des programmateurs en transmettant les informations les plus importantes aux ingénieurs commerciaux.
De plus, il dispose de différentes missions supplémentaires qui permettent le bon fonctionnement des nombreux dispositifs. Il peut aussi être amené à avoir un rôle de support technique dans la pose d’holter et dans la télé cardiologie. La mission d’un IA CRM est de s'assurer aussi que les produits de MicroPort CRM soient utilisés correctement et de faire l’interface avec les différents ingénieurs commerciaux de sa région, l’équipe marketing France ainsi que les différents départements de l'entreprise
A. La mission de l’Ingénieur d’Application lors d’une implantation d’un dispositif cardiaque implantable
La première étape dans le suivi d’un malade, pour un IA CRM chez MicroPort CRM, consiste à implanter un dispositif médical dans une salle d’opération. Lors du début de cette première étape, le médecin choisira parmi les différents produits existants, tels qu’un stimulateur cardiaque, défibrillateur automatique implantable ou un CRT, le modèle le plus approprié (Simple, double ou triple chambre) pour traiter le ou les troubles du rythme du patient.
L'IA CRM sera un support technique et clinique la plupart du temps lors d’implantations de DAI et surtout de CRT-D, qui sont des interventions très délicates, et rarement durant des implantations de stimulateurs cardiaques car, à l'exception du stimulateur cardiaque triple chambre (CRT-P), cette implantation n'introduit pas de complexité particulière.
1. Présentation du matériel nécessaire pour l’implantation de DAI
Lors de chaque intervention il est nécessaire, pour l’IA, de commencer à préparer le matériel qui va être implanté tel que les différentes sondes et le boitier (MicroPort CRM) demandé par le cardiologue stimuliste. Il existe plusieurs types de sondes, que l’IA doit connaitre, en fonction de leurs polarités, de leurs fixations dans la cavité et de leurs types de connexion :
- Type de polarité : Unipolaire ou bipolaire (voir quadripolaire)
- Type de fixation (Figure 16)[43] :
- Passive, aussi nommée à barbe, qui se fixe dans la zone fibrotique de l’oreillette ou du ventricule (Sonde XFine chez MicroPort CRM).
- Active, aussi nommée à vis ou vis rétractable, qui se fixe dans le myocarde de la cavité dans laquelle elle est (Sonde Vega ou SonR chez MicroPort CRM
- Type de connexion :
- IS-1 ou IS-4 : sont des sondes de stimulation bipolaire (IS-1) et quadripolaire (IS-4) à fixation active ou passive.
- DF-1 ou DF-4 : sont des sondes de défibrillation, à fixation active ou passive qui vont conduire les thérapies anti-tachycardiques au patient. La sonde DF-1 possède 3 connecteurs (stimulation, défibrillation VD et VCS) tandis que la sonde DF-4 possède qu’un seul connecteur.

Figure 16 : Fixations passive (haut) ou active (bas) (Source auteure)
Concernant le boitier, comme expliqué précédemment, il existe des : simple chambre, double chambre ou triple chambre. Cependant ils différent aussi en fonction de leurs connexions, l’IA doit donc faire attention au type de connexion de sondes qui sont inscrites sur le boitier. Si le médecin choisit un double chambre, le plus souvent, les connexions peuvent être IS-1, pour stimuler la cavité atriale droite (RA en anglais), et DF4, pour pouvoir prodiguer des thérapies dans la cavité ventriculaire droite (RV en anglais) (Figure 17).
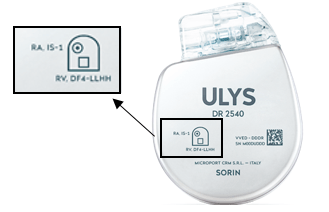
Figure 17 : Connexion DAI double chambre (Source : auteure)
Ainsi, l’ensemble du matériel implantable rapporté par l’IA doit être correctement vérifié en fonction des demandes du médecin tels que la date de non-conformité de l’ensemble du matériel implantable.
Une fois que l’ensemble du matériel est préparé l’IA doit se munir du programmateur MicroPort CRM qui est affilié au centre. Ce programmateur a été conçu uniquement pour les boitiers implantables de MicroPort CRM, il est donc impossible d’interroger nos boitiers avec un autre programmateur d’une marque concurrente. MicroPort CRM en dispose deux, un plus récent, la Smart Touch, et un plus ancien, l’Orchestra plus. Ce programmateur lui permettra dans un premier temps d’interroger le DAI sélectionné à l’aide d’une tête de télémétrie et ensuite de le programmer à distance à l’aide d’une antenne RF (Figure 18) [42], [44].

Figure 18 : Programmateur de MicroPort CRM : La Smart Touch avec sa tête de télémétrie (gauche) et son antenne RF (droite) (Source : auteure)
L’ensemble boitier, sondes et programmateur forment un système de défibrillation qui doit être complet pour le bon déroulement de l’implantation.
2. Procédure d’implantation pour des DAI
Les procédures d'implantation des défibrillateurs automatiques implantables sont un peu plus longues que celles pour les pacemakers. En effet, la programmation des DAI nécessite plus de temps puisqu'en plus de programmer dans la partie bradycardie les thérapies de stimulations, il est nécessaire de programmer dans la partie tachycardie des thérapies associées, ce qui est bien plus complexe. Lors de ces procédures, il est essentiel pour le médecin et l'IA CRM de bien contrôler l'intégrité des sondes, des connectiques et le fonctionnement optimal du boitier afin de pouvoir assurer complètement la sécurité du malade. De plus, l’IA assure la sécurité du patient tout au long de la procédure ; car c’est à lui qu’incombe la stimulation en cas de BAV, de pauses, ou de tachycardie. En effet, beaucoup de médecin s’attendent à ce que les IA soient leurs yeux sur l’ECG et le rythme du patient de façon à ce qu’ils soient réactifs lors d’un évènement.
Pour ce genre de procédure, l’IA CRM, est amené à travailler avec un grand nombre de cardiologues stimulistes, ce dernier doit donc s'adapter continuellement puisque chaque cardiologue possède des habitudes de travail différentes. Il est donc essentiel pour l'IA de connaitre les habitudes de chaque médecin et d’être très attentif pour que l'implantation remplisse ces objectifs.
En ce qui concerne la procédure dans sa globalité, elle commence, pour le cardiologue stimuliste, au moment de ponctionner ou disséquer une veine et donc de positionner les sondes dans les différentes cavités du cœur. Selon les différents besoins du malade, le médecin peut implanter soit un DAI simple chambre avec une seule sonde de défibrillation dans le VD, soit un DAI double chambre avec une sonde de défibrillation dans le VD et une sonde de stimulation dans l’OD. Une fois que le médecin a terminé de fixer ces sondes, il va devoir concevoir une poche naturelle sous la peau, le plus souvent au niveau pré-pectoral, afin de pouvoir y fixer le dispositif. Enfin, l’ensemble des sondes sont vissées au dispositif, puis rabattues derrière celui-ci lorsque le tout est positionné dans la poche. A ce moment le médecin attend la confirmation des différents tests réalisés par l’IA pour refermer l’incision [45].
En ce qui concerne la mission de l’IA CRM lors de cette procédure d’implantation, elle se décompose en trois grandes étapes. La première étape pour lui, en arrivant dans la salle d’opération, commence par vérifier que l’ensemble du matériel (sondes, dispositif, programmateur et ces périphériques) soit conforme. Puis, il va interroger le dispositif (encore dans sa boite) et réaliser en priorité un temps de charge des condensateurs à 42 Joules, qui doit impérativement être inférieur à 13 secondes afin de garantir un fonctionnement optimal des thérapies du dispositif.
Ce test est à utiliser avec parcimonie parce qu’il consomme de l’énergie. Ainsi, le rôle d’un IA CRM est de programmer le boitier de façon à ce qu’il consomme le moins d’énergie afin que la batterie du dispositif puisse durer le plus longtemps possible (Figure 19).
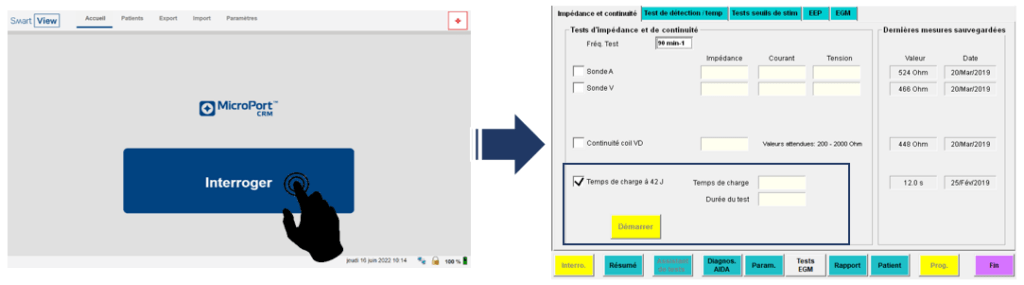
Figure 19 : Interrogation de l’appareil et test de temps de charge à 42J (Source : auteure)
Par la suite, l’IA va commencer par renseigner l’onglet « Patient » avec l’ensemble des informations qu’il aura récolté (Figure 20). Puis il commencera à préprogrammer les différents paramètres et mode de stimulation/détection, de bradycardie, et de tachycardie (ATP et chocs maximums à 42 Joules) en fonction des différentes habitudes des médecins mais aussi principalement en fonction de l‘indication du patient (Figure 20). Ainsi, il est donc essentiel pour l’IA de connaitre toutes les pathologies liées aux troubles du rythme afin d’adapter au mieux les paramètres et les modes à programmer. De plus, à ce jour, les médecins demandent à ce que les patients soient suivi à distance (télécardiologie), dans ce cas-là, l’IA programme aussi le suivis à distance.
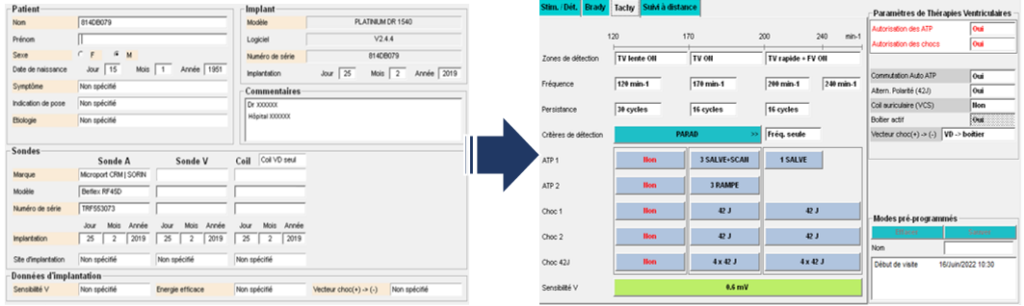
Figure 20 : Onglet patient puis onglet de thérapie de tachycardie à programmer (Source : auteure)
De plus, pendant toute la durée de l’intervention l’IA doit renseigner un carnet patient qui indique que le porteur dispose d’un DAI.
Pour la deuxième étape, l’IA CRM doit revêtir un gilet de plomb ainsi qu’un cache tyroïde puisque cette étape nécessite l’utilisation de Rayon X. Il doit faire preuve d’une grande observation durant l’implantation, puisqu’il doit savoir où le cardiologue stimuliste à positionner les différentes sondes dans les cavités, veiller à ce que la vis de chaque sonde est bien sortie et vérifier qu’elles sont bien fixées aux parois musculaires du cœur (Figure 21). En ce qui concerne la position des sondes, qui seront à compléter dans l’onglet et le carnet patient, IA CRM doit savoir si la sonde est positionnée dans l’auricule (endroit recommandé) ou dans un autre endroit de l’oreillette, pour cela, il doit regarder à la scopie si celle-ci fait un mouvement « d’essuie-glace ». Si c’est le cas alors la sonde est bien implantée dans l’auricule. Pour ce qui est du ventricule, il lui suffit de regarder à la scopie si la sonde est par exemple implantée au niveau du septum du ventricule ou au niveau de l’apex de celui-ci. Enfin, pour ce qui est de savoir si la sonde VD est bien positionnée dans le ventricule et pas dans l’oreillette par exemple, il suffit d’observer des petits sauts au niveau du corps de sonde.
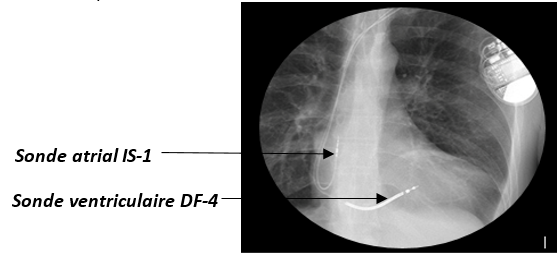
Figure 21 : Position des sondes IS-1 et DF-4 d'un DAI dans le cœur (Source : auteure)
A chaque sonde fixée par le médecin, l’IA CRM va tester leur emplacement selon la détection (mV), l’impédance (admis entre 200 et 2000 Ohms), et le seuil de stimulation des sondes (définis comme une tension électrique minimale appliquée, en volt, durant un temps donné, en millisecondes, pour générer une contraction musculaire cardiaque) avec un programmeur et analyseur de stimulation (PSA). En dehors de réaliser l’ensemble de ces mesures, l’IA CRM doit aussi prévenir le médecin lorsque les valeurs ne sont pas acceptables. Pendant ce temps-là, le médecin va fixer les sondes à la peau, de façon à ce qu’elles ne bougent plus, puis il va demander le boitier à implanter. Une fois le boitier donné, l’IA va récupérer l’étiquette avec le numéro de série de celui-ci et la coller dans le carnet patient. Lorsque le médecin, va s’apprêter à brancher les différentes sondes au boitier, l’ingénieur d’application doit être à ces cotés (à la tête du patient) afin de pouvoir conseiller ou vérifier la connexion des différentes sondes dans le boitier. C’est à ce moment-là, où le dispositif est branché dans la poche pré-pectoral, qu’il est nécessaire que l’IA effectue de nouveau les différents tests avec le programmateur de sa marque (Figure 22).

Figure 22 : Tests d'impédance et de continuité des sondes, de détection et de seuil de stimulation (Source : auteure)
Si les valeurs ne correspondent pas du tout aux valeurs du premier test ou qu’elles abordent des valeurs limites, ainsi plusieurs pistes sont à explorer :
- Soit la sonde s’est déplacée, dans ce cas il faut revérifier à la scopie si c’est vraiment le cas, il est nécessaire de la repositionner,
- Soit le médecin a interverti les sondes OD et VD dans les connecteurs du DAI, dans ce cas il suffit de les vérifier au niveau du boitier et de remettre les sondes dans leurs bons connecteurs,
- Soit dans le cas le plus extrême, une rupture de la sonde, qui peut être due au moment où le médecin a fixé les sondes à la peau, dans ce cas présent, le médecin doit intervenir à nouveau pour changer la sonde endommagée.
- Soit dans le cas le plus rare, un défaut au niveau du connecteur du DAI.
Attention, il est primordial de vérifier au plus vite ces valeurs avant que le médecin referme l’incision du patient, de façon à ce qu’il n’est pas besoin de ré intervenir et donc de perdre du temps.
Pour la dernière étape, l’IA CRM doit demander à activer les thérapies (choc et ATP) une fois que le médecin a refermé l’incision. Dès que celui-ci donne son accord, l’IA programme donc les thérapies et adapte au mieux les différentes programmations (bradycardie, tachycardie) en fonction des demandes du médecin. L’activation des thérapies se réalise vraiment à la fin de l’intervention, car si le cardiologue stimuliste emploie un bistouri électrique, l’outil pourrait être détecté par le dispositif ce qui engendrerait des artéfacts détectés (sur-détection) et ainsi induire des chocs inutiles et inappropriés. A la suite de cela l’IA va faire le bon de livraison du DAI implanté pour qu’il soit facturé et renouvelé. Pour finir, si l’IA n’a pas pu voir le patient avant l’intervention, il doit aussi aller le voir en salle de réveil afin de lui parler du transmetteur (télécardiologie). Pour information, l’ensemble des numéros de série qui ont été récupéré pendant cette intervention permet, principalement, d’avoir une traçabilité du matériel implanté dans le patient, mais cela permet aussi de perdurer cette traçabilité lors d’un changement de boitier.
Autrefois, l’induction, était constamment réalisée afin de vérifier la performance d’un DAI à détecter une tachycardie (TV) ou une fibrillation ventriculaire (FV) et à la traiter. A ce jours, l’induction n’est plus une pratique courante durant la première pose d’un DAI, mais elle peut être réalisée durant le changement d’un boitier afin de vérifier l’intégrité de la sonde de défibrillation. Ainsi, l’IA doit être à l’aise avec ce genre de pratique même si elle n’est pas souvent réalisée.
Lors d’un changement de boitier, comme le nom l’indique, seul le boitier est changé (à part si une sonde est défaillante, dans ce cas-là on rajoute une autre sonde similaire). L‘ensemble des sondes, quant à elles, sont testées par l’IA CRM avec le programmateur et le PSA, comme lors d’une première l’implantation, afin de vérifier l’intégrité des sondes et si le patient est dépendant de son dispositif (procédure délicate à ce moment-là puisque l’IA CRM devra être prêt à stimuler le cœur du patient avec le PSA à tout moment). Cependant, si le médecin à un doute sur une sonde de défibrillation, il peut demander à ce qu’une induction soit réalisée.
Ainsi, l’induction a pour but d’induire une FV ou une TV au malade afin de vérifier et de tester la performance du DAI. En plus de tester que le DAI soit apte à de délivrer un choc, le procédé permet également d’identifier l'énergie minimale pouvant stopper la FV du patient. Dans cette approche, le rôle de l’IA CRM est de programmer correctement et minutieusement le dispositif dans l’onglet EEP et d’induire une FV (par exemple) chez le patient. Pour cela, il existe deux méthodes bien distinctes :
- La stimulation à 30 Hz (Figure 23) : est un qui permet de réaliser une stimulation à 30 Hz, un rythme rapide, sur une courte durée ce qui va provoquer une soudaine accélération du rythme du cœur.
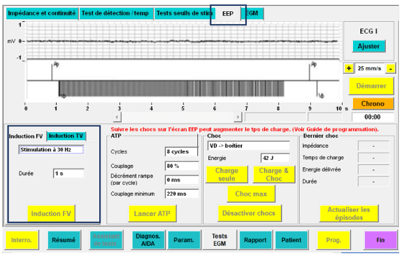
Figure 23 : Induction par la stimulation à 30 Hz (Source : auteure)
- Le choc sur l’onde T (Figure 24) : est un mode qui permet d’appliquer un choc électrique d’une petite intensité (0,8 Joules) sur l’onde T afin d’induire un trouble du rythme voir une FV. Une fois que le dispositif à détecter l’arythmie celui-ci délivre un choc pour rétablir la fonction cardiaque du patient (voir un deuxième s’il n’est pas efficace).
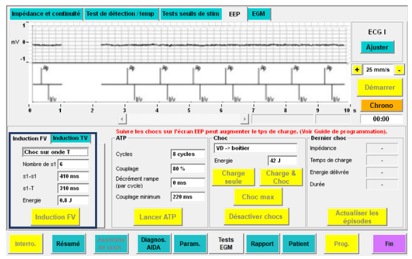
Figure 24 : Induction par un choc sur l'onde T (Source : auteure)
Cependant, pour ces deux méthodes, il est essentiel d’attendre que le malade syncope (ou sous anesthésie générale) avant d’administrer un choc puisqu’un choc est excessivement douloureux et traumatisant pour un patient, même s’il est inférieur à 10 Joules. Une fois le choc administrer, il est nécessaire d’observer si le rythme du patient revient à la normal ou si un deuxième est nécessaire. Ces différentes méthodes permettent donc de prouver la performance du DAI et de sa sonde de défibrillation à détecter et traiter une arythmie ventriculaire (FV).
Un bilan qui retrace les principales missions d’un ingénieur d’application CRM lors du déroulement d’une implantation au bloc opératoire est disponible en Annexe 2.
3. Procédure d’implantation pour des CRT
La mission de l’IA lors de la procédure d’implantation d’un CRT (Cardiac Resynchronization Therapy), ne diffère pas de celle des DAI. Cependant les médecins ont besoin du support technique et clinique de l’IA, principalement, durant cette intervention. En effet, l’IA va être sollicité pour conseiller le médecin lors du placement de la sonde VG puisque cette pratique est la plus compliquée de toutes les interventions (Figure 25). L’objectif est de passer la sonde VG dans le sinus coronaire afin de la positionner dans une veine antéro latérale (de préférence) située au niveau du VG. Pour cela il est nécessaire de cathétériser le sinus coronaire ce qui peut prendre plusieurs heures à le trouver, puis trouver une veine adéquate qui pourra recevoir la sonde. Ainsi, il est primordial pour l’IA de connaitre tous les types de sondes gauche (IS-1, IS-4) des différentes marques afin de pouvoir conseiller le médecin sur celle qui sera la plus adaptée à la forme et l’épaisseur de la veine ciblée. De plus, lors de cette intervention il est possible d’implanter une sonde auriculaire SonR qui possède la capacité de détecter les différents sons du cœur, de les analyser et donc de changer les paramètres du dispositif automatiquement de façon à fournir une resynchronisation cardiaque la plus optimale possible.

Figure 25 : Position de la sonde VG IS-4 d'un CRT-D dans le cœur (Source : auteure)
B. La mission de l’Ingénieur d’Application CRM lors de consultations de suivis
que leur boitier n’ait plus que quelque mois de batterie (< 6 mois). La fréquence des consultations de suivi peut augmenter lorsqu’une complication menace la sécurité du patient ou lorsque le dispositif se rapproche des indications de changement. Dans cette situation, le dispositif implanté doit donc être remplacé, et si les sondes sont toujours en bon état alors cette intervention sera, normalement, plus rapide que la première pose. Ces consultations peuvent être faites dans un cabinet de cardiologie avec un cardiologue de ville, pour des pacemakers, et à l’hôpital avec le cardiologue stimuliste, pour des pacemakers, des défibrillateurs et des CRT [45].
Lors d’une consultation de dispositifs MicroPort CRM, l’IA CRM travaille en binôme avec le cardiologue stimuliste du malade. Il assure donc un réel suivi des malades et assiste aux différentes consultations post opératoires. L’objectif de ces différentes consultations est de vérifier et de veiller à ce que le boitier du patient fonctionne correctement depuis l’implantation de celui-ci et pour les jours à venir. Ces consultations peuvent servir aussi lors d’un cas urgent, par exemple, lorsque l’appareil du patient a détecté des troubles du rythme grave qui ont pu nécessiter des thérapies. Dans ce genre de cas, le rôle de l’IA est de vérifier si le patient a réellement eu des troubles du rythme et dans quelle situation, ou si l’appareil a été leurré et qu’il a donc prodigué des thérapies inutiles et inappropriées. Enfin, lorsqu’un patient doit passer une IRM, il est indispensable que celui-ci passe par une consultation de façon à ce que le médecin, ou l’IA s’il est présent aussi, protège le dispositif mais aussi le patient en programmant un mode asynchrone sur l’appareil le temps que le patient passe son examen médical. Un fois l’IRM passée par le malade, avant qu’il ne rentre à son domicile, celui-ci doit revenir en consultation de façon à remettre les paramètres de base [44].
Par conséquent, l’ensemble des consultations post opératoire de suivis constituent aussi une partie non négligeable du champ d’action de l’IA CRM. Pendant ces consultations, les cardiologue stimuliste ou de ville, peuvent poser de nombreuses questions allant de questions techniques sur le fonctionnement des différents algorithmes du dispositif à des discussions sur les multiples méthodes pour programmer de façon optimum le dispositif implanté.
1. Echanges au près du patient et réalisation de tests
L’IA CRM est présent lors des consultations de suivis de dispositif de sa marque. Il sera donc en contact avec le médecin mais aussi le patient, qui lui, s’interroge assez souvent sur son dispositif implanté. Un échange entre le patient ainsi que le cardiologue et l’IA peut alors débuter juste avant le contrôle du boitier. Pour ce qui est du contrôle du dispositif, il se fera de la même manière que lors de l’implantation. Ainsi, il va commencer par interroger le dispositif, en posant la tête de télémétrie sur celui-ci (Figure 26).

Figure 26 : Interrogation du dispositif (Source : auteure)
La première action que l’IA va réaliser est de contrôler les valeurs d’impédance et de continuité de coil (de la sonde de défibrillation), de détection afin de voir s’il y a des réglages à changer et si le patient est dépendant de son dispositif ou non, et de seuil de stimulation des différentes sondes. Une fois ces contrôles effectués, l’IA aura une idée de leur caractère défectueux ou du déplacement de la sonde. Si c’est le cas, alors un changement de sonde est nécessaire. Une fois ces tests réalisés et enregistrés dans l’onglet résumé, il va annoncer au médecin les pourcentages de stimulation et de détection du dispositif, la longévité de la batterie en année ou en mois et les valeurs des tests qu’il vient de réaliser (Figure 27). De plus, sur l’onglet résumé, il est possible de voir l’ensemble des épisodes de troubles du rythme que l’appareil à enregistrer. Il est important durant cette étape pour l’IA de ne pas énoncer devant le patient lorsqu’il y a un problème. Pour cela, il doit seulement énoncer les différentes valeurs au médecin, qui lui, comprendra s’il y a un dysfonctionnement avec le dispositif. Ainsi, dans la situation où un problème est soulevé, l’objectif de l’IA CRM est alors de discuter avec le médecin des modifications de paramètre à réaliser afin d’optimiser au mieux le dispositif sans oublier de tenir compte du bénéfice/risque pour le malade.
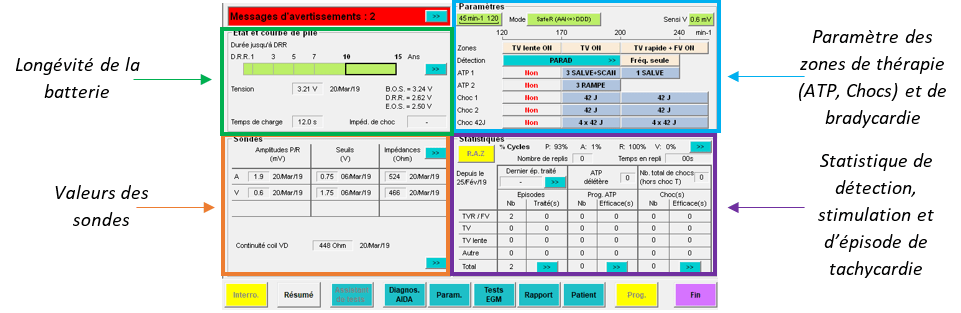
Figure 27 : Onglet de résumé de la programmation du dispositif et des valeurs des différents tests (Source : auteure)
A la suite de ces premiers tests et d’une vérification générale du boitier, l’IA doit vérifier plus en profondeur, avec le médecin, si les différents paramètres mis en place ont été efficaces et donc adaptés au patient. Pour cela, il devra analyser les mémoires du dispositif. De plus, il peut être intéressant de communiquer avec le patient, afin de voir avec lui s’il a ressenti des symptômes ces derniers mois tels que de la gêne, des palpitations, des étourdissements de la fatigue ou même fait une syncope. Ces informations permettront d’aiguiller les recherches dans les mémoires.
2. Analyse des mémoires du dispositif cardiaque
La mission primordiale, pour l’IA et médecin, lors des consultations de suivi est la vérification des mémoires, nommées AIDA (Automatic Interpretation for Diagnosis Assistance) chez MicroPort CRM. Ces mémoires regroupent l’ensemble des évènements (épisodes de BAV, TV, FV et autres) enregistrés qui sont apparus depuis l’implantation ou la précédente consultation. Ce qui a été enregistré est primordial pour le cardiologue, puisque ça lui permet de choisir le traitement le plus approprié pour le patient et de vérifier le bon fonctionnement du dispositif. Pour cela, IA CRM doit analyser l’ensemble des tracés qui sont enregistrés, de façon à confirmer ou infirmer les analyses du dispositif. Ainsi, il doit connaitre l’ensemble des différentes spécificités de chaque trouble du rythme pour pouvoir les reconnaître et dire au médecin si l’appareil a correctement fonctionné ou non. Il doit aussi parfaitement maîtriser l’ensemble des fonctionnalités de chaque dispositifs de façon à expliquer au médecin pourquoi, par exemple, l’appareil est passé d’un mode AAI à un mode DDD (mode SafeR). Il peut aussi proposer au médecin de mettre en place différents algorithmes tels que SAM, s’il est suspecté des troubles d’apnée du sommeil chez le patient, ou de changer différents paramètres en fonction des résultats des tests qui ont été réalisé.
De plus, en analysant les mémoires il est possible que l’IA observe sur un épisode, considérer comme de la FV, des interférences ou des artéfacts qui leurrent l’appareil, tels que du 50Hz, des myopotentiels, ou dans le pire des cas un défaut de conducteur sur une sonde (changement de sonde nécessaire). Lorsque ce genre d’évènements apparait ponctuellement et sur les sondes, il est donc important d’échanger avec le patient afin de savoir ce que celui-ci faisait pendant ces différents évènements. Ainsi, il est essentiel pour l’IA CRM de savoir faire la distinction entre un réel évènement de FV suivit d’un choc et des artéfacts (Figure 28).
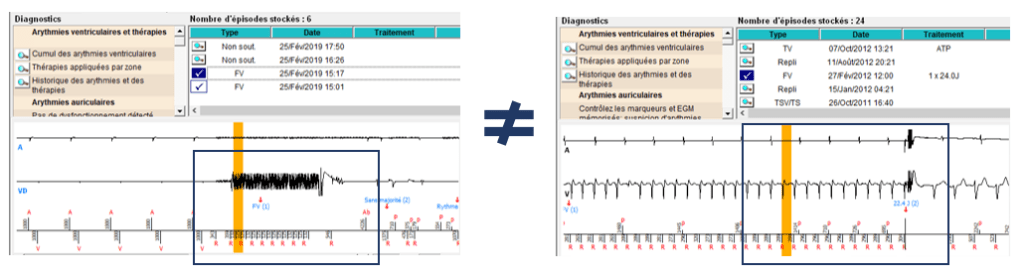
Figure 28 : Différence entre un épisode de FV dû à des artéfacts (gauche) et dû à une réelle FV (droite) (Source : auteure)
Enfin, l’ultime but pour l’IA sera de préserver au maximum la batterie du dispositif, en programmant les différents algorithmes de façon à ce qu’ils détectent et réagissent, avec un minimum d’énergie, de manière adaptée au rythme du malade afin d’éviter un changement précoce du dispositif. Cependant, aucun changement de paramètre n’est effectué sans l’accord du médecin.
3. Cas concrets d’une consultation d’un DAI double chambre
e Mardi 05 avril 2022, lors d’une consultation d’un patient, portant un DAI double chambre, en ouvrant la session il a été découvert dans l’onglet résumé différents épisodes de FV dont 32 non traités et 1 épisode traité par un choc (Figure 29). Pourtant, le patient indiquait que tout allait bien. Dans ce genre de cas, il est donc essentiel de comprendre l’origine de ces épisodes. C’est pour cela que différents tests et différentes observations sont réalisés.
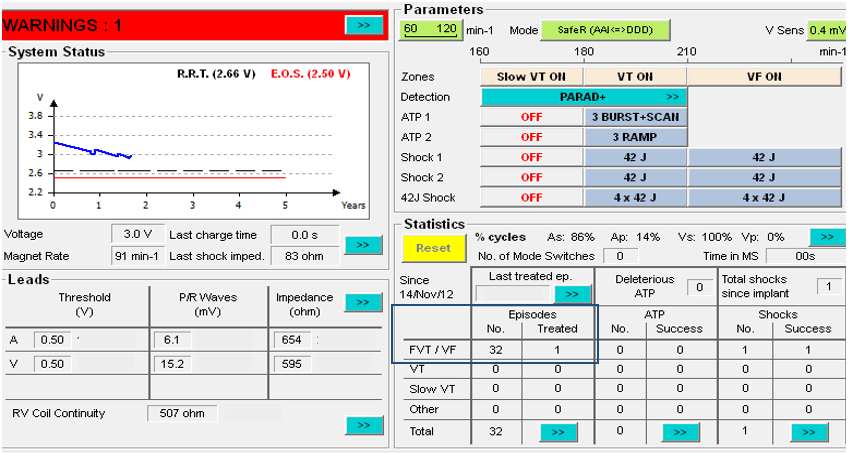
Figure 29 : Ecran résumé du patient (Source : auteure)
Les paramètres électriques des sondes, dont les tests d’impédances, de seuils et de détections sont tous apparus normaux. Suite à un grand nombre d’épisodes non traités, il est suspecté une sur-détection ventriculaire. De ce fait, il est nécessaire de vérifier la programmation des zones de fréquences de tachycardies. Après quoi, il faut vérifier dans les mémoires AIDA, les courbes et les histogrammes. En particulier celles de l’auto détection atrial et ventriculaire qui permet de donner des informations sur la détection des ondes P et R en fonction de la sensibilité programmée (Figure 30). Dans ces histogrammes, il est remarqué des ondes R proches de la valeur minimale de sensibilité durant des VT et des VF. Cela nous permet de continuer à suspecter une sur-détection ventriculaire.

Figure 30 : Histogrammes de sensibilités des ondes R (Source : auteure)
Afin de confirmer ces hypothèses il est essentiel d’ouvrir les différents épisodes de VF et de les analyser. Lors de l’observation de l’électrocardiogramme intracardiaque (EGM), il a été détecté des signaux qui n’évoquaient pas une activité électrique cardiaque en plus des signaux physiologiques. Il y a donc bien une sur-détection au niveau de la sonde ventriculaire et non une réelle tachycardie ou fibrillation ventriculaire (Figure 31). Le patient a donc reçu un choc inapproprié.
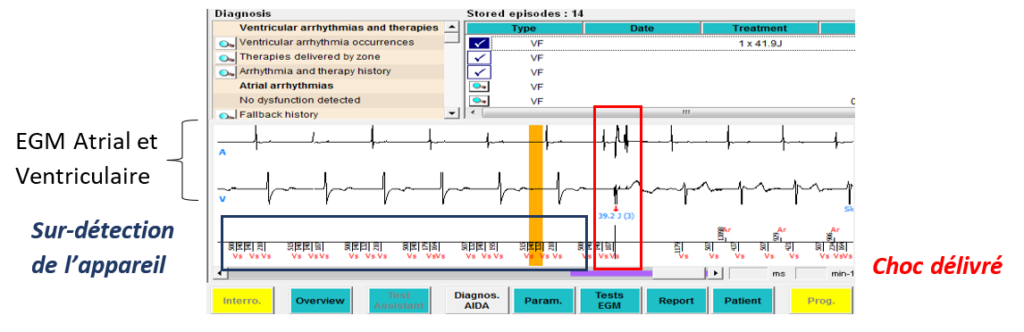
Figure 31 : Episode de Fibrillation Ventriculaire enregistré par le dispositif (Source : auteure)
Mais la question est pourquoi ? Pour répondre à cette question il faut demander au patient qu’est-ce qu’il était en train de faire durant ces jours où l’appareil a détecté quelque chose d’anormale ?
Le patient en question, était chez le kinésithérapeute durant ces jours avec des électrodes collées dans le dos. Cependant durant ses séances de kinésithérapies, ses stimulations ont été captées par la sonde ventriculaire et considérées comme un signal provenant du ventricule, causant ainsi un choc inapproprié. Suite à ces révélations et a une discussion avec le médecin il a été décidé de changer la valeur de la sensibilité et de l’augmenter en passant de 0,4mv à 0,6mv de façon à ce que l’appareil ne détecte plus les signaux en dessous de 0,6mV. De cette façon, si ce genre d’événements (la sur-détection) venaient à ré apparaitre, ils ne seraient pas traités. Il est aussi possible en plus de modifier certains paramètres du dispositif médical de façon à éviter d’autres chocs inappropriés tels que la persistance de l’évènement avant choc. De plus, le kinésithérapeute a été averti de ne pas réitérer cette pratique avec des patients portant un dispositif cardiaque implantable.
C. L’Ingénieur d’Application et ces missions supplémentaires
Outre le fait que l’IA doit être un bon support technique au bloc opératoire et en consultation afin d’assurer le réglage le plus optimal des dispositifs cardiaques implantables, il doit savoir faire preuve de pédagogie lors de la formation des médecins aux nouveaux produits par exemple. Il doit avoir un bon relationnel avec les médecins et le personnel paramédical tel que les infirmiers.ère, les anesthésistes et les pharmaciens.ennes pour une bonne entente lors des différentes procédures mais aussi parce que l’IA est l’image de sa société. En dehors des procédures d’implantation et de consultations, l’IA possède d’autres missions qui sont toutes aussi importantes.
1. Gestion des stocks et des mises à jour
La gestion des stocks, est essentielle, elle concerne les pacemakers, les défibrillateurs, les CRT, les sondes, les programmateurs et tout ce qui est en rapport avec celui-ci tels que la tête de télémétrie, son adaptateur et l’antenne de radiofréquence. Elle est réalisée dans les différents établissements de santé, aussi bien dans des centres hospitaliers, que des cliniques et même dans des cabinets de cardiologie. Elle est aussi réalisée sur le stock personnel de l’IA. Afin de gérer ces stocks un inventaire est réalisé dans le but de surveiller et maîtriser ce qui est disponible de ce qui ne l’est plus et d’agir en conséquence. De plus, l’IA est amené à réaliser des mises à jour sur l’ensemble des programmateurs de sa région afin de corriger certaines anomalies. Il est donc nécessaire que des mises à jour soient effectuées sur l’ensemble des programmateurs.
Il peut être aussi amené à tester et juger les mises à jour futures pour l’équipe de recherche et développement
2. Collaboration avec les autres départements de l’entreprise
L’Ingénieur d’application doit assurer le partage d’informations sur les différents produits de son domaine ainsi que sur les différentes problématiques techniques qui ont été rencontrées au bloc opératoire ou lors de consultations de suivis. Il est donc crucial pour lui d’être en étroite collaboration avec les équipes en marketing, pour les remontées d’informations et pour les formations continues du corps médical, surtout avec l’équipe de matériovigilance afin de transmettre toutes informations sur les produits défaillants et en connaître les causes, mais aussi avec le département de Recherche Clinique où l’IA devra prendre part à la mise en place des différentes études réalisées (Ex : Etudes sur les sondes).
3. Support technique dans la pose d’holter et pour la télé cardiologie
L’ingénieur d’application a également pour mission de s’occuper du support technique lors de la pose d’Holters non invasifs (SpiderFlash = enregistreurs d’évènements) dans les différents établissements de santé. L’IA pourra donner des conseils au médecin lors de diagnostics et d’analyses techniques des ECG des patients. L’IA est aussi sollicité sur des cas de télé cardiologie pour relayer le service de télé cardiologie de MicroPort CRM et les centres de télé cardiologie, ou pour donner des conseils techniques concernant des rapports de télé cardiologie au médecin.
IV. Bilan personnel et professionnel
A. Difficultés rencontrées
Durant ce stage de fin d’études, j’ai pu travailler en tant qu’Ingénieur d’Application (IA) en Management du Rythme Cardiaque (CRM). Il a été gratifiant pour moi de faire partie d’une entreprise mondiale humaine qui accorde la priorité aux patients. Cependant, j’ai été confronté à certaines problématiques qui ont nécessité une prise de recul essentiel afin de savoir les gérer.
L’une des principales difficultés à laquelle j’ai dû faire face, a été d’assimiler et maîtriser l’ensemble des troubles du rythme et les algorithmes des différents dispositifs médicaux. En effet, l’ensemble des différentes formations ont été très intenses durant 4 semaines et étaient dispensées en anglais. Ne connaissant rien au domaine de la rythmologie, cela a été une réelle épreuve que de réussir à assimiler 80% du programme en si peu de temps. J’ai dû faire preuve de détermination et de persévérance afin de réussir l’ensemble des formations et acquérir des connaissances solides ainsi que des compétences essentielles pour être certifiée et devenir un IA CRM. Une autre problématique que j’ai rencontré était liée à l’environnement au sein du bloc opératoire et à mes connaissances cliniques et techniques.
En effet, les cardiologues stimuliste sont des professionnels très pointilleux et exigeants, qui demandaient un certain niveau de connaissances et de maîtrise pour intervenir avec eux. Ce qui pouvait être très déstabilisant et impressionnant au début de mes premières implantations et consultations de suivi. Néanmoins, ma confiance en moi, mon autonomie, et ma proactivité dans ce domaine, m’ont permis d’acquérir les connaissances et compétences nécessaires pour mener à bien les différentes missions qui m’étaient confiées. De plus, il m’est arrivée par moments de me sentir déborder face aux différentes situations qui m’étaient encore jusqu’alors méconnues. En effet, au vu de ce milieu exigeant, mes collègues ont souhaité très rapidement que j’effectue un travail de qualité. Etant très proactive, rigoureuse et avec la volonté de réussir, j’ai su réagir en conséquence et m’adapter à cette expérience.
Ce stage a aussi imposé une certaine contrainte car il a demandé une disponibilité constante. En effet, notre agenda change quotidiennement, soit en raison d’annulations ou d’urgences qui s’ajoutent dans la journée. Il était donc nécessaire pour moi d’être constamment attentive et réactive vis-à-vis de la sollicitation de mes collègues. Mais aussi de savoir anticiper le moindre évènement et de m’adapter aux différents besoins des médecins et des patients. Ce qui n’a pas toujours été facile. Sans compter toutes ces difficultés auxquelles j’ai été confronté, la vie à Paris à également bouleverser mes habitudes. En effet, étant une bonne partie du temps en déplacement pour aller dans les différents établissements de santé, j’ai dû faire preuve d’une grande anticipation quant au trafic parisien. Ce qui au début de mon stage a été compliqué à gérer. Cependant, j’ai su m’adapter petit à petit à ce nouveau mode de vie et à réussir à gérer l’ensemble de mes déplacements.
Enfin, il a été compliqué pour moi d’allier mon travail en tant qu’étudiante et en tant que stagiaire Ingénieur d’Application au sein de MicroPort CRM. Mais avec beaucoup d’organisation j’ai su trouver un équilibre pour m’investir complètement à travers ces deux missions.
B. Apports du stage
Depuis le début de mon stage, l’ensemble des missions qui m’ont été confiées par mes collègues m’ont aidée à me développer tant professionnellement que personnellement. Il a été pour moi une réelle opportunité parce qu’il m’a permis de rejoindre une équipe solidaire, de découvrir un domaine fascinant, d’approfondir et de concrétiser mon projet professionnel. Ainsi, grâce à l’ensemble des équipes de formation, Marketing, d’Ingénieurs d’Applications et des responsables commerciaux de France, j’ai pu acquérir et perfectionner mes compétences en physiopathologie, en technicité (sur les produits de MicroPort CRM), en relationnel avec le personnel médicaux-soignant et les patients, et en langue anglaise.
Le domaine du CRM est un environnement riche et en évolution permanente. C’est pourquoi, l’adaptation est l’une des qualités primordiales qui doit être maîtrisée dans le monde du CRM. Car les découvertes évoluent constamment avec de nouvelles pratiques d’implantation et de nouveaux dispositifs médicaux possédant toujours plus de fonctionnalités. J’apprécie le métier d’IA et d’utiliser mes capacités d’adaptation par un discours et un comportement adapté en fonction de chaque interlocuteur que ce soit un collègue de l’entreprise, un médecin, un personnel paramédical ou un patient et de leur apporter des réponses à leurs questions. De plus, j’ai trouvé cela très gratifiant d’être impliquée dans les soins des patients souffrant de maladies cardiaques et en particulier de troubles de rythme. Cela m’a permis de prendre conscience de l’importance de ce métier et mon utilité en ce monde.
Après avoir été certifiée, j’ai commencé à exercer le métier en autonomie, et ainsi assister mes collègues. De plus, mes qualités sociales m’ont aidée à m’intégrer correctement à l’équipe Paris-Ouest ainsi qu’avec l’ensemble des employés de MicroPort CRM avec lesquelles j’ai eu l’opportunité d’échanger. Ma façon d’être ainsi que ma curiosité pour ce domaine qu’est la rythmologie m’ont aidé à réussir à établir un bon relationnel avec les médecins, les infirmières, les pharmaciens et surtout avec les patients.
Au total lors de mon stage, j’ai parcouru plus de 15 000 km sur ma région Paris-Ouest et sur les autres régions de France, en intervenant en binôme pour des implantations, des consultations de suivis, des changements de matériels, des mises à jour et des inventaires. De plus, j’ai effectué des missions dans les différentes régions de France avec mes collègues, IA comme responsables commerciaux, afin qu’ils puissent me transmettre leur différente façon de travailler. En voyageant à travers la France, j’ai pris conscience de l’importance d’être autonome et de la parfaite connaissance de la théorie pour une bonne application. C’est pourquoi la formation d’IA CRM dure minimum six mois afin d’être opérationnelle et experte en la matière. J’ai également vécu l’aspect solitaire de la profession lors des diverses interventions. Cependant, mes collègues m’ont toujours appris à rester en contact avec eux pour rester une équipe solidaire à l’écoute les uns des autres. A ce jour, je peux affirmer que j’ai la capacité d’effectuer des procédures d’implantations et des consultations de suivis de pacemaker en autonomie et bientôt celles de défibrillateurs automatiques implantables ainsi que de CRT.
Pour finir, ce stage de fin d’étude a été enrichissant. Cela m’a amené à conforter mon attrait pour le domaine de la cardiologie et particulièrement la rythmologie. J’ai eu la chance, dans le cadre de ce stage, de commencer à m’épanouir dans un métier qui me plait et me fascine de jour en jour. Ce contact quotidien avec le personnel médico-soignant et les patients est devenu pour moi important et gratifiant. C’est pour cela, que je suis convaincu d’avoir trouvé ma voie professionnelle grâce à ce stage.
Conclusion
L’humanité est confrontée aux nombreux arrêts cardiaques, à la réduction de la qualité de vie et au danger d’engendrer voire aggraver des pathologies concomitantes. Leur traitement est donc une priorité pour l’entreprise MicroPort CRM. Ainsi, l’ingénieur d’application CRM possèdent de nombreuses missions capitales dans la prise en charge des patients atteints de troubles du rythme. Il doit être en mesure de répondre correctement aux questions formulées lors des différentes implantations ainsi que lors de consultations de suivis. Au cours de ce stage, mon parcours scolaire a grandement facilité mon intégration chez MicroPort CRM. En effet, mes compétences en anatomie, physiopathologie et mon intérêt pour la cardiologie, en particulier la rythmologie, m’ont aidé à mener à bien ce stage. De plus, cela m’a permis de découvrir un milieu passionnant, de développer de nombreuses compétences à la fois cliniques et techniques et de devenir une experte dans la gestion des troubles du rythme. La rigueur, l’adaptabilité et le bon relationnel sont des qualités et compétences que j’ai acquis pour pouvoir mener à bien mon projet professionnel.
Participer à ce monde de la meilleure façon qui soit est une priorité pour moi. Je suis fière de mettre mes compétences acquises lors de mon parcours d’études et professionnel au service d’une entreprise novatrice et leader dans le soin de haute technologie médicale. C’est un honneur de contribuer à sauver et pérenniser des vies grâce à ce métier d’ingénieur d’application CRM.
Je suis impressionnée par les découvertes technologiques des dispositifs médicaux de précision et d’utilité vitale pour l’être humain. En effet, les défibrillateurs automatiques implantables sont d’une technicité si minutieuse et performante qu’ils m’offrent cette possibilité de participer à l’évolution de la médecine et de la vie. Cela confirme mon intérêt pour ce domaine d’activité professionnelle et ma volonté d’y poursuivre mon parcours.
Références bibliographiques
[1] S. Anys et al., « Mort subite, en quête d’une explication », Ann. Cardiol. Angéiologie, vol. 70, no 3, p. 129‑135, juin 2021, doi : 10.1016/j.ancard.2021.03.002.
[2] V. Waldmann et E. Marijon, « Troubles du rythme cardiaque : diagnostic et prise en charge », Rev. Médecine Interne, vol. 37, no 9, p. 608‑615, sept. 2016, doi : 10.1016/j.revmed.2015.12.032.
[3] W. Bougouin et al., « Characteristics and prognosis of sudden cardiac death in Greater Paris : population-based approach from the Paris Sudden Death Expertise Center (Paris-SDEC) », Intensive Care Med., vol. 40, no 6, p. 846‑854, juin 2014, doi : 10.1007/s00134-014-3252-5.
[4] R. Garcia, « Mort subite – Cardiopathie ischémique – Défibrillation cardiaque », These de doctorat, Poitiers, 2020. Consulté le : 18 juin 2022. [En ligne]. Disponible sur : https://www.theses.fr/2020POIT1402
[5] « L’OMS lève le voile sur les principales causes de mortalité et d’incapacité dans le monde : 2000-2019 », 9 décembre 2020. https://www.who.int/fr/news/item/09-12-2020-who-reveals-leading-causes-of-death-and-disability-worldwide-2000-2019 (consulté le 25 juin 2022).
[6] « History », Microport. https://microport.com/en/about-us/history (consulté le 18 juin 2022).
[7] « Purpose and Values », Microport. https://microport.com/en/about-us/purpose-and-values (consulté le 18 juin 2022).
[8] « Cardiac Rhythm Management », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management-home-page (consulté le 11 juin 2022).
[9] S. G. Priori et al., « 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death : The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by : Association for European Paediatric and Congenital Cardiology (AEPC) », Eur. Heart J., vol. 36, no 41, p. 2793‑2867, nov. 2015, doi : 10.1093/eurheartj/ehv316.
[10] « About Us | Microport ». https://microport.com/about-us# (consulté le 20 mai 2022).
[11] « Purpose and Values », Microport. https://microport.com/en/about-us/purpose-and-values (consulté le 11 juin 2022).
[12] « Home - Page d’accueil », MicroPort (Source interne), 2022. https://microportfra.sharepoint.com/SitePages/fr/Home.aspx (consulté le 24 juin 2022).
[13] Club ETI - Île de France, « MICROPORT CRM », Club ETI - Ile de france, 2021. https://www.clubeti-idf.fr/listing/microportcrm/ (consulté le 11 juin 2022).
[14] ResearchAndMarkets, « Global Implantable Cardioverter Defibrillators (Cardiovascular) Market Report 2022 Featuring Medtronic, Abbott Laboratories, Boston Scientific, Biotronik, & MicroPort Scientific », 16 mars 2022. https://www.businesswire.com/news/home/20220316005573/en/Global-Implantable-Cardioverter-Defibrillators-Cardiovascular-Market-Report-2022-Featuring-Medtronic-Abbott-Laboratories-Boston-Scientific-Biotronik-MicroPort-Scientific---ResearchAndMarkets.com (consulté le 24 juin 2022).
[15] Pierre M., « Cardiologie : Généralités sur le coeur, Rythme cardiaque, Structure Anatomique », Santé sur le Net, l’information médicale au cœur de votre santé, 14 octobre 2015. http://dev.ssn.fr/fiches-info/generalites-sur-le-coeur/ (consulté le 23 mai 2022).
[16] SANOFI, « La circulation sanguine », Agir Thrombose, agir sur la thrombose, 2021. https://www.agir-thrombose.fr/coeur-et-vaisseaux/circulation-sanguine (consulté le 24 juin 2022).
[17] E. Docteur Mervoyer, « Bases de la cardiologie », Université médicale virtuelle francophone, 2009. http://campus.cerimes.fr/semiologie-cardiologique/enseignement/cardiologie/site/html/2_2.html (consulté le 24 juin 2022).
[18] J. R. Hampton, L’ECG facile. 2015.
[19] Robinet S, Van Casteren L, Delcour A, Lancellotti P, « Les Troubles du Rythme Cardiaque sévères », 2018, Consulté le : 6 juin 2022. [En ligne]. Disponible sur : https://orbi.uliege.be/bitstream/2268/234388/1/20180506_07.pdf
[20] Fédération Française de Cardiologie, « L’activité électrique du cœur », FFC, 23 août 2016. https://fedecardio.org/je-m-informe/l-activite-electrique-du-coeur/ (consulté le 23 mai 2022).
[21] « Tout savoir sur les troubles du rythme cardiaque », Fondation pour la Recherche Médicale. https://www.frm.org/recherches-maladies-cardiovasculaires/troubles-du-rythme-cardiaque/focus-sur-les-troubles-du-rythme-cardiaque (consulté le 11 juin 2022).
[22] « Symptômes, diagnostic et évolution des troubles du rythme cardiaque », L’assurance Maladie, Ameli, 11 février 2022. https://www.ameli.fr/moselle/assure/sante/themes/trouble-rythme-cardiaque/symptomes-diagnostic-evolution (consulté le 11 juin 2022).
[23] « SPIDERFLASH », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management/arrhythmia-assessment/spiderflash (consulté le 11 juin 2022).
[24] P. Taboulet, « Bloc AV 1er degré », e-cardiogram, 14 novembre 2020. https://www.e-cardiogram.com/bloc-av-1er-degre/ (consulté le 9 juin 2022).
[25] P. Taboulet, « Bloc AV 2e degré. Mobitz 1 », e-cardiogram, 14 novembre 2020. https://www.e-cardiogram.com/bloc-av-2eme-degre-2-mobitz-i/ (consulté le 9 juin 2022).
[26] P. Taboulet, « Bloc AV 2e degré. Mobitz 2 », e-cardiogram, 15 janvier 2022. https://www.e-cardiogram.com/bloc-av-2eme-degre-3-mobitz-ii/ (consulté le 9 juin 2022).
[27] P. Taboulet, « Bloc AV 3ème degré », e-cardiogram, 14 novembre 2020. https://www.e-cardiogram.com/bloc-av-3eme-degre/ (consulté le 9 juin 2022).
[28] P. Taboulet, « Aberration ventriculaire (BBD ou BBG) », e-cardiogram, 3 novembre 2021. https://www.e-cardiogram.com/aberration-ventriculaire-1/ (consulté le 10 juin 2022).
[29] P. Taboulet, « Bloc de branche : Généralités », e-cardiogram, 28 mars 2022. https://www.e-cardiogram.com/bloc-de-branche-1-generalites/ (consulté le 10 juin 2022).
[30] X. COPIE, G. LASCAULT, O. PAZIAUD, O. PIOT, « Incompétence chronotrope », 2010, Consulté le : 8 juin 2022. [En ligne]. Disponible sur : https://www.realites-cardiologiques.com/wp-content/uploads/sites/2/2010/11/0828.pdf
[31] A. Gabet, E. Chatignoux, C. Grave, Y. Béjot, et V. Olié, « Épidémiologie de la fibrillation atriale en France. Incidence des patients nouvellement traités par un anticoagulant oral, évolutions temporelles et disparités territoriales », SPF, 7 avril 2021. https://www.santepubliquefrance.fr/import/epidemiologie-de-la-fibrillation-atriale-en-france.-incidence-des-patients-nouvellement-traites-par-un-anticoagulant-oral-evolutions-temporelles-e (consulté le 25 juin 2022).
[32] L. Dipesh, G. Amandeep, et J. Mandar, « Ventricular Fibrillation », NIH, 11 août 2021. https://www.ncbi.nlm.nih.gov/books/NBK537120/ (consulté le 25 juin 2022).
[33] « Insuffisance cardiaque », Santé publique France, juin 2019. https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-cardiovasculaires-et-accident-vasculaire-cerebral/insuffisance-cardiaque (consulté le 24 juin 2022).
[34] « Insuffisance cardiaque : des recherches novatrices », Institut Pasteur de Lille, 2019. https://pasteur-lille.fr/actualites/dossiers/recherche-insuffisance-cardiaque/ (consulté le 25 juin 2022).
[35] M. Tadic et al., « Right ventricular strain in heart failure : Clinical perspective », Arch. Cardiovasc. Dis., vol. 110, no 10, p. 562‑571, oct. 2017, doi : 10.1016/j.acvd.2017.05.002.
[36] « Pacemakers », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management/pacemakers (consulté le 11 juin 2022).
[37] « ALIZEATM », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management/pacemakers/alizea (consulté le 12 juin 2022).
[38] MicroPort, « UlysTM UNCOMPROMIZED EXCELLENCE ». mars 2022. Consulté le : 12 juin 2022. [En ligne]. Disponible sur : https://microport.com/assets/blog/brochure_def_ulys_mri_range_en_eu_digital.pdf
[39] MicroPort, « Gali SonRTM EXCELLENCE, REDEFINED ». mars 2022. Consulté le : 12 juin 2022. [En ligne]. Disponible sur : https://microport.com/assets/blog/brochure_def_gali_sonr_mri_range_en_eu_digital.pdf
[40] Y. Nassima, « Suivi par télésurveillance des patients porteurs d’un moniteur cardiaque implantable », p. 134, mars 2021.
[41] « SmartView Connect », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management/patient-follow-up/smartview-connect (consulté le 11 juin 2022).
[42] « Patient management », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management/patient-follow-up (consulté le 15 juin 2022).
[43] « Leads », Microport. https://microport.com/en/healthcare-professional/cardiac-rhythm-management/leads (consulté le 15 juin 2022).
[44] « Programmation du MODE IRM », MicroPort CRM, 2019. https://microportcrm.showpad.com/share/vJevstCf9GL3wUymK7AJP (consulté le 15 juin 2022).
[45] « Surveillance des sondes de défibrillation », ANSM, 10 juin 2021. https://ansm.sante.fr/dossiers-thematiques/surveillance-des-sondes-de-defibrillation-et-defibrillateurs-implantables (consulté le 24 juin 2022).
[46] P. Taboulet, « Pacemaker 1. électronique », e-cardiogram, 1 mai 2022. https://www.e-cardiogram.com/pacemaker-b-electronique/ (consulté le 13 juin 2022).
Annexes
Annexe 1 : Exemples de mode de stimulation
Simple chambre :
- AAI(R) : Stimulation de l’OD, détection de la dépolarisation de celle-ci et inhibition lors d’une détection. Ce mode est recommandé s’il y une dysfonction sinusale (associée à une insuffisance chronotrope), la conduction auriculo-ventriculaire doit être normale et il doit y avoir une absence totale de n’importe quelles cardiopathies évolutives. Ce mode est donc quotidiennement associé à un algorithme (SafeR) impliquant une électrode ventriculaire ou pour réaliser un seuil atrial ou si la sonde VD est endommagée [46].
- VVI(R) : Stimulation du VD, détection de la dépolarisation de celui-ci et inhibition lors d’une détection. Ce mode est un basique si le patient fait des BAV II ou III (associé à une insuffisance chronotrope) et si l’OD ne peux pas être stimulé ou détecté de façon générale (FA continue) [46].
Double chambre :
- DDD(R) : Stimulation et détection des deux cavités (VD + OD). Ce mode permet de synchroniser la stimulation ventriculaire sur la détection et la stimulation de l’OD. Il y a donc un délai auriculo-ventriculaire qui est programmé [46].
- DDI(R) : Stimulation et détection des deux cavités (VD + OD) sans suivis des oreillettes détectés. Si les oreillettes possèdent une fréquence de stimulation supérieure à la stimulation de base, donc détection au niveau de l’OD, alors il y a une inhibition de la stimulation OD et absence de déclenchement de délai auriculo-ventriculaire. Et ceci, afin d’éviter un emballement des ventricules lors d’arythmies atriales (Ex : FA). Ce mode est donc quotidiennement associé au mode Switch (repli) [46].
Asynchrone :
- OOO : Aucune cavité est stimulée et détectée. Ce mode peut être activé par le médecin, durant une consultation, pour que le patient puisse passer une IRM [46].
- DOO : les deux cavités sont stimulées. Cependant l’appareil ne détecte aucune cavité. Ce mode a été conçu pour des patient dépendant de la stimulation de leur boitier. En revanche, ce mode ne possède pas la capacité de détecter. De ce fait, la stimulation se fait à une fréquence fixe sans tenir compte de la fréquence du patient. Si celui-ci à un rythme supérieur à celui programmé alors la stimulation de l’appareil pourrait tomber dans une période vulnérable (onde T) qui pourrait engendrer des arythmies voir une FV[46].
Annexe 2 : Les principales missions d’un ingénieur d’application CRM lors d’une implantation d’un DAI
