IDS172 - Avancées technologiques en radiothérapie externe
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs

Contacts
- BENKHORIS Brahim : brahim.benkhoris@gmail.com
- GHZAIEL Karim : karimghzaiel1@gmail.com
- HADJIDJ Ines : ines.hadjidj@gmail.com
- MUKANYANDWI Yvette : yvettemukanyandwi@gmail.com
- PARODI Raphaël : rparodi.pro@gmail.com
Citation
A rappeler pour tout usage : Benkhoris Brahim, Ghzaiel Karim, Hadjidj Ines, Mukanyandwi Yvette et Parodi Raphaël, "Avancées technologiques en radiothérapie externe", Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS), Mémoire de projet, janvier 2023, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids172 ; https://doi.org/10.34746/ids172
Résumé
Le cancer est une des pathologies chroniques les plus étudiées dans les données d’épidémiologie. Sa lutte représente un des enjeux primordiaux de santé publique avec aujourd’hui un nombre de décès qui ne cesse d’augmenter chaque année, avec une atteinte particulière chez les hommes puisqu’elle en est la première cause de mortalité.
Pour les prochaines années, des centres de luttes se mobilisent pour atténuer la maladie grâce aux progrès de la recherche. Dans cette démarche, les innovations technologiques représentent un atout puissant qui a déjà fait ses preuves. Parmi la pluralité des moyens de lutte, la radiothérapie est une des contributions essentielles qui restent encourageantes. Son procédé passe par l’irradiation des cellules cancéreuses grâce à l’utilisation de rayons X de haute intensité d’énergie. C’est un domaine en plein essor, les innovations interviennent à chaque étape du parcours de soin du patient.
Dans les différents types de traitements, la radiothérapie externe est un sujet probant, puisqu’elle met en valeur l’innovation biomédicale et reste majeure dans ses avancées. Ainsi nous nous sommes activement investis dans la recherche des avancées technologiques en radiothérapie externe. Ce recueil traite du principe même de la radiothérapie externe et propose les futures innovations qui aideront certainement les utilisateurs dans leurs pratiques quotidiennes.
Abstract
Cancer is one of the most studied chronic pathologies in epidemiological data. Its fight represents one of the most primordial stakes of public health with today a number of deaths which does not cease increasing each year, with a particular attack in the men since it is the first cause of mortality.
For the next few years, the fight centers are mobilizing to alleviate the disease thanks to the progress of research. In this process, technological innovations represent a powerful asset that has already proven itself. Among the many ways of fighting, radiotherapy is one of the most important and encouraging contributions. Its process involves the irradiation of cancerous cells through the use of high-energy X-rays. This is a rapidly developing field, with innovations occurring at every stage of the patient's treatment.
In the different types of treatments, external radiotherapy is a convincing subject, since it highlights biomedical innovation and remains major in its advances. Thus we are actively involved in the research of technological advances in external radiotherapy. This collection deals with the very principle of external radiotherapy and will propose future innovations that will certainly help users in their daily practices.
Téléchargements


Mémoire Complet
Les avancées technologiques en radiothérapie externe
Remerciements
En tout premier lieu, l’ensemble de notre groupe tient à remercier particulièrement tous les contributeurs de ce travail.
Nous souhaitons exprimer notre gratitude envers nos responsables pédagogiques et enseignants du Master Ingénierie de la Santé de l’Université de Technologie de Compiègne. Merci à Isabelle CLAUDE, Jean-Matthieu PROT et Gilbert FARGES pour tous leurs précieux conseils durant ces deux années d’études et tout au long du projet.
Nous saisissons également cette occasion pour remercier les professionnels de santé des centres de luttes contre le cancer et de radiothérapie qui ont accepté d’échanger avec nous sur notre projet de recherche. Ils ont été disponibles et à l’écoute pour répondre à l’ensemble de nos questions. Leurs connaissances en radiothérapie ont été un facteur déterminant pour la progression de ce mémoire.
Enfin, nous tenons à remercier nos collègues de promotion pour leurs encouragements et leur aide tout le long des jalons.
Introduction
Dans la prise en charge du cancer, le traitement prend une place importante et nécessaire, pour espérer la guérison du patient. Sous l’effet du vieillissement des populations, du stress, de la pollution ou encore de la malnutrition, le nombre de cas de cancers devrait bondir d’après l’OMS au cours des deux prochaines décennies. Un état des lieux sur les dernières évolutions technologiques dans ce domaine nous paraît pertinent.
Un état des lieux sur les dernières évolutions technologiques dans ce domaine nous paraît pertinent. Il s’agit ici de s'intéresser à la radiothérapie et plus précisément à la radiothérapie externe, riche en innovations technologiques. Cette dernière a évolué ces dernières décennies et est devenue une des méthodes de référence dans le traitement des cancers en utilisant des rayonnements ionisants puissants. Avec toutes les évolutions et l'intérêt que suscite cette modalité, le but est de s’interroger sur les différentes innovations technologiques en radiothérapie externe et comment s'insèrent elles dans le parcours patient pour améliorer sa prise en charge ?
Tout d’abord, la radiothérapie sera contextualisée, puis les interactions biologiques, principes physiques et technologiques en jeu seront abordés. Enfin, les innovations technologiques seront présentées et intégrées dans chaque étape du parcours patient.
I. Le contexte
1. Le cancer
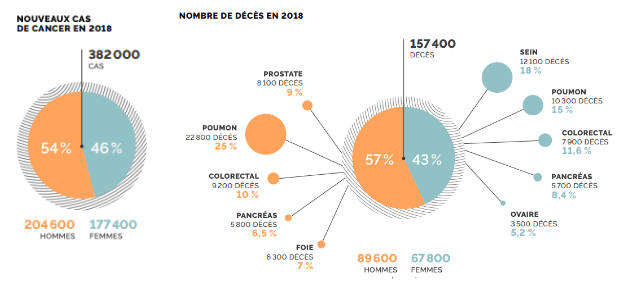
Le cancer représente un véritable enjeux de santé publique, quand on sait qu’à ce jour en France, il représente la première cause de mortalité chez les hommes et la deuxième chez la femme et cela ne cesse de croître. En 2019 environ 23,6 millions de nouveaux cas de cancers ont été recensés dans le monde avec environ 10 millions de décès chaque année contre 18,1 millions de nouveaux cas en 2018 [1]. En France, on compte 382 000 nouveaux cas de cancer, avec 154 700 décès en 2018. On retrouve en majorité les cancers du poumon (25%) ( figure 1) chez l’homme et du sein chez la femme (18%) [2].
Le terme cancer est un terme générique désignant une centaine de maladies ayant une caractéristique commune “une transformation de cellules qui deviennent anormales et prolifèrent de façon excessive. Ces cellules déréglées finissent par former une masse qu'on appelle tumeur maligne. Les cellules cancéreuses ont tendance à envahir les tissus voisins et à se détacher de la tumeur. Elles migrent alors par les vaisseaux sanguins et les vaisseaux lymphatiques pour aller former une autre tumeur (métastase)”[2].
2. Les différents traitements
Il existe de très nombreuses formes de cancer, les traitements ne peuvent donc pas être les mêmes : la chimiothérapie, l’immunothérapie, la chirurgie ou encore la radiothérapie seules ou associées entre elles constituent les principaux traitements. Le but recherché n’est pas de soumettre le malade au plus grand nombre de traitements possibles, mais de définir au mieux le traitement adapté à son cas.
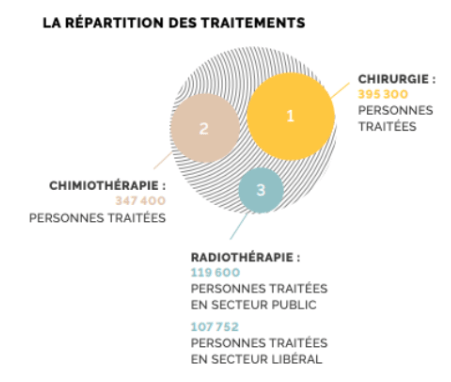
Les cancers sont fréquemment traités par chirurgie. En effet, en 2017 (figure 2) 395 000 personnes ont été traitées par chirurgie. Lors de cette intervention, le chirurgien peut procéder à l’ablation de la tumeur ainsi que des ganglions voisins à un stade où la tumeur n’a pas encore métastasé. On parle de “résection chirurgicale complète” lorsque tout le tissu malade/tumoral a été retiré. Il faut savoir que dans certains cancers, le traitement chirurgical est alors utilisé pour permettre la diminution de la masse dite tumorale afin d’utiliser d’autres traitements complémentaires pour l’éradiquer [2] [3].
On retrouve ensuite la chimiothérapie, avec 347 400 patients traités en 2017, juste derrière la chirurgie. La chimiothérapie est un traitement chimique qui tue ou affaiblit les cellules cancéreuses. Il existe de nombreux médicaments en chimiothérapie, qui seront souvent associés entre eux pour augmenter l'efficacité globale du traitement. Les médicaments peuvent être administrés aux patients de différentes façons : par perfusion, piqûre ou sous forme de comprimés par exemple. Les médicaments de chimiothérapie touchent les cellules cancéreuses, mais aussi les cellules saines qui se divisent rapidement, ce qui peut entraîner des effets secondaires connus du grand public : nausées, vomissements, perte des cheveux, fatigue, etc. Ces effets, variables selon les médicaments et la réaction de la personne, sont temporaires mais souvent difficiles à supporter [3].
On trouve également l’immunothérapie, un traitement qui vise à stimuler les défenses immunitaires de l'organisme contre les cellules cancéreuses.
Pour finir, il existe également la radiothérapie. “C’est un type de traitement basé sur l’utilisation de rayons ionisants administrés localement et à fortes doses en vue de détruire les cellules cancéreuses ou de stopper leur développement. Les rayons en eux-mêmes ne sont pas douloureux, mais ils peuvent provoquer des effets secondaires, parfois plusieurs semaines après la radiothérapie”[4][5][6]. Il faut savoir que la radiothérapie peut aussi être associée à d’autres traitements en parallèle comme la chimiothérapie (radio chimiothérapie) qui va rendre les cellules cancéreuses plus sensibles au rayon. En associant les deux traitements, le but est de réduire le risque de récidive tumorale ainsi que la taille de la tumeur (avant chirurgie). La durée du traitement, ainsi que le nombre de séances, varient selon la zone à traiter et la technique employée [5].
3. Les différentes techniques de radiothérapie et leurs marchés
La radiothérapie fait l'intermédiaire entre la biologie tumorale, comprenant l'immunologie et le fonctionnement métabolique des cellules et la physique intégrant l'imagerie, les mathématiques ou encore les statistiques. De plus, on estime qu’environ 60% des cancers sont traités par la radiothérapie en France, soit 175 000 patients par an dont 1000 enfants, ce qui représente environ 4 millions de séances en France [5].
On retrouve 3 types de radiothérapies avec : la curiethérapie, la radiothérapie métabolique et la radiothérapie externe (celle-ci sera traitée dans ce rapport) [5].
La curiethérapie désigne une mise en contact directe d’une source radioactive avec les tissus à traiter à l'intérieur de cavités naturelles [5]. Cette modalité de traitement concerne 5% des prises en charges soit 7500 patients annuels [6]. La curiethérapie est couramment utilisée pour traiter les cancers du col de l'utérus, de la prostate, du sein, et de la peau.
La radiothérapie métabolique porte sur l’administration de substance radioactive en intraveineuse ou par voie orale. Le but est de cibler spécifiquement les cellules cancéreuses pour les détruire [5]. Elle peut être utilisée pour la métastase osseuse par exemple.
La radiothérapie dite externe concerne l’irradiation des tissus cancéreux par un faisceau de rayons X de haute énergie. Nous avons décidé de nous intéresser exclusivement à la radiothérapie externe au vu des nombreuses innovations technologiques la concernant [5] [7]

A l’échelle internationale, la France fait partie des pays les mieux dotés en équipements de radiothérapie (figure 4).
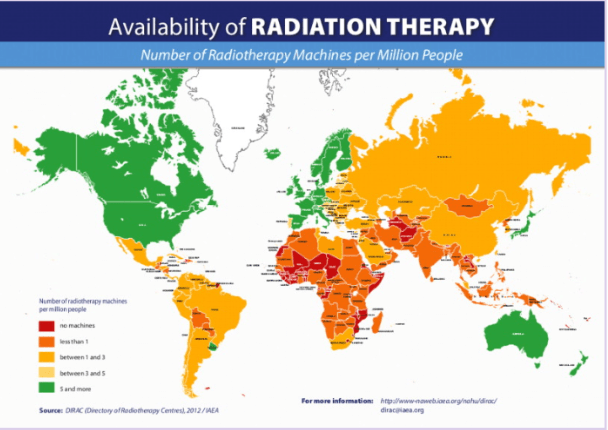
Il faut savoir, que le marché mondial de la radiothérapie est évalué à 6,3 milliards USD actuellement et devrait atteindre 8,1 milliards USD d'ici 2027 ce qui souligne sa constante évolution et son importance. Les progrès technologiques en radiothérapie, l'incidence croissante du cancer et l'augmentation des investissements sont les principaux facteurs de croissance de ce marché [7]. Les principaux acteurs opérant sur le marché mondial de la radiothérapie externe sont Elekta AB, Systèmes médicaux Varian, IBA Radiopharma Solutions, et Accuray.
II. La radiothérapie externe
1. Les principes biologiques
L’irradiation des tissus par un faisceau de rayons X de haute énergie provoque des lésions sur les tissus. Ainsi, les cellules sont principalement touchées au niveau de l’ADN, ce qui induit la mort cellulaire, la mutagénicité ou encore la cancérogénicité des cellules saines. Néanmoins, cela peut être source d'effets indésirables. [10]
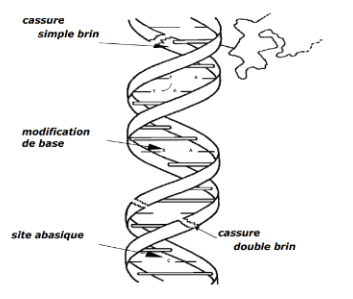
En effet, au niveau génétique, la principale cible critique est l’ADN [10]. Les rayons affectent les cellules essentiellement au niveau du génome, aussi bien des cellules cancéreuses que des cellules saines, par des lésions de simple brin, double brin ou par la modification des bases. (figure 5)
Les lésions de double brin sont les plus graves et la réparation de la cellule est plus difficile. Ces lésions sont considérées comme les principales responsables de l’effet létal des radiations ionisantes.
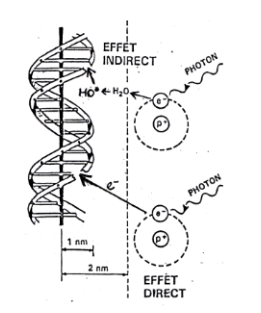
Il existe deux actions des rayonnements ionisants sur l’ADN :
- Action indirecte : principalement par la radiolyse de l’eau qui entraîne la formation de radicaux libres. Ces derniers vont ensuite interagir avec les cellules et altérer leur ADN, la majorité des lésions surviendraient via ce mécanisme.
- Action directe : par l’ionisation directe des atomes de l’ADN. En une fraction de seconde, les cellules subissent des altérations atomiques et moléculaires engendrées par le passage des rayonnements ionisants.
Au niveau cellulaire, les conséquences des lésions sont diverses. Elles dépendent de la dose des rayonnements ionisants reçue par les cellules. On distingue :
- La mort cellulaire immédiate : il s’agit d’un phénomène rare à cause d’une irradiation à forte dose (plusieurs centaines de Gy).
- La mort mitotique différée : la cellule meurt durant les prochaines divisions suivantes. Ainsi il y a une perte de la capacité d’une cellule à proliférer de façon infinie.
- L'apoptose : on parle de mécanisme de “mort cellulaire programmée”. C’est le processus par lequel une cellule déclenche son autodestruction. Des études ont démontré que l’irradiation peut déclencher un mécanisme d’induction de l’apoptose dans les lymphocytes T CD4 hautement radiosensibles [13].
- Mutations cellulaires et cancérisation : si les anomalies de la molécule d'ADN ont été mal réparées et la cellule n'est pas éliminée par un phénomène d'apoptose, on aura alors une cellule mutante. Cette cellule a la capacité de proliférer et peut donner naissance à un cancer [12].
Au niveau de l’organisme, on distingue deux types d'effets secondaires sur l'organisme selon la dose et l'organe irradié [14] :
- Des effets à court terme, dits déterministes : ils sont directement liés aux lésions cellulaires lors de fortes doses d’irradiation et pour lesquels il existe un seuil à ne pas dépasser.
Ces effets se manifestent généralement de quelques jours à quelques semaines après l'exposition par des pathologies tissulaires.
- Des effets à long terme, dits stochastiques : ils se manifestent d'une façon aléatoire sur la forme des cancers ou anomalies génétiques.
Ces effets apparaissent généralement plusieurs années après l’exposition.
Mécanisme de défense de la cellule tumorale à l’irradiation
Lorsqu’on utilise la radiothérapie, les dégâts que l’on va apporter vont faire libérer des motifs moléculaires associés aux dommages connus sous le nom de DAMP (Damage Associated Molecular Pattern) [15]. Il en existe deux types :
- Le premier visant à accroître la réponse tumorale et surtout sa résistance à la radiothérapie (on peut citer comme exemple l'adénosine comme le signal d'alarme le plus courant)
- Le deuxième visant à détruire le microenvironnement de la tumeur.
La radiothérapie externe peut donc réduire l'immunité antitumorale si elle n’est pas efficacement contrôlée. Le radiothérapeute doit être précis et prendre le plus de précautions possible pour ne pas affecter les cellules non cancéreuses. Cela risquerait d’être en faveur de la croissance tumorale.
2. Les principes physiques et technologies de la radiothérapie
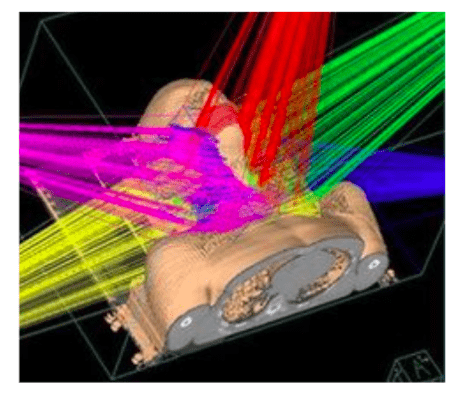
L’irradiation du patient peut être réalisée selon différentes méthodes, en fonction du type de technologie employée. De nos jours, la technique la plus répandue est l’irradiation conformationnelle tridimensionnelle [16]. Son but est d’irradier un volume se rapprochant le plus possible du volume tumoral afin de maximiser l’effet de la dose sur la tumeur et d’épargner les tissus sains au voisinage. Des outils numériques de simulation permettent d’exploiter les imageries anatomiques obtenues par tomodensitométrie afin de visualiser les volumes d’irradiation et tumoral. A cette technique peut également être associée la modulation d’intensité où le niveau de dose est ajusté en cours d’irradiation afin de préserver les tissus sains, comme illustré dans la figure 7 , où les modulations de niveau de dose sont représentées par des couleurs différentes.
Ces modalités d’irradiations sont délivrées par un accélérateur linéaire de particule, équipement fondamental en radiothérapie externe. Un accélérateur linéaire de particule est composé d’un système de production du faisceau de haute énergie (4 - 25 MeV) , d’une tête d’irradiation et d’une table de traitement à plateau carbone (figure 8).
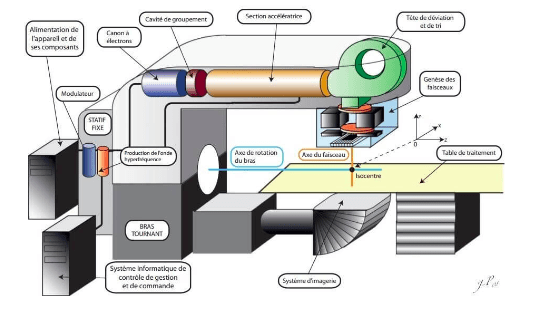
La production du faisceau d’électrons de haute énergie est assurée par un canon à électron couplé à une section linéaire d’accélération.
Le canon à électron est constitué d’un tube à vide où un filament de Tungstène est soumis à une intensité électrique dont la température augmente jusqu’à l’ionisation : des électrons du cortège électronique des atomes de Tungstène vont être arrachés et libérés. Les électrons libres sont accélérés par une haute tension entre l’anode et la cathode, creuses, puis focalisés au centre de l’anode par l’intermédiaire d’une grille de contrôle vers la section accélératrice.
La section accélératrice, sous vide, est composée d’une succession de cavités avec un orifice axial. Une onde de très haute fréquence est émise par un magnétron à l’intérieur de la section créant ainsi un champ électrique variable dans chaque cavité : soumis aux champs électriques successifs, les électrons sont accélérés progressivement jusqu’à la sortie de la section. En sortie, les électrons de haute énergie sont focalisés à travers deux bobines :
- une bobine de focalisation qui façonne la taille du faisceau ;
- une bobine de pilotage qui assure le centrage du faisceau dans l’axe ;
La section accélératrice étant parallèle au plan dans lequel le patient est allongé, un ensemble d'électroaimants formant une tête de déviation permet de redresser le faisceau et de l 'homogénéiser énergétiquement. Les électrons peuvent être utilisés en l’état pour traiter le patient, ou utilisés pour produire des rayons X. Le traitement par faisceau d'électrons n’est presque plus utilisé aujourd’hui dans la mesure où il ne permet que de traiter des cellules en superficie. De fait, les électrons sont envoyés sur une cible en tungstène en interagissant avec la matière par rayonnement de freinage , induisant des rayonnements X.
Ainsi, le faisceau de rayons X est généré, collimaté et contrôlé à l’intérieur de la tête d’irradiation. Des cônes compensateurs sont utilisés pour ajuster le profil du rayonnement qui a naturellement tendance à être plus énergétique en surface, et moins en périphérie. Dans le but de garantir l'homogénéité de l’irradiation sur toute la géométrie du champ, le faisceau est collimaté par deux lames plombées : on parle de collimation primaire.Au regard des niveaux d’énergies délivrées et des risques associées, une chambre d' ionisation permet de mesurer et contrôler le niveau d’énergie du faisceau produit.
Enfin, la dernière étape consiste à collimater le faisceau en fonction de la zone à irradier : un collimateur composé de plusieurs lames plombées façonne le faisceau de manière à minimiser l’impact sur les tissus sains. Le réglage des lames est réalisé à partir de la planification réalisée par les physiciens, ou en temps réel sur certaines technologies d’asservissement (figure 9).

3. La radioprotection
Notion de dose
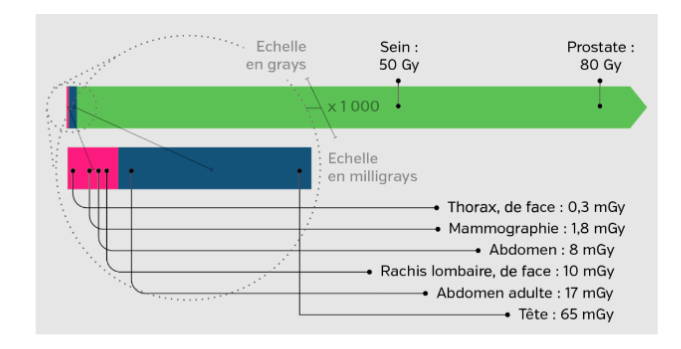
En terme de radioprotection, il convient de faire un rappel sur les notions de dose qui ont un effet déterminant sur l’apparition des effets ionisants. La dose de rayons est exprimée en GRAY (abrégé Gy) et 1 Gy = 1 joule absorbée dans une masse de 1 kilo.
Pour la plupart des applications cliniques, la dose délivrée est de 50 Gy en 25 fractions de 2 Gy. Pour des petites interventions à un stade précoce, les doses sont évaluées en mGy Pour les tumeurs, le traitement par radiothérapie est administré pour des tailles supérieures à 4 centimètres [20].
Conformité
Des réglementations ont été imposées dans les centres de radiothérapie en conformité avec les critères d’autorisation faisant de la radiothérapie un gage de qualité pour le patient [22]. C’est une des priorités nationales concernant la sécurité et la qualité de la radiothérapie externe.
Ainsi, l’Institut de Radioprotection et de Sureté Nucléaire (IRSN) a installé sur le territoire une veille permanente pour organiser le parcours du patient et assurer une bonne orientation des actions à entreprendre [23].
4. Les applications cliniques
De nombreux cancers peuvent être traités par radiothérapie externe. Ici, nous prendrons comme exemple les deux pathologies les plus traitées : le cancer du sein et le col de l'utérus.
Les cancers du sein
C’est une des applications les plus visées par la radiothérapie. Il s’agit du cancer le plus fréquent chez la femme [24]. Les risques concernent l’irradiation de la chaîne mammaire interne.
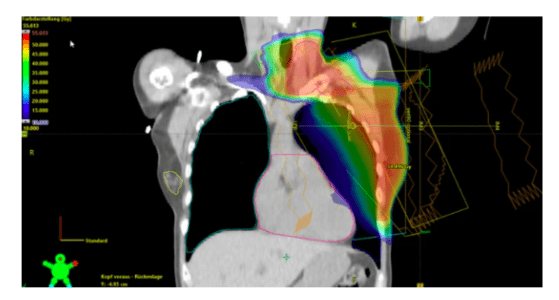
Ici, la décision doit être prise au cas par cas en fonction du patient concerné. Pour les symptômes, on observe une déformation de la peau et un changement physiologique du sein.
Les cancers gynécologiques (utérus, col de l’utérus, vagin) et urogénitaux (vessie, prostate)
Le cancer de l’utérus est devenu le cancer le plus fréquent de l’appareil gynécologique et est classé 12 ième des cancers les plus fréquents chez la femme [26]. On s’intéresse ici à la partie basse de l’utérus. Son origine principale est une infection par un virus transmis par voie sexuelle : le papillomavirus humain ou HPV. On constate qu’il y a environ 3000 nouveaux cas par an d’atteinte de cancer du col de l’utérus. L’irradiation est primordial pour un traitement local. Dans le cas de la radiothérapie, elle est généralement concomitante faisant intervenir la radiothérapie externe et la curiethérapie.
Autres cas traités [10] :
- les cancers de la sphère ORL (nez, oreilles, pharynx, larynx) et de la bouche
- les tumeurs cérébrales,
- les cancers du poumon
- les cancers du sang, de la moelle osseuse et des ganglions (leucémies, maladies de Hodgkin, lymphomes non hodgkiniens)
5. Le parcours de soins en radiothérapie externe
Le parcours de soins du patient en radiothérapie externe est découpé en 5 grandes étapes au cours desquelles différents acteurs interviennent (figure 13). On retrouve tout d’abord la consultation pré-traitement puis le scanner de centrage, la planification, la phase de traitement et enfin le suivi post traitement.
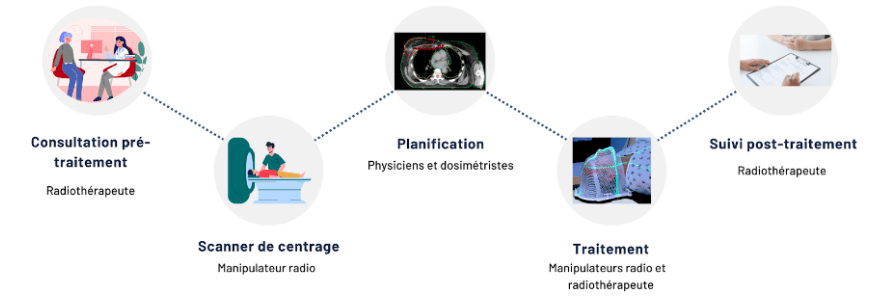
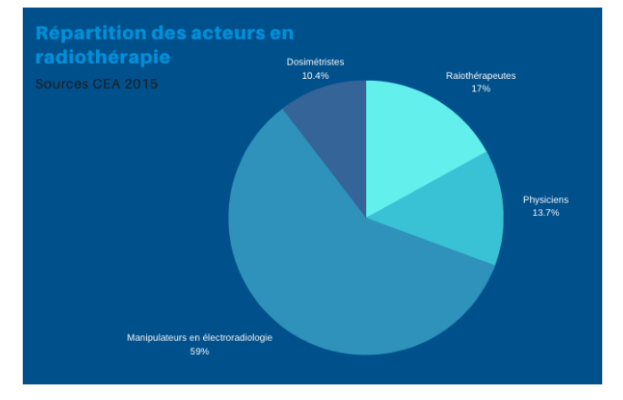
Le tout est assuré et suivi par un radiothérapeuthe. On retrouve également en grande majorité des manipulateurs radio (figure 14) ainsi que les physiciens et les dosimétristes qui permettent d’assurer les différentes étapes du parcours de soin.
III. Les innovations au sein du parcours patient en radiothérapie externe
1) La consultation pré-traitement
Lors de cette consultation, l’oncologue radiothérapeute étudie avec le patient l’ensemble de son dossier et propose un projet thérapeutique adapté. Des examens complémentaires sont nécessaires avant de finaliser les modalités de traitement.
C’est lors de ce rendez-vous que le patient peut poser des questions précises sur la maladie : son stade, son évolution prévisible, les traitements envisagés, leurs déroulements, leurs effets secondaires ainsi que leurs gestions, etc….
Ce premier entretien a pour but d’expliquer en détail le déroulé du traitement au patient qui va le recevoir. En fonction des antécédents (premier cancer ou récidive), les questions et explications ne seront pas les mêmes. Le médecin prend le temps de répondre à toutes les interrogations afin de rassurer le patient.
Aujourd’hui le manque de médecins et l’augmentation du nombre de cas de cancers a pour conséquence une diminution du temps accordé à cette consultation. De plus, il n'est pas toujours aisé de calmer l’angoisse que peut engendrer la première séance de radiothérapie et l’inconnu de ces machines et robots articulés bien souvent imposants et impressionnants qui tournent très proches autour du patient. Pour calmer ses angoisses, une innovation alliant réalité virtuelle et radiothérapie permettrait d’améliorer l’expérience du patient. Le patient lors de cette consultation a alors la possibilité de visualiser grâce à un casque les étapes du traitement qu’il va recevoir. Des études ont déjà été menées par l’Institut de Radiothérapie Hartmann à Levallois-Perret avec le projet VortHex [28] notamment, mais également par le Centre de cancérologie du grand Montpellier [29] .

Dans une démarche de personnalisation du traitement en radiothérapie, de nouveaux outils comme la radiomique [30] voient le jour, situés au croisement entre l’imagerie médicale et les mathématiques. On s’intéresse ici à l’étude informatique d’une très grande quantité de données qui proviennent d’imagerie médicale (transformée d’une part numériquement puis traitée par la suite mathématiquement). Le but final serait d’apporter un traitement personnalisé pour tous les patients en radiothérapie. On retrouve deux objectifs : pouvoir prédire et pronostiquer la réponse du traitement pour le patient atteint d’un cancer traité en radiothérapie et ainsi apporter une aide à la décision en cancérologie mais également de pouvoir définir une approche biologique, en comprenant les facteurs entraînant un cancer pour ainsi changer certaines pratiques. Pour l’instant, ce sont les centres hospitaliers universitaires et les centres de luttes contre le cancer qui s’intéressent à cette nouvelle technologie. C’est une avancée majeure que la société SOPHIA GENETICS développe en appliquant sa technologie radiomique pour la recherche clinique en oncologie [31] . La figure 16 permet de mettre en évidence l'intérêt de cette technique.
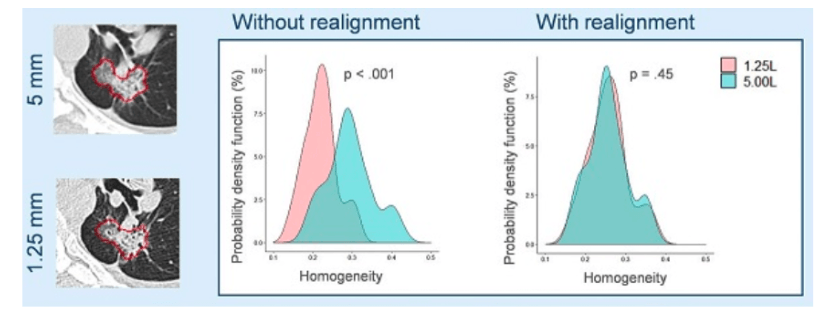
Sur la figure ci-dessus, on a pu démontrer que pour deux épaisseurs de coupes différentes (1.25 mm et 5 mm), nous avons la même prédiction de réponse au traitement.
L’autre enjeu serait de standardiser les données. Ainsi le radiothérapeute devra adopter une méthode d’insertion des données, qui sera implémentée dans plusieurs centres sur une même base de données. L’objectif serait d’avoir une meilleure approche des patients traités par radiothérapie grâce à la réalisation d'études multicentriques sur les effets secondaires.
2) Le scanner de centrage
Le scanner de centrage, aussi appelé scanner de marquage, dosimétrique ou de pré-traitement, est très important dans le parcours de soin du patient. En effet, le but de ce scanner n’est pas de rechercher des anomalies ou d’établir un diagnostic mais de recueillir des informations précises sur l’anatomie du patient pour planifier au mieux le traitement. Ce scanner va permettre de déterminer la position dans laquelle le patient recevra les rayons X. C’est à partir de ces images que le physicien travaillera, pour préparer ce que l’on appelle la dosimétrie, c'est-à-dire la quantification de la dose sur la zone d’irradiation. Différents dispositifs existent pour assurer une position constante au cours du traitement.
Le patient est allongé sur une table en carbone, peu confortable, mais indispensable pour essayer d’assurer un positionnement identique lors des différentes séances de traitement. La reproductibilité de la position est caractérisée selon le type de lésions et de tissus. Pour les patients atteints de lésions au cerveau par exemple, des masques thermoformés sont moulés à la forme du visage qui peuvent s’étendre jusqu’au cou ou aux épaules.
Ces masques seront ensuite vissés à la table en carbone lors de chaque séance de radiothérapie afin de retrouver au mieux la position de référence utilisée pour la planification des rayons administrés.
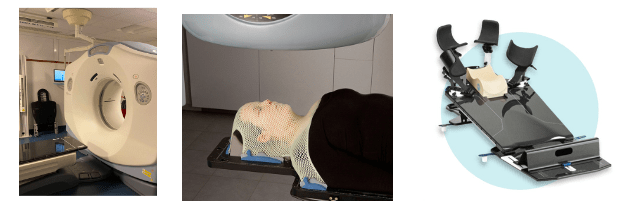
De nouveaux masques de traitement personnalisés pour chaque patient voient le jour grâce à l'utilisation d'imprimante 3D. Un patient souffrant d'un cancer de la tête et du cou se présente pour un traitement de radiothérapie par exemple. Le plan de traitement prévoit l'utilisation d'un masque de traitement pour maintenir la position du patient. Cependant, le masque de traitement standard disponible ne s'adapte pas bien au visage du patient et peut être inconfortable à porter pendant de longues périodes. De plus, les masques thermoformés limitent le mouvement du patient jusqu’à moins de 2 mm [33][35][36].
Pour résoudre ce problème, les médecins peuvent utiliser une imprimante 3D pour créer un masque de traitement personnalisé qui s'adapte parfaitement au visage du patient. Ils peuvent utiliser des images de tomodensitométrie ou du scanner de centrage pour obtenir un modèle 3D précis de la tête et du cou du patient, puis utiliser ces données pour créer un fichier de modèle 3D qui peut être envoyé à une imprimante 3D. L'imprimante imprime alors le masque de traitement sur mesure en utilisant un matériau résistant aux rayons X, comme le polycarbonate. [37].
Ces dispositifs personnalisés permettent d’apporter au patient un plus grand confort lors de la séance de radiothérapie tout en garantissant son immobilisation et en restant extrêmement fidèles à son anatomie. En termes de coût, l’achat d’une imprimante 3D permet de réduire le budget du centre de radiothérapie dédié aux accessoires pour ne plus l’externaliser. On peut citer différents constructeurs comme 3D Systems, Raise Pro2 et ultimaker 2+ par exemple qui à l’origine n’avait pas pour vocation d’être utilisé en radiothérapie.

Des marquages sont effectués sur le corps du patient, à l’encre de chine (donc indélébiles) pour servir de repère et assurer un bon positionnement. Les données du scanner seront utilisées d’abord par le médecin pour définir avec précision les zones à traiter et les zones à protéger des rayons, c’est ce qu’on appelle le contourage. Elles seront ensuite transmises aux physiciens et dosimétristes qui étudieront la répartition de la dose de radiothérapie que le patient recevra. Pour les patients atteints d’un cancer du sein, des dispositifs aidant au positionnement sont ajoutés à la table en carbone, afin que le scanner de centrage se fasse les bras levés au-dessus de la tête.
Ainsi, pour optimiser la position du patient de nouvelles technologies voient le jour comme la surveillance radiographique et thermique (figure 19). Une entreprise allemande BrainLab propose un nouvel outil d’extrême précision au service de la radiothérapie : ExacTrac Dynamic [38].
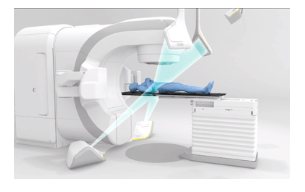
ExactTrac Dynamic offre une approche alternative du positionnement et une surveillance de précision infra millimétrique en radiothérapie. Le système se compose d’un système de radiothérapie externe classique (tubes à rayons X) mais on retrouve en plus deux détecteurs à panneau plat montés et différentes caméras (caméra thermique 4D qui contient un projecteur à lumière structurée, deux caméras haute résolution et une caméra thermique intégrée)
La position de la caméra thermique 4D permet un champ de vision dégagé, pendant le traitement sans risque d'occlusions causées par le portique. Le système peut être exploité dans deux modes différents. Le premier permet de pré-positionner grossièrement le patient avant le traitement et le deuxième mode est utilisé pour suivre le mouvement intra-fraction du patient. Les tubes à rayons X montés au sol offrent la possibilité d'acquérir des images en direct montrant les structures osseuses, les repères et les tissus mous. Grâce à leurs positions et leurs indépendances par rapport à l’accélérateur, l'imagerie par rayons X intra-fraction est possible à tout moment et avec une faible dose d'imagerie. Cette modalité d'imagerie est essentielle pour éviter une irradiation inutile. De plus, la possibilité d'acquérir rapidement des images radiographiques stéréoscopiques sans faire pivoter la table peut diminuer le temps d'installation du patient [38].
3) La planification
C’est le physicien médical qui est chargé de la planification du traitement de la tumeur, il travaille dessus sur un temps imparti avant le début du traitement et doit ensuite faire valider sa proposition au médecin. Par ailleurs, les dossiers sont toujours revérifiés au sein même de l'équipe des physiciens avant d’être envoyés en poste définitivement. Cela réduit de manière considérable le risque d’erreur.
Les physiciens et dosimétristes travaillent sur un logiciel leur permettant de faire la planification du traitement qui sera délivré à partir des images obtenues avec le scanner de centrage. Ce logiciel dépend de chaque hôpital et de son équipement, la figure 20 en montre un exemple.
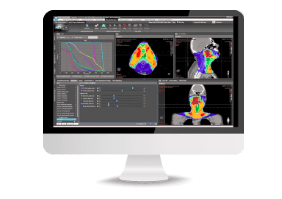
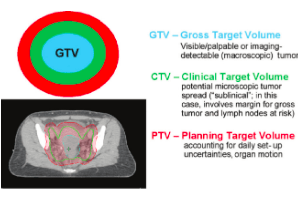
Lorsque le patient a effectué son scanner de positionnement , le radiothérapeute va identifier les volumes cibles qui doivent recevoir une irradiation. Il va alors contourer les images du scanner de centrage qui lui auront été transmises. L'émergence de l’intelligence artificielle en contourage à fait ses preuves, son utilisation commence à se démocratiser et permet au physicien de gagner du temps. Les contours appelés GTV pour Gross Tumor Volume, qui va définir le volume de la tumeur en elle-même et CTV pour Clinical Target Volume, expansion du volume tumoral pour prendre en compte la maladie infraclinique.
Le physicien reçoit alors le scan avec ces deux contours et va lui rajouter le PTV pour Planning Target Volume, pour prendre en compte les difficultés de positionnement et les mouvements du patient pendant son traitement (figure 21). Ce volume est construit par l'expansion du CTV. Le PTV reçoit la dose minimum prescrite par le médecin radiothérapeute.
Il faut également prendre en compte le fait que le corps garde en mémoire chaque dose de rayons reçus. En principe, on préfère estimer que les effets des rayons ne s’estompent pas avec le temps qui passe. C’est pourquoi lors d’une planification, le physicien va toujours prendre en compte la quantité de rayons qui a déjà été reçue par les tissus auparavant et va travailler avec plusieurs paramètres tels que le tableau de tolérance de dose aux organes à risque et l’histogramme dose/volume pour respecter les contraintes. Évidemment plus la zone a déjà été irradiée (récidive de cancer ayant déjà été traitée par radiothérapie par exemple) plus la planification devient difficile.
Toute la difficulté de la planification réside dans le fait de suffisamment irradier le volume tumoral, sans abîmer les tissus sains aux alentours. C’est pourquoi, l'analyse de la distorsion géométrique en Imagerie par Résonance Magnétique (IRM) peut être bénéfique pour la radiothérapie externe. En effet, l’Imagerie par résonance magnétique l’IRM est une modalité de plus en plus utilisée et couplée au scanner de centrage (mise en place lors de l'étape de scanner de centrage, acquisition d'image d'IRM). Cependant les images présentent systématiquement des distorsions géométriques pouvant atteindre jusqu'à plusieurs centimètres dans certaines régions. Il est donc important de pouvoir quantifier et corriger les distorsions pour améliorer la prise en charge du patient à l’aide de fantômes, comme celui développé par Spin Up le cartesian 3D couplé au logiciel Spin TK. Différentes étapes doivent être mise en place :
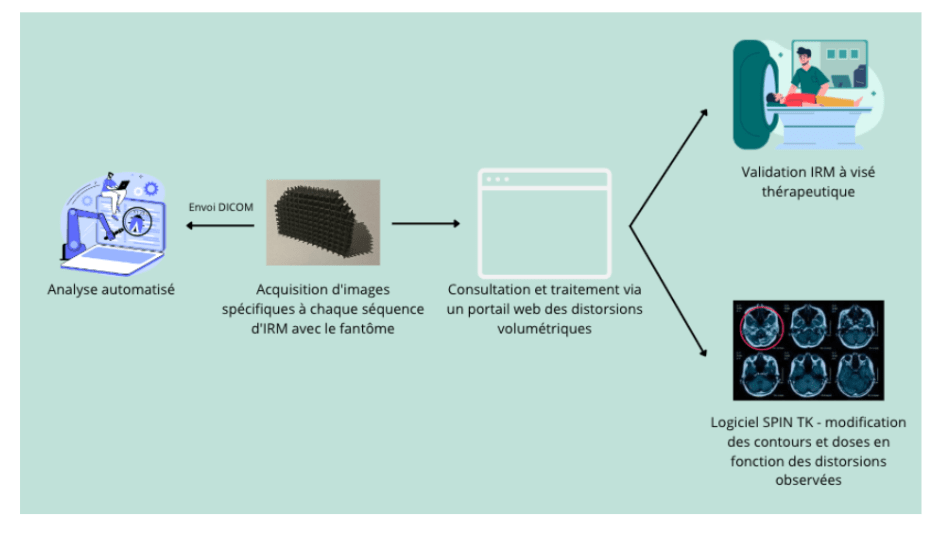
Ils permettent à la fois de quantifier la distorsion observée mais de corriger le contour faussé à travers le logiciel, et ainsi entraîner les modifications dosimétriques nécessaires.
4) Le traitement
La durée d’une séance avec préparation du patient comprise est d’environ 10 minutes ce qui est relativement court. Le temps d’irradiation lui, est seulement de quelques minutes. Le plan de traitement comporte généralement entre 15 à 40 séances réparties sur une durée oscillant entre 3 à 7 semaines pour la radiothérapie externe [20][23] . La salle de traitement est divisée en deux parties :
On retrouve le bunker, qui constitue la salle même où le patient reçoit son traitement. Les murs de celui-ci sont très épais (1 m environ) et la porte blindée l’est également pour permettre une protection optimale du personnel lorsque le traitement est en cours. On y trouve à l’intérieur les accélérateurs de particules, avec une table pour allonger le patient. Dans cette salle se trouvent également les contentions, moulées lors du premier scanner. On retrouve également, une partie « zone de contrôle » pour les manipulateurs de radiothérapie qui contient plusieurs écrans qui ont différentes fonctions :
- Un écran avec les informations médicales du patient,
- Un écran affichant plusieurs vues de caméra disposées à l’intérieur du bunker ,
- Un écran qui affiche les faisceaux pendant le traitement ,
- Un écran affichant le scanner de positionnement du patient , comparé à une acquisition d’images par rayons X obtenue à l’aide d’un système d’imagerie portale couplé à l’accélérateur, pour vérifier que le positionnement est bien le même. S’il y a une différence de positionnement , la table de traitement est mobile et contrôlable à distance par les manipulateurs.
La radiothérapie classique délivre une dose au patient toujours au même emplacement et à chaque séances, en faisant l'hypothèse que les organes et la tumeur ne subissent aucune modification pendant la phase de traitement sur plusieurs semaines. En réalité, cette hypothèse est fausse. On peut prendre comme exemple, la forme des organes au voisinage de la tumeur située au niveau de l’abdomen qui subit des variations anatomiques liées au niveau de remplissage de l'estomac, des intestins ou du rectum. Il y a donc une modification du volume, d’où l'intérêt de la radiothérapie adaptative. Ce principe repose sur l’adaptation du traitement en fonction du volume et de l'emplacement de la tumeur en calculant la distribution de dose à chaque nouvelle séance. Les nouvelles machines de radiothérapie disposent d'imagerie embarquée comme la tomodensitométrie, l’imagerie par résonance magnétique (IRM) ou la tomographie par émission de positons (TEP), et ouvrent la voie à cette modalité de radiothérapie, en adaptant la situation anatomique du patient à travers un scanner acquis au début de la séance [41].
L’intelligence artificielle aussi est l’une des clés de succès de la radiothérapie adaptative : elle offre ses performances, tant pour la segmentation automatique de nouveaux emplacements des organes, que pour l’optimisation intelligente de la dose [42] . Il existe deux types de radiothérapie adaptative : la radiothérapie adaptative online (qui se déroule lorsque le patient est sur la table de traitement) et la radiothérapie adaptative offline (c’est-à-dire entre les séances de traitement [41]) :
- Le TEP-Linac peut permettre une adaptation du traitement de type off-line
- L'IRM-Linac est tout particulièrement adaptée à la planification on-line
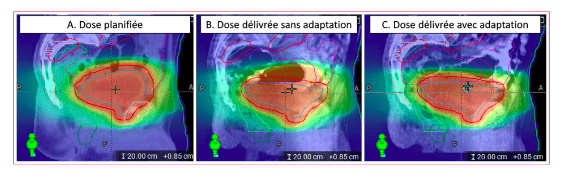
Les avantages de la radiothérapie adaptative sont notamment l'amélioration de la précision sur le volume irradié et la diminution de la toxicité sur les tissus sains (figure 23) . Cependant, cette technologie engendrent des modifications majeures sur le plan de traitement avec des nouveaux rôles pour chaque acteur. Il y a donc un surcoût en ressources humaines ce qui influence systématiquement la tarification du traitement.
On retrouve aussi la radiothérapie hybride. A la différence de la radiothérapie adaptative nécessitant plusieurs séances, elle permet de délivrer la dose maximale à la tumeur tout en épargnant les organes à risques. Le but de cette dernière est de délivrer la dose maximale à la tumeur tout en épargnant les organes à risques. En effet, il est très difficile d’épargner les cellules saines en cas de modifications volumétriques de la tumeur. L'apport de l'imagerie fonctionnelle par TEP et la précision des tissus mous par IRM permet d'envisager une radiothérapie adaptative optimisée. Actuellement, l'IRM-linac permet une radiothérapie adaptative basée sur l'anatomie le jour même. La radiothérapie adaptative a également été développée à l'aide de la TEP et de divers traceurs pour tenir compte des changements interactionnels dans la biologie tumorale.
On retrouve : L’IRM-Linac qui est un système hybride intégrant une machine d'imagerie par résonance magnétique (IRM) à haut champ magnétique avec également un accélérateur linéaire guidant la radiothérapie. Il existe actuellement deux solutions cliniques sur le marché (Unity®, Elekta AB, Stockholm, Sweden et MRIdian®, ViewRay Inc., Cleveland, OH, USA) [43].
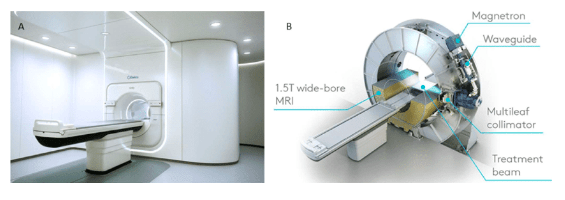
On obtient ainsi un meilleur contraste notamment pour les tissus mous par rapport à l’imagerie par les rayons X, et d’autre part l’absence de radiations ionisantes.
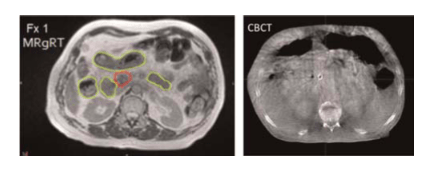
Un IRM-Linac offre la possibilité d'un suivi en temps réel entre et pendant les fractions directes de la cible, afin de traiter les tumeurs cancéreuses avec une plus grande précision et d’épargner les tissus sains périphériques. De plus, elle apporte des approches fonctionnelles qui ouvrent des perspectives intéressantes pour la radiothérapie adaptative [43].
Concernant le PET-Linac : c’est la combinaison d’un accélérateur linéaire guidé par un PET scan.
Le principe est le suivant : lorsque les tumeurs émettent des photons provenant de l'absorption radiopharmaceutique, ces photons sont détectés par le composant TEP du système. L'accélérateur linéaire capte alors ce signal, puis renvoie ses propres photons, utilisés pour détruire les cellules à des doses précisément ciblées. La société RefleXion Medical est la seule à développer un système PET-Linac.
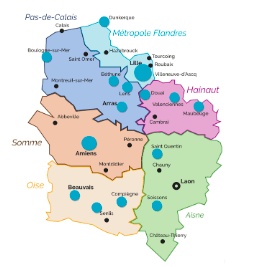
Le principal avantage du TEP-Linac est qu'il peut fournir un traitement à plusieurs sites de cancer à la fois, ce qui est essentiel pour traiter une métastase en même temps que la tumeur primaire. Le système peut traiter cinq à dix sites de cancer en une seule séance, contre un à trois sites pour une unité de radiothérapie conventionnelle. Il peut également être utilisé pour un cancer à site unique. Cette innovation ouvre des perspectives intéressantes vis-à-vis de la gestion des mouvements et de la prise en compte de l’hétérogénéité tumorale [45].Les séances en radiothérapie externe sont majoritairement réalisées en ambulatoire, c'est -à -dire que le patient se rend chaque jour au centre pour être irradié. Toutefois en France, malgré l'augmentation sur les vingt dernières années du nombre de centres de radiothérapie et des équipements, il subsiste une certaine inégalité d’implantation des centres selon les régions. En effet, même dans les régions bien équipées, les allers retours chaque jour restent parfois longs, contraignants, fatigants et coûteux. A titre d'exemple, la carte des centres de radiothérapie en Hauts de France (figure 27) souligne le manque d’équipement dans la Somme où les deux centres se trouvent à Amiens ce qui peut poser problème pour les habitants ruraux.
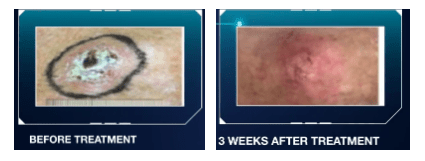
La réduction du nombre de séances de traitement est donc un des axes permettant d’améliorer le parcours de soins des patients en radiothérapie, et c’est là tout l’objet de l’innovation de la FLASH radiothérapie. Cette nouvelle technique consiste en une irradiation à très haut débit de dose sur une très courte période temporelle. C’est en 2014 que celle-ci est découverte par l’équipe de Vincent Favaudon dans les laboratoires de l’Institut Curie à Orsay [47]. Au-delà de ce gain de temps prometteur, cette innovation permettrait également de mieux détruire les cellules tumorales tout en améliorant la préservation des tissus. En termes de chiffres, le débit de dose moyen en radiothérapie conventionnelle est d’environ 4 Gray/min contre 100 Gray/sec avec la FLASH. Le temps de traitement est donc drastiquement réduit et passe de plusieurs minutes à quelques millisecondes.
En France, l’Institut Curie mène des recherches dans ce domaine. En 2021 un dispositif unique de plateforme de recherche expérimentale a été installé sur le site d’Orsay, suite à une collaboration avec l’entreprise italienne SIT depuis 2019 : l’ElectronFlash (figure 28).

Cette plateforme va permettre de nouvelles études in vitro et précliniques qui sont nécessaires avant le passage en phase clinique. En Juillet 2022, l’institut Curie et le groupe Thales ont annoncé vouloir créer une filière française et européenne de thérapie Flash VHEE (Very High Energy Electron) avec comme objectif un déploiement d’ici 2028 des installations Flash dans les hôpitaux [48].
L’irradiation par rayons X de haute énergie demeure risquée dans certaines applications critiques. De ce fait, chercheurs, médecins et industriels ont cherché à mettre en œuvre une technique d’irradiation permettant de s’affranchir des contraintes dosimétriques : la protonthérapie. Cette modalité de radiothérapie externe repose sur l’application d’un faisceau de protons de haute énergie sur les tissus cancéreux, en vue de la destruction des cellules cancéreuses.
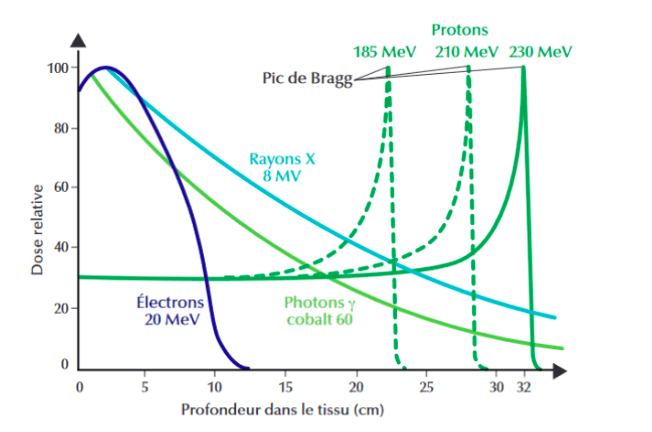
L'intérêt de la protonthérapie réside dans la physique des protons et les interactions associées. Pour rappel, un proton est une particule chargée positivement constituant, avec les neutrons, le noyau d’un atome. Lorsqu’un proton accéléré traverse des tissus biologiques, il va interagir avec les électrons de la matière qui vont le freiner jusqu’à son arrêt et sa disparition. Cela va induire une libération de son énergie cinétique dans l’environnement. On parle donc de pouvoir d'arrêt pour caractériser la perte énergétique du proton en fonction de la profondeur de matière. Le pouvoir d'arrêt des protons est fonction de leur vitesse de propagation et de la densité des tissus. Ainsi, plus l’énergie cinétique des protons est élevée, plus leur profondeur d’arrêt (où l’énergie est cédée à l’environnement) est importante. La figure 30 présente les différents profils de dose en fonction de la profondeur du tissu, pour différentes particules. On peut y observer l’impact du niveau d’énergie des protons sur la profondeur de libération de la dose, ainsi que le pic de Bragg, qui désigne le pic de libération d’énergie lors de l'arrêt des protons. A titre comparatif, les faisceaux de rayons X et d’électrons ne libèrent leurs énergies cinétiques sous forme de dose qu'uniquement en superficie [50] [51].
Ces propriétés physiques offrent donc des intérêts balistiques et dosimétriques significatifs dans le cadre d’irradiations de tumeurs. Concernant la balistique, l’énergie cinétique initiale étant proportionnelle à la profondeur, il est possible de déterminer avec précision (de l’ordre du millimètre) la profondeur à laquelle les tissus vont être irradiés. Du point de vue dosimétrique, le centrage du pic de Bragg sur la zone à irradier permet de protéger considérablement les tissus sains. De plus, une fois l'énergie libérée, les protons disparaissent : ils ne sont donc pas traversant comme les rayons X. La figure 31 représente deux simulations d’irradiation cérébrale respectivement par rayons X et par protons, où les niveaux de dose déposée sont gradués de manière croissante du bleu au rouge. Il apparaît clairement que pour une même tumeur cérébrale, la protonthérapie permet de protéger les tissus à l’arrière du crâne [51] [52].
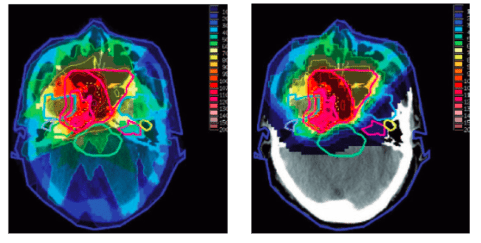
(droite) coupe cérébrale transverse d’un simulation d’une irradiation par protons[51]
La protonthérapie est particulièrement recommandée lorsque la radiothérapie par rayons X est trop risquée, notamment, en pédiatrie, en ophtalmologie, où le cristallin est particulièrement radiosensible, en neurologie, pour le traitement de cancers de la colonne vertébrale en pneumologie, en sénologie, lorsque les tissus ont déjà été irradiés [50], [53] . En pratique, une installation de protonthérapie nécessite une instrumentation lourde, comprenant un accélérateur de particule pour la production de protons et d’un ou plusieurs bras isocentrique, en fonction du nombre de salles. En effet, un accélérateur peut être utilisé pour plusieurs salles de traitement (figure 32).

Le bras isocentrique désigne la tête d’irradiation présente dans la salle de traitement (figure 33).
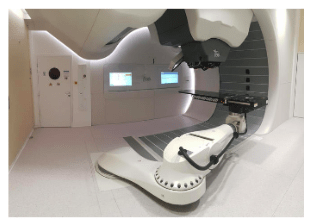
Source : lejournal.cnrs.fr/les-promesses-de-lhadrontherapie
Le principe d’irradiation le plus récent est le pencil beam scanning [55]. Lorsque le faisceau de protons produit par l’accélérateur de particule arrive au niveau du bras isocentrique, il traverse un modulateur qui permet de sélectionner le niveau d’énergie (donc de sélectionner la profondeur), puis un jeu d'électro-aimants permet de faire varier l’orientation du faisceau dans les trois dimensions. Ainsi, cette technique permet de traiter un volume entier par couches successives, de la plus profonde à la moins profonde, tout en protégeant le reste des tissus (figure 34).
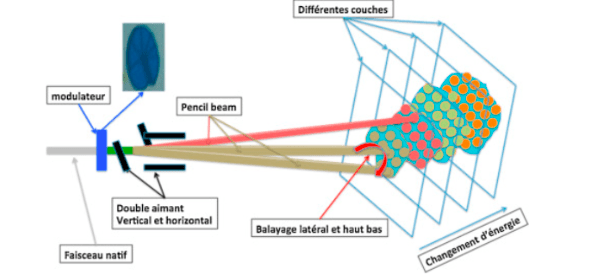
La protonthérapie présente des avantages considérables en termes de précision, d'efficacité et de radioprotection. Néanmoins, les contraintes liées à l’installation et au coût rendent cette technique encore peu répandue : la France compte actuellement 3 centres équipés [56] .
L’efficacité de la radiothérapie externe conventionnelle peut être limitée pour certains patients dû aux doses nécessaires pour détruire le tissu cancéreux. C’est pourquoi l’utilisation de nanoparticules couplé à celle-ci est prometteuse [57] [58].
Nanobiotix à développé NBTXR3 : un “radio enhancer” composé de nanoparticules d’oxyde d’hafnium d’environ 50 nanomètres. Cette nanoparticule a été mise en place pour détruire les tumeurs lorsqu’elles sont activées par les rayons X. D’après les différents retours cliniques lorsque la NBTXR3 est active, cela permet de multiplier par 9 l'énergie qui sera alors absorbée par la tumeur. De plus, elle permet l’accroissement de la dose délivrée en induisant la destruction des tissus tumoraux mais sans augmenter les dommages pour les tissus sains à proximité [58] [59].
Concernant le mode d’action, les nanoparticules sont de forme sphérique et vont être directement injectés dans la tumeur avant de commencer le traitement en radiothérapie via une injection (piqure directement dans la tumeur avec l'aide d'un échographe). Toute l'ergonomie (taille, forme, charge de surface…) a été pensée et créée pour augmenter son absorption par les cellules tumorales et ainsi améliorer le traitement par la suite. Après avoir été injectés dans la tumeur, les nanoparticules vont alors s'amasser au niveau des cellules cancéreuses sous forme de cluster tout en restant inactives.
Une fois activés par les rayons X, NBTXR3 augmente de manière considérable l'énergie absorbée et améliore ainsi la dose délivrée. Après chaque séance de radiothérapie, les nanoparticules retournent à leurs état inactif : les rayonnements peuvent donc être appliqués de manière répétitive avec seulement une seule injection. Cette nouvelle solution pour traiter le cancer à obtenu un marquage CE pour le traitement du sarcome des tissus mous localement avancé le 4 Avril 2019. De nombreuses études cliniques et certifications sont actuellement en cours pour d’autres cancers (différentes anatomies) et pourraient ainsi révolutionner le traitement en radiothérapie externe [58] [59].
5) Le suivi post-traitement
Une fois le plan de traitement terminé, le radiothérapeute revoit régulièrement le patient qui a reçu les soins pour évaluer l'efficacité de la radiothérapie sur le cancer et faire un suivi des effets indésirables que les rayons auraient pu engendrer. Des scanners et IRM sont prescrits quelques mois après pour s’assurer que la tumeur a bien réduit en taille et qu’elle ne continue pas de grossir. Concernant les effets indésirables on peut retrouver des altérations de la muqueuse. Cela se traduit par des inflammations, pouvant être douloureuse et perturber l’organisme du patient.
Des inflammations de la muqueuses peuvent apparaître (on parle alors de mucite). Aujourd'hui, l'utilisation du stylo laser à basse énergie permet de limiter ces effets indésirables en traitant l'inflammation dès qu'elles apparaissent après une séance de radiothérapie. On parle alors de photobiomodulation. Cependant, ce procédé reste fastidieux à cause de la manipulation point par point sur la peau et représente un coût non négligeable.
Neomedlight est une société qui développe une innovation thérapeutique apportant une alternative à l’utilisation du stylo laser dans les moyens de lutte contre les effets indésirables de la radiothérapie : l'utilisation d'un textile lumineux grâce au dispositif CareMin650 [60] [61].

De ce fait, le dispositif a permis d'augmenter les effets de la photobiomodulation. Par rapport à l'utilisation du stylo laser, CareMin650 permet d’augmenter la surface de contact de la peau et de rendre le traitement rapide et indolore (10 minutes contrairement à 45 minutes avec le stylo laser) et il est moins coûteux. Pour l’instant, le dispositif reste en phase clinique, mais les résultats restent prometteurs et pourraient être une avancée intéressante particulièrement pour les patients atteints d’un cancer ORL [61].
De plus, la téléconsultation est aussi utilisée pour la radiothérapie afin d’évaluer la chronicité des cancers. On parle alors de télé oncologie pour désigner l’ensemble des pratiques numériques en lien avec le suivi à distance des patients. Aujourd'hui, plusieurs dispositifs sont utilisés pour la télé oncologie [62]. L’information de la pratique peut être fastidieuse pour les personnes âgées atteint du cancer qui ne sont pas à l’aise avec ce type de consultation [63] [64]. Ces derniers temps, des outils tel la dictée numérique se développent et s'adaptent au domaine médical permettant ainsi de gagner du temps et de rendre efficace la création des dossiers médicaux patients. C’est une des priorités identifiées par les médecins qui ont fait part de leurs exigences pour un meilleur confort que la dictée analogique relativement fastidieuse pour les secrétaires médicales qui n'est pas spécifique à la radiothérapie externe[65] .
Exemple : le dispositif DigtaSoft Voice medical est un des outils permettant de répondre aux exigences des professionnels de santé dans sa dictée. Le dispositif intègre un lexique médical pour la médecine et ses spécialités. Le point fort : DigtaSoft propose des modèles rapports de diagnostic déjà établis. Ainsi, avec une utilisation adaptée à la fonction du praticien, DigtaSoft facilite le travail du radiothérapeute en lui faisant gagner du temps pour se consacrer davantage au suivi du patient [66] . Enfin, la dernière idée est que le patient rapporte lui-même ses symptômes après le traitement au radiothérapeute. On parle de PRO (patients reported outcomes), il s’agit d’une fiche que le patient remplit tout seul indépendamment de l’oncologue. Le National Cancer Institute (NCI) [67] a créé un système d’enregistrement des saisies du patient en ligne du nom d’ePRO. En France, ce système n’est pas encore utilisé à un niveau national. Cependant, depuis l’adoption de la réforme du système de santé “Ma santé 2022” [68] pour améliorer le système de soins, l’implémentation des PRO est fortement soutenue par l’HAS qui souhaite déployer son utilisation sur le territoire national [69].
Conclusion
Les innovations en radiothérapie ont pour principal but une amélioration des résultats obtenus lors du traitement tout en gardant une maîtrise des doses délivrées aux patients. Toutefois nous avons pu voir au cours de nos recherches que ces innovations prennent place à chaque étape du parcours de soins du patient. En mettant le patient au cœur des objectifs, certaines entreprises développent des solutions innovantes permettant aux personnes soignées de mieux vivre cette étape difficile de leur vie. L’innovation en radiothérapie doit répondre à de nombreux défis que se soit sur l’aspect clinique, sociétal ou encore technique.
Les interviews que nous avons pu avoir avec différents acteurs du secteur de la radiothérapie nous ont aussi permis de prendre du recul sur la pertinence de certaines innovations. De plus, de nombreuses alternatives voient le jour avec l’utilisation des ultrasons ou encore la cryogénie qui ouvrent de nouvelle voies de guérison dans la lutte contre le cancer et qui pourraient peut être à terme remplacer l’utilisation des rayons X. Cependant, avec les dernières annonces en novembre 2022 de la signature d’un accord entre le Conseil européen pour la recherche nucléaire (CERN), le Centre hospitalier universitaire vaudois (CHUV) et la société THERYQ concernant : le développement d’un dispositif médical permettant des essais cliniques de flash radiothérapie d’ici 2025 et l’espoir d’une nouvelle solution de traitement en radiothérapie semble plus concret.