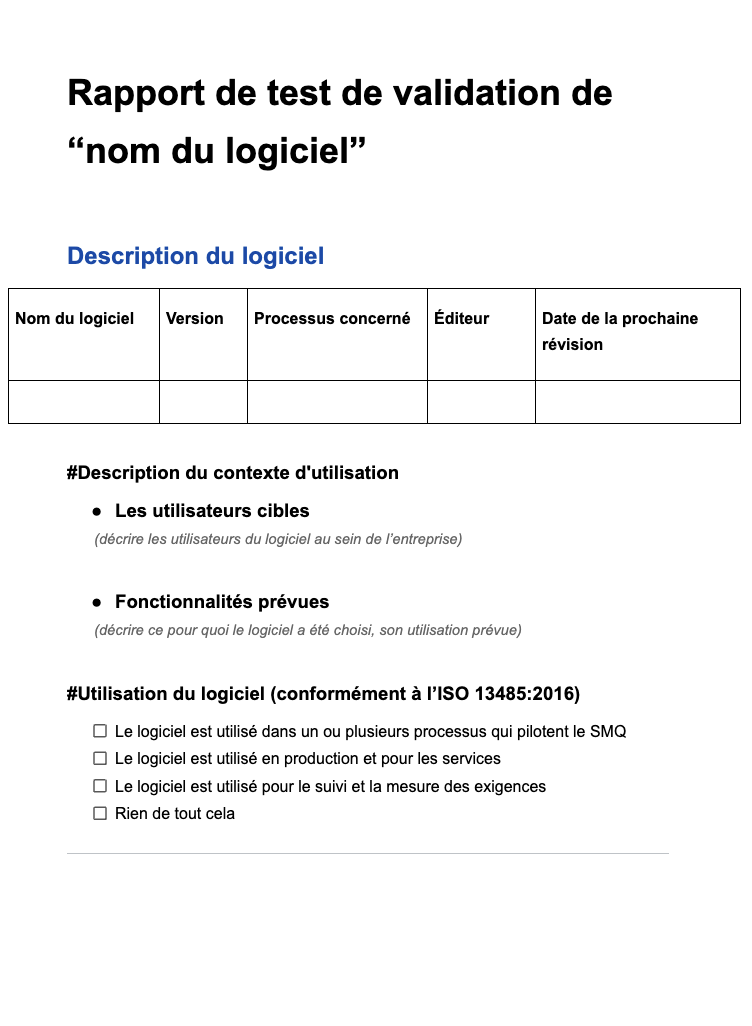
IDS233 - Mise en place de la procédure de validation des applications logicielles conformément à l'ISO 13485:2016
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Autrice

Contacts
- Maryse de PETANG : marysedepetang@gmail.com
Citation
A rappeler pour tout usage : M. de PETANG, « Mise en place de la procédure de validation des applications logicielles conformément à l'ISO 13485:2016 », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Dispositifs médicaux et affaires réglementaires, Mémoire d'apprentissage, https://travaux.master.utc.fr/, réf n° IDS233, juillet 2024, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids233/
Résumé
La validation des applications logicielles dans le secteur des dispositifs médicaux numériques revêt une importance capitale pour garantir la conformité et la sécurité des patients. Conformément à la norme ISO 13485:2016+AC:2016, cette pratique est cruciale pour minimiser les risques associés aux logiciels défaillants, indispensables aux entreprises utilisant ces technologies dans des processus critiques. À l'heure actuelle, l'utilisation généralisée des logiciels dans toutes les facettes des opérations des entreprises de dispositifs médicaux en fait une exigence incontournable.
La mise en place d'un processus de validation des applications logicielles permet d'observer des améliorations significatives en termes de conformité et de sécurité des dispositifs médicaux. En suivant une approche méthodique conforme à l’ISO 13485 et en impliquant les équipes de l’entreprise, il est possible de réduire efficacement les risques associés aux logiciels tout en optimisant les processus internes. Ces efforts renforcent non seulement la conformité réglementaire, mais également la fiabilité et l'efficacité des produits, ce qui contribue à assurer la sécurité et la satisfaction des utilisateurs et des patients.
En conclusion, ce mémoire d’apprentissage présente un cas pratique illustrant la validation d’une application logicielle utilisée dans la production de dispositifs médicaux numériques : Github, soulignant les risques élevés en cas de défaillance.
Abstract
Validation of software applications in the digital medical device sector is of paramount importance in ensuring compliance and patient safety. In line with ISO 13485:2016+AC:2016, this practice is crucial to minimizing the risks associated with faulty software, essential for companies using these technologies in critical processes. Today, the widespread use of software in all facets of medical device company operations makes it an unavoidable requirement.
Implementing a software application validation process can deliver significant improvements in medical device compliance and safety. By following a methodical approach that complies with ISO 13485, and by involving the company's teams, it is possible to effectively reduce the risks associated with software, while optimizing internal processes. These efforts reinforce not only regulatory compliance, but also product reliability and efficiency, helping to ensure user and patient safety and satisfaction.
In conclusion, this learning memoir presents a case study illustrating the validation of a software application used in the production of digital medical devices : Github, highlighting the high risks in the event of failure.
Téléchargements