IDS255 - Technologies d'exploration fonctionnelle respiratoire
DOI mémoire
https://doi.org/10.34746/ids255Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs




Contacts
- JIMENEZ Juanita : juanitajimenezn@hotmail.com
- LEMOINE Hugo : hugolemoine01@gmail.com
- PELLEGER Raphael : r.pelleger@gmail.com
- DIOMANDE Iman : lyne.diomande@gmail.com
Citation
A rappeler pour tout usage : Jimenez Juanita, Lemoine Hugo, Pelleger Raphael, Diomande Iman, "Les technologies de l'exploration fonctionnelle respiratoire", Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies biomédicales et territoires de santé (TBTS), Mémoire de projet, janvier 2025, Bibliothèque des travaux Master, réf n°IDS255, https://doi.org/10.34746/ids255, url direct : https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids255
Résumé
Ce document traite des technologies d'exploration fonctionnelle respiratoire (EFR), essentielles pour le diagnostic et la gestion des maladies respiratoires telles que la BPCO et l'asthme. Le rapport est destiné aux ingénieurs biomédicaux en particulier, afin de les guider dans l’évaluation, l’utilisation et l’intégration de ces dispositifs médicaux dans un cadre clinique. Il détaille la physiologie respiratoire, y compris l'anatomie pulmonaire et les capacités et volumes pulmonaires, pour comprendre les bases nécessaires à l'interprétation des EFR. Les techniques principales d'EFR incluent la spirométrie, la pléthysmographie et la gazométrie artérielle, chacune fournissant des informations vitales sur les capacités respiratoires des patients. Le projet souligne également l'importance de ces technologies dans le parcours de soins, en intégrant les innovations comme la spirométrie 3D et la tomographie d'impédance électrique, pour améliorer la précision diagnostique et le traitement des maladies respiratoires. En explorant les pathologies restrictives et obstructives, le document illustre comment les EFR s'insèrent dans la gestion clinique et le suivi des patients, soulignant ainsi leur rôle dans la prise en charge des maladies respiratoires en France.
Abstract
This document discusses the technologies of functional respiratory exploration (EFR), crucial for the diagnosis and management of respiratory diseases such as COPD and asthma. The guide is intended for biomedical engineers in particular, to assist them in the evaluation, use and integration of these medical devices in a clinical setting. It details respiratory physiology, including lung anatomy and pulmonary capacities and volumes, to understand the foundational knowledge necessary for interpreting EFR. The primary EFR techniques discussed include spirometry, plethysmography, and arterial blood gas analysis, each providing vital information about patients' respiratory capabilities. The project also emphasizes the importance of these technologies in the care pathway, integrating innovations like 3D spirometry and pulmonary MRI with hyperpolarized gases to enhance diagnostic accuracy and treatment of respiratory diseases. By exploring restrictive and obstructive pathologies, the document illustrates how EFRs are integrated into clinical management and patient follow-up, highlighting their critical role in the care of respiratory diseases in France.
Téléchargements

Mémoire Complet
Les technologies de l'exploration fonctionnelle respiratoire
I. Introduction, problématique et présentation du contexte
Les maladies respiratoires sont une cause majeure de mortalité et de morbidité en France, représentant un défi primordial pour la santé publique. Ces pathologies sont responsables d'environ 98 700 décès annuels [1]. C’est pour cette raison que cette étude porte un intérêt aux technologies de l’exploration fonctionnelle pulmonaire qui possèdent un degré d'importance significative lors de la prise en charge de nombreuses pathologies respiratoires.
Les explorations fonctionnelles respiratoires (EFR) englobent l’ensemble des examens cliniques qui permettent l’évaluation des capacités respiratoires d’un patient. Ces examens peuvent être prescrits dans le cas du diagnostic ou suivi des pathologies respiratoires ou maladies avec atteinte respiratoire, d’une évaluation de la fonction pulmonaire avant une intervention chirurgicale ou afin d’étudier les possibles complications respiratoires dues à la prise de certains médicaments. Les techniques sont nombreuses et il est important d'adapter les modalités d'examen à la pathologie suspectée afin d'améliorer la prise en charge du patient.
Une maladie respiratoire désigne une affection qui impacte le système respiratoire et qui peut entraîner, dans certains cas, des difficultés respiratoires. Ces pathologies comprennent à la fois des infections respiratoires aiguës, telles que la pneumonie, la grippe et la bronchite, ainsi que des maladies respiratoires chroniques, comme la bronchopneumopathie chronique obstructive (BPCO), l'asthme et le cancer du poumon [2]. En France, en 2022, 3 881 800 personnes ont été prises en charge pour une maladie respiratoire chronique [1], hors mucoviscidose. C’est pourquoi il est important d’étudier les pathologies associées au système respiratoire, ainsi que les différentes modalités de diagnostic permettant de mieux comprendre le choix du dispositif de diagnostic.
De nos jours, les EFR demeurent en marge par rapport à d'autres domaines de santé comme la cardiologie ou la neurologie. L’étude a pour objectif d’explorer les pathologies respiratoires les plus fréquentes en France, les EFR et leurs applications cliniques, en excluant les techniques d’imagerie médicale. Ceci en tenant en compte de toutes les tranches d’âge : les enfants, les adultes et personnes âgées.
Ce rapport va répondre à la problématique suivante :
Comment les technologies d’explorations fonctionnelles respiratoires contribuent-elles au diagnostic des pathologies respiratoires et s’intègrent-elles dans le parcours de soins en France ?
L’enjeu principal de ce rapport est de pouvoir orienter l’ingénieur biomédical lorsqu’il se retrouve face à ces technologies. Il vise à lui donner une compréhension de leur fonctionnement et une présentation de leur place dans la prise en charge des patients, afin de prendre les décisions nécessaires pour offrir un parcours de soin adapté.
II. Les principes fondamentaux de la physiologie respiratoire
1. Anatomie pulmonaire
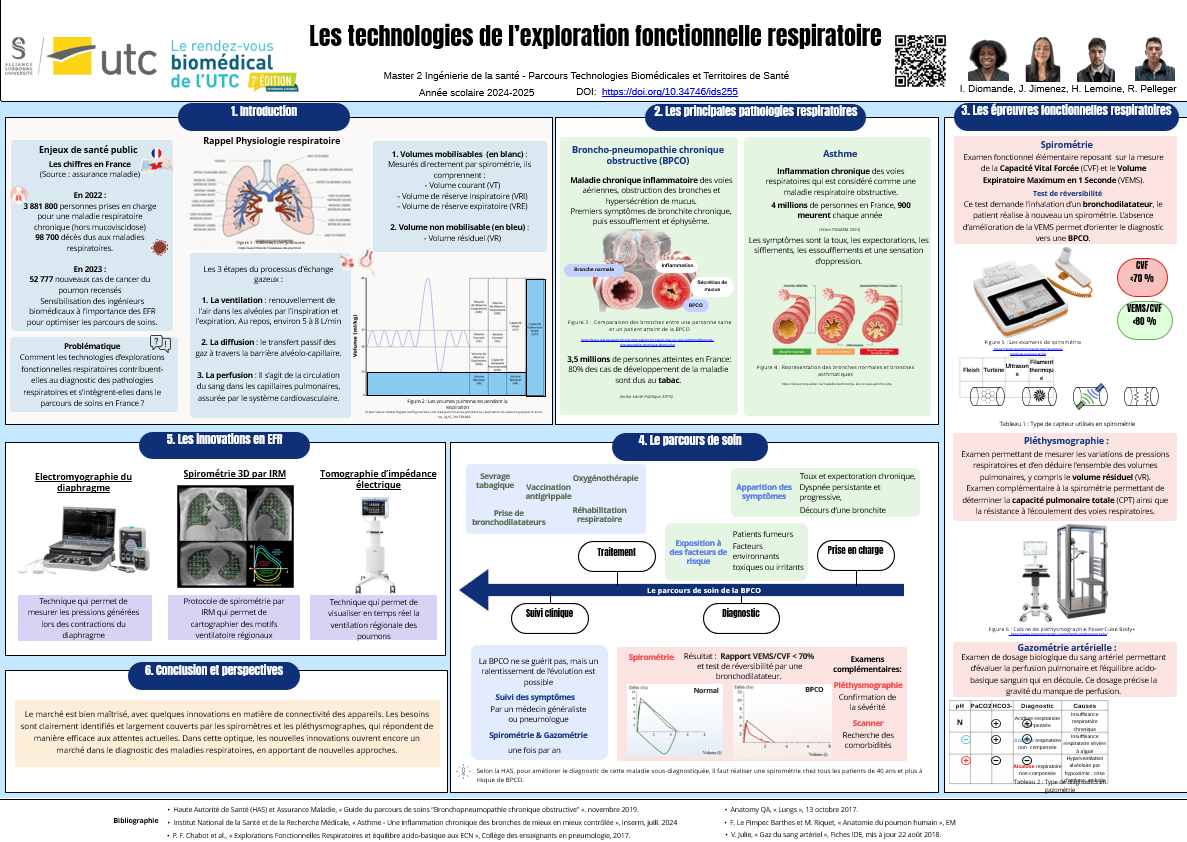
Les poumons sont des organes essentiels du système respiratoire, situés dans la cavité thoracique. Chaque poumon a une forme conique, avec une base reposant sur le diaphragme et un sommet (apex) s'étalant au-dessus de la clavicule. Les poumons sont enveloppés par une membrane séreuse appelée plèvre, composée de deux feuillets : le feuillet viscéral collé directement à la surface du poumon, et le feuillet pariétal tapissant la paroi thoracique interne [3] [4]. Dans cette partie nous allons faire quelques rappels physiologiques afin de consolider un socle de connaissance qui seront utiles pour la compréhension du projet.
A. Segmentation pulmonaire
Chaque lobe pulmonaire est subdivisé en segments broncho pulmonaires, qui sont des unités anatomiques et fonctionnelles du poumon. On compte généralement 10 segments (voir figure 1) dans le poumon droit et 9 à 10 dans le poumon gauche. Cette segmentation est importante en clinique, notamment pour localiser précisément des lésions pulmonaires.
Figure 1 : L’anatomie segmentaire des poumons (Source : Médecine Savoir) [5]
B. Hile pulmonaire
Le hile est une région primaire située sur la face médiastinale de chaque poumon. C'est par cette zone que passent les structures essentielles entrant et sortant du poumon comme les bronches principales, l’artère pulmonaire, les veines pulmonaires, les vaisseaux bronchiques, les nerfs ou encore les vaisseaux lymphatiques [6].
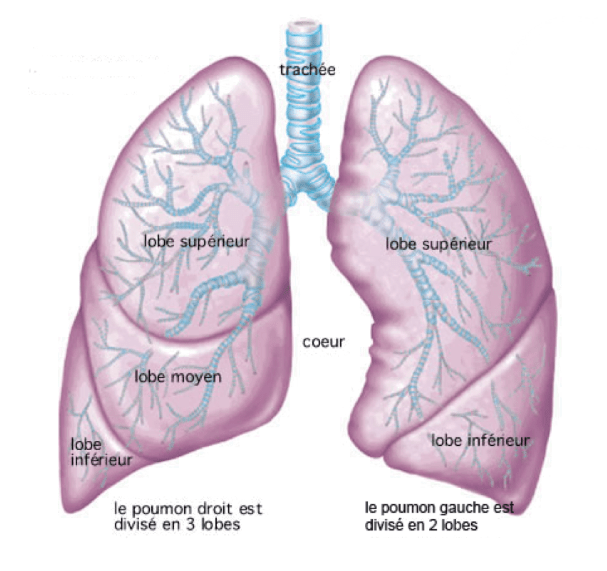
C. Structure microscopique
Les poumons sont principalement constitués de lobules pulmonaires qui s’articulent autour d’une bronchiole terminale, puis en sac alvéolaires qui contiennent les alvéoles (voir figure 2), lieu des échanges gazeux entre l’air et le sang [6].
Figure 2 : Mécanisme des échanges gazeux au niveau alvéolaire (Source : Assistance Scolaire Personnalisée) [7]
La paroi alvéolaire est fine (0,2 μm d'épaisseur) et est hautement vascularisée, permettant la diffusion efficace des gaz. La surface totale d'échange dans les poumons humains est estimée à environ 140 m².
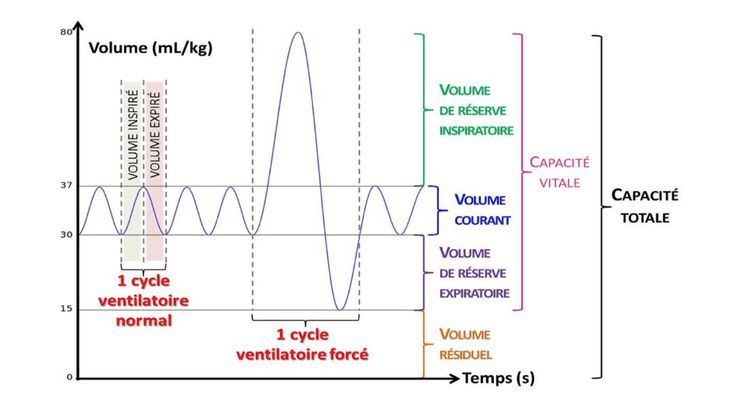
2. Volumes et capacités du poumon
Les volumes et capacités pulmonaires sont des mesures essentielles pour évaluer la fonction respiratoire. Ils fournissent des informations sur la quantité d'air que les poumons peuvent contenir et mobiliser lors de la respiration. Ces volumes et capacités pulmonaires vont avoir des conséquences et sont des sources d’informations précieuses pour les EFR.
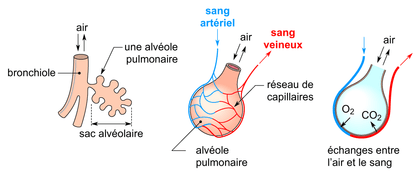
A. Les volumes pulmonaires
Les volumes pulmonaires se divisent en deux catégories principales qui sont les volumes mobilisables et non mobilisables (voir figure 3) :
Les volumes mobilisables : sont mesurables directement par spirométrie, et comprennent :
- Le Volume courant (VT) : Volume d'air inhalé et expiré lors d'une respiration normale au repos. Il est généralement d'environ 500 ml.
- Le Volume de réserve inspiratoire (VRI) : Volume d'air supplémentaire pouvant être inspiré après une inspiration normale.
-Le Volume de réserve expiratoire (VRE) : Volume d'air supplémentaire pouvant être expiré après une expiration normale.
Le volume non mobilisable :
- Le Volume résiduel (VR) : Volume d'air restant dans les poumons après une expiration forcée maximale. Il est d'environ 1200 ml et ne peut être mesuré directement par spirométrie.
B. Les capacités pulmonaires
Les capacités pulmonaires sont des combinaisons de volumes pulmonaires (voir figure 3) :
1. Capacité vitale (CV) : Somme du volume courant, du volume de réserve inspiratoire et du volume de réserve expiratoire. Elle représente le volume maximal d'air pouvant être mobilisé entre une inspiration et une expiration maximale.
2. Capacité pulmonaire totale (CPT) : Volume total de gaz contenu dans les poumons à la fin d'une inspiration maximale. Elle est la somme de la capacité vitale et du volume résiduel.
3. Capacité résiduelle fonctionnelle (CRF) : Volume d'air restant dans les poumons après une expiration normale. Elle est la somme du volume de réserve expiratoire et du volume résiduel.
Figure 3 : Les volumes pulmonaires de la respiration (Source : profSVT OEHMICHEN) [8]
Ces fondamentaux de la physiologie du poumon sont exploités en EFR et permettent le diagnostic d’une variété de pathologies. Souvent multifactorielles, ces pathologies respiratoires demandent une étude précise pour que soient connues les causes d’origines pour ensuite adapter un traitement et son suivi.
3. Paramètres importants en pneumologie
Afin de mieux comprendre les explications futures, il est important de définir certains paramètres respiratoires :
- VEMS (Volume Expiratoire Maximal en 1 Seconde) :
Le VEMS mesure la quantité maximale d'air qu'une personne peut expirer en une seconde après une inspiration maximale. Ce paramètre est primordial pour évaluer la fonction pulmonaire, notamment dans le diagnostic et le suivi de maladies obstructives comme la bronchopneumopathie chronique obstructive (BPCO) ou l'asthme. Un VEMS réduit indique souvent une obstruction des voies aériennes.
- DEP (Débit Expiratoire de Pointe) :
Le DEP mesure la vitesse maximale à laquelle une personne peut expulser l'air de ses poumons après une inspiration complète. C'est un indicateur simple et rapide qui aide à évaluer le degré de rétrécissement des voies aériennes. Le DEP est souvent utilisé par les patients asthmatiques pour surveiller leur état au quotidien. Une valeur basse peut signaler une exacerbation de l'asthme ou une nécessité d'ajuster le traitement.
- CVL (Capacité Vitale Lente) :
Le CVL, ou Capacité Vitale Lente, est le volume maximal d'air qu'une personne peut expulser des poumons après une inspiration maximale, mais effectuée à un rythme lent et contrôlé. Ce paramètre est essentiel pour évaluer la quantité totale d'air que les poumons peuvent contenir et est utilisé pour détecter des restrictions pulmonaires. Un CVL réduit peut indiquer des conditions telles que la fibrose pulmonaire ou d'autres maladies obstructives des poumons.
III. L’intégration des EFR dans le diagnostic des pathologies respiratoires
1. Les pathologies respiratoires
Quand on se concentre sur les différentes maladies pulmonaires, il y a différentes raisons qui peuvent altérer le fonctionnement des poumons.
Le premier type de problème respiratoire qu’on peut rencontrer ce sont les difficultés à faire rentrer l’air à l’intérieur des poumons, c’est le cas des maladies pulmonaires dites restrictives. Au contraire, dans le cas d’une maladie pulmonaire obstructive, le patient peut avoir du mal à faire sortir l’air des poumons. Il peut y avoir d’autres dysfonctionnements physiologiques comme les troubles de diffusion pulmonaire qui désignent un problème lors des échanges gazeux entre les alvéoles et les capillaires sanguins. Enfin dans le cas des troubles de perfusion pulmonaire, le sang n’arrive pas au niveau de la surface d’échange au contact des alvéoles.
Plus précisément, les pathologies restrictives correspondent à la limitation de la quantité d’air qu’on est capable d’inspirer à chaque cycle respiratoire. Le problème principal dans ces maladies repose sur la difficulté à faire rentrer de l’air dans les poumons, et par conséquent, le volume pulmonaire est plus petit. Cette restriction peut être due à une myopathie (une maladie musculaire qui empêche le patient de gonfler ses poumons à chaque inspiration) ou une fibrose pulmonaire (perte d'élasticité du poumon), entre autres.
Les pathologies obstructives s’opposent aux pathologies restrictives. Dans ce cas, le patient a du mal à faire sortir l’air des poumons et, ainsi, le dysfonctionnement est présent lors du cycle expiratoire. En effet, les poumons peuvent avoir du mal à reprendre leur taille initiale à la fin de l’expiration. Une des raisons principales est que les bronches possèdent un épaississement de leur paroi, ce qui laisse moins de place pour que l’air puisse s’échapper des poumons, provoquant une respiration difficile.
En France, les services de pneumologie prennent en charge diverses pathologies respiratoires, telles que le cancer des poumons, la pneumonie, la pleurésie, la tuberculose, le syndrôme d’apnées du sommeil, entre autres. Cependant, cette étude se concentre particulièrement sur deux maladies : la broncho-pneumopathie obstructive et l’asthme, deux maladies obstructives.
Plus précisément, la broncho-pneumopathie chronique obstructive associe, dans des proportions variables, deux formes de dysfonctionnement : une bronchite chronique et un emphysème. Un autre exemple de pathologie obstructive courante est l’asthme qui désigne une maladie inflammatoire où l’obstruction des bronches n'apparaît qu’à chaque crise d’asthme. L’obstruction est donc réversible mais, crise après crise, des périodes d’inflammation chronique induisent des cicatrices et certaines fibroses pulmonaires accentuent l’obstruction. Il se peut que des pathologies mixtes aient à la fois un syndrome restrictif et un syndrome obstructif avec des sévérités variées.
A. BPCO
La broncho-pneumopathie chronique obstructive est une maladie chronique inflammatoire qui atteint notamment les bronches. Elle engendre une inflammation des voies aériennes et une obstruction lente et progressive des bronches, ce qui provoque une hypersécrétion de mucus. Ainsi, le tissu pulmonaire est inflammé et cela déclenche un dysfonctionnement cellulaire [9].
Les symptômes qui se déclenchent en premier sont similaires à ceux de la bronchite chronique ; c'est -à -dire une toux permanente, notamment le matin, et des expectorations régulières dues à la sécrétion de mucus au niveau des bronches. Néanmoins, ces symptômes vont évoluer et s’aggraver. Le patient va avoir du mal à respirer, il y a apparition d'un essoufflement, ce qui est caractéristique des maladies obstructives. Il est important de savoir qu'à ces symptômes, il peut s’ajouter un emphysème. Dans ce cas, les tissus qui entourent les alvéoles pulmonaires sont dégradés et perdent leurs propriétés élastiques, ainsi, les alvéoles ne peuvent pas se gonfler (voir figure 4). Il y a donc une diminution de la quantité d’oxygène qui passe dans la circulation sanguine, ce qui augmente la présence d’essoufflements et la difficulté à respirer [10] .
Figure 4 : Comparaison des bronches entre une personne saine et un patient atteint de la BPCO (Source : Ramsey Santé) [11]
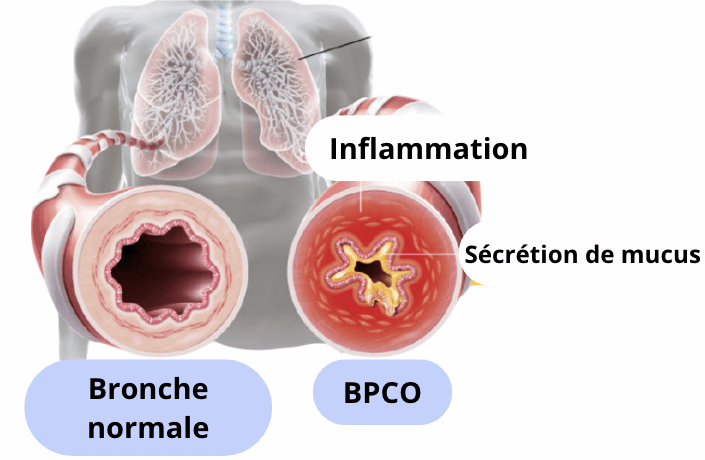
Les symptômes de la BPCO sont généralement négligés, elle est qualifiée comme “tueuse silencieuse” car ⅔ des personnes sont atteintes de cette maladie sans le savoir [12]. C’est une pathologie méconnue par le grand public mais elle n’est pas considérée comme maladie rare car 3,5 millions de personnes sont touchées en France [13], ce qui peut être un chiffre sous-estimé dû au sous-diagnostic important de celle-ci.
Le principal facteur de risque est le tabagisme, qu’il soit actif ou passif : 80% des cas de développement de la maladie sont dus au tabac [14]. En effet, les substances toxiques présentes dans le tabac détruisent l’épithélium bronchique constitué de cellules glandulaires et des cellules ciliées. Ces cellules ont des rôles indispensables dans la protection du tissu bronchique car les cellules glandulaires sécrètent un mucus qui enferme les impuretés qui ont pu arriver jusqu’aux bronches et les cellules ciliées vont expulser les microbes des voies aériennes grâce aux cils présents dans leur structure. Dans le cas des fumeurs, les cellules ciliées n’ont plus leur rôle nettoyant et les cellules glandulaires vont produire plus de mucus afin de compenser ce dysfonctionnement. En parallèle, la fumée du tabac peut également détruire les alvéoles pulmonaires.
Néanmoins, il y a d’autres causes de BPCO. La pollution de l’air intérieur et extérieur peut engendrer un phénomène similaire que dans le cas du tabac. De plus, l’exposition aux polluants industriels dans certains milieux professionnels comme dans le secteur minier, de la sidérurgie ou de la fonderie ont une probabilité plus importante d’apparition de cette pathologie. Finalement, le développement d’une infection au sein des voies respiratoires inférieures lorsque le patient est enfant, peut déclencher la BPCO lorsqu’il est adulte [9].
Selon l’Organisation Mondiale de la Santé (OMS), cette maladie pourrait être la troisième cause de mortalité en 2030 [15]. Cette pathologie demeure un véritable enjeu pour la santé publique mondiale, notamment pour les femmes en France, où la consommation de tabac a fortement augmenté entre 2019 et 2021 [16]. Le taux d'hospitalisation lié à la BPCO a augmenté de 15,5 % de 2007 à 2012 en France [17]. Il est important de savoir qu'à consommation égale de tabac, la femme est plus susceptible de développer des formes précoces et plus sévères de BPCO que l’homme [10].
En tant que maladie chronique, la BPCO ne peut pas être soignée définitivement mais une prise en charge du patient est indispensable afin de ralentir son évolution et d’en réduire les symptômes.
B. Asthme
L’asthme se caractérise par une inflammation chronique des voies respiratoires, ce qui les rend étroites et provoquent une difficulté à respirer. Cette pathologie est souvent banalisée ou sous-estimée, cependant elle touche 4 millions de personnes en France [18].
Les patients atteints ont des exacerbations ou des crises d’asthme qui sont généralement déclenchés par des substances qui sont présentes dans l’environnement. Lorsque ces molécules traversent les voies aériennes et arrivent au niveau des bronches, il y a une activation du système immunitaire inappropriée, forte et permanente dans la paroi ce qui provoque deux changements. Tout d’abord, le muscle lisse qui est autour de la bronchiole commence à se contracter de façon involontaire et soudaine, induisant un rétrécissement du calibre des bronches et des voies respiratoires. Deuxièmement, il y a une augmentation de la sécrétion du mucus au sein de l’appareil respiratoire, réduisant encore plus la lumière des bronches (voir figure 5). Quand ces deux syndromes sont combinés, il est difficile de respirer et c’est pour cette raison que l’asthme est considéré comme une maladie pulmonaire obstructive.
Figure 5 : Représentation des bronches normales et bronches asthmatiques (Source : Association pulmonaire du Québec) [19]
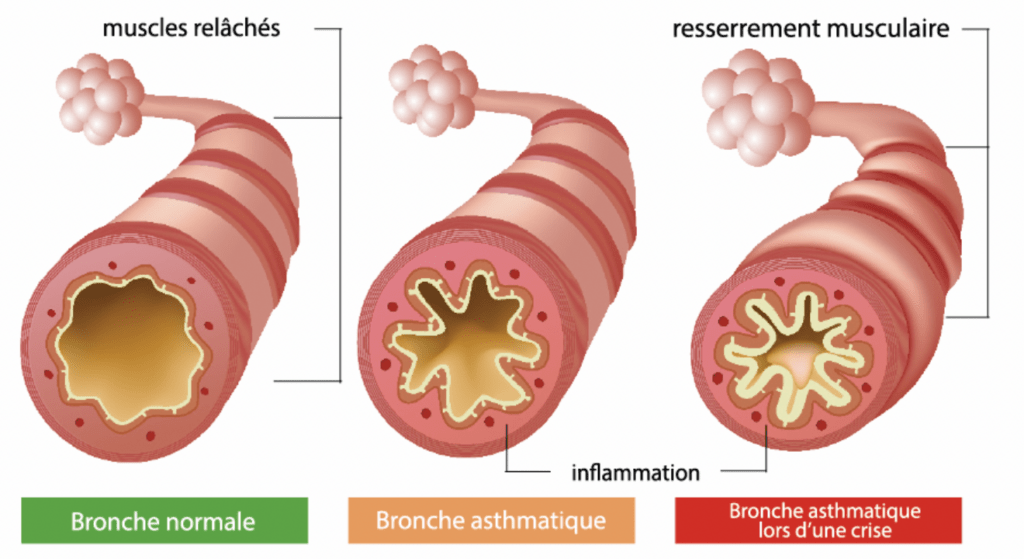
La substance qui déclenche la crise d’asthme peut varier d’une personne à une autre, les plus courantes sont les polluants comme la fumée de tabac, la pollution de l’air extérieur, ainsi que les allergènes comme la poussière, les poils d’animaux, les blattes et les moisissures [20].
Les symptômes les plus souvent associés à l’asthme sont la toux, les expectorations qui sont une conséquence de la surproduction du mucus causée par l’inflammation, les sifflements, les essoufflements, car cela demande un effort supplémentaire au patient pour pouvoir respirer, et une sensation d’oppression au niveau thoracique. Les erreurs de diagnostic sont très courantes à cause de la similitude des symptômes entre l’asthme, le syndrôme d’hyperventilation (dyspnée associée à une sensation d’essoufflement et oppression thoracique liées à l’anxiété) et un dysfonctionnement de cordes vocales, par exemple, qui engendre également un sifflement.
L’asthme peut être classé en fonction de la fréquence des symptômes (la nuit, le matin), la fréquence d’usage des médicaments inhalateurs pour aider à lutter contre les signes de l’asthme, le VEMS (le volume expiratoire maximal en 1 seconde, le DEP (le débit expiratoire de pointe). Ces deux indicateurs mesurent le volume d’obstruction dans les voies respiratoires. Par ordre croissant de sévérité, les types d’asthme sont l’asthme intermittent, l’asthme persistant léger, l’asthme persistant modéré et l’asthme persistant sévère.
Dans la plupart des cas, l’asthme apparaît pendant l’enfance. Plus de 10% des enfants sont asthmatiques [21]. Généralement, il y a une amélioration des symptômes à l’adolescence. Cependant, il peut y avoir des révélations d’asthme vers l’âge de 40 à 50 ans. En général, les causes de l’asthme chez l’enfant diagnostiqué avant l’âge de 12 ans sont pensées être dues à une plus forte influence génétique, alors que l’asthme d’apparition tardive est plus susceptible d’être en grande partie dû à des facteurs environnementaux.
L’asthme est une maladie chronique qui peut être contrôlée, néanmoins 900 personnes meurent encore chaque année à cause de l’asthme en France, pourtant les traitements existent [22].
2. Les technologies utilisées dans les EFR
Les EFR regroupent un nombre important de techniques de diagnostic pour des patientèles très variées allant de la pédiatrie au trouble chronique en gériatrie. Ces techniques incluent la réalisation de tests d’efforts maximum (VO2Max) pour du suivi post-opératoire, de la mesure d’insuffisance respiratoire pour patients multi-pathologiques ou encore l’évaluation d’un asthme chez l’enfant. Ces technologies reposent sur 3 modalités complémentaires qui couvrent les pathologies mentionnées précédemment : la spirométrie, la pléthysmographie corporelle et la gazométrie artérielle [23].
Les EFR et les épreuves fonctionnelles en général sont les parents pauvres des technologies biomédicales. Cependant, cette étude a révélé leur complexité et leur importance clinique. Nous proposons ici une analyse technique de ces équipements afin de guider les ingénieurs biomédicaux dans le choix de leur matériel.
A. La spirométrie
La spirométrie est l’examen élémentaire des EFR, présent pour tout diagnostic d'insuffisance respiratoire. Elle a pour objectif principal la mesure des débits et volumes d’air mobilisables d’un patient. La spirométrie repose sur l’analyse de courbe, les courbes volume-temps, ainsi que les courbes débit-volume. Cette information fonctionnelle peut varier de manière très importante en fonction des conditions de réalisation, ce qui demande une grande expertise de la part des utilisateurs et une grande précision de la part des équipements.
Figure 6 : Courbes typiques d’un patient sain (en bleu) et d’un patient atteint d’un trouble obstructif (en rouge) (Source : Eolys) [24]
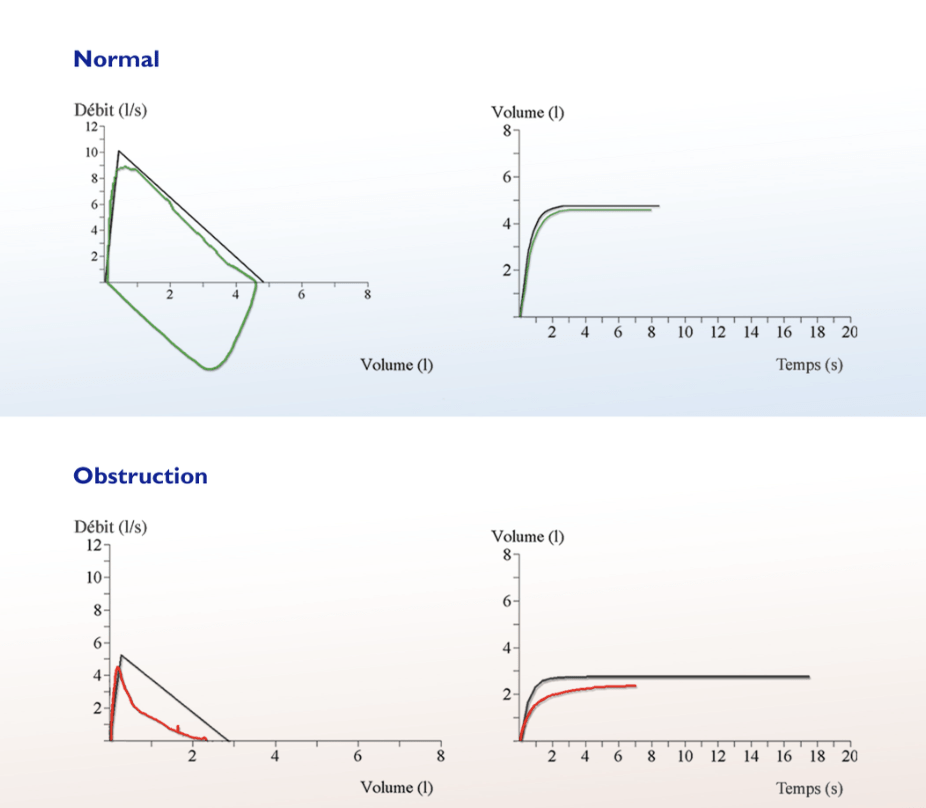
Un coefficient de Tiffeneau (VEMS/CVF) faible indique un Trouble Obstructif (TO) (voir figure 6) mais, pour préciser le diagnostic, un test de réversibilité est nécessaire. Ce test permet la distinction entre les 2 TO les plus fréquents, soit l'asthme ou la BPCO, en faisant inhaler un bronchodilatateur au patient.
Figure 7 : Schéma d'un circuit patient de spiromètre (Source : auteurs à partir de Medusoft) [25]
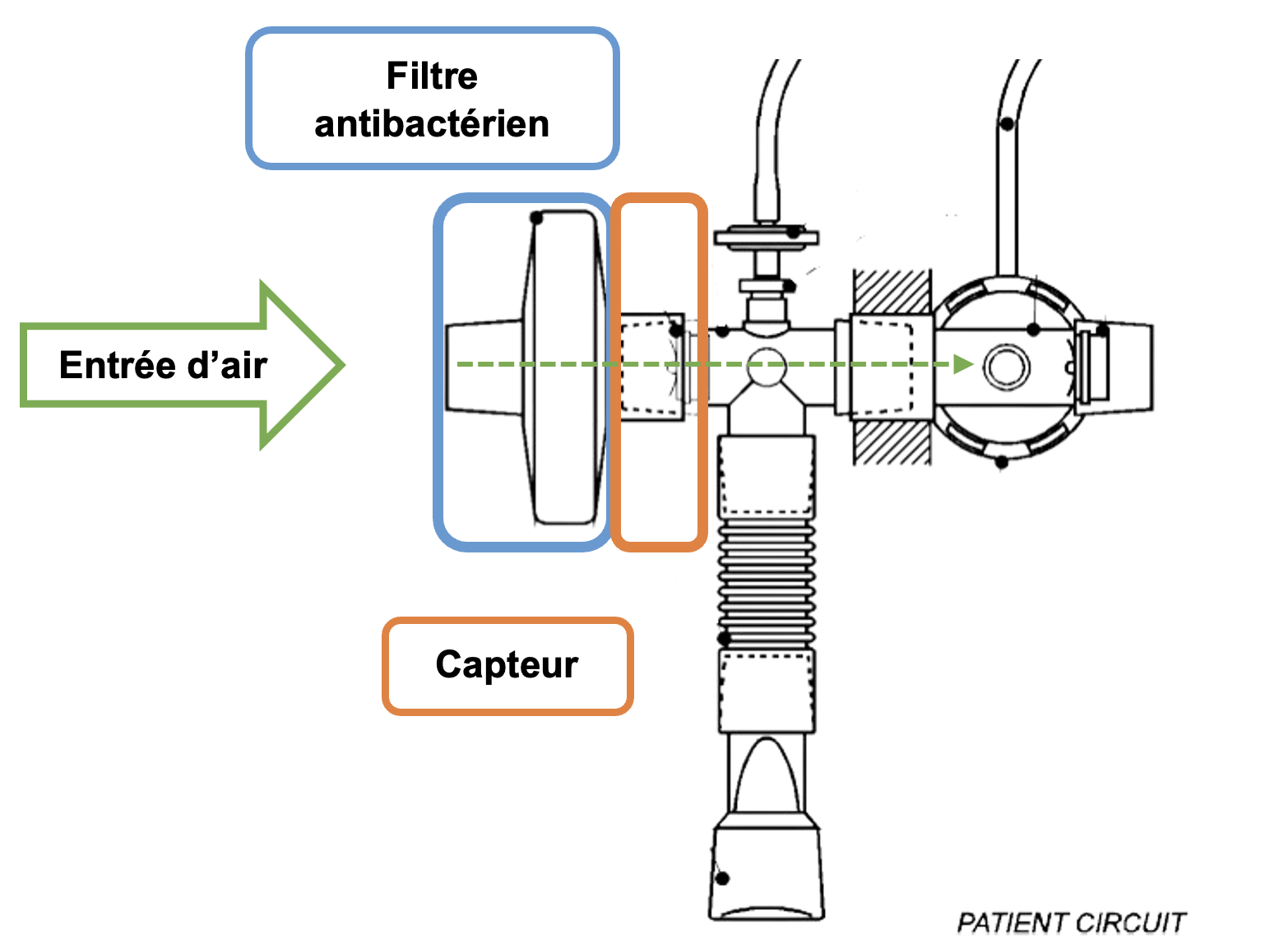
Le circuit patient
Les spiromètres existent sous deux formes de fonctionnement mais ont des éléments similaires. Le système principal est le circuit patient (voir figure 7) constitué d’un filtre bactérien, d’une entrée d’air et d’un capteur. Ces éléments sont toujours présents et sont aujourd’hui accompagnés d’un logiciel de traitement de l’information ainsi que d’un poste informatique pour visualiser les résultats.
Figure 8 : Spiromètre incitatif (Source : Consomed) [26]

Les spiromètres à volumes sont les premiers à exister et réalisent une mesure directe du volume d'air mobilisable par les poumons du patient. Ils fonctionnent généralement à l'aide d'un dispositif mécanique comme un soufflet ou une cloche à eau qui se déplace en fonction du volume d'air présent dans le système durant la respiration. Aujourd'hui cette technologie subsiste dans les spiromètres incitatifs mais n'est plus utilisée en clinique (voir figure 8). Il va être en général plus simple à l’usage et la compréhension pour le patient mais n’est plus un outil clinique en raison de sa faible précision et son besoin d’apport en O2 (circuit fermé).
Les spiromètres à débit sont largement utilisés en milieu clinique et constituent le gold standard pour le diagnostic de nombreuses pathologies respiratoires, telles que la BPCO et l'asthme chronique. Ils mesurent le débit d'air expiré, à partir duquel le volume est calculé. Ce type de dispositif repose sur différents types de capteurs, notamment les pneumo tachographes, les capteurs à ultrasons et les capteurs à fil chaud, chacun ayant ses avantages et des précautions spécifiques. Leur fonctionnement en circuit ouvert les rend moins coûteux pour le milieu clinique, tout en étant plus légers et portables que les spiromètres à volume. Cette portabilité leur permet également d'être utilisés pour le suivi des patients à domicile. La diversité des capteurs utilisés dans ces dispositifs reflète leur polyvalence et leur fiabilité dans différentes situations cliniques.
Pneumotachographe
Le pneumotachographe ou spiromètre de Fleish repose sur la mesure d’une variation de pression à travers une membrane en nid d’abeilles qui va avoir un effet résistif sur l’air expiré. Cette chute de pression est proportionnelle au débit respiratoire traversant la membrane. Cette technique connue et exploitée de longue date à une forte reconnaissance clinique et fut le standard en EFR pendant des décennies. Ce capteur permet des mesures précises de débit laminaire, particulièrement grâce à sa structure en nid d’abeilles. Cette technologie bien connue est souvent utilisée dans des études cliniques ou dans des centres spécialisés pour sa haute longévité (voir figure 9). Néanmoins, le spiromètre de Fleish est très sensible aux conditions ambiantes (température, pression atmosphérique, condensation, dépôts). Il nécessite donc un thermostat pour éviter les biais de mesure et un suivi assidu des utilisateurs autour de la calibration journalière. Il nécessite également un nettoyage récurrent pour réduire le risque de contamination [27].
Figure 9 : Capteur de Fleish (Pneumotachographe) (Source : MGC Diagnostic) [28]

Turbine
Les spiromètres à turbine fonctionnent en mesurant la vitesse de rotation d’une hélice entraînée par le flux respiratoire expiré, ce qui permet d’en déduire les volumes correspondant. Cette technologie présente l’avantage d’une mesure directe des débits et d’une moindre sensibilité aux conditions ambiantes, surtout si l’hélice est fabriquée en matériaux peu thermosensibles comme le carbone ou le Kevlar. Cependant, ils nécessitent une calibration quotidienne pour compenser l’inertie liée à l’accumulation de corps étrangers (salive, débris) et sont moins précis à faible débit, avec un risque de sous-estimation de la capacité vitale. Les turbines fixes, en particulier, requièrent une maintenance et un nettoyage fréquents pour garantir leur fiabilité.
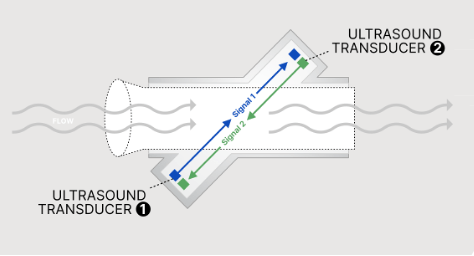
Ultrasons
Les spiromètres à ultrasons fonctionnent à l'aide de deux capteurs positionnés de part et d'autre d'un conduit respiratoire : un émetteur génère des ondes ultrasonores, et un récepteur enregistre les variations de fréquence des ondes en fonction du flux d'air. Basé sur l'effet Doppler (voir figure 10), ce mécanisme permet de mesurer avec précision les débits respiratoires, qu'ils soient inspiratoires ou expiratoires. Ces dispositifs présentent plusieurs avantages, notamment une excellente stabilité des mesures, une calibration minimale, et une indépendance vis-à-vis des conditions externes. Cependant, leur utilisation nécessite de tenir compte de certaines contraintes : les filtres consommables sont associés avec le capteur et certains composants internes, engendrant des coûts supplémentaires, et leur remplacement régulier est essentiel pour garantir des performances optimales. Ces caractéristiques en font un outil précieux, particulièrement adapté aux environnements cliniques où une précision élevée et une manipulation simple sont primordiales.
Figure 10 : Capteur de spiromètre à ultrason (Source : Schiller) [29]
Filaments thermiques
Les spiromètres à filaments thermiques mesurent le débit respiratoire en exploitant la différence de température entre l’air expiré, plus chaud, et l’air inspiré. Cette variation entraîne la dilatation ou la rétraction des filaments, ce qui est utilisé pour calculer le débit. Les filaments chauds offrent une faible résistance intrinsèque, favorisant une meilleure tolérance pour le patient, et sont peu sensibles aux variations des conditions environnementales. Cependant, ces dispositifs présentent des limitations : les filaments, souvent fragiles, ont une durée de vie restreinte et nécessitent l’utilisation d’un double capteur pour garantir une précision optimale. De plus, la linéarité du débit peut être moins fiable selon les modèles, ce qui impose une attention particulière à leur calibration et leur utilisation.
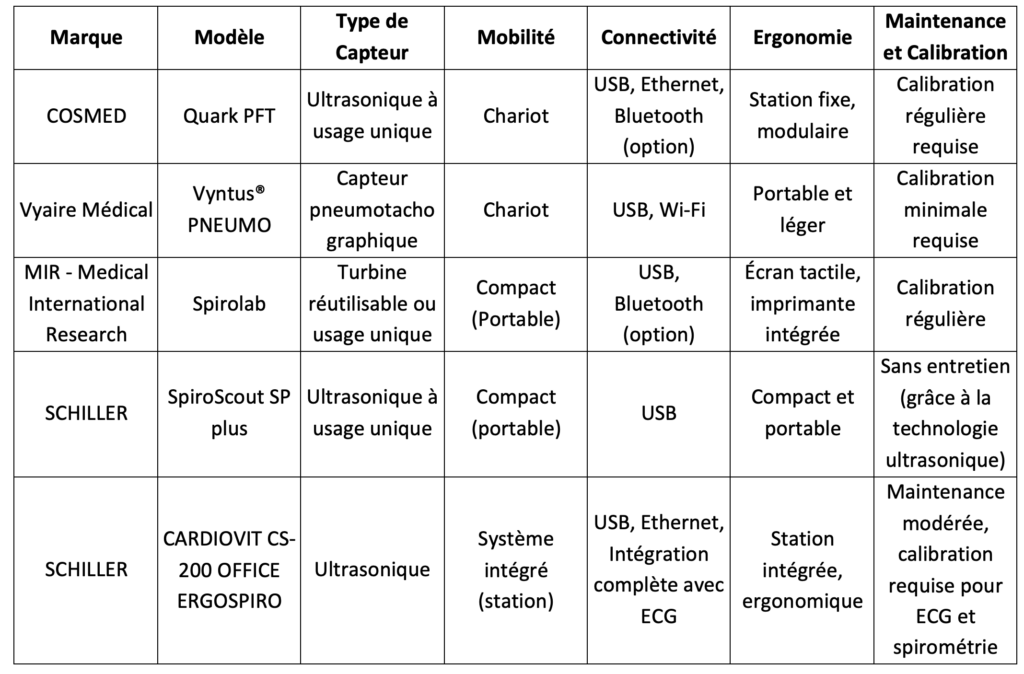
En résumé, chaque technologie de spirométrie présente des avantages et des inconvénients. Le choix du type de capteur dépend des besoins spécifiques de chaque centre ou clinique. Il faut donc prendre en compte tous les éléments pour une décision éclairée. Un tableau ( voir annexe 1) répertorie les principaux éléments pour déterminer le choix d’un spiromètre.
Le déroulement d’un examen clinique
Le déroulement d’une spirométrie nécessite une préparation minutieuse et le respect de protocoles pour garantir des résultats fiables.
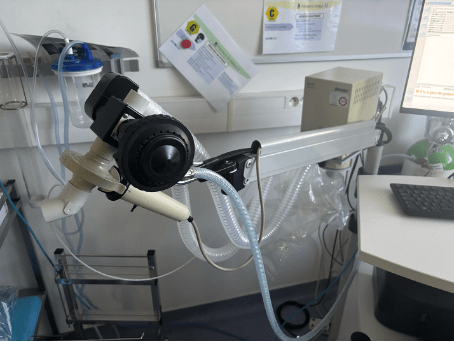
Tout d'abord, une calibration précise des équipements est indispensable (voir figure 11). Cela comprend l'allumage et la phase de chauffe du spiromètre d’environ 10 minutes, suivis du relevé des conditions atmosphériques (température, pression barométrique, hygrométrie) grâce aux capteurs internes de l’appareil, permettant de s'assurer que les conditions environnementales soient conformes. Ensuite, une seringue de 3 litres est utilisée quotidiennement pour vérifier la calibration des volumes. Un pompage est réalisé, simulant des inspirations et expirations à différents débits. Des vérifications supplémentaires sur des « étalons vivants » peuvent également être pratiquées selon les pratiques du centre.
En parallèle, la préparation du patient est tout aussi importante : une explication claire de la procédure par l’opérateur, complétée par des brochures explicatives, contribue à la bonne compliance du patient Il est également nécessaire d’actualiser les informations anthropomorphiques du patient lors de son arrivée au centre d’examen (poids, âge, taille, etc …) et de les reporter dans le logiciel du spiromètre [30].
Lors de l’effort, le patient est installé en position assise avec une posture correcte droite. Un embout buccal en caoutchouc neuf lui est installé ainsi qu’un pince-nez. Une manœuvre idéale consiste en 3 à 4 cycles de respiration calme, suivis d’une inspiration rapide et profonde et d’une expiration, forte et prolongée (au moins 6 secondes) sans pause ou toux, puis d’une reprise d’inspiration et d’une respiration normale. Une réalisation à minimum 3 reprises et maximum 8 doit permettre la confirmation de reproductibilité des courbes [31].
L’opérateur joue un rôle en encourageant le patient après chaque essai, en fournissant des commentaires précis sur l’effort réalisé et en prévoyant une minute de repos entre les essais pour obtenir ses trois manœuvres acceptables (sans dépasser huit essais). La réussite de l’examen repose sur la coopération du patient, capable de suivre les consignes, et sur l’expérience de l’opérateur pour guider efficacement chaque étape.
Figure 11 : Appareil de spirométrie à l’AP-HP Pitié Salpêtrière (source : auteurs)
Les valeurs observées sont rapportées à des valeurs théoriques obtenues chez des individus sains de même âge, sexe et taille. La comparaison est indispensable dans l'interprétation mais n’empêche pas la prise en compte de la qualité de réalisation uniquement retranscrit dans l’allure des courbes ou le nombre de tentatives échouées.
B. La pléthysmographie
La pléthysmographie est un examen d’EFR permettant de mesurer l’ensemble des volumes pulmonaires, y compris ceux qui ne peuvent pas être mesurés par spirométrie (VR et CPT). Elle est utilisée pour évaluer la compliance pulmonaire et thoracique, permettant le diagnostic et le suivi de maladies obstructives comme la BPCO ou l’asthme.
Historiquement, c’est grâce à Paul Bert en 1868 que la pléthysmographie a été introduite comme méthode permettant d’évaluer les variations de pression dans un système fermé, avant d’être adaptée à l’étude des fonctions pulmonaires [32].
Les principes physiques
Le patient est enfermé dans une cabine hermétique dont le volume est connu. Cette cabine se nomme un pléthysmographe. La boîte possède 3 capteurs : un capteur de débit ou pneumographe (mesure des RVA), un capteur de pression buccale ou ΔPbuc (estimation du VGT) et un capteur de pression de la boîte ou ΔPboîte (valeur de pression à l’intérieur de la cabine) [33]. Le pléthysmographe fonctionne selon deux modes : barométrique ou débimétrique [34].
Figure 12 : Cabine de pléthysmographie à la Pitié-Salpêtrière (Source : auteurs)

Le pléthysmographe barométrique est une cabine entièrement étanche (voir figure 12) utilisée pour mesurer les petites variations de volume pulmonaire.
Quand le patient inspire, le volume de la cabine reste constant, mais la pression à l'intérieur diminue. Cette baisse de pression est enregistrée par des capteurs et utilisée pour calculer les variations du volume pulmonaire. Comme la cabine est étanche, toute variation du volume pulmonaire entraîne une variation inverse de la pression dans la cabine [31].
Le pléthysmographe débimétrique est une cabine ouverte sur l'extérieur par une grille résistante utilisée pour mesurer les grandes variations de volume pulmonaire.
Lorsque le patient inspire ou expire, une fuite de gaz se produit à travers la grille. Cette fuite de gaz est mesurée par des capteurs de débit d'air. Les variations de débit d'air sont utilisées pour calculer les variations de volume pulmonaire.
Intérêts de la pléthysmographie
La pléthysmographie offre deux intérêts pour l'évaluation de la fonction respiratoire :
- La mesure du volume gazeux thoracique (Pression x Volume = Constante dans un système fermé): quantifier le volume d'air présent dans les poumons, y compris après une expiration complète, ce qu'on appelle le volume résiduel (VR) [35];
- Évaluation de la difficulté avec laquelle l'air circule dans les voies respiratoires (résistance des voies aériennes soit Raw) qui se fait en mesurant la différence de pression intérieur-extérieur de la cabine en fonction du débit d’air mesuré pendant la respiration [36].
Évaluation des résistances des voies aériennes
Le pléthysmographe mesure les variations de pression dans la cabine et à la bouche du patient pendant la respiration. La résistance des voies aériennes (Raw) est calculée en divisant la différence de pression entre les alvéoles et la bouche par le débit d'air (soit Raw = Palv - Pbuc / Débit) . Cela permet d'évaluer l'obstruction des voies respiratoires [37].
Le déroulement d’un examen de pléthysmographie
Dans le cadre d’une pléthysmographie, le patient est placé dans une cabine hermétique (fermée). Il doit être assis bien droit sur un siège, pieds à plat, jambes décroisées et épaules relâchées.
Avant l'examen, le patient remplit un questionnaire (possible traitement par oxygène, comorbidité cardiaque, claustrophobie) permettant à l’opérateur d’évaluer les contre-indications ou difficultés pour la réalisation qualitative de l’examen.
Afin de réaliser l’examen, le patient ferme sa bouche et ses lèvres autour d’un embout. Ensuite, on lui pince le nez avec un pince-nez. Dans un premier temps, il doit respirer normalement à son propre rythme pendant quelques semaines. Dans un deuxième temps, il va haleter (plusieurs cycles d’inspiration et d’expiration rapides). Le pléthysmographe va bloquer sa respiration pendant environ une seconde puis le patient reprend une respiration normale. Ensuite il vide ses poumons afin de prendre la plus grande inspiration possible. Puis au moment d'expirer, il va souffler le plus longtemps possible aux minimum 6 secondes.
Les contraintes de réalisations
Avant un examen de pléthysmographie, le patient doit respecter certaines consignes importantes : arrêter les médicaments comme les bronchodilatateurs la veille de l’examen, éviter les efforts physiques importants, ne pas fumer ni consommer d’alcool et privilégier un repas léger avant l’examen. Aussi, il est important de noter que c’est un examen d’EFR qui n’est pas indiqué en cas de grossesse. De même, l’enfermement dans la cabine peut être mal toléré par les patients claustrophobes.
La durée d’un examen de ce type évolue entre 15 et 45 minutes selon la validité des résultats et le respect des conditions de réalisation.
Les avancées technologiques
L'utilisation de dispositifs de pléthysmographie modernes présente de nombreux avantages pour optimiser les soins et mieux maîtriser les coûts. En intégrant plusieurs mesures (volumes pulmonaires, diffusion pulmonaire, résistance des voies respiratoires) dans une seule session, certains dispositifs permettent un gain de temps considérable et une simplification des processus. Réduction du nombre d'étapes dans une épreuve facilite la gestion pour le personnel, tout en rendant les examens plus rapides et plus accessibles aux patients. On peut citer comme exemple d’équipement le BodyBox de chez MGC Diagnostic qui permet en de réaliser l’ensemble des EFR avec un équipement unique.
Le confort du patient est également amélioré grâce à des conceptions adaptées qui réduisent l’anxiété et permettent une meilleure coopération. Les modèles sans cabine fermée, par exemple le MiniBox + de chez PulmOne (voir figure 13) , conviennent parfaitement aux patients claustrophobes ou à mobilité réduite, tandis que d'autres dispositifs intègrent des cabines modulaires adaptées aux fauteuils roulants comme le PowerCube Body + de chez Schiller. Cette attention portée au bien-être contribue à améliorer l’expérience des patients et en affecte la précision des mesures.
Figure 13 : MiniBox + (Source : PulmOne) [38]

Sur le plan économique, la polyvalence des pléthysmographe permet de réduire les coûts d’exploitation et de maintenance en limitant le besoin d’investissements dans des équipements multiples. Le coût d’un pléthysmographe étant assez peu important, il est primordial de choisir un équipement entièrement modulable. Ce qui simplifie la maintenance et prolonge la durée de vie des appareils, peut en augmenter le coût en consommable qui est un point de vigilance pour l’ingénieur biomédical. Par ailleurs, l’intégration des données dans les systèmes d’information hospitaliers est un atout majeur que tous les modèles ne possèdent pas. Les résultats centralisés sont facilement analysés, stockés et transmis, ce qui renforce la coordination des soins et accélère les prises de décision médicales. Ce confort est plébiscité par les praticiens mais demande une anticipation dans l’achat pour sa mise en service.
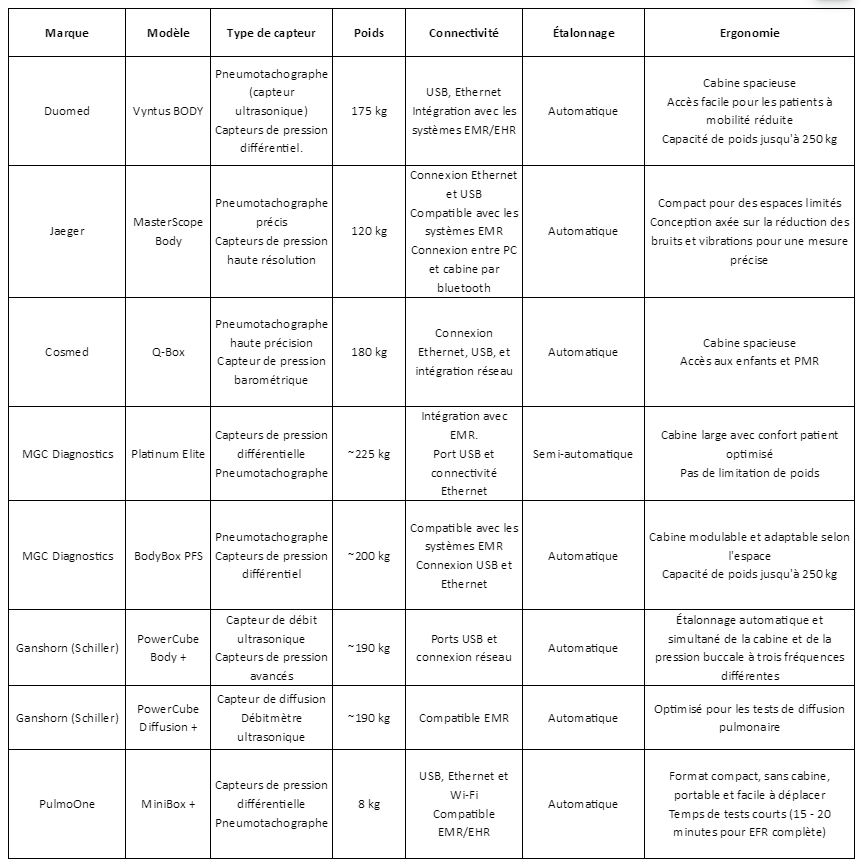
Les pléthysmographes de dernières générations combinent ainsi innovation, fiabilité et efficacité pour répondre aux exigences cliniques tout en améliorant la qualité des soins et en optimisant les ressources disponibles. Un tableau ( voir annexe 2) répertorie les principaux éléments pour déterminer le choix d’une cabine de pléthysmographie.
C. La gazométrie artérielle
La gazométrie est un examen d’analyse biologique intégré en EFR, qui permet de mesurer les gaz sanguins (oxygène et dioxyde de carbone) à partir d'une prise de sang provenant d'une artère [39].
Le principe physique
La gazométrie consiste à examiner les gaz présents dans le sang artériel (oxygène, dioxyde de carbone) afin d'évaluer les échanges gazeux et l'efficacité de diffusion des voies respiratoires. Pendant cet examen, une combinaison de différents paramètres permet d'évaluer les échanges gazeux alvéolaires. Le niveau d'oxygène dans le sang, connu sous le nom de PaO2 (en mmHg), la quantité de CO2 résiduelle dans le sang PaCO2 (mmHg) et le potentiel d'hydrogène (pH) du sang. Grâce aux mesures de ces paramètres, il est possible d'en obtenir d'autres. Par exemple, la concentration en hydrogénocarbonate, également connu sous le nom de HCO3- (mmol/L), joue un rôle de tampon du pH dans le sang, ce qui garantit la fonction d'homéostasie. Le taux d'oxygène mesurable dans le sang, appelé SaO2 (%), permet également d'évaluer la quantité d'oxygène présente dans l'hémoglobine [40].
La gazométrie est un examen qui offre donc deux avantages cliniques :
- L’évaluation de la fonction de diffusion d’un patient ;
- La détection des déséquilibres acido-basiques induit (acidose, alcalose).
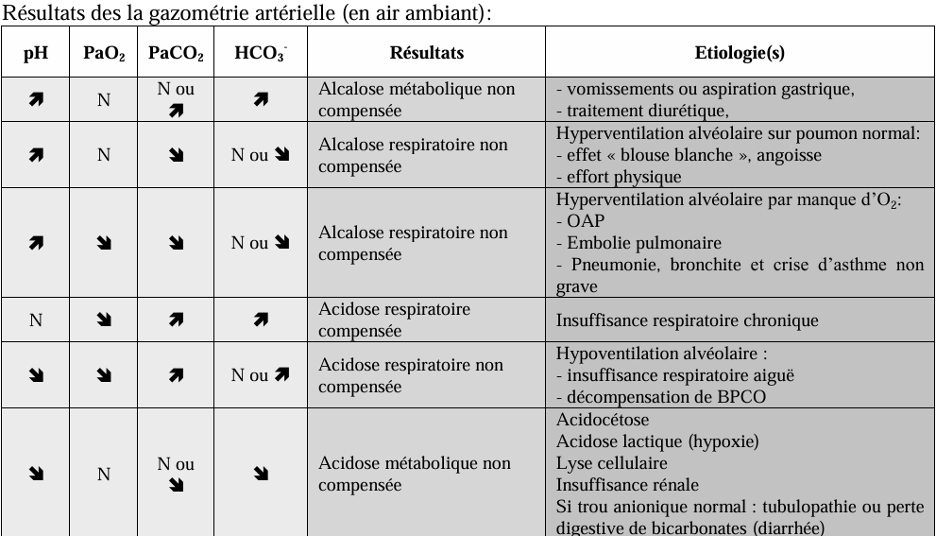
- L’interprétation des résultats est complexe et dépend des paramètres mesurés lors l'examen (voir tableau 1).
Tableau 1 : Interprétation des résultats de la gazométrie artérielle en air ambiant (Source : Collège des enseignants en pneumologie) [41]
Le déroulement d’un examen de gazométrie
Les conditions de réalisation
Pour réaliser une gazométrie, il s’agit d’une ponction de sang artériel pouvant être prélevé à différents endroits : le poignet (artère radiale), le bras (artère humérale), le lobe de l’oreille ou encore l’aine (artère fémoral). De manière fréquente, les résultats peuvent être disponibles en quelques minutes [42].
Les contraintes :
Avant un examen de gazométrie, le patient doit respecter certaines consignes importantes : arrêter les médicaments comme les bronchodilatateurs la veille de l’examen, éviter les efforts physiques importants, ne pas fumer ni consommer d’alcool et privilégier un repas léger avant l’examen. A noter que c’est un examen pouvant être légèrement douloureux. Un pansement compressif est posé à la fin du prélèvement pour prévenir d'éventuels hématomes.
IV. Le parcours de soin
Les technologies de l’exploration fonctionnelle respiratoire, présentées ci-dessous, sont fondamentales lors du diagnostic des maladies respiratoires comme la BPCO et l’asthme. Par conséquent, elles ont leur place dans la prise en charge des patients en France. En tant qu’ingénieur biomédical, il est indispensable de prendre connaissance du parcours de soin afin de prendre des meilleures décisions d’achat, gestion et optimiser les dispositifs médicaux en adéquation avec les besoins de l’établissement.
1. BPCO
Lorsque le patient présente un des symptômes cliniques révélant une possible BPCO, tels que des expectorations, une toux persistante et des essoufflements, il devrait consulter immédiatement le médecin. Notamment, si le patient est un fumeur ou s’il est exposé à des facteurs environnementaux qui sont toxiques ou irritants dans son quotidien.
Le diagnostic se fait principalement par spirométrie. A l'issue de l’examen, le professionnel de santé doit montrer que le patient possède un trouble ventilatoire obstructif qui est non réversible après le test de réversibilité avec l’inhalation de bronchodilatateurs (médicaments permettant de dilater les bronches du patient). Plus précisément, la spirométrie démontre un rapport VEMS/CVF qui est inférieur à 70%, ce qui est caractéristique de cette pathologie. Pour aller plus loin dans le diagnostic et connaitre la sévérité de la BPCO, les résultats spirométriques sont comparés aux valeurs de référence qui sont spécifiques selon la taille, le sexe, le poids et l’âge du patient (voir tableau 2). De même, le pneumologue peut effectuer un examen de pléthysmographie afin de confirmer le stade de la maladie. Enfin, comme 70% des patients présentent des comorbidités associées [43], un examen par imagerie médicale peut être conseillée afin de repérer un trouble sous-jacent comme l’obésité, le cancer broncho-pulmonaire, les pathologies cardiovasculaires, entre autres [44].
Tableau 2 : Résultats de VEMS permettant de classer le degré de sévérité de la BPCO (Source : Inserm) [45]

Une fois le diagnostic posé, il est indispensable d’insister sur l’importance du sevrage tabagique au patient. Néanmoins, il est important de savoir que la BPCO est une maladie sans guérison, mais un ralentissement de l’évolution de la pathologie est possible à l’aide des traitements. Selon les symptômes, il est possible d’effectuer une vaccination antigrippale pour les diminuer [46]. Pour les cas les moins graves, le pneumologue va prescrire des traitements médicamenteux qui se basent sur la prise de bronchodilatateurs afin de mimer une respiration correcte. Par contre, si le stade de la pathologie est très avancé, le patient va avoir besoin de l’oxygénothérapie de longue durée, où il y a une administration pendant 15 heures d’oxygène, une réhabilitation respiratoire et un suivi nutritionnel.
Un suivi clinique est nécessaire pour suivre l’amélioration des symptômes. Peu importe le stade de BPCO, le patient devra réaliser une spirométrie une fois par an, afin d’évaluer l’évolution de la maladie.
2. Asthme
La prise en charge du patient débute généralement par un interrogatoire avec un pneumologue afin de comprendre la maladie du patient individuellement. Ensuite, il y a lieu une auscultation qui va permettre de repérer un rétrécissement des bronches chez le patient asthmatique et, à l’aide du stéthoscope, le médecin va pouvoir remarquer un sifflement qui est caractéristique de cette pathologie.
Le test complémentaire d’EFR qui permet de poser le diagnostic est la spirométrie. Grâce à cet examen, le pneumologue évalue le volume d’air qui passe dans les bronches quand le patient expire, correspondant au VEMS. De plus, le patient va réaliser des efforts physiques à plusieurs reprises avant et après administration d’un bronchodilatateur tel que la ventoline. Si les bronches fermées s’ouvrent à nouveau après inhalation du médicament, le diagnostic est confirmé.
Mis à part le diagnostic de l’asthme, la spirométrie permet d’éviter les erreurs de diagnostic. En effet, les sifflements que le professionnel de santé peut percevoir avec le stéthoscope, ne sont pas forcément perçus que dans le cas de l’asthme mais aussi peuvent être présents lors d’infections respiratoires comme la bronchite ou la pneumonie.
Par la suite, le patient asthmatique peut poursuivre les examens pour trouver un traitement de fond mieux adapté à son asthme et afin d’améliorer sa qualité de vie.
Bien qu’il n’y ait pas de remède pour l’asthme, il y a des traitements disponibles qui peuvent aider à traiter les symptômes et empêcher l’apparition d’une crise d’asthme. Tout d’abord, les personnes asthmatiques devraient éviter ou minimiser le contact avec les substances de déclenchement. Il existe également un certain nombre de médicaments qui peuvent réduire les symptômes de l’asthme : les bronchodilatateurs tels que les agonistes bêta-adrénergiques de courte action et les anticholinergiques sont souvent administrés comme inhalateurs en urgence. Ces médicaments à action rapide provoquent un relâchement des muscles lisses et donc dilater les voies aériennes, les ouvrir de façon que le patient puisse respirer.
Les patients ayant des formes plus sévères pourraient avoir besoin de traitements supplémentaires comme des doses quotidiennes de corticoïdes, les agonistes des béta-bloquants de longue durée ou les antagonistes de leucotriènes. Dans des cas très graves, les corticostéroïdes par voie intraveineuse, le sulfate de magnésium et l’oxygénothérapie pourraient être nécessaires.
V. L'innovation et les nouvelles technologies en EFR
1. La contribution de l’ingénieur biomédical dans l’innovation
L'ingénieur biomédical joue un rôle important dans l'implémentation et la mise en place des nouvelles technologies en Explorations Fonctionnelles Respiratoires. Cette profession combine expertise technique et connaissance médicale pour intégrer efficacement les avancées technologiques dans les pratiques cliniques. L'ingénieur biomédical évalue les nouvelles technologies, s'assure de leur conformité avec les normes réglementaires et médicales, et forme le personnel de santé à leur utilisation. Il participe également à l'analyse des données collectées, ce qui contribue à améliorer les diagnostics et les soins aux patients. L'ingénieur biomédical est essentiel pour garantir que les innovations en EFR soient non seulement techniquement viables, mais aussi adaptées aux besoins spécifiques des patients et intégrées de manière fluide dans les parcours de soins. Nous allons maintenant nous focaliser sur trois innovations comme les EMG diaphragmatiques, la spirométrie 3D et tomographie d'impédance électrique (EIT).
2. Les EFR neuromusculaires : EMG diaphragmatique
L’électromyographie du diaphragme (EMG) est une technique très spécifique qui est utilisée dans le service de pneumologie de l’hôpital Pitié Salpêtrière de l'AP-HP. Contrairement à la spirométrie ou la pléthysmographie, l’EMG permet d’évaluer directement l’état fonctionnel du diaphragme.
Lors d’un examen, un électromyogramme (voir figure 14) est utilisé. Il va y avoir des stimulations magnétiques et le médecin va placer des plaques au niveau du cou du patient, créant ainsi un champ électrique qui stimule le nerf phrénique. Plus précisément, ce nerf est indispensable dans la respiration car il représente le nerf principal du diaphragme. Ensuite, les stimulations vont provoquer la contraction du diaphragme. Ainsi, afin de mesurer les pressions générées lors des contractions, des ballonnets en latex avec des capteurs de pression sont insérés par le nez et placés au niveau de l'œsophage et de l'estomac, sous anesthésie locale. Les capteurs de pression vont permettre de mesurer les variations de pression créées par la contraction du diaphragme.
Figure 14 : Électromyogramme chez Duomed (Source : Duomed) [47]
À chaque stimulation, des courbes apparaissent à l'écran, permettant au médecin de visualiser et d’évaluer précisément la contraction diaphragmatique. Cette technique donne des informations plus détaillées sur la dynamique musculaire et permet de distinguer les problèmes neuromusculaires des troubles mécaniques.
En tant qu'applications cliniques, cet examen est utile pour les patients atteints de maladies neuromusculaires comme la sclérose latérale amyotrophique ou la dystrophie musculaire, qui affectent indirectement la respiration. Dans le cas de la BPCO, les patients présentent fréquemment une altération de la force du diaphragme et donc ceci impacte leur capacité à respirer correctement [48].
3. La spirométrie 3D en IRM
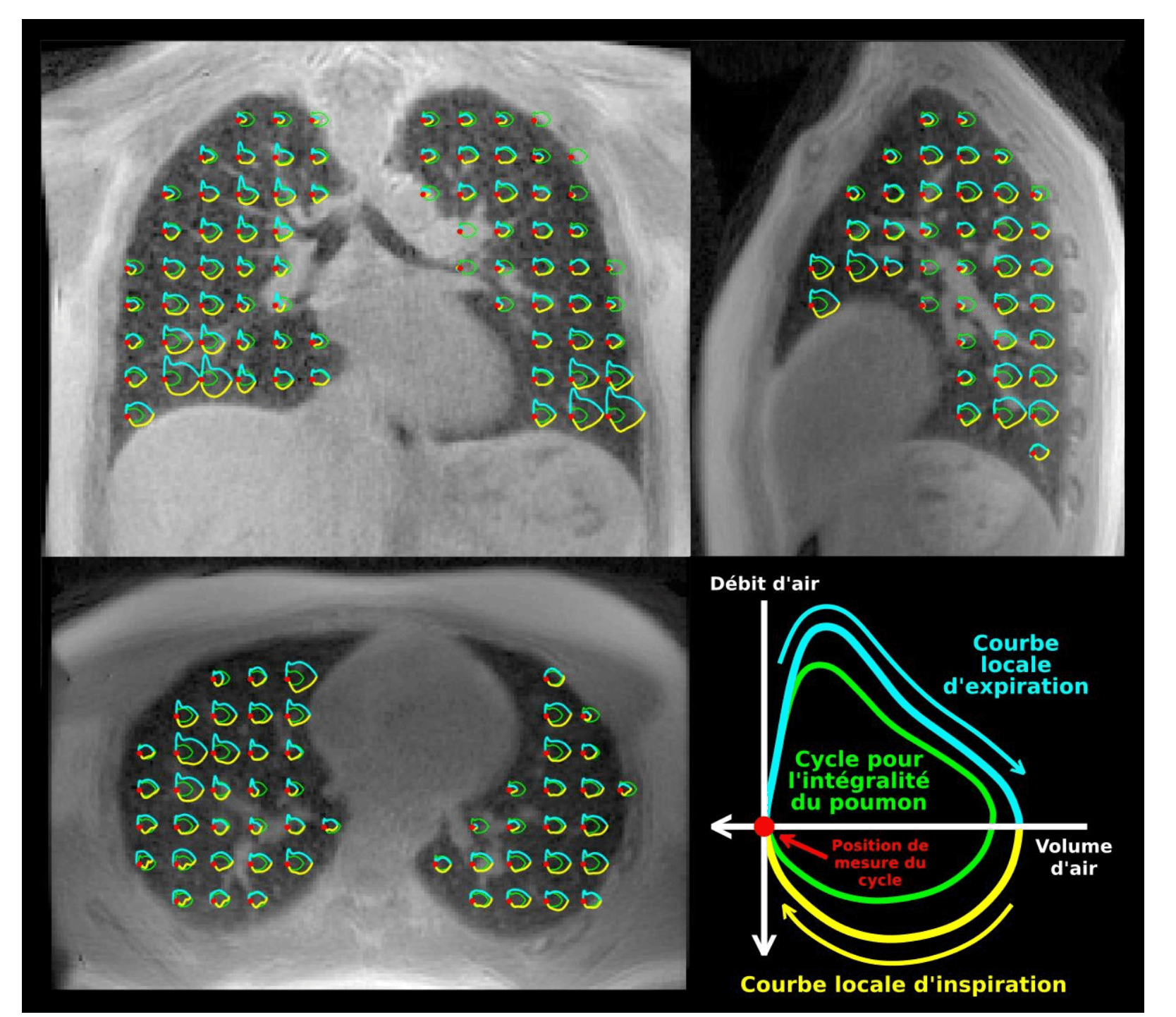
L’imagerie par résonance magnétique (IRM) est la modalité d’imagerie fonctionnelle ayant le potentiel de suppléer les EFR. Cette modalité supprime les difficultés de compliance du patient ou d’invalidité. La spirométrie 3D par IRM, offre une caractérisation régionale précise de la fonction pulmonaire, constituant une évolution prometteuse des EFR.
Les travaux de Bauman, Kolb et Boucneau mettent en lumière son potentiel dans l’analyse de la ventilation pour chaque segment pulmonaire (voir figure 15). Une étude sur des volontaires sains a permis de cartographier des motifs ventilatoires régionaux, confirmant la sensibilité de l’IRM aux gradients de ventilation liés à la gravité et ouvrant la voie à la création de profils ventilatoires types comparables à ceux des EFR.
La spirométrie 3D par IRM a été appliquée à des cas cliniques variés, incluant asthme, BPCO, dystrophies musculaires et COVID long. Cette étude clinique révèle des motifs ventilatoires spécifiques à chaque pathologie et permet également d’explorer les contributions différenciées des muscles thoraciques et du diaphragme. Ces avancées font écho aux dispositifs développés à la Pitié-Salpêtrière pour analyser les troubles du diaphragme, renforçant ainsi l’intérêt de cette technologie dans la compréhension et le suivi des pathologies respiratoires.
Figure 15 : Image de Spirométrie par IRM avec la légende en bas à droite (Source : « Magnetic resonance imaging of respiratory mechanics ») [49]
4. La tomographie par impédance électrique
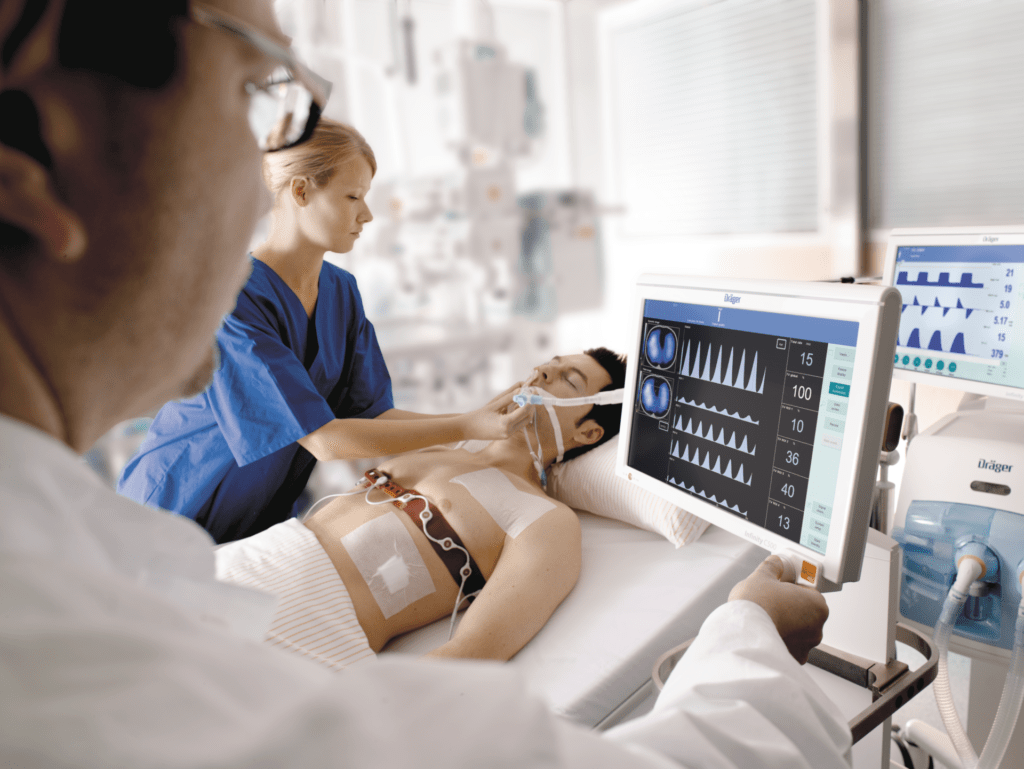
Le PulmoVista 500 de chez Drager est un appareil innovant utilisant la tomographie d'impédance électrique (EIT) pour fournir une visualisation en temps réel de la ventilation régionale des poumons. Grâce à une ceinture d'électrodes placée autour du thorax (voir figure 16), l’appareil mesure les variations de conductivité électrique liées aux mouvements d’air dans les poumons. Ces données sont ensuite transformées en images dynamiques montrant la distribution de la ventilation, ainsi qu’en paramètres comme les variations d’impédance (ΔEELI) ou les délais de ventilation régionale (RVD). Ces informations permettent une surveillance continue et non invasive des fonctions pulmonaires, en particulier dans des contextes critiques tels que les soins intensifs ou la prise en charge des pathologies respiratoires complexes.
Figure 16 : Disposition Pulmovista sur patient (Source : Dräger) [50]
Le PulmoVista 500 est un outil complémentaire aux techniques classiques d’EFR. Par exemple, là où la spirométrie mesure les volumes pulmonaires globaux, l’EIT fournit une analyse régionale de la ventilation, aidant à identifier des déséquilibres spécifiques dans les différentes segmentations pulmonaires. Avec la pléthysmographie, qui évalue les volumes non mobilisables comme le volume résiduel, l’EIT ajoute une dimension dynamique en suivant les variations de ces volumes en temps réel, notamment lors des manœuvres de recrutement alvéolaire. La gazométrie artérielle, qui analyse les échanges gazeux, est complétée par l'EIT, qui localise les zones pulmonaires responsables des anomalies détectées, facilitant les ajustements des paramètres ventilatoires.
Conclusion
Les explorations fonctionnelles respiratoires représentent une modalité biomédicale parfois insuffisamment valorisée, voire sous-estimée. Ce phénomène résulte de plusieurs facteurs convergents, notamment le coût relativement faible de ces équipements, leur classification en tant que dispositifs médicaux de classe IIA (ne nécessitant pas de maintenance obligatoire) et l'absence récente d’innovations de rupture dans ce domaine. Ces éléments peuvent expliquer la perception générale des EFR comme une moindre priorité dans la gestion biomédicale hospitalière.
Cependant, comme il a été souligné dans ce mémoire d’intelligence méthodologique, l’évolution des équipements, incluant des technologies utilisées en routine clinique et des innovations, tend à remettre en question certains à priori concernant les EFR. Il est apparu important de faire un état des lieux du rôle clinique des EFR et de mettre en avant leur diversité technologique, ainsi que les avancées susceptibles de transformer les pratiques cliniques et le parcours patient.
Les nouvelles technologies en matière de connectivité, d’ergonomie, de réglages, de maintenance, ainsi que les progrès dans la calibration et la sensibilité des équipements, ouvrent de nouvelles perspectives pour leur déploiement au sein des établissements hospitaliers.
Dans l’espoir que ce rapport aura suscité votre intérêt pour les technologies liées aux EFR et qu’il contribuera à renforcer leur reconnaissance et leur intégration.
Annexes
Annexe 1 : Tableau comparatif des spiromètres
Annexe 2 : Tableau comparatif des pléthysmograhes
Bibliographie
[1] L’Assurance Maladie, « Personnes prises en charge pour maladies respiratoires chroniques (hors mucoviscidose) en 2022 ». Mise à jour le 26 juin 2024. Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.assurance-maladie.ameli.fr/sites/default/files/2022_fiche_maladies-respiratoires-chroniques-hors-mucoviscidose.pdf
[2] Santé Respiratoire France, « Les maladies respiratoires », Association Santé Respiratoire France. Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://sante-respiratoire.com/les-maladies-respiratoires/
[3] D. Nassra, Cours « Anatomie de l’appareil respiratoire », Université de Bordeaux, Année académique 2022/2023. Consulté le : 10 novembre 2024. [En ligne]. Disponible sur : https://www.ch-carcassonne.fr/imgfr/files/Anatomie%20cours%20Dr%20Nassra%282%29.pdf
[4] A. Shahidi, « Poumons ». Kenhub, 2 mai 2024. Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.kenhub.com/fr/library/anatomie/poumons
[5] Anatomie pulmonaire. Consulté le : 07 janvier 2025. [En ligne]. Disponible sur : Anatomie pulmonaire | Medecine
[6] F. Le Pimpec Barthes et M. Riquet, « Anatomie du poumon humain », EM-Consulte, p. 13, juill. 2019. Disponible sur : https://www.em-consulte.com/article/1305472/anatomie-du-poumon-humain
[7] Assistance Scolaire Personnalisée (ASP), « Les échanges gazeux dans une alvéole pulmonaire ». Consulté le : 10 novembre 2024. [En ligne]. Disponible sur : https://www.assistancescolaire.com/enseignant/college/ressources/base-documentaire-en-sciences/les-echanges-gazeux-dans-une-alveole-pulmonaire-5sre0204
[8] profSVT OEHMICHEN, « Volumes pulmonaires », Overblog, 8 septembre 2015. Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : http://svt-oehmichen.over-blog.fr/2015/09/volumes-pulmonaires.html
[9] Institut National de la Santé et de la Recherche Médicale, « Bronchopneumopathie chronique obstructive (BPCO), une toux chronique et un essoufflement à ne pas négliger », Inserm, juin 2020, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.inserm.fr/dossier/bronchopumopathie-chronique-obstructive-bpco/
[10] VIDAL, « BPCO - symptômes, causes, traitements et prévention », janv. 2024, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.vidal.fr/maladies/voies-respiratoires/bpco.html
[11] Ramsay Santé, « Broncho-pneumopathie chronique obstructive ». Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : Broncho-pneumopathie chronique obstructive | Ramsay Santé
[12] Santé Respiratoire France, « Bronchopneumopathie chronique obstructive (BPCO) et l’emphysème », Association Santé Respiratoire France. Consulté le : 10 novembre 2024. [En ligne]. Disponible sur : https://sante-respiratoire.com/les-maladies-respiratoires/bpco/
[13] Santé Respiratoire France, « BPCO, pour que cet acronyme marque enfin les esprits », janv. 2024, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://sante-respiratoire.com/bpco-pour-que-cet-acronyme-marque-enfin-les-esprits/
[14] Santé Publique France, « BPCO et insuffisance respiratoire chronique », juin 2019, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-et-infections-respiratoires/bpco-et-insuffisance-respiratoire-chronique
[15] Institut National de la Santé et de la Recherche Médicale, « BPCO : Bloquer l’inflammation pour mieux respirer. », Inserm, août 2020, Consulté le : 3 novembre 2024. [En ligne]. Disponible sur : https://www.inserm.fr/actualite/bpco-bloquer-inflammation-pour-mieux-respirer/
[16] Mission Interministérielle de Lutte contre les Drogues et les Conduites Addictives, « Tabagisme en 2022 : un nombre de fumeurs stable et des inégalités de santé toujours marquées », juin 2023, Consulté le : 10 décembre 2024. [En ligne]. Disponible sur : https://www.drogues.gouv.fr/tabagisme-en-2022-un-nombre-de-fumeurs-stable-et-des-inegalites-de-sante-toujours-marquees
[17] Haute Autorité de Santé, « BPCO : des indicateurs de qualité pour évaluer le parcours de soins des patients », HAS, avr. 2022, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.has-sante.fr/jcms/p_3329428/en/bpco-des-indicateurs-de-qualite-pour-evaluer-le-parcours-de-soins-des-patients
[18] Institut National de la Santé et de la Recherche Médicale, « Asthme - Une inflammation chronique des bronches de mieux en mieux contrôlée », Inserm, juill. 2024, [En ligne]. Disponible sur : https://www.inserm.fr/dossier/asthme/
[19] Association pulmonaire du Québec, « Qu’est-ce que l’asthme : diagnostic, traitements et gestion ». Consulté le : 2 novembre 2024. [En ligne]. Disponible sur : https://poumonquebec.ca/maladie/asthme/qu-est-ce-que-asthme.php
[20] Centers of Disease Control and Prevention, « Qu’est-ce que l’asthme ? » Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.cdc.gov/asthma/pdfs/AsthmaFAQ-factsheet_FR-FR_508.pdf
[21] Delmas MC et Fuhrman C, « L’asthme en France : synthèse des données épidémiologiques descriptives », Santé Publique France, vol. 27, p. 151‑9, sept. 2019.
[22] Institut National de la Santé et de la Recherche Médicale, « Asthme - Une inflammation chronique des bronches de mieux en mieux contrôlée », Inserm, juill. 2024, [En ligne]. Disponible sur : https://www.inserm.fr/dossier/asthme/
[23] K. L. Wood, « Revue générale des épreuves fonctionnelles respiratoires », Édition professionnelle du Manuel MSD, avr. 2024, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.msdmanuals.com/fr/professional/troubles-pulmonaires/épreuves-fonctionnelles-respiratoires-efr/revue-générale-des-épreuves-fonctionnelles-respiratoires
[24] Eolys, « La Spirométrie en pratique ». [En ligne]. Disponible sur : La spirométrie est un examen permettant d'évaluer l'efficacité du système respiratoire grâce à la mesure des volumes et des débits expiratoires et inspiratoires
[25] Medusoft, « Operation Manual for Spirometer System ». Consulté le : 11 décembre 2024. [En ligne]. Disponible sur : https://medusoft.com.au/Brochures/Spiro-EN_3.080.pdf
[26] Consomed, matériel médical professionnal, « Spiromètre incitatif RESPIPROGRAM de Mediflux », CONSOMED. Consulté le : 11 décembre 2024. [En ligne]. Disponible sur : https://www.consomed.fr/diagnostic-et-examen-debitmetres-et-accessoires/2586-spirometre-incitatif-pulmo-gain
[27] D. A. Kharat, « Spirométrie ». Service de pneumologie, Hôpitaux Universitaires Genève, décembre 2018. Consulté le : 9 novembre 2024. [En ligne]. Disponible sur : https://www.hug.ch/sites/interhug/files/atelier_mpr/dre_a._kharat_191218.pdf
[28] MGC Diagnostics Corporation, « BodyBox PFS pléthysmographe ». 2023. [En ligne]. Disponible sur : https://mgcdiagnostics.com/images/uploads/documents/FRENCH_BodyBox_PFS_Brochure_23.pdf
[29] Ganshorn, Schiller Group, « PowerCube Body+ – GANSHORN Medizin Electronic GmbH ». Consulté le : 10 décembre 2024. [En ligne]. Disponible sur : https://www.ganshorn.fr/powercube-body-fr/
[30] L’Assurance Maladie, « Comment se déroule une spirométrie ? », sept. 2023, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.ameli.fr/loiret/assure/sante/examen/exploration/deroulement-spirometrie
[31] D. F. Aubourg, « Explorations fonctionnelles respiratoires de l’adulte ». 2017. Consulté le : 2 novembre 2024. [En ligne]. Disponible sur : http://www.smtoif.asso.fr/upload/docs/comptesrendus/3877172107528882916216850484394684458271/Cours%20Spirométrie%202017.pdf
[32] S. GROMCZYK, « Définition des besoins pour le renouvellement d’une cabine de pléthysmographie », Université de Technologie de Compiègne, Hôpital Robert-PAX de Sarreguemines, 2010. Consulté le : 10 novembre 2024. [En ligne]. Disponible sur : https://www.utc.fr/tsibh/public/3abih/10/stage/gromczyk/index.html#Les_examens_des_EFR
[33] Société de Pneumologie de Langue Française, « Pléthysmographie : Théorie et pratique ». 2013. Consulté le : 10 novembre 2024. [En ligne]. Disponible sur : https://splf.fr/wp-content/uploads/2014/10/Atelier-Plethysmographie-2013.pdf
[34] Sylvie Poulet, « La pléthysmographe : à quoi sert cet instrument médical ? », Passeport Santé, nov. 2024, Consulté le : 18 novembre 2024. [En ligne]. Disponible sur : https://www.passeportsante.net/materiel-medical?doc=plethysmographe-sert-cet-instrument-medical
[35] L. Delaunois et J.-P. Delwiche, « Exploration fonctionnelle respiratoire », EMC - Pneumologie, vol. 2, no 2, p. 61‑73, mai 2005, doi : https://doi.org/10.1016/j.emcpn.2005.04.003.
[36] T. Perez, « La pléthysmographie est-elle nécessaire dans l’asthme ? », Revue Française d’Allergologie, vol. 53, no 3, p. 113‑116, avr. 2013, doi : https://doi.org/10.1016/j.reval.2013.01.019.
[37] R. Barbier, « Pourquoi et Comment mesurer et interpréter les RVA / RaW ? », Blog du matériel médical, mai 2022, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.mediprostore.com/blog/pourquoi-et-comment-mesurer-et-interpreter-les-rva-raw-dans-votre-pratique-quelques-reponses-dun-pneumologue/
[38] PulmOne, Clarion Medical Technologies, « MiniBox + ». 2019. [En ligne]. Disponible sur : https://medical.clarionmedical.com/hubfs/product-images/surgical/minibox/PulmOne-MiniBox-Brochure-Clarion.pdf?hsLang=fr
[39] « Exploration fonctionnelle respiratoire (EFR) », Elsan Care. Consulté le : 16 novembre 2024. [En ligne]. Disponible sur : https://www.elsan.care/fr/pathologie-et-traitement/maladies-poumons/exploration-fonctionnelle-respiratoire-EFR-definition-deroulement-suites
[40] J. Violet, « Gaz du sang artériel », Fiches IDE, mis à jour 22 août 2018. Consulté le : 18 novembre 2024. [En ligne]. Disponible sur : https://www.fiches-ide.fr/gaz-du-sang-arteriel/
[41] P. F. Chabot et al., « Explorations Fonctionnelles Respiratoires et équilibre acido-basique aux ECN », Collège des enseignants en pneumologie, 2017. Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://cep.splf.fr/wp-content/uploads/2017/07/EFR-pour-ECN-2017.pdf
[42] Hospices Civils de Lyon (HCL), « Exploration fonctionnelle respiratoire (EFR) / Spirométrie ». 18 novembre 2024. Consulté le : 14 janvier 2025. [En ligne]. Disponible sur : https://www.chu-lyon.fr/exploration-fonctionnelle-respiratoire-efr-spirometrie
[43] Haute Autorité de Santé (HAS) et Assurance Maladie, « Guide du parcours de soins “Bronchopneumopathie chronique obstructive” ». novembre 2019. [En ligne]. Disponible sur : https://www.has-sante.fr/upload/docs/application/pdf/2020-01/app_323_guide_bpco_actu_2019_vf.pdf
[44] G. Brinchault et al., « Les comorbidités dans la BPCO », Revue de Pneumologie Clinique, vol. 71, no 6, p. 342‑349, déc. 2015, doi : https://doi.org/10.1016/j.pneumo.2015.09.009.
[45] Institut National de la Santé et de la Recherche Médicale, « Bronchopneumopathie chronique obstructive (BPCO), une toux chronique et un essoufflement à ne pas négliger », Inserm, juin 2020, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.inserm.fr/dossier/bronchopneumopathie-chronique-obstructive-bpco/
[46] P.-R. Burgel, « Quels vaccins pour les patients atteints de BPCO ? », La revue du praticien, no 74(1);13‑5, janv. 2024, Consulté le : 19 novembre 2024. [En ligne]. Disponible sur : https://www.larevuedupraticien.fr/article/quels-vaccins-pour-les-patients-atteints-de-bpco
[47] DUOMED, « Sierra Summit - EMG, NCS, EP, et Ultrasons ». Consulté le : 10 décembre 2024. [En ligne]. Disponible sur : https://www.duomed.com/fr-BE/produits/sierra-summit-emg-ncs-ep-et-ultrasons
[48] O. Bouroubi, A. Chikhi, et N. Zaabat, « L’atteinte de l’EMG de surface du diaphragme chez le BPCO », Revue des Maladies Respiratoires, vol. 36, p. A67, janv. 2019, doi :https://doi.org/10.1016/j.rmr.2018.10.126.
[49] T. Boucneau, « Magnetic resonance imaging of respiratory mechanics. Signal and Image Processing. », Université Paris Saclay (COmUE), 3 juillet 2019. [En ligne]. Disponible sur : https://theses.hal.science/tel-03336547
[50] E. Teschner et M. Imhoff, « Tomographie par impédance électrique : La réalisation de la surveillance régionale de la ventilation - Dräger », août 2015, [En ligne]. Disponible sur : https://www.draeger.com/Content/Documents/Products/eit-bk-gesamt-9067044-fr-1508-2.pdf