IDS256 - Intérêt de la simulation numérique pour la validation des dispositifs médicaux
DOI mémoire
https://doi.org/10.34746/ids256Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs(es)




Contacts
- Dieudonnée Lenaelle TEGANG MEYIMO : teganglenaelle@gmail.com
- Fabiola Valdese NZIMI NYABEYEU : valnzims@gmail.com
- Hermann KUETE LONTSI : hermannkuete91@gmail.com
- Ahmed ALISAWI : a.issawwi@gmail.com
Citation
Dieudonnée Lenaelle TEGANG MEYIMO, Fabiola Valdese NZIMI NYABEYEU, Hermann KUETE LONTSI, Ahmed ALISAWI, « Intéret de la simulation numérique pour la validation des dispositifs médicaux », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de projet, Janvier 2025, réf n° IDS256, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids256/, https://doi.org/10.34746/ids256
Résumé
La simulation numérique est une technique qui utilise les modèles mathématiques pour la modélisation d’un système ou d’un organe. Elle est très développée dans plusieurs secteurs à savoir l’aéronautique, le secteur de l’automobile où nous avons TI Automotive qui utilise la simulation numérique pour anticiper les problèmes mécaniques de leur structure. Ceci aide à amoindrir le temps de développement tout en permettant l’optimisation du produit final. Le secteur des dispositifs médicaux est faiblement représenté dû au fait de l’unicité des individus ceci rendant difficile la création des modèles précis.
Cette technique pourrait intervenir dans la plupart des étapes du processus d’homologation des dispositifs médicaux. C’est dans cette optique que notre mémoire vise à montrer la place que pourrait prendre la simulation numérique dans le processus d’homologation des dispositifs médicaux.
Cette technique de modélisation et de simulation numérique est développée aux USA notamment sur les dispositifs médicaux à travers la norme ASME V&V40 qui régit l’utilisation de la simulation numérique. Le processus de validation selon cette norme sera abordé dans le cadre du projet ainsi que les différents outils Medical Devices Development Tools développés par les fabricants de dispositifs médicaux et la Food and Drug Administration permettant de valider les dispositifs médicaux. Etant donné que l’Union Européenne n’a pas harmonisé de normes concernant cette technique, l’approche de notre mémoire vise à proposer des suggestions pour son adoption.
Abstract
Numerical simulation is a technique that employs mathematical models to digitally represent systems or their components. These innovative techniques are highly advanced and widely used in various sectors, such as aeronautics and the automotive industry. For instance, IT in the automotive sector leverages digital simulation to predict mechanical issues in structures. This approach helps reduce time consumption while optimizing and developing the final product design. However, the medical device sector has been slower to adopt such methods in manufacturing. This is primarily due to the limited number of specialists in this field and the complexity of creating accurate models for medical devices.
Digital simulation techniques can be used as a valuable tool in the medical device certification process. Thus, our memoir aims to address the question : What role could digital simulation play in the approval process for medical devices ? Modeling and digital simulation techniques are being actively developed in the USA, particularly for regulatory submissions concerning medical devices. This progress is according to the ASME V&V40 standard, which provides instructions on using digital simulation to validate computational models for testing medical device specific functions and material or components characteristics. In contrast, such validation and testing methods are currently absent in the European Union, as no harmonized standards concerning these techniques have been established. Therefore, our dissertation seeks to explore the role that digital simulation could play in the approval process of medical devices, specifically within the European Union .
Téléchargements


Introduction
La modélisation est un processus spécifique qui permet de représenter de façon abstraite un système, un phénomène ou une situation réelle appelée modèle. Cette représentation consiste à utiliser un modèle numérique préalablement réalisé afin d’effectuer des calculs ou des expériences virtuelles pour le confronter au monde réel dans le but d’augmenter la confiance à l’égard du modèle traité [1] . Les programmes algorithmiques implémentés dès lors dans ces modèles sont largement utilisés dans les domaines d’ingénierie, de sciences mais aussi dans des domaines tels que l’économie ou le social. Une fois les modèles computationnels informatiques établis, ils sont utilisés pour prédire, analyser et optimiser le comportement des systèmes avant leur mise en œuvre réelle [2].
La simulation et la modélisation numérique (CM&S) qui jusque-là était limitée à la validation du design, a considérablement évolué depuis les années 1960 dans les secteurs de l’aéronautique, de l’automobile et du nucléaire, précisément aux États-Unis et en Europe. De nos jours, elle permet le développement d’un produit de l’idée jusqu’à sa surveillance post commercialisation, car elle permet de prédire, grâce à des modèles mathématiques, des modèles de calcul et à l’intelligence artificielle, des phénomènes physiques à travers des techniques de simulation [3].
Plus tard, l’on a commencé à s'intéresser à comment l’on pourrait implémenter cette technique telle qu'utilisée dans l'aéronautique pour l’intégrer dans le processus d’homologation d’un dispositif médical(DM). Au cours des dernières années, plusieurs organismes ont joué un rôle essentiel dans l’utilisation de la modélisation et de la simulation pour développer le concept d’essais in silico, qui désigne l'utilisation de la simulation informatique individualisée dans le développement ou l'évaluation réglementaire d'un médicament, d'un dispositif médical ou d'une intervention médicale [4].
Grâce à des initiatives, le Congrès américain et le Parlement européen ont émis des recommandations similaires à l’intention de leurs agences réglementaires respectives : la Food and Drug Administration (FDA) et L’European Medecines Agency (EMA), soulignant la nécessité de pouvoir adopter l’évaluation in silico dans le cadre du processus réglementaire. En 2016, la FDA a publié un premier guide sur le « Reporting of Computational Modeling Studies in Medical Device Submissions » [5]. Cela a été suivi en 2018 par la publication de la norme technique ASME V&V 40-2018 « Assessing Credibility of Computational Modeling through Verification and Validation : Application to Medical Device » [5], [6].
Par la suite, en 2018, l’EMA publie le guide sur « Guideline on the reporting of physiologically based pharmacokinetic (PBPK) modelling and simulation » . Cependant, la CM&S pose un défi un majeur : celui d'établir des normes et des cadres réglementaires pour garantir la rigueur et la productivité de l'activité de simulation dans le cadre de la validation et d’homologation des dispositifs médicaux.
C’est dans ce contexte que nous avons posé la problématique suivante : “Quelle place pourrait prendre les techniques de simulation numérique dans le processus de validation ou d’homologation des dispositifs médicaux ?”
Pour répondre à cette problématique, on s’est concentré dans un premier temps de faire le contexte des techniques de CM&S, les enjeux et les objectifs. Dans un second temps on a fait un rappel sur les différentes techniques de CM&S avec des exemples spécifiques. Par la suite, on va se focaliser sur le positionnement de la CM&S dans le processus d’homologation des DM aux Etats-Unis. Enfin nous proposerons des suggestions pour intégrer la CM&S dans le processus de validation des DM en Europe.
Chapitre 1 - Contexte, enjeux et objectifs
1. Contexte d'utilisation de la simulation numérique
Les techniques de la CM&S s’appliquent dans tous les secteurs de l’industrie. En 2016, le rapport de CIMdata a mis en exergue une adoption largement majoritaire dans le secteur automobile qui représente 29 % du marché mondial, suivi du secteur aérospatial lui-même représenté à quasi 22 %. Ces différents secteurs font usage de la CM&S pour la conception, les essais de sécurité, l’optimisation des performances et la gestion des risques ; créant ainsi un désir d’innovation permettant de réduire les coûts de développement. À l’opposé, le secteur du médical n’est qu’un tout petit acteur du marché mondial de la simulation numérique à hauteur de 1 % [7].
La Figure 1 montre la répartition de la CM&S dans tous les secteurs industriels
Figure 1 : Répartition de la modélisation et simulation numérique dans tous les secteurs industriels [7]
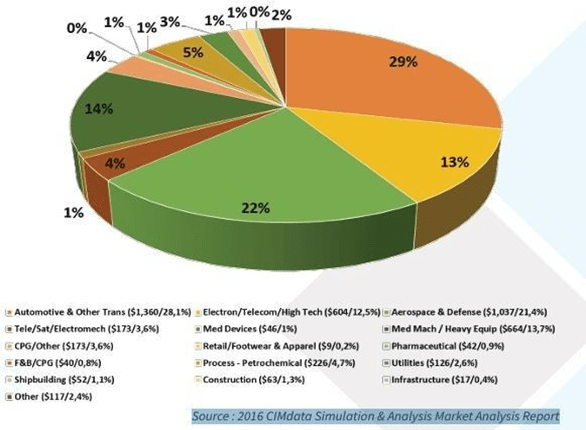
A travers ce diagramme on constate que le domaine de santé n’est pas minimisé car elle représente une part importante. Le MDIC est un partenariat public-privé conçu pour faire progresser le processus de réglementation des DM. Elle a réalisé une enquête en 2014 et 2021 pour recueillir des données auprès de 40 experts dans les organisations sur leur vision du domaine de la CM&S. D’après leurs retours la simulation numérique est utilisée dans plusieurs étapes du cycle de vie représentés dans le schéma qu’il suit [1]. (Figure 2)
Figure 2 : Répartition du pourcentage de la simulation numérique dans le cycle de vie des DM [7].

Certains domaines de la simulation numérique sont plus avantageux que d’autre, notamment le développement et la découverte de nouveaux dispositifs représenté dans le schéma ci-contre (Figure 3):
Figure 3 : Répartition de la simulation numérique dans le développement des DM [7].

Entre 2014 et 2021 la rentabilisation de CM&S a considérablement évolué dans le domaine de la recherche, du développement des nouvelles thérapies, la productivité, la performance des systèmes et la croissance des revenus dans une entreprise.
2. Enjeux de la simulation numérique
Les enjeux de la simulation numérique sont multiples notamment les enjeux éthiques en préservant l’espèce animale et en réduisant les tests sur ceux-ci. Un autre enjeu réside dans la réduction des risques et des tests liés aux différentes innovations technologiques. En effet, il s’agit d’une étape importante dans la validation d’un DM, étant donné qu’elle augmente sa sécurité et sa fiabilité.
De plus, le gain de temps est aussi un avantage majeur, car les tests traditionnels sont très longs parce qu'ils comprennent les phases de préparation, d'exécution et d'analyse [2].
Les techniques de modélisation et de simulation numérique permettent d’obtenir des itérations plus rapides et fournissent un modèle de calcul modulaire de grande valeur. La rentabilité et l’optimisation des ressources est un enjeu majeur, car elle permet de déterminer les limites du modèle.
D’autres applications de la CM&S offrent la mise en œuvre d’une plateforme de simulation qui soutiendrait la transition vers le Jumeau Humain Virtuel européen développée par EDITH qui est une plateforme qui capitalise sur le développement des technologies numériques et de la disponibilité des ressources afin de promouvoir la recherche en Europe, mais ce jumeau est encore en phase de prototypage [2].
3. Objectifs du projet
Pour répondre à notre problématique, nous nous sommes fixés des objectifs, à savoir :
- Montrer l’importance de la simulation numérique dans le processus de validation des DM qui permet de réduire le cycle de la conception et de la validation.
- Faire un état de l’art comparatif sur l’évolution de la simulation numérique dans le domaine médical en Europe et ailleurs.
- Montrer les avantages de l'application de la simulation numérique en examinant les approches réglementaires européennes relatives aux modèles de (CM&S) et en présentant l’état de l'art de la simulation numérique utilisée dans le secteur des soins de santé en Europe.
Après avoir fait un état des lieux des enjeux, du contexte d’utilisation de la simulation numérique dans le domaine de l’industrie en général et plus spécifiquement dans le domaine de la santé et d’établir les différents objectifs qui doivent être atteints dans les suites des chapitres.
Chapitre 2 - Techniques de modélisation et simulation numérique dans le domaine médical
La modélisation informatique est une technique qui consiste à créer un modèle 3D représentatif d'un organe ou d’un système à l’aide des équations et algorithmes. La simulation quant à elle est une technique permettant d’analyser le comportement d’un système en le reproduisant sur une application informatique. Plusieurs techniques de simulation et modélisation informatique existent et dans le cadre du présent projet, les techniques de jumeaux numériques d'organes, de cohorte de patients et de méthode d’analyse par éléments finis seront abordées tout au long de cette partie.
1. Jumeaux numériques d'organes
Le jumeau numérique est la représentation numérique d’un objet ou d’un organe physique basée sur des lois scientifiques et des modèles mathématiques issues de données réelles. Ces données réelles vont simuler l’apparence d’un objet ou d’un système réel, mais aussi son comportement et ses interactions dans un environnement à l’image de celui dans lequel il sera amené à fonctionner.
Applications :
Dans le domaine sanitaire, le jumeau numérique est appliqué de plusieurs manières ; l’une des applications de la simulation informatique est celle de la représentation numérique du cœur développée par Simcardio Test [9], utilisée couramment pour la mise au point et le développement de nouveaux stents, dispositifs médicaux valvulaires ou pacemakers, couvrant les différentes dimensions du cardiovasculaire.
Une autre application est celle de la représentation numérique de l’aorte utilisée pour lutter contre la rupture d’anévrisme. Développée par l’Institut Mines Télécom (I’MTech), cette représentation utilise des données réelles des patients atteints d’anévrisme pour simuler en modèle 3D l’évolution d’un anévrisme avec le fil du temps afin de prévoir l’effet d’une prothèse posée par chirurgie [10].
Bien que les modèles informatiques individuels créent une réplique numérique d’un seul individu ou d’une partie du corps, ils peuvent être divisés en modèles personnalisés, qui capturent des informations spécifiques au patient (également appelés jumeaux numériques), et en modèles familiaux, qui regroupent des individus partageant des caractéristiques communes.
2. Cohorte de patients
Les modèles familiaux représentent un sous-groupe d’une population avec des variations caractéristiques, ce qui les rend stochastiques et capables de générer plusieurs sorties aléatoires encore appelée cohorte patient [11]. Ces modèles peuvent être basés sur des images médicales ou sur des connaissances. Lorsque les modèles de population sont basés sur des images médicales, elles peuvent être paramétrées avec des équations mathématiques qui permettent de générer d’autres images représentant une population d’humains numériques. A contrario, les modèles basés sur des connaissances reposent sur des mesures physiques ou biologiques. Une caractéristique importante d’un modèle est sa capacité à échantillonner des cohortes représentatives de la population cible, ce qui nécessite de concevoir des techniques adaptées à la variabilité réelle des patients. La figure 4 nous montre le processus d’obtention des cohortes de patients.[11]
Figure 4 : Chemin de création des cohorte patient (Auteur(e)s) [11]
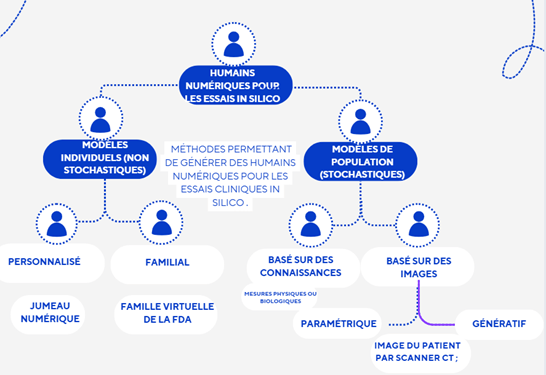
Applications : in silico trials
Les essais cliniques des dispositifs médicaux sont longs et coûteux, retardant ainsi l'évaluation réglementaire des technologies innovantes et leur mise sur le marché. Pour y remédier, plusieurs projets utilisant des modèles informatiques ont été lancés afin de déterminer si les essais in silico peuvent jouer un rôle clé dans l'évaluation des dispositifs. Comme énoncé précédemment, les modèles informatiques sont calqués sur des algorithmes et équations mathématiques afin d’évaluer au mieux les DM à travers plusieurs techniques parmi lesquelles le jumeau numérique, cohorte de patient et FEA. En effet, on distingue deux types d’essais in silico à savoir : Test de dispositif in silico pour simuler le dispositif pour générer des preuves de sécurité/efficacité et Essai clinique in silico où la performance du dispositif est évaluée en utilisant une « cohorte virtuelle » de patients simulés [12]. Le projet VICTRE (Virtual Imaging Clinical Trial for Regulatory Evaluation) est un exemple d’essai clinique in silico qui utilise des modèles réalistes de seins et leurs images acquises par Mammographie Numérique (DM) et Tomosynthèse Numérique du Sein (DBT) pour évaluer l'impact des essais d'imagerie in silico dans l'évaluation des systèmes d'imagerie médicale [13]. La figure 5 illustre les différentes parties du sein qui constitue le modèle computationnel de l’organe concerné.
Figure 5 : CM&S du sein [13]
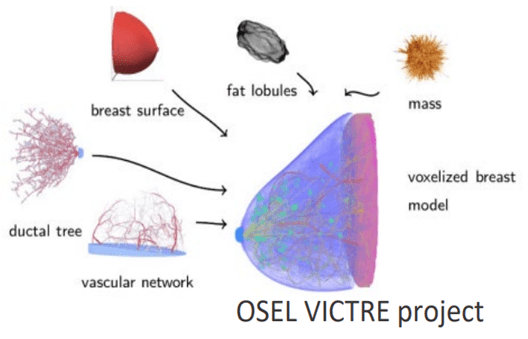
3. FEA : méthode d'analyse par éléments finis
La méthode d’analyse par éléments finis (FEA) est une méthode numérique permettant de résoudre différents types d'équations différentielles [14]. Elle permet de simplifier la structure donnée en la divisant en petits éléments. En effet, plus les éléments sont petits, plus, l'analyse prend du temps et plus la valeur de l'exactitude des résultats finaux est grande [15]. Pour la conception médicale, cela se traduit généralement par la vérification des performances du dispositif dans un domaine virtuel représentatif de l'application réelle prévue [16].
Applications : Modèle à éléments finis
La méthode des éléments finis a été utilisée dans le domaine de la médecine pour prédire la distribution des contraintes et des déformations sur les dents, les implants et les autres os environnants qui ne peuvent être résolus par l'analyse in vivo, comme les zones entre l'implant et l'os cortical, la prothèse et la gencive. Aujourd’hui, elle est aussi observée dans plusieurs cas d’étude des dispositifs médicaux à l'instar de : l’orthopédie et colonne vertébrale, cardiovasculaire et neurovasculaire, système de cathéters, conteneurs, flacons et autres systèmes d’emballages.
Un cas médical dans l’orthopédie est celui de la chirurgie de remplacement de l'épaule en utilisant la FEA pour évaluer les conditions critiques afin de prédire la performance à court et moyen terme du système total de l'épaule. Aussi, la méthode FEA est utilisée pour étudier les contraintes osseuses et les micromouvements de la cheville afin d'anticiper la stabilité de l'implant, le modèle numérique utilisé pour simuler les 3 phases d'adduction (angle de fixation) : 45°, 60° et 90° et déterminer la situation la plus critique. La figure 6 représente la division de l’épaule en plusieurs éléments afin de déterminer les contraintes et les déformations.
Figure 6 : Système total de l'épaule à court et à long terme. Simulation numérique des contraintes et des déformations et des micromouvement [15]
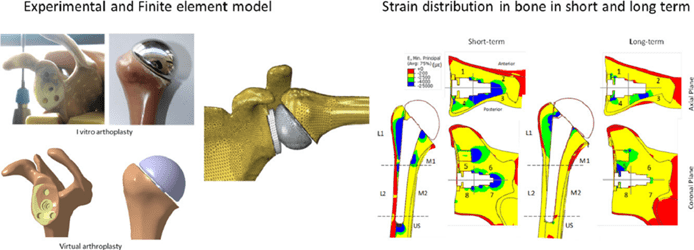
Après avoir fait un état de l’art des différentes techniques de simulations et de modélisation numériques existant dans le domaine de la santé avec des exemples illustratifs, il s’agira par la suite de présenter le processus d’homologation des DM selon la norme ASME V&V40 ainsi que des différents outils développés.
Chapitre 3 - Place de la simulation numérique dans le processus d'homologation d'un dispositif médical
1. Processus d'homologation d'un dispositif médical
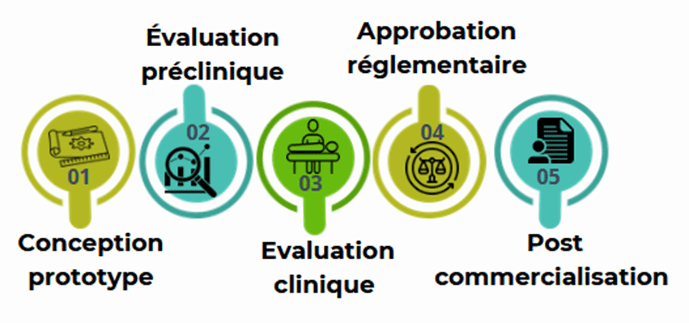
Le processus d'approbation d'un DM repose sur un cadre réglementaire rigoureux conçu pour garantir la sécurité des patients et l'efficacité des produits. Dans ce cadre, le règlement UE relatif aux dispositifs médicaux définit les exigences essentielles à prendre en compte lors du processus d'homologation d’un DM. Ces exigences sont décrites dans les phases de conception, d’évaluation des risques, d’essais cliniques, de validation des performances et de surveillance après commercialisation.
- Conception et Prototypage : L’élaboration initiale du dispositif comprend le développement du concept et la réalisation de prototypes physiques, qui servent de base pour les tests ultérieurs.
- Tests Précliniques : Ces évaluations, réalisées sur des modèles animaux (in vivo) et qui peuvent être réalisées in vitro, visent à démontrer la sécurité et la performance du dispositif avant les essais sur l’homme.
- Essais cliniques : Cette étape évalue l’efficacité et la sécurité du dispositif sur des patients humains, en conditions réelles d’utilisation.
- Approbation Réglementaire : Les agences réglementaires examinent la documentation pour vérifier si le produit répond aux exigences de sécurité et de performance définies.
En ce qui concerne la Surveillance Post-Marché, il s’agit du suivi du dispositif après commercialisation, afin de détecter et résoudre d’éventuelles défaillances ou problèmes de sécurité à long terme. La figure 7 résume les grandes étapes d'homologation DM
Figure 7 : Etapes d'homologation DM
2. Simulation numérique dans le processus d'homologation des dispositifs médicaux
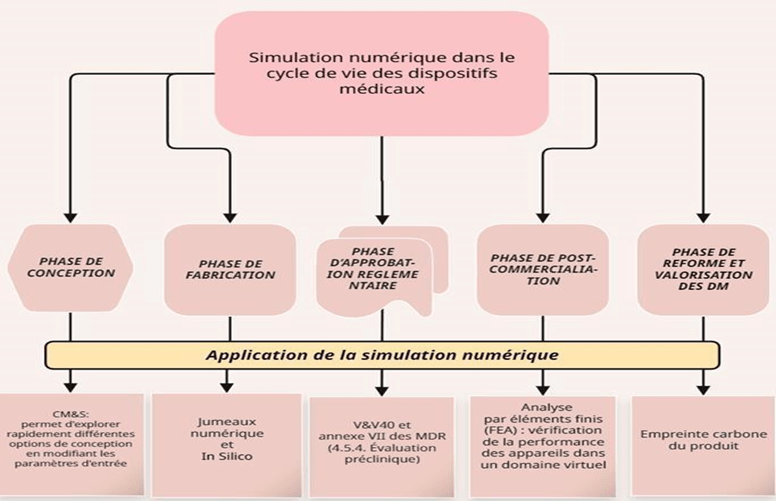
Le développement d’un DM suit un processus structuré encadré par une autorité compétente(Organisme Notifié) permettant ainsi de garantir sa performance et sa conformité réglementaire pour la sécurité du patient. Le cycle de vie d’un DM est un processus méthodique qui vise à transformer une idée innovante de l’identification du besoin jusqu'à la fin de vie du dispositif. Intégrée à diverses étapes du cycle de vie d’un DM, la simulation numérique pourrait offrir la possibilité de modéliser, de tester et d’optimiser les performances des DM en réduisant considérablement et parfois en annulant la nécessité d'effectuer des tests pré-cliniques. En effet, la simulation numérique peut potentiellement transformer chaque étape de l'approbation d'un DM, en fournissant une analyse virtuelle détaillée des performances, des risques et des interactions possibles [17] tels que décrit ci-après :
- Optimisation de la conception : Les simulations, telles que la FEA, permettraient de modéliser le comportement structurel ou mécanique du dispositif. Par exemple, les simulations de flux fluidiques sont utilisées dans la conception de stents vasculaires ou de valves cardiaques pour prédire leur efficacité avant la fabrication des prototypes.
- Compléter les essais précliniques : Plutôt que de s’appuyer uniquement sur des essais physiques, la simulation pourrait offrir une alternative virtuelle fiable pour évaluer la sécurité biomécanique ou la biocompatibilité, réduisant ainsi la dépendance aux tests sur animaux. Elle réduirait la taille et/ou la portée des essais cliniques (« essais in silico »).
- Évaluation des risques : En intégrant des scénarios extrêmes (worst case), des simulations crédibles et validées pourraient être utilisées pour générer des preuves de sécurité et d'efficacité qui font partie des soumissions réglementaires. C’est le cas de certaines entreprises qui font dans la simulation et la détermination des worst case des prothèses orthopédiques (épaule, hanche, genoux).
- Support réglementaire : Bien qu’il n'y ait pas de norme harmonisée concernant la CM&S au niveau de l’Union Européenne qui expliquent les exigences attendues, certaines autorités et entreprises reconnaissent de plus en plus la valeur des simulations numériques. De ce fait, comme exemple, les analyses prédictives pourraient être intégrées dans le dossier réglementaire pour démontrer les performances du dispositif dans diverses situations cliniques.
- Surveillance post-commercialisation : la simulation peut aider à déterminer les causes profondes des problèmes signalés par les clients qui utilisent le DM. La figure 8 est une représentation de la place que pourrait prendre la CM&S à différentes étapes du processus d’homologation d’un DM.
Figure 8 : Simulation numérique dans le cycle de vie des DMs Source (Auteurs)
3. Utilisation de la simulation numérique aux USA
Aux Etats unis, selon le Code of Federal Regulation (CFR), la protection et la promotion de la santé publique sont les missions de la FDA au sein duquel se trouve le Center for Devices and Radiological Health (CDRH). Le CDRH réglemente et participe au développement de nouvelles méthodes, normes et approches pour évaluer la sécurité, l'efficacité, la qualité et les performances des DM. Elle réglemente aussi la commercialisation des DM aux États-Unis. Selon la Loi fédérale sur les aliments, les médicaments et les cosmétiques sont soumis aux réglementations du 21 CFR parties 1 à 58, 800 à 1299. Ainsi, toutes les spécifications applicables lors de la fabrication, la validation et la commercialisation d’un DM tirent leur essence dans le 21 CFR-FDA de 800-1050 où de 800-861, on parle des exigences transversales pour les dispositifs et de 862-1050, des exigences spécifiques aux dispositifs.
Traditionnellement, les tests sur banc, les études sur les animaux et les essais cliniques ont été les principales sources de preuves pour la mise sur le marché de DM aux Etats-Unis et ailleurs dans le monde. Cependant, au fil des dernières années, la modélisation informatique est devenue un outil de plus en plus puissant, utilisée dans les plateformes logicielles et servant d’aide à la décision clinique, particulièrement aux Etats-Unis. En raison de son énorme potentiel et de sa portée, l’Office Of Science and Engineering Laboratories (OSEL), une autre branche de la FDA, a transformé la modélisation informatique en outil réglementaire précieux et à l’élaboration de mécanismes permettant à la CDRH de s’appuyer davantage sur des preuves numériques au lieu d’autres preuves.
3.1. Description de l'outil de modélisation et simulation informatique
Définition et objectif
Le désir de la CDRH de s’appuyer sur d’autres preuves telles que les preuves numériques a permis que le développement de la CM&S aboutisse à des simulations d’une variété de conditions. Ces conditions imitent un aspect de l’environnement clinique ou d’utilisation pour étudier un aspect de performance du DM. A travers cela, la CDRH met en place un outil de développement de DM : Medical Device Development Tools (MDDT) [18]. L’outil MDDT est
- Volontaire ;
- Réduit la charge réglementaire dans l'évaluation des DM ;
- Facilite le développement et l'évaluation rapide des DM ;
- Soutient les soumissions réglementaires et la prise de décisions ;
- Les soumissionnaires d'outils peuvent être une personne, un groupe, un consortium ou une organisation (y compris le gouvernement fédéral).
En effet, le MDDT est une méthode permettant à la FDA de qualifier les outils que les fabricants de DM peuvent choisir d'utiliser dans le développement et l'évaluation des DM[19]. Cette qualification consiste à évaluer la sécurité, l'efficacité ou la performance d’un dispositif médical[18].
Catégories d’outil MDDT
A ce jour, il existe trois catégories d’outil de développement des dispositifs médicaux distingués principalement par la manière dont l'outil mesure les paramètres pertinents. Ce sont : les Modèles d'Évaluation Non-cliniques (NAM), les Tests de Biomarqueurs (BT), et les Évaluations des Résultats Cliniques (COA).
- Modèle d'évaluation non clinique : modèle ou une méthode de test non clinique qui mesure où prédit des paramètres d'intérêt pour évaluer la sécurité, l'efficacité ou la performance d'un dispositif. Exemples : modèles computationnels, modèles animaux, fantômes/Cohorte patient.
- Test de biomarqueur : Test ou un instrument utilisé pour détecter ou mesurer un biomarqueur[19]. C’est test peuvent être utilisés pour mesurer des caractéristiques moléculaires, histologiques, radiographiques ou physiologiques
- Évaluation des résultats cliniques : catégorie d’outil MDDT qui décrit ou reflète comment une personne se sent, fonctionne ou survit, et peut être rapportée par un fournisseur de soins de santé, un patient, un observateur non clinique ou par la performance d'une activité ou tâche.
La FDA se sert de l’outil MDDT pour faciliter la prise de décision réglementaire des DM en complément avec les tests précliniques ou mesures des résultats d’évolution clinique. Il met également à la portée des fabricants un outil qualifié leur permettant de faciliter le developpement, l’évaluation rapide et la promotion de l’innovation de leur DM avant la soumission [20]. Aussi, un fabricant peut également concevoir son outil MDDT et le qualifier afin de permettre aux autres fabricants de DM du même secteur de l’utiliser diminuant ainsi le temps et les procédures de qualification que devait prendre la procédure de vérification du DM par l’outil MDDT.
Qualifier un MDDT exige de passer par deux phases principales à savoir :
- Phase de proposition dont l’objectif est de déterminer si le MDDT est adapté à la qualification par le biais du programme MDDT. Durant cette phase, les informations soumises sont : Un plan de qualification complet pour la collecte des preuves en vue de la qualification de l'outil, une description du MDDT et le contexte d'utilisation[18].
- Phase de qualification dont l’objectif est de déterminer si, pour un contexte d'utilisation spécifique, l'outil est qualifié sur la base des preuves et des justifications fournies. Les informations requises pour soumissions sont : Les données collectées selon le plan de qualification dans le cadre du dossier complet de qualification, que la FDA examine pour la décision de qualification.
Exemples d’outils MDDT :
Fin 2024 aux états unis, sont reconnus 17 outils qualifiés de développement de dispositifs médicaux dont[20] :
- 07 outils de catégorie NAM qui prennent en compte plusieurs domaines notamment le domaine d’imagerie médicale, de cybersécurité, d’orthopédie, de biocompatibilité et biostabilité. Comme exemple :
- Virtual MRI Safety Evaluations of Medical Devices : Outil MDDT utilisé dans le domaine d’imagerie, c’est un modèle multiphysique pour analyser les effets électromagnétiques et thermiques d'une bobine RF d'IRM sur un dispositif médical placé dans un gel ASTM [21].De par la complexité de réunir les conditions de mise en œuvre des tests d’évaluation du comportement d’un DM implantable lors des tests pré-clinique, cet outil vise à prédire l’augmentation de température autour du DM passif dans un IRM. En effet, avec la CM&S implémenté dans cet outil, il sera mis en avant la quantité de température autour du DM due au dépôt de puissance RF et l’identification de la configuration la plus défavorable du DM implantable passif. L’objectif de cet outil est de remplacer les tests physiques en réalisant plusieurs simulations.
- 02 outils de la catégorie BT présents dans les domaines de neurologie, cardiologie et surveillance patient. Comme exemple :
- Apple Atrial Fibrillation History Feature : Utilisé dans le domaine de cardiologie et surveillance des patients, c’est un outil valable pour évaluer la charge de fibrillation auriculaire dans les essais cliniques. Il permet de mesurer la fréquence et la durée des épisodes de fibrillation auriculaire de manière non invasive[22].
- 08 outils de la catégorie COA des domaines tels que l’esthétique, la dermatologie, la cardiologie. Comme exemple :
- Assessment of IntraOcular Lens Implant Symptoms (AIOLIS) instrument : du domaine de l'ophtalmologie, comme la description de la catégorie dans lequel il existe, cet outil permet d’évaluer et de mesurer la satisfaction et la qualité de vie des patients ayant subi des interventions esthétiques faciales. Il intègre aussi des échelles pour évaluer le ressenti du vieillissement, l'impact du traitement sur la vie quotidienne, ainsi que la satisfaction par rapport aux résultats obtenus[23].
Après avoir décrit l’outil de modélisation et simulation informatique implémenté aux USA, il est normal de se demander ce qui permet aux autorités américaines d’affirmer de la crédibilité, la fiabilité des preuves numériques fournies par les CM&S implémentées au sein des outils MDDT pour faciliter les décisions réglementaires. Après s'être penché sur la question dans le cadre de ce projet, nous avons découvert que la norme V&V 40 était utilisée pour évaluer la crédibilité de la CM&S pour les DM aux USA.
3.2. Validation de la modélisation et simulation informatique : norme ASME V&V40
Dans l’optique d’évaluer la crédibilité de la CM&S pour les DM, la norme ASME V&V 40 Standard a vu le jour en 2018. Comme le soulignent les initiales V&V, elle permet de vérifier et de valider les modèles mathématique et computationnel implémentés. La figure 9 est une représentation fonctionnelle de la norme pour la V&V 40.
Figure 9 : Représentation fonctionnelle de vérification et validation [12]

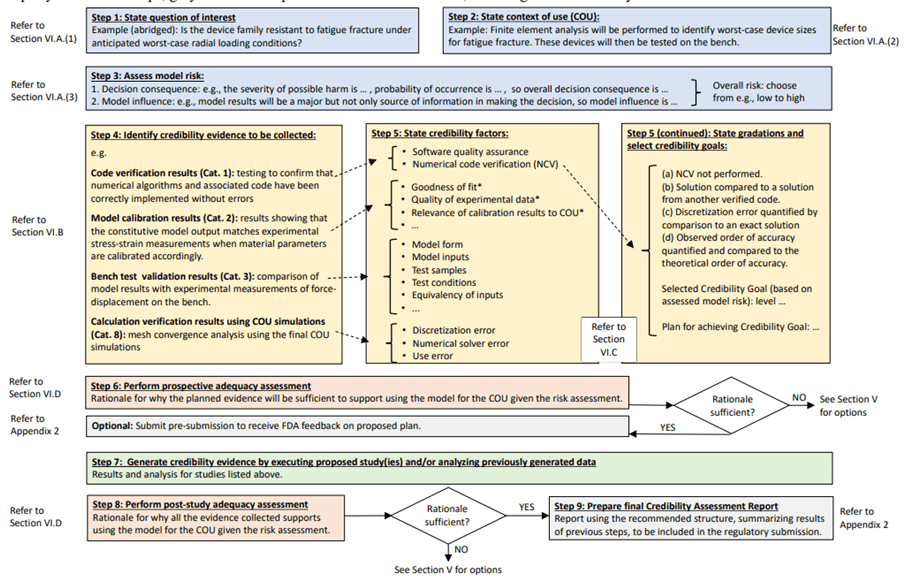
Processus de validation selon la norme V&V 40 Comme mentionné précédemment, l’objectif de création et d’utilisation de la norme ASME V&V 40 était d’établir un ensemble de procédures et de tests reconnus pour vérifier la crédibilité de performance du modèle informatique d’un modèle physique (DM, organes, patient virtuel). Selon les guides lus en rapport à cette norme, la crédibilité est la confiance, basée sur toutes les preuves disponibles, dans la capacité prédictive d'un modèle computationnel [24]. Ces preuves sont des documents qui démontrent que le modèle computationnel répond parfaitement à la question d'intérêt, au contexte d’utilisation du DM tel que défini par le fabricant. La figure 10 décrit les 09 étapes clés nécessaires pour implémenter la norme ASME V&V 40 pour établir la crédibilité d’un CM&S d’un DM.
Figure 10 : Les grandes étapes de la norme ASME V&V 40 [12]
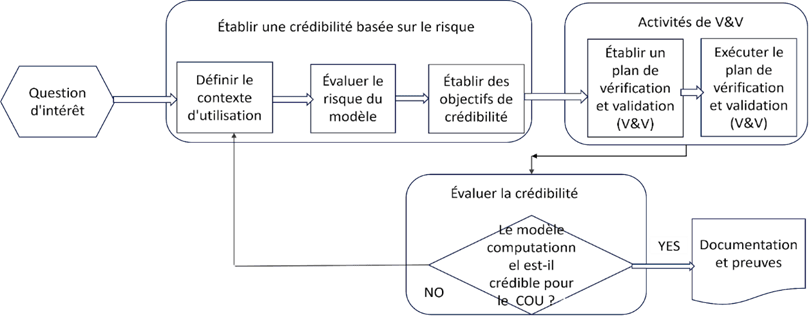
Pour résumer les 09 étapes à suivre selon la norme ASME V&V 40 pour établir, évaluer la crédibilité et valider le modèle computationnel informatique, nous présentons la figure 11.
Figure 11 : Les différentes étapes implémentées pour répondre à la norme ASME V&V 40 [24]
Une fois que la crédibilité des CM&S est validée et établie, la FDA considère le modèle computationnel du DM ou de l'organe comme crédible. Si ces modèles sont jugés crédibles, cela signifie également que les résultats de performance générés par l'outil MDDT sont fiables. Par conséquent, la FDA pourra évaluer de manière adéquate le DM et lui délivrer la notification nécessaire à sa commercialisation.
Aussi, lors de nos différents entretiens, nous nous sommes rendus compte qu’il est possible pour certains fabricants de ne pas faire des tests cliniques au niveau des Etats-Unis. En effet, cela est observé dépendamment de plusieurs facteurs :
- Lorsque le facteur de sécurité est élevé (i.e. lorsqu’ils ont une grande largeur en termes de sécurité du patient lors des simulations numériques. La mesure de la résistance du matériau à l’application d’une force permet de mesurer le facteur de sécurité.
- Lorsque le nouveau produit/implant peut fournir des informations sur son produit par rapport au produit existant du marché.
Aux vues de ce qui précède, les différentes notifications nécessaires à la commercialisation du produit sont représentées par le tableau 1 :
Tableau 1 : Type de notification délivrée par la FDA
| Soumission avant commercialisation | Caractéristiques |
| Notification avant commercialisation (510k) : 21 CFR Part 807 Subpart E | Demande de commercialisation pour les dispositifs à faible et moyen risque.« Équivalence substantielle » entre le nouveau dispositif et un dispositif légalement commercialisé Comparer L’utilisation prévue, les caractéristiques du dispositif, les tests de performance |
| Demande d'approbation avant commercialisation (PMA) : 21 CFR Part 814 | Demande de commercialisation pour les dispositifs à haut risque Assurance raisonnable : Sécurité et efficacité Les preuves doivent être indépendantes, Pas d'équivalence |
| De Novo | Permet de classer les nouveaux dispositifs médicaux pour lesquels il n'existe pas d'équivalents commercialisés légalement, mais qui offrent une sécurité et une efficacité adéquates avec des contrôles généraux. La FDA effectue une évaluation basée sur les risques du dispositif en question avant de l'approuver et d'autoriser sa commercialisation. |
La simulation numérique est un processus très réglementé aux Etats- Unis à travers la norme ASME V&V 40. Ce processus est très structuré mais qu’en est- il de l’Europe ? Qu’en est-il de la norme ASME V&V 40 ? Est-elle reconnue au niveau européen ? Dans la suite de notre MIM, il s’agira de répondre à ces questions et de faire des suggestions par rapport à l’adoption de cette technique de simulation numérique en se basant sur les différents projets financés par l’UE.
Chapitre 4 - Recommandation de la simulation numérique dans le processus de validation en Europe
1. Positionnement de la simulation numérique dans l'Union européenne
D’une manière générale, il n’y a pas dans le règlement (UE) 2017/745 sur les dispositifs médicaux un cadre explicite concernant l’utilisation de données de simulation numérique pour justifier des preuves cliniques. A l'annexe VII du règlement, est mentionné le mot simulation, sans directive spécifique. Ceci peut s’expliquer par le fait qu'il n'y ait pas en Europe une norme qui encadre les CM&S sur laquelle ils peuvent s’appuyer comme c’est le cas aux Etats-Unis avec la norme ASME V&V 40.
La simulation numérique dans le developpement des médicament
Cependant, l’Agence Européenne des Médicaments (EMA) reconnaît l’utilisation et l’importance de la simulation numérique dans le cadre du développement et l‘évaluation des médicaments comme par exemple la Modélisation pharmacocinétique et physiologique PBPK[25]. Il est aussi utilisé pour l’enseignement et les formations dans le cadre sanitaire. Plusieurs modèles CM&S ont été développés notamment :
Modélisation pharmacocinétique et physiologique PBPK
La simulation et modélisation PBPK, permettent de prédire l’interaction du médicament, à partir des propriétés physicochimiques du médicament, des données physiologiques d’animal ou humain. Ceci permet d’optimiser les doses et la posologie tout en réduisant les études in vivo[26].
Nous avons par exemple du Rivaroxaban qui est un anticoagulant oral indiqué dans la prévention des accidents vasculaires. Il utilise le modèle PBPK pour simuler l'inhibition des enzymes métabolisant le rivaroxaban (comme le CYP3A4) et les transporteurs (comme la P-glycoprotéine) par d'autres médicaments [27].
Pour la standardisation de la présentation des travaux de modélisation sur la PBPK, l’EMA a rendu public en 2018 un guide intitulé « Guideline on the reporting of physiologically based pharmacokinetic (PBPK) modelling and simulation ». L’objectif de ce guide est d’assurer la transparence et la cohérence des rapports de recherche, en donnant des recommandations sur les éléments à présenter et les modalités d’évaluation des simulations PBPK [28].
La simulation numérique dans la formation du personnel
La simulation numérique est aussi utilisée dans le domaine sanitaire pour la formation des personnels sanitaires et dans l’enseignement pour la formation des étudiants dans le but d’améliorer leurs compétences cliniques. Ils vont avoir un environnement réaliste pour pratiquer des interventions médicales sans danger sur le patient et de réduire le recours aux tests cliniques sur les patients. Grâce à la simulation numérique, les apprenants ont la possibilité d'expérimenter plusieurs scénarios qui vont leur permettre de renforcer leurs compétences dans la pratique clinique.
Toujours dans le domaine médical, des entreprises expérimentées utilisent l’imagerie médicale avancée pour créer des modèles numériques pour concevoir des jumeaux numériques d'organes. Dassault Systèmes grâce au projet “living heart” ont développé des jumeaux numériques de cœur humain en intégrant des images médicales (IRM, échocardiographies). Ainsi, les cœurs virtuels permettent de tester les effets des médicaments, d’anticiper les réponses thérapeutiques, d’optimiser les enseignements et les formations [29].
2. Intérêt de la simulation numérique dans la validation d'un DM en Europe
La (CM&S) pourrait améliorer et accélérer les progrès de la validation et de la vérification des dispositifs médicaux dans le cadre du processus d’homologation en réduisant les coûts et en augmentant la compétitivité par rapport à d'autres régions.
Un intérêt est celui de la réduction de la durée du processus de réglementation, ce qui permettra de lancer rapidement de nouveaux produits, en réduisant le temps d'évaluation clinique et en obtenant l'approbation formelle du dispositif médical pour le marché [30].
Un autre aspect est la réduction des essais précliniques et cliniques, ce qui permettra de lancer rapidement des DM innovants, en obtenant l'approbation formelle du dispositif médical sur le marché.
Le soutien des solutions d'innovation et l'amélioration du processus de recherche et de développement attirera les entreprises (start-ups).
En outre, la nouvelle approche de la simulation numérique du dispositif médical accélère le processus d'harmonisation des organismes notifiés en ce qui concerne le processus d'approbation [31]. De plus, les méthodes de simulation (essais in silico) optimisent l'utilisation des ressources en réduisant les besoins en équipement de laboratoire, en personnel et en infrastructure pour les essais physiques. Les coûts associés à l'entretien des laboratoires et aux essais in vitro ou in vivo sont nettement réduits. Ces méthodes sont également durables, car elles limitent les déchets biologiques et chimiques produits lors des essais traditionnels.
3. Suggestion d'implémentation des procédures numériques pour la validation d'un dispositif médical en Europe
La CM&S prend une place importante dans le développement et la validation des DM et peut être très recommandée en Europe. C’est pour cette raison que plusieurs associations se sont mises ensemble pour promouvoir une norme standard pour l'Europe comme : Le projet initié par AVICENNA ALLIANCE en 2016 qui vise à promouvoir l’usage de la simulation informatique dans la réglementation des dispositifs médicaux [9]. À Travers l’Alliance Avicenna et les associations NAFEMS et Micado se sont engagés à porter un plan d’actions, « France BIOMECA 2023 », qui se donne pour objectif de repositionner la filière des fabricants de DM dans l’innovation en promouvant les normes et standards, comme le standard de la norme V&V40 ASME (Vérification & Validation des équipements médicaux) dont le référentiel V&V10 pour la mécanique, V&V20 pour la mécanique des fluides (CFD) [32]. Plusieurs projets utilisant la CM&S sont financés par l’UE à l’instar du projet nommé Simcardio Test financé par la commission européenne visant à accélérer l’utilisation de la simulation informatique pour concevoir les médicaments et dispositifs médicaux cardiaques se base sur la norme ASME V&V40. Ce projet a pour but de mettre en avant l’innovation dans le domaine de la santé en Europe et ailleurs[9].
De plus, au cours de nos entretiens avec les professionnels du secteur, ces derniers ont mis en avant l’importance croissante d’une collaboration entre les acteurs de l’industrie, les régulateurs et les chercheurs qui se faisait déjà ceci pour développer et promouvoir des normes spécifiquement adaptées à la simulation numérique. Ensemble, ces acteurs peuvent
définir les besoins propres aux spécificités de chaque groupe, harmoniser les pratiques et promouvoir l’essor de la simulation numérique dans la conception, la validation et l’homologation des dispositifs médicaux.
Tout ceci pour dire que l’Europe est dans un processus ou ils veulent reconnaitre la simulation numérique pour la validation des DM c’est pour cela qu’ils participent à des projets innovants pouvant montrer la crédibilité de cette technique.
Conclusion
En définitive, après avoir analysé tous les éléments sur la simulation numérique dans le domaine médical, il est clair que la modélisation et la simulation trouve son importance dans le processus d’homologation des Dispositifs Médicaux. Tout au long de ce projet a été présenté un ensemble d’éléments qui montrait la place que pourrait prendre les modèles computationnelles informatique dans le processus de validation des dispositifs médicaux. En effet, à travers la présentation de l’outil Medical Development Device Tools (MDDT) développé par la FDA, il a été démontré que la vérification et la validation du modèle computationnel informatique implémenté dans l’outil est règlementé par l’implémentation de la norme ASME V&V 40 [34] . Cette norme permet de faciliter la prise de décision à la FDA aux USA lors des délivrances de notification nécessaire à la commercialisation. Dès lors, l’outil étant régit par un certain nombre d’exigences bien qu’accessibles à tous, peut être utilisé à toutes les étapes du cycle de vie du dispositif médical permettant également la prise de décisions réglementaires plus rapide. Également, cette problématique trouve une réponse dans le règlement Européen où il est écrit que la modélisation informatique peut être acceptée par l’organisme notifié comme état de l’art pour les tests précliniques à l’annexe VII section 4.5.4 [33]. Concernant la simulation, le mot simuler apparait dans le règlement à l’annexe 2 section 6.1 [33]. Toutefois, le règlement ne spécifie pas que les preuves de la modélisation et simulation numérique fournies à l’organisme notifié peuvent remplacer les tests précliniques faits sur les animaux. Aussi, l’Union Européenne ne reconnait la simulation numérique que dans le secteur de la formation des personnels et dans le développement des médicaments à travers l’Agence Européenne de Médicament.
En se basant sur le présent projet et les recherches exercées dans le cadre de ce dernier, il est proposé qu’au niveau Européen, un début de solution pour faciliter la validation des DM en intégrant le concept de modélisation computationnelle serait de premièrement Établir une norme harmonisée au niveau européen pour encadrer ces pratiques. Deuxièmement, il serait intéressant de créer un outil de développement dédié aux DM, similaire au programme MDDT aux États-Unis pour uniformiser les pratiques à l’aide de la norme harmonisée et de l’outil. Enfin, comme autre proposition, il serait intéressant de soutenir les projets de simulation numérique pour la validation des DM, comme EDITH VHT et InEUHeart afin de mieux s’informer sur les difficultés des professionnels et planifier déjà les améliorations, perspectives qui pourront accompagner le projet.