IDS257 - Imagerie cérébrale dans le diagnostic de la maladie d'Alzheimer
DOI mémoire
https://doi.org/10.34746/ids257Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs



Contacts
- BOUTUIL Alaeddine : alaeddine.boutuil@outlook.com
- LAWSON Estelle : lawson.estelle5@gmail.com
- MARCHAND Alex : marchand.alex4@gmail.com
Citation
A rappeler pour tout usage : Alaeddine BOUTUIL, Estelle LAWSON et Alex MARCHAND, « Imagerie cérébrale dans le diagnostic de la maladie d'Alzheimer », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Projet, https://travaux.master.utc.fr/, réf n° IDS257, https://doi.org/10.34746/ids257, janvier 2025, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids257
Résumé
La maladie d’Alzheimer (MA) est une pathologie neurodégénérative progressive qui constitue la forme la plus courante de démence. Son diagnostic précoce représente un enjeu crucial pour optimiser la prise en charge des personnes atteintes et ralentir la progression des symptômes. Ce mémoire traite des différentes modalités d’imagerie cérébrale utilisées dans le diagnostic de la MA. Parmi celles-ci, L’imagerie par résonance magnétique (IRM) structurelle et la tomographie par émission de positons (TEP) sont les deux principales méthodes d’imagerie utilisées pour identifier les biomarqueurs spécifiques de la maladie, tels que l’atrophie du cerveau, le dépôt de plaques amyloïdes et l’accumulation de protéine tau. L’intégration des données d’imagerie avec des approches biologiques et cliniques renforce la précision du diagnostic, en particulier au stade précoce de la maladie. Cependant, des défis persistent, notamment concernant le coût et l’accessibilité de ces technologies. Enfin, ce mémoire met en évidence les perspectives offertes par les avancées technologiques, comme l’électroencéphalogramme (EEG) ou l’imagerie rétinienne, qui pourraient permettre un diagnostic précoce afin d’améliorer la qualité de vie des patients.
Abstract
Alzheimer's disease (AD) is a progressive neurodegenerative pathology that is the most common form of dementia. Early diagnosis is a crucial factor in optimising care for sufferers and slowing the progression of symptoms. This dissertation looks at the different brain imaging modalities used to diagnose AD. Structural magnetic resonance imaging (MRI) and positron emission tomography (PET) are the two main imaging methods used to identify specific biomarkers of the disease, such as brain atrophy, the deposition of amyloid plaques and the accumulation of tau protein. The integration of imaging data with biological and clinical approaches improves the accuracy of diagnosis, particularly at the early stages of the disease. However, challenges remain, particularly concerning the cost and accessibility of these technologies. Finally, this thesis highlights the prospects offered by technological advances, such as electroencephalogram (EEG) and retinal imaging, which could enable early diagnosis to improve patient’s quality of life.
Téléchargements
Mémoire Complet :
Imagerie cérébrale dans le diagnostic de la maladie d'Alzheimer
Introduction
Le cerveau humain est l’organe le plus complexe du corps humain. A travers les années, de nombreuses recherches ont été réalisées afin d’en apprendre plus chaque jour sur la structure et les fonctions de cet organe. Aujourd’hui, grâce à l’essor des technologies et des techniques de diagnostic innovantes, notamment dans le domaine de l’imagerie médicale, le cerveau est observé avec une plus grande précision pour identifier les maladies qui lui sont associées.
En effet, l’imagerie médicale regroupe différentes modalités, telles que la tomodensitométrie, l’imagerie par résonance magnétique (IRM) ou encore la tomographie par émission de positons (TEP). Ces outils permettent de détecter des anomalies structurelles ou fonctionnelles des pathologies du cerveau. Ainsi, certains signes de troubles neurologiques comme les accidents vasculaires cérébraux (AVC), l’épilepsie ou les tumeurs cérébrales peuvent être identifiés et confirmés par des diagnostics réalisés grâce à l’imagerie cérébrale.
L’association des innovations technologiques et de l’expertise médicale amène à une meilleure compréhension des maladies neurologiques et offre une meilleure prise en charge pour les patients. De plus, cette approche ouvre sur de nouvelles perspectives dans le diagnostic, le suivi des pathologies et le développement de traitements.
1. Les maladies neurologiques : un enjeu croissant de santé publique
1.1. Les maladies neurologiques
Les maladies neurologiques sont un enjeu de santé public. Le nombre de personnes touchées par ces maladies ne cesse de s’accroitre dû notamment à une population de plus en plus vieillissante. D’après une étude publiée par The Lancet Neurology, en 2021, plus de 3 milliards de personnes étaient atteintes d’une pathologie neurologique dans le monde. Ce qui fait des troubles neurologiques la première cause de maladies dégradant la santé et la qualité de vie des individus touchés [1].
Dans les maladies neurologiques, des pathologies sont plus fréquentes que d’autres comme la Maladie d’Alzheimer (MA), Parkinson, la sclérose en plaques ou encore les démences à corps de Lewy. Ce sont des maladies chroniques progressives, la fréquence évolue donc avec l’âge. En France, en 2023, près d’1,5 million de personnes étaient atteintes de maladies neurodégénératives [2]. Cela s’explique notamment par la population qui devient de plus en plus vieillissante et l’absence de traitement curatif. Ces maladies sont responsables de la dégradation progressive des neurones, ce qui provoque des conséquences délétères chez les personnes atteintes.
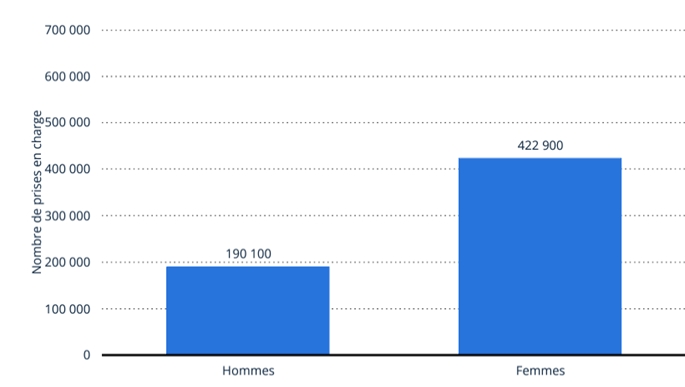
Parmi ces maladies, il y a la maladie d’Alzheimer (MA). C’est la maladie neurodégénérative la plus fréquente, touchant ainsi 1,3 millions de personnes en France en 2024 et ce nombre pourrait doubler d’ici 2050. Seulement 35% des malades seraient diagnostiqués. Cette maladie concerne plus souvent les personnes âgées à partir de 65 ans (Figure 1). Par ailleurs, les femmes sont deux fois plus atteintes que les hommes (Figure 2) [3].
Figure 1 : Nombre de personnes prises en charge pour démences (dont la maladie d’Alzheimer) selon l’âge, en France en 2017 (Source : Statista) [4]
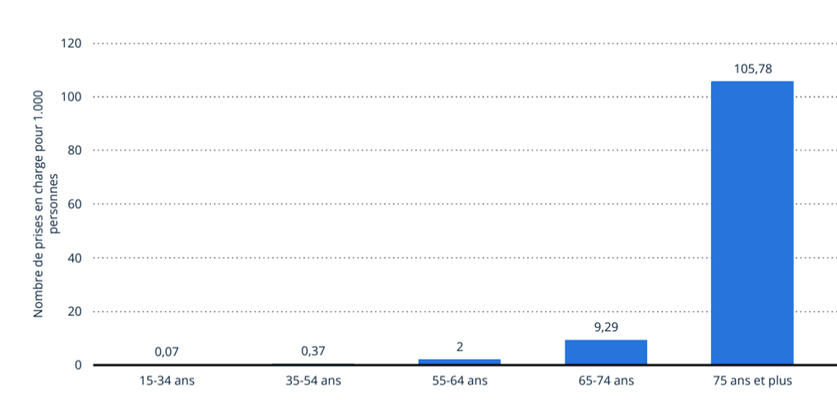
Figure 2 : Nombre de personnes prises en charge pour démences (dont la maladie d’Alzheimer) selon le sexe, en France en 2017 (Source : Statista) [4]
Ensuite, la maladie de Parkinson qui est responsable de troubles au niveau des fonctions motrices. Le patient rencontre des difficultés pour initier des mouvements (akinésie), présente une rigidité des membres (hypertonie), des ralentissements des gestes et des tremblements au repos. C’est la 2ème maladie neurodégénérative la plus fréquente, touchant un peu plus de 272 000 personnes en France en 2024 [5].
Puis, la sclérose en plaque qui est une maladie auto-immune du système nerveux central (SNC). Le système immunitaire s’attaque à la gaine protectrice des fibres nerveuses, la myéline empêchant alors la propagation de l’influx nerveux. Cette maladie touche plus les jeunes femmes adultes, avec environ 120 000 personnes atteintes en France en 2021 [6].
Enfin, il est important de citer la démence à corps de Lewis qui fait partie des démences neurodégénératives les plus fréquentes. Elle apparaît après l’âge de 50 ans. Elle se caractérise par des dépôts anormaux de protéines alpha-synucléine à l’intérieur des neurones. Cela affecte le tronc cérébral, qui est responsable du contrôle des mouvements, mais aussi le cortex cérébral qui s’occupe des fonctions cognitives. En 2021, près de 200 000 personnes étaient atteintes en France, dont 67% des malades n’étaient pas diagnostiqués [7].
Cette liste n’est pas exhaustive, il existe d’autres maladies neurologiques qui touchent de nombreuses personnes chaque année. Des recherches sont en cours afin de mieux comprendre les pathologies pour les diagnostiquer précocement et potentiellement de trouver un traitement.
1.2. Enjeux de la prise en charge des maladies neurologiques
L’enjeu dans la prise en charge des maladies neurologiques réside souvent dans l’absence de traitement curatif, ce qui concentre les efforts sur la gestion des symptômes afin d’améliorer la qualité de vie des patients. La détection précoce des signes est essentielle pour mieux contrôler l’évolution des maladies et retarder l’apparition des symptômes graves. En effet, un diagnostic précoce permet de planifier les soins de manière optimale, d’offrir des traitements symptomatiques plus efficaces et de préparer les patients ainsi que leur famille à affronter l’évolution de ces pathologies. Cependant, détecter ces maladies suffisamment tôt reste un challenge, particulièrement pour les maladies neurodégénératives, ce qui entraine fréquemment des retards dans le diagnostic et la prise en charge.
Par la suite, ce rapport traitera plus spécifiquement le diagnostic de la maladie d’Alzheimer, car c’est la première maladie neurodégénérative (MND) en termes de nombre de patients atteints. Notre intérêt particulier pour le diagnostic s’explique par le fait que toute avancée dans ce domaine, notamment grâce à la recherche et à l’amélioration des techniques de diagnostic comme l’imagerie médicale, pourrait avoir un impact significatif sur le système de santé et donc sur le parcours de soins du patient.
En effet, l’absence de traitement curatif et la nécessité d’un diagnostic précoce souligne l’importance des outils de détection performants pour la maladie d’Alzheimer. Parmi ces outils, l’imagerie médicale s’impose comme une technologie clé, montrant des perspectives prometteuses. Par conséquent, la question qui se pose est la suivante :Comment l’imagerie médicale, présente et à venir, peut-elle contribuer au diagnostic de la maladie d’Alzheimer ?
1.3. Méthodologie et objectifs du projet
Pour répondre à cette problématique, une démarche méthodologique structurée sera adoptée. Dans un premier temps, la physiopathologie de la maladie d’Alzheimer sera abordée afin de mieux la comprendre. Ensuite, viendra l’examen de la prise en charge actuelle et les méthodes de diagnostic utilisées pour cette pathologie. Ensuite, le questionnement sur la place de l’imagerie dans le diagnostic sera analysé en détaillant les méthodes de l’Imagerie par Résonance Magnétique (IRM) et la Tomographie par Emission de Positons (TEP), ainsi que l’intérêt de combiner ces approches grâce à la multimodalité. Enfin, il est essentiel d’explorer les innovations récentes qui ouvrent de nouvelles perspectives pour le diagnostic de la maladie.
Pour renforcer cette démarche, il est nécessaire de s’appuyer sur des recherches bibliographiques et à l’aide d’une enquête de terrain avec des professionnels dans le domaine de la neuroradiologie TEP et IRM, notamment un médecin nucléaire exerçant au CH du Mans et un neuroradiologue pratiquant au CH de Tours. De ce fait, il est souhaitable de vérifier que les modalités d’imagerie et diverses informations trouvées dans la littérature soient réellement utilisées en pratique, dans les établissements de santé, afin de valoriser et d’enrichir le travail.
Du point de vue du groupe, l’objectif de cette étude est d’approfondir certaines connaissances sur l’imagerie médicale et d’en apprendre davantage sur le diagnostic de la maladie d’Alzheimer. Pour ce faire, l’exploration des avantages de la multimodalité en imagerie, c’est-à-dire l’utilisation combinée de différentes techniques (IRM, TEP) pour obtenir des informations complémentaires est primordiale. Cela permettra d’évaluer l’apport de chaque modalité en termes de données cliniques et de diagnostic.
2. Physiologie du cerveau et physiopathologie de la maladie d'Alzheimer
2.1. Physiologie du cerveau
Le cerveau est un organe appartenant au système nerveux central (SNC) capable de percevoir, d’intégrer des informations afin d’agir en conséquence. Il contrôle diverses fonctions de notre corps telles que la motricité et les fonctions cognitives.
Il est protégé par une boite crânienne, recouvert par les méninges et il baigne dans le liquide céphalorachidien, lui évitant ainsi de nombreux chocs. Il consomme essentiellement du glucose apporté par l’alimentation et est entouré de nombreux vaisseaux sanguins permettant son oxygénation. Le cerveau est segmenté en différents lobes répondant à certaines fonctions. Il est constitué de 2 hémisphères : droit et gauche, reliés par le corps calleux. Chaque hémisphère possède un lobe frontal permettant le raisonnement, le langage et la coordination des mouvements volontaires ; un lobe pariétal permettant au corps de se repérer dans l’espace ; un lobe occipital lieu d’intégration des messages ; et un lobe temporal rassemblant le centre de l’audition, de la mémoire et des émotions ou centre limbique (Figure 3) [8].
Figure 3 : Schéma représentant les différents lobes du cerveau (Source : Lésion cérébrale Canada)
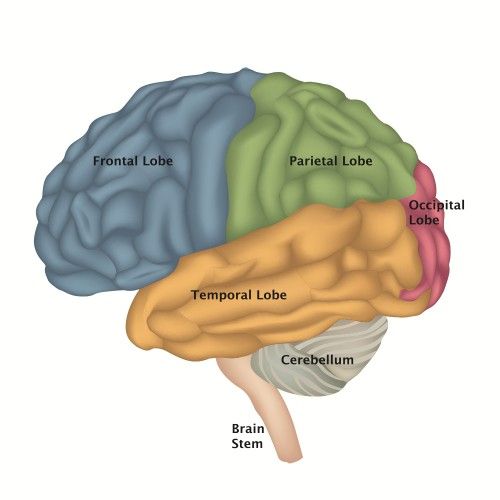
De plus, le cerveau est composé de 100 milliards de neurones favorisant la propagation de l’information à d’autres neurones ou à des organes. Il possède une couche superficielle contenant les corps cellulaires des neurones appelée substance grise et une zone plus en profondeur appelée substance blanche contenant les fibres myélinisées. Ces neurones sont essentiels pour la transmission d’influx nerveux [8].
Dans des cas pathologiques tels que la maladie d’Alzheimer, certaines connexions synaptiques se brisent entraînant la perte de communication entre les neurones, puis leur mort.
2.2. Physiopathologie de la maladie d'Alzheimer
La maladie d’Alzheimer (MA) découverte en 1907 par le médecin Aloïs Alzheimer est une maladie neurodégénérative se caractérisant par une perte progressive de certaines fonctionnalités du cerveau. Les neurones atteints se détériorent progressivement jusqu’à leur mort, entraînant des conséquences handicapantes dans la vie quotidienne des personnes atteintes de la MA. Les personnes présentent des troubles de la mémoire (amnésie), des troubles du langage (aphasie), des difficultés à réaliser des gestes (apraxie) et des difficultés pour reconnaître ou identifier des personnes ou des objets (agnosie). Le diagnostic de la maladie se fait généralement à l’âge de 65 ans et plus [9].
La MA est caractérisée par trois types de lésions : l’atrophie cérébrale, l’apparition de plaques amyloïdes et l’accumulation de dépôts de protéines tau hyperphosphorylées.
Le dépôt de plaques amyloïdes, constitué principalement de protéines amyloïdes β, empêche la connexion entre les neurones, tandis que l’accumulation de la protéine tau se fait à l’intérieur des neurones, entraînant une neurodégénérescence neurofibrillaire.
La MA peut se diviser en 3 phases. La première est la phase asymptomatique, elle se caractérise par la présence d’au moins un des marqueurs cellulaires sans que le patient ne présente de troubles cognitifs. Cette phase peut se développer très en amont avant l’apparition des premiers symptômes et le diagnostic est impossible dû à l’absence de signe clinique. Ensuite vient la phase où le patient présente des troubles cognitifs légers, appelée phase prodromique. Le diagnostic est possible grâce à la présence de biomarqueurs. Enfin, la dernière phase est celle de la démence. Le patient présente des signes cliniques et des biomarqueurs permettant aux médecins de diagnostiquer la MA. Ce dernier stade se subdivise selon sa sévérité : légère, modérée, sévère (Figure 4) [10].
Figure 4 : Modèle théorique de la progression clinique et des biomarqueurs de la maladie d’Alzheimer [11]
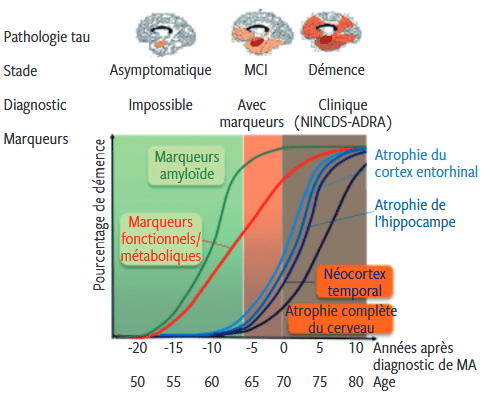
La totalité du cerveau est impactée par la maladie, mais son évolution se fait de manière temporelle et hiérarchique. La tauopathie, c’est-à-dire l’accumulation de la protéine tau dans les neurones, se manifeste d’abord dans l’hippocampe et dans le cortex entorhinal, pour s’étendre par la suite dans le système limbique puis dans le néocortex. L’amyloïdopathie, c’est-à-dire l’apparition de dépôts de plaques d’amyloïde, débute au niveau du néocortex puis se propage au système limbique et de l’allocortex pour enfin atteindre les autres régions du cerveau. Dans les deux cas, la progression des lésions neuropathologiques cérébrales affecte tout le cerveau. Le patient présentera une atrophie cérébrale correspondant à la diminution du volume du cerveau due à la dégénérescence et des troubles cliniques (amnésie, agnosie, aphasie, et apraxie) dus aux zones cérébrales touchées ne pouvant plus accomplir leurs fonctions. Ceci amène à constater que selon l’endroit touché par l’atrophie cérébrale, les symptômes ne seront pas exactement les mêmes [10].
2.3. Prise en charge de la MA
La maladie d’Alzheimer est la maladie neurodégénérative la plus fréquente en France et la cause la plus courante de démence. Bien que le principal facteur de risque soit la vieillesse, la maladie peut aussi se développer chez de jeunes adultes, même si cela est beaucoup plus rare.
La première phase de la maladie est asymptomatique, c’est pourquoi elle peut être difficile à diagnostiquer dès son commencement. Pour prendre en charge cette maladie le plus précocement possible et donc espérer ralentir la progression (ou du moins la stabiliser temporairement), l’entourage de la personne ainsi que les professionnels de santé doivent rester vigilants quant aux différents signes cliniques pouvant indiquer une atteinte.
Figure 5 : Signes cliniques pouvant indiquer une atteinte par la MA (source : Fondation Alzheimer)

Les premiers signes de la maladie d’Alzheimer peuvent se manifester de différentes façons. Bien qu’ils ne soient pas toujours synonymes de la maladie, la présence ou la répétition de plusieurs des 10 signes suivants doit inciter à consulter un médecin généraliste (Figure 5). Ces signes précèdent le stade de démence et nécessitent une attention particulière pour permettre un diagnostic et une prise en charge précoce de cette maladie progressive.
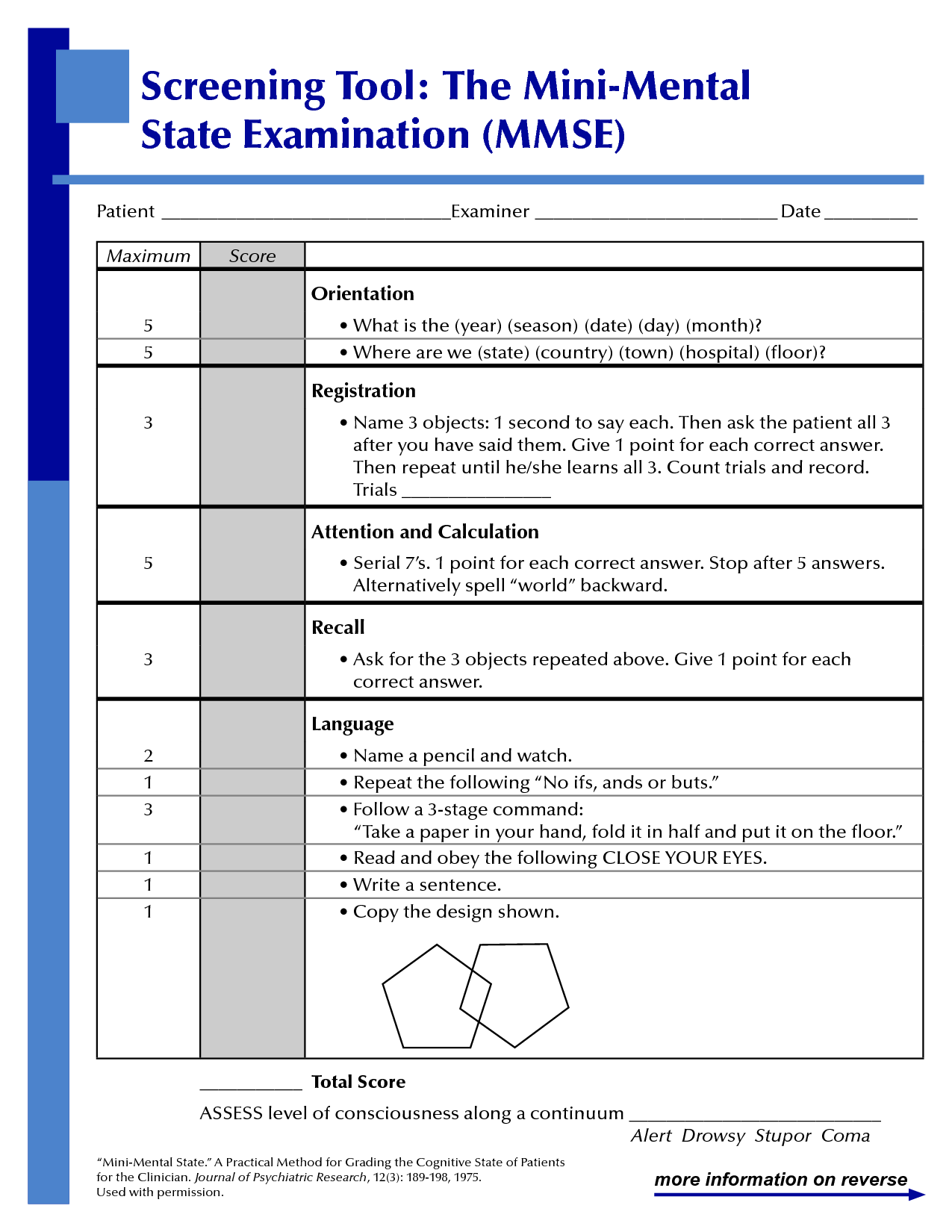
En cas de doute, le médecin généraliste est le premier professionnel de santé à consulter. Il effectue un examen clinique, utilise des tests cognitifs comme le test de l’horloge pour évaluer la situation et, si nécessaire, prescrit des examens complémentaires. Le Mini Mental State Examination (MMSE), également connu sous le nom de test de Folstein (Figure 6), est l’outil d’évaluation cognitive le plus couramment prescrit. Il permet d’évaluer les fonctions cognitives et la mémoire d’une personne lorsque l’on suspecte une démence, notamment dans le cadre du diagnostic de la maladie d’Alzheimer.
Ce test a pour objectif de détecter la présence d’éventuels troubles cognitifs et d’en mesurer la gravité. Toutefois, il est important de souligner qu’il ne permet pas de poser un diagnostic formel d’Alzheimer ou d’une autre forme de démence.
Le MMSE se concentre sur l’évaluation globale de six grandes fonctions cognitives :
- Les capacités d’apprentissage et la mémoire immédiate : le patient doit retenir et restituer une série de mots.
- L’orientation spatio-temporelle : Le patient doit démontrer sa capacité à se repérer dans le temps (date, jour, mois, saison) et dans l’espace (ville, région, pays).
- La mémoire à court terme : On demande au patient de se souvenir de certains mots après avoir réalisé une activité intermédiaire.
- Capacité orale et écrite : Cette partie du test évalue la compréhension des consignes, la prononciation correcte des mots, la rédaction d’une phrase, ainsi que la capacité à nommer des objets courants.
- L’attention et le raisonnement : le patient doit, par exemple, épeler un mot à l’envers ou effectuer des calculs mentaux simples.
- La motricité : le patient doit réaliser des exercices tels que la reproduction d’un dessin géométrique.
Le test dure environ 15 minutes et comporte 30 questions. Certaines réponses se donnent à l’oral, tandis que d’autres exercices sont réalisés sur papier.
Les résultats de ce test permettent d'identifier d'éventuels troubles cognitifs chez le patient et d'en évaluer la gravité. Ils permettent ainsi de distinguer les atteintes légères, modérées ou sévères, ainsi que les cas où aucune altération n'est détectée [12].
En fonction de la gravité des résultats, le médecin peut proposer un suivi accompagné de mesures de prévention, orienter le patient vers un spécialiste comme un neurologue s’il suspecte la maladie d’Alzheimer, ou prescrire des examens complémentaires si une maladie apparentée est envisagée [13].
Figure 6 : Test de Folstein (MMSE)[12]
Une fois le patient chez le spécialiste, de nouveaux examens sont réalisés. Ces examens peuvent inclure un bilan neuropsychologique, un examen neurologique, un bilan sanguin ou encore une ponction lombaire pour doser les biomarqueurs de la MA dans le liquide cérébro-spinal. Le bilan sanguin sera utile pour s’assurer que le patient n’est pas atteint d’une autre maladie ou affectation du cerveau.
L’imagerie cérébrale (IRM et TEP) peut également être employée pour diagnostiquer la MA, bien qu’elle ne soit absolument pas systématique. En effet, ces examens sont bien plus onéreux que de simples tests cognitifs et consultations. De plus, il n’existe pas de traitements curatifs contre cette maladie, il est donc assez rare de suivre l’efficacité, via l’imagerie, d’un traitement qui ne servirait qu’à ralentir la progression de la maladie.
La grande difficulté dans le diagnostic de la MA est qu’il existe une multitude de maladies neurodégénératives, qui présentent souvent des caractéristiques similaires. Il est donc assez aisé de confondre MA et un trouble cognitif léger, par exemple, lors des premiers stades de la maladie [13].
Les résultats sont ensuite synthétisés pour confirmer ou non le diagnostic de la MA ou d’une autre pathologie. Une fois la MA confirmée, le médecin généraliste et le spécialiste (neurologue, psychiatre, gériatre, ...) peuvent diriger le patient, s’il est en impossibilité de vivre seul, vers des structures spécialisées comme les centres mémoire ou des Etablissements pour Personnes Agées Dépendantes (EHPAD) disposant d’unités spécifiques pour les malades d’Alzheimer, avec un personnel formé à la prise en charge de troubles cognitifs.
Dans ces établissements, une éducation thérapeutique du patient (ETP) sera proposée aux résidents. Il faut bien distinguer la prévention de l’éducation thérapeutique. En 1948, l’OMS décrit la prévention de la santé comme « l’ensemble des mesures visant à éviter ou réduire le nombre et la gravité des maladies, des accidents et des handicaps ». La prévention agit en amont avec des conseils ou des actions (ex. : alimentation équilibrée, activité physique, stimulation cérébrale (lecture, jouer un instrument, etc))
L’ETP, en revanche, intervient après le diagnostic pour aider le patient à mieux comprendre sa pathologie, gérer son traitement et adopter des comportements favorisant sa santé au quotidien.
Selon la définition du rapport OMS-Europe (1996), l’éducation thérapeutique du patient vise “ à aider les patients à acquérir ou maintenir les compétences dont ils ont besoin pour gérer au mieux leur vie avec une maladie chronique. Elle fait partie intégrante et de façon permanente de la prise en charge du patient. Elle comprend des activités organisées, y compris un soutien psychosocial, conçues pour rendre les patients conscients et informés de leur maladie, des soins, de l’organisation et des procédures hospitalières, et des comportements liés à la santé et à la maladie. Ceci a pour but de les aider, ainsi que leurs familles, à comprendre leur maladie et leur traitement, à collaborer ensemble et à assumer leurs responsabilités dans leur propre prise en charge, dans le but de les aider à maintenir et améliorer leur qualité de vie ” [14].
2.4. Rôle de l'imagerie dans le diagnostic des maladies neurodégénératives
Le diagnostic des maladies neurodégénératives, telles que la maladie d'Alzheimer ou de Parkinson peut également reposer sur les techniques d’imagerie. Grossièrement, il est possible de distinguer deux catégories d’imagerie :
Imagerie structurelle : Elle est utilisée pour étudier l’anatomie du cerveau. Les images sont réalisées avec des scanners (par le principe physique des rayons X), ou avec l’IRM en raison de sa meilleure résolution spatiale.
Imagerie fonctionnelle : Elle est utilisée pour étudier le fonctionnement du cerveau. C’est par ce biais que les mécanismes des maladies neurodégénératives sont étudiés à l’aide de modalités telles que l’imagerie par résonance magnétique et/ou leur combinaison avec la TEP (par le principe physique de la radioactivité).
Si elles sont utilisées suffisamment tôt, elles peuvent détecter précocement des anomalies cérébrales, bien avant l’apparition des premiers symptômes. Cependant, en pratique, il arrive souvent que ces maladies ne soient diagnostiquées qu’à un stade déjà avancé, par soucis de moyens financiers et dans certains cas, pas de traitement efficace pour guérir de la maladie.
Lorsque la maladie est déclarée, l’imagerie peut être utilisée afin de suivre son évolution en mesurant les défaillances cérébrales liées à la perte de neurones.
Finalement, l’imagerie peut être utilisée pour évaluer les effets de différents traitements sur le cerveau afin de ralentir la progression de la maladie et donc d’améliorer l’état des patients.
Par conséquent, cette atrophie et ces lésions neuropathologiques vont être mises en évidence grâce à différentes techniques d’imagerie. Lorsque le médecin va utiliser l’imagerie pour mettre en évidence ces biomarqueurs, il va privilégier d’abord l’examen par IRM, puis l’examen par TEP. Par conséquent, dans ce rapport, l’IRM sera abordée en premier lieu et la TEP secondairement.
3. Imagerie par résonance magnétique structurelle
3.1. Principe de fonctionnement de l'IRM
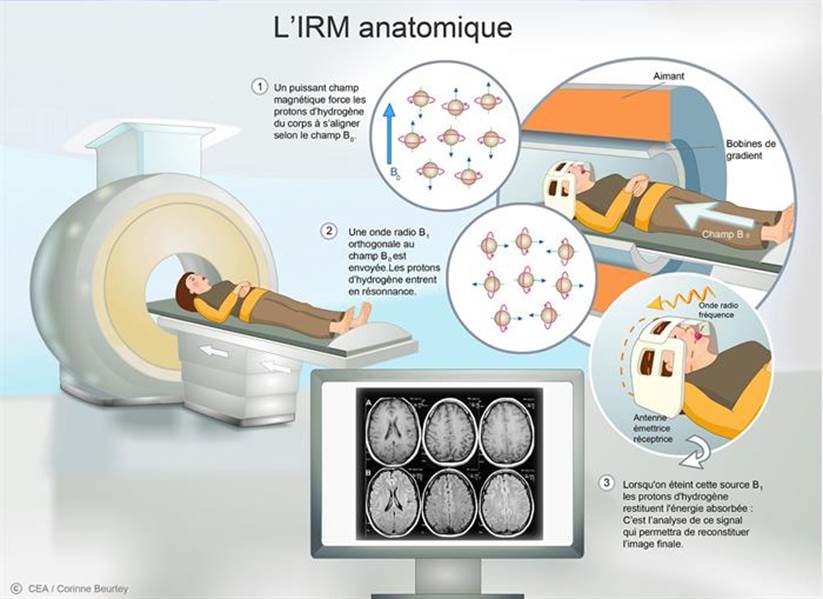
L’Imagerie par Résonance Magnétique (IRM) est une modalité d’examen en imagerie utilisant les champs électromagnétiques. Cette technique non irradiante et non invasive, permet d’obtenir des images anatomiques du corps humain et plus spécialement des tissus mous (cerveau, moelle épinière, muscles…). Elle étudie la résonance magnétique des atomes d’hydrogène contenue dans les molécules d’eau de notre organisme. Ces atomes d’hydrogène possèdent un moment magnétique appelé spin qui agit comme un aimant.
Tout d’abord, l’appareil va créer un puissant champ magnétique B0 à l‘aide d’une bobine qu’on mesure en Tesla. Le patient est placé au centre de ce champ magnétique. Ce champ va forcer les spins, à s’orienter dans la direction du champ B0. Selon la zone à explorer, dans notre cas le cerveau, une antenne va émettre des ondes radio B1 perpendiculaires au champ B0 à différentes fréquences, créant des impulsions qui vont modifier l’orientation des spins ; les protons entrent en résonance. En fin de résonance, les spins retrouvent leur position d’origine en émettant une onde de fréquence. L’onde de fréquence est reçue par l’antenne. Le retour à la position d’origine est caractérisé par le temps de relaxation dans le plan transversale perpendiculaire à B0, appelé T2 et un temps de relaxation de l’aimantation longitudinale parallèle à B0, appelé T1.
La durée de retour des spins à leur état d’origine permet d’identifier la nature du tissu observée. En effet, chaque tissu est caractérisé par un temps de relaxation différent qui permet d’observer le contraste dans les images d’IRM et de ce fait de différencier les tissus entre eux. Ainsi, le radiologue va pouvoir visualiser la structure du cerveau (Figure 7) [15].
Figure 7 : Fonctionnement de l’IRM [15]
3.2. Application de l'IRM anatomique à la maladie d'Alzheimer
L’objectif de l’utilisation de l’IRM est double, le diagnostic précoce de la maladie et la distinction de la MA des autres formes de démence ou des troubles cognitifs comme les lésions vasculaires ou tumorales. En effet, plus une maladie est détectée précocement, plus la prise en charge du patient est optimisée pour ralentir la progression de ses symptômes.
Dans le cadre de la MA, certains marqueurs sont essentiels au diagnostic de la maladie. L’un d’eux est l’atrophie cérébrale. Elle illustre la diminution du volume de certains lobes cérébraux et donc la perte neuronale (Figure 12). Pour cela, l’IRM est la méthode qui est utilisée en première intention dans le diagnostic de la maladie. En effet, c’est la méthode de référence qui permet de fournir des images les plus précises et les plus détaillées de la structure cérébrale, notamment pour mettre en évidence la présence de cette atrophie. Plus précisément, ce sont les atrophies hippocampiques et temporales que le neuroradiologue va pouvoir observer grâce à l’IRM, qui sont les meilleurs biomarqueurs pour observer l’évolution de cette maladie. Selon une étude réalisée par l’INSERM, l’analyse du cortex cérébral par IRM permet d’appuyer le diagnostic de la maladie dans environs 80% des cas [16].
Lors d’une atrophie cérébrale, les sillons qui composent le cerveau se creusent. Plus spécifiquement c’est l’hippocampe, qui joue un rôle dans la mémoire, qui va être fortement réduit. Les ventricules vont être également élargis, dont leur rôle est de produire et stocker le liquide céphalorachidien. Ce liquide est primordial dans la protection de l’encéphale contre les chocs et traumatismes (Figure 8).
Figure 8 : RM du cerveau chez un adulte cognitivement normal (à gauche) comparée à l’IRM du cerveau d’un patient avec un diagnostic clinique de maladie d’Alzheimer (Source : radiopeadia.org)

3.3. Diagnostic en fonction des stades de la maladie
La maladie d’Alzheimer se décompose en plusieurs stade : précoce, modéré et sévère (Figure 9). Le stade précoce peut révéler une atrophie de l’hippocampe. Celle-ci peut être quantifiée afin de suivre l’évolution de la maladie avec une sensibilité de 70% et une spécificité de 90%. De plus, certains tests de la mémoire, tel que le rappel de listes de mots, vont être associés à l’atrophie hippocampique pour confirmer le stade précoce de la maladie. Cependant, cet examen n’est pas suffisant pour en établir un diagnostic de la MA. En effet, l’atrophie est également présente lors du vieillissement normal du cerveau et dans d’autres formes de démence (maladie de Parkinson, démence à corps de Lewis…) [17].
Figure 9 : Schéma montrant l’évolution de la maladie : les neurones localisés dans l’hippocampe, siège de la mémoire sont atteints en premier par des lésions (a), qui se propagent progressivement dans presque tout le cortex (b,c) [17]

Il est nécessaire de préciser la mesure du volume de l’atrophie et de l’associer avec d’autres marqueurs (présence de protéine tau et plaques amyloïdes). Cela dépend également de l’intensité du champ magnétique et de la séquence utilisée de l’IRM [18].
Dans les hôpitaux, les IRM utilisées sont de 1,5 à 3 Tesla, et peuvent aller jusqu’à 7 Teslas comme celui installé au CEA à Neurospin à Saclay. Plus le champ est important, plus les différentes couches qui constituent le cerveau sont observables. Les IRM à très haut champ (7 Teslas et plus) fournissent des images de grande résolution des régions hippocampiques [17].
Le diagnostic de la MA à un stade précoce se révèle difficile en raison de l’intensité du champ qui n’est pas assez élevé et de la confusion de cette maladie avec d’autres formes de démence.
Lorsque la maladie évolue, elle passe à un stade modéré. L’atrophie se répand dans d’autres le lobe médio-temporal, dans la zone limbique en touchant l’amygdale jouant un rôle dans l’apprentissage et le cortex parahippocampique.
A un stade sévère, le néocortex temporal et toutes les structures associées au néocortex sont impliquées.
Sur la figure ci-dessous (Figure 10), l’atrophie hippocampique évolue avec le temps et par conséquent, l’imagerie par IRM permet plus clairement de distinguer l’atrophie à un stade avancé (modéré et sévère) permettant d’établir un diagnostic [19].
Figure 10 : mages en coupe frontale d’un cerveau d’un patient atteint de la MA montrant l’évolution de l’atrophie de l’hippocampe (H) au 3 stades (précoce, modéré, sévère) de la maladie de gauche à droite [19]
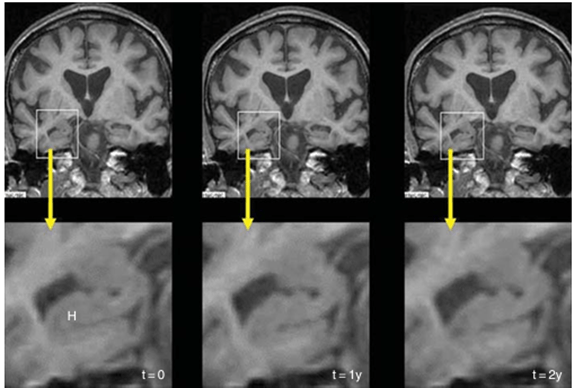
Les mesures de l’atrophie cérébrale reflètent l’accumulation des lésions neuronales qui sont directement responsables de l’état clinique des patients. Cependant, l’atrophie cérébrale est un résultat non spécifique des lésions neuronales et est présent dans plusieurs formes de démence.
Par conséquent, l’IRM ne suffit pas toujours à confirmer le diagnostic de la MA. Pour affiner l’évaluation, il est nécessaire de compléter cette approche avec des techniques d’imagerie fonctionnelle, comme la TEP.
4. Tomographie par émission de positons
La Tomographie par Émission de Positons (TEP) est une technique d’imagerie médicale fonctionnelle utilisée à l’échelle moléculaire pour observer en temps réel les processus métaboliques au sein du corps humain. Elle repose sur l’injection par voie intraveineuse d’une molécule marquée avec un atome radioactif émetteur de positons, appelée radiotraceur (ou radiopharmaceutique dans un contexte clinique), permettant de recueillir des informations quantitatives sur sa distribution. Ceci est la médecine nucléaire [20].
La qualité des images perçue par ce type d’imagerie dépend de l’expertise du radiologue, du radiopharmaceutique utilisé ainsi que de la reconstruction de l’image informatique. L’objectif de notre étude est d’étudier et de comprendre la pertinence de la TEP dans le diagnostic de la maladie d’Alzheimer [21].
4.1. Principe de fonctionnement de la TEP
L’imagerie par TEP repose sur le principe de l’émission de positons par un atome radioactif d’un isotope présent dans le radiopharmaceutique administré au patient (voir point 4.3 : production d’un radioisotope).
Le positon, ou particule β⁺, est une particule subatomique possédant la même masse et le même spin qu’un électron, mais avec une charge opposée, c’est-à-dire positive. Une fois émis par le radioisotope, le positon parcourt un trajet dans la matière environnante, en l’occurrence les tissus humains, sur une distance appelée parcours moyen. Ce parcours dépend de l’énergie cinétique initiale du positon et constitue une caractéristique du radioisotope utilisé.
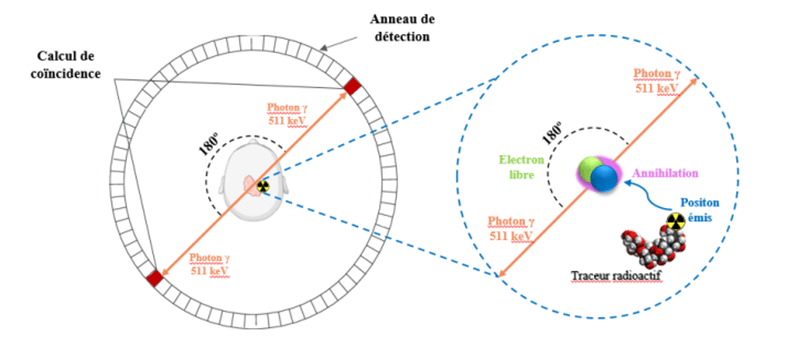
Lorsque le positon perd toute son énergie cinétique, il interagit avec un électron libre présent dans le milieu. Cette interaction donne lieu à un phénomène appelé annihilation, où le positon et l’électron se détruisent mutuellement en se convertissant en énergie kilo électron Volt. Ce processus d’annihilation engendre la production de deux photons gamma d’une énergie de 511 keV chacun. Ces photons sont émis simultanément, en coïncidence, et à 180° l’un de l’autre dans des directions opposées.
Ces photons gamma sont ensuite détectés par des capteurs disposés tout autour du patient dans l’appareil TEP. La simultanéité de l’émission des photons, ainsi que la trajectoire qu’ils empruntent, permettent de déterminer avec précision l’emplacement exact où l’annihilation a eu lieu [21].
Figure 11 : Phénomène d’annihilation[21]
Pour cela, un théorème mathématique est utilisé, appelé la transformation de Radon. Ce théorème permet de reconstruire une image en déduisant les points d’origine des particules détectées. En combinant les données recueillies par les détecteurs sur les différents rayons, il devient possible de déterminer avec précision la localisation de l’annihilation au sein du corps, permettant ainsi d'obtenir une image détaillée des zones d'activité métabolique [22].
Figure 12 : Fonctionnement de la TEP [22]
Figure 13 : Appareil de Tomographie par Emission de Positon

En utilisant ces informations, une image tridimensionnelle est reconstruite, représentant la distribution du traceur radioactif dans l’organisme. Cette image permet de visualiser l’activité métabolique des tissus et d’identifier des anomalies éventuelles. L’imagerie TEP en neurologie permet d’étudier alors l’activité cérébrale et de diagnostiquer des maladies comme Alzheimer, Parkinson ou l’épilepsie.
4.2. Caractéristiques de la TP
- Résolution spatiale de l’ordre de 4 millimètres : Elle fait référence à la capacité d’un système d’imagerie à distinguer des détails fins dans l’espace, autrement dit, à discriminer des structures proches dans l’image. 4mm est correcte pour des lésions avancées, mais elle présente des limites pour la détection précoce des atteintes subtiles dans des régions critiques.
- Faible résolution temporelle : Elle correspond à la capacité d’un système à capturer des changements rapides au fil du temps. Une bonne résolution temporelle est essentielle pour observer des processus dynamiques, cependant cette dernière est relativement faible pour la tep.
4.3. Production d'un radioisotope
Un isotope est une forme d'un élément chimique dont les noyaux possèdent le même nombre de protons, mais un nombre différent de neutrons. Cela signifie que les isotopes d'un élément chimique ont les mêmes propriétés chimiques, mais des masses atomiques différentes. Leurs propriétés physiques sont cependant différentes. Par exemple le carbone 14 est un isotope instable émettant de la radioactivé sous forme de rayons beta [23].
Un aspect fondamental qui différencie les isotopes est leur période radioactive, exprimée en temps de demi-vie (notée t₁/₂).
La période radioactive ou temps de demi-vie est la durée pendant laquelle la quantité de matière radioactive diminue de moitié. Chaque isotope possède une demi-vie caractéristique qui peut aller de fractions de seconde à plusieurs millions d'années, en fonction de la stabilité du noyau atomique. Le choix de l’isotope est primordial dans le contexte de l’application clinique visée (Figure 14).
Figure 14 : Temps de demi vie de différents isotopes [24]

Les radioisotopes utilisés pour l’imagerie TEP sont produits de manière artificielle à l’aide de cyclotrons, des dispositifs sophistiqués d’accélération de particules largement utilisés en physique et en médecine nucléaire. Un cyclotron fonctionne en accélérant des particules chargées, telles que des protons ou des ions, grâce à un champ électrique oscillant. Les particules chargées sont d’abord injectées au centre de l’appareil.
Figure 15 : Principe de fonctionnement d’un cyclotron [21]
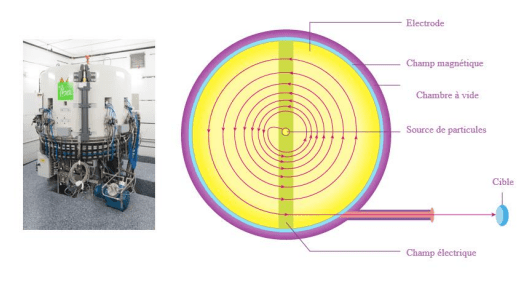
Un champ magnétique perpendiculaire à la trajectoire de la particule la fait tourner en spirale. Cela maintient les particules dans une trajectoire circulaire ou hélicoïdale.
À chaque passage dans la région entre les deux électrodes les particules reçoivent une impulsion électrique qui augmente leur énergie cinétique. Leur vitesse et leur rayon de trajectoire augmentent progressivement. Une fois que les particules atteignent une énergie cinétique suffisante, elles sont dirigées vers une cible solide, liquide ou gazeux. Cette collision induit des réactions nucléaires, produisant des isotopes radioactifs spécifiques [25], [26].
Par exemple pour produire du FLUOR 18 (F-18), isotope, un proton a une certaine énergie cinétique entre en collision avec une cible d’eau enrichit en oxygène (oxygène 18). La collision va éjecter un neutron et produire le fluor 18 comme suit :
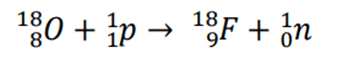
Pour créer un radiopharmaceutique, il est alors intéressant de lier le radioisotope à un vecteur biologique spécifique afin de cibler la région de l’organisme à étudier. Par exemple, l'isotope radioactif fluor-18 peut être attaché à un vecteur biologique, tel qu'un analogue du glucose comme le FDG (fluorodésoxyglucose). Ce vecteur agit comme un radiotraceur, imitant le glucose, ce qui lui permet de se lier à des récepteurs cellulaires attractif du glucose, en particulier dans le cerveau ou les tumeurs où la consommation de glucose est significative. Cette liaison donne le complexe 18F-FDG et permet ensuite de réaliser des images par tomographie par émission de positons (TEP).
La fluoruration nucléophilique est la réaction chimique courante pour fixer le fluor-18 sur une molécule cible, comme dans le cas de la synthèse du FDG. Après la réaction, le produit est purifié et contrôlé avant d'être isolé et utilisé pour des scans diagnostiques en médecine nucléaire [27].
4.4. Intérêt de tracer l'activité dans le système neuronal
Le cerveau est composé de millions de neurones, qui permettent la conductivité électrique. Pour faciliter son étude, les chercheurs ont subdivisé le cerveau en différentes aires cérébrales (Figure 17). Ces aires communiquent entre elles pour transmettre les informations nécessaires au bon fonctionnement de l’organisme. La transmission de ces informations se fait par le biais d’une activité électrique neuronal, un processus qui nécessite de l’énergie. Cette communication se déroule principalement au niveau d'une synapse, qui est une région spécialisée où un neurone (appelé neurone présynaptique) transmet un signal à un autre neurone (neurone postsynaptique).
Lorsque le neurone présynaptique est excité au niveau des dendrites (Figure 16), il génère un signal électrique appelé potentiel d'action. Ce potentiel d'action se propage le long de l'axone jusqu'à atteindre l'extrémité de l'axone, appelée terminaison axonale.
Figure 16 : Schéma complet d’un neurone et d’une fente synaptique
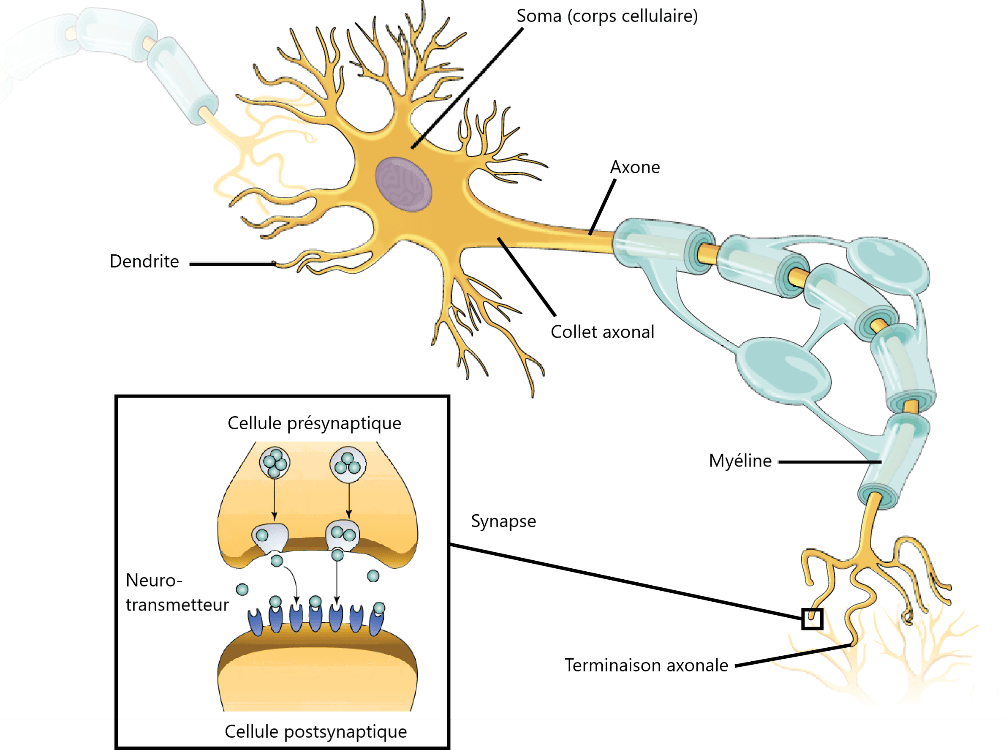
À l'arrivée du potentiel d'action à la terminaison axonale (Figure 16). Des canaux calciques voltage-dépendants s'ouvrent. Cela permet l'entrée de calcium (Ca²⁺) dans la terminaison axonale depuis le milieu extracellulaire. L'augmentation de la concentration en calcium entraîne la fusion des vésicules synaptiques (qui contiennent des neurotransmetteurs) avec la membrane plasmique de la terminaison axonale. Les neurotransmetteurs sont alors libérés dans l'espace entre les deux neurones, appelé fente synaptique, par un processus appelé exocytose. Les neurotransmetteurs diffusent à travers la fente synaptique pour atteindre la membrane du neurone postsynaptique. Les neurotransmetteurs se lient à des récepteurs spécifiques situés sur la membrane du neurone postsynaptique. En fonction du type de neurotransmetteur et de récepteur impliqués :
- Un potentiel postsynaptique excitateur (PPSE) est généré. La dépolarisation et la génération d'un potentiel d'action du prochain neurone est effectué.
- Un potentiel postsynaptique inhibiteur (PPSI) est généré, entraînant une hyperpolarisation qui inhibe la transmission du signal du prochain neurone.
Ainsi, une dilatation des vaisseaux sanguins survient dans les aires cérébrales en activité pour augmenter le débit sanguin et fournir un apport énergétique sous forme d’ATP (Adénosine triphosphate). Ce phénomène est connu sous le nom de « résonance d’une aire cérébrale » et représente l’augmentation du flux sanguin dans une zone spécifique du cerveau.
Ainsi, l’utilisation de radiotraceurs et radioisotopes spécifiques dans certaines régions du cerveau permet de révéler cette activité cérébrale, offrant des indications fondamentales pour le diagnostic de la maladie d’Alzheimer. Cette démarche s’inscrit dans une recherche constante du radioisotope le plus précis et adapté pour mettre en évidence les mécanismes physiopathologiques de cette maladie.
Par exemple, une neurodégénérescence se manifeste souvent par une diminution de l'activité métabolique, traduite par une moindre dépense énergétique et donc d’ATP dans certaines aires cérébrales ciblées (Source : cours de physiologie de Jean-François Grosset, 2024).
4.5. Application de la TEP à la maladie d' Alzheimer
4.5.1. Application du radiopharmaceutique 18F-FDG
Il existe un grand nombre de traceurs radioactifs spécifiques pour le diagnostic des maladies neurodégénératives. Aujourd'hui, les neuroradiologues utilisent fréquemment le 18F-FDG (fluorodésoxyglucose), car il est plus abordable, largement disponible dans la plupart des établissements de santé et présente un temps de demi-vie non négligeable de 110 minutes.
Le 18F-FDG est transporté vers le cerveau par la circulation sanguine à l'aide de transporteurs de glucose, principalement GLUT1 dans la barrière hémato-encéphalique et GLUT3 dans les neurones et est métabolisé dans un processus impliquant les neurones et les astrocytes. Une fois dans les cellules, il est phosphorylé par l'hexokinase (enzyme qui catalyse la première étape de la glycolyse) mais ne peut pas être complètement métabolisé, ce qui entraîne son accumulation. Cette accumulation reflète l'activité métabolique neuronale et synaptique dans différentes régions cérébrale [Radiologue][28].
La TEP au 18F-FDG permet de détecter avec sensibilité les changements d'activité neuronale liés à la neurodégénérescence. Les différents troubles de maladie neurodégénérative se traduisent par des variations dans la captation du 18F-FDG, visibles en TEP. De plus, le 18F-FDG permet la différenciation des trois principaux troubles neurodégénératifs, à savoir, la maladie d'Alzheimer, la démence fronto-temporale et la démence à corps de Lewy. Ce qui permet de supprimer quelques suspicions de maladies.
La TEP 18F-FDG révèle une réduction de la captation de 18F-FDG dans les régions temporo-pariétales pour les patients atteints de la maladie d’Alzheimer. Les régions temporo-pariétales sont des zones du cerveau situées à l’intersection des lobes temporaux et pariétaux (Figure 17). Elles jouent un rôle dans le traitement de l'information sensorielle et cognitive. Les patients atteints de MA ont alors une réduction des performances dans les tâches de mémoire épisodique et d’intégration cognitive.
Cette captation est détectée avec une sensibilité comprise entre 80 % et 93 % et une spécificité de 60 % à 76 %.
La sensibilité permet de donner la capacité à détecter une maladie lorsqu’elle est présente. En l’occurrence, une sensibilité comprise entre 80 et 93 % est considérée comme élevée. Cela signifie que la TEP au traceur FDG est efficace pour identifier la maladie d’Alzheimer.
La spécificité, quant à elle, mesure la capacité d’exclure les personnes qui ne présentent pas la maladie. Dans le cas de la FDG, une spécificité de 60 % à 76 % signifie qu'il y a une probabilité moyenne de donner un résultat négatif chez une personne qui ne souffre pas d’Alzheimer.
En d’autres termes, la sensibilité indique la probabilité de détecter de vrais cas de maladie, tandis que la spécificité représente la probabilité de détecter de faux cas de maladie [29] [30].
Figure 17 : Zone temporo pariétale, intersection entre zone temporale et pariétale

Figure 18 : Baisse d’activité bilatéral temporo-pariétale [31]
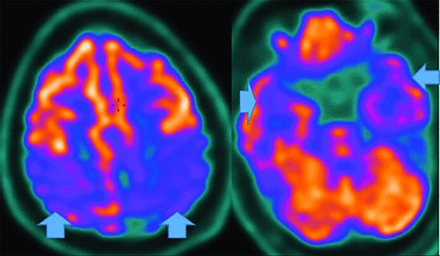
A l’image, la TEP 18F-FDG chez un patient atteint de la maladie d’Alzheimer montre une diminution d’activité pariétale (Figure 18). Les dépôts d’amyloïdes en sont responsable associés à un déclin de présence au 18F-FDG au niveau des zones pariétales donnant un métabolisme anormal du glucose, illustrant différents symptômes pour le patient tels que la perte de mémoire [31].
4.5.2. Mise en évidence des plaques amyloïdes par le composé Pittsburg Compound –B
Depuis 2003, l’UCSF (University of California, San Francisco), l'un des plus grands centres mondiaux d'évaluation du déclin cognitif et de la démence, offre aux patients atteints de troubles de la mémoire la possibilité d’une évaluation de la maladie d'Alzheimer par tomographie par émission de positons (TEP) axée sur les plaques amyloïdes, caractéristique physiopathologique de la MA. Cette technique permet de visualiser les plaques amyloïdes dans le cerveau à l’aide d’une tomographie par émission de positons, permettant ainsi de détecter ces dépôts avec précision chez des patients vivants, ce qui constitue une avancée significative dans le diagnostic de la maladie [32].
Une forte présence d’amyloïde résulte d’une haute dépense énergétique illustrée sur une échelle de couleur vert à rouge (Figure 19).
Figure 19 : TEP Amyloïde au PIB[32]
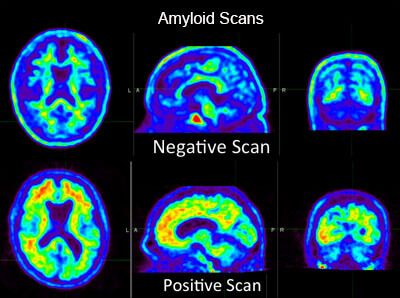
Le traceur employé pour l’observation in vivo des dépôts d’amyloïde est le Pittsburg Compound-B (PIB). Ce traceur se distingue par sa forte affinité pour les plaques amyloïdes et sa capacité à franchir la barrière hémato-encéphalique. De plus, il a la particularité de se lier exclusivement aux plaques de β-amyloïde, sans interférence avec d'autres éléments. Ce qui en fait un excellent confirmant le diagnostic de l’Alzheimer [33].
Le Pittsburg Compound-B (PIB) est un radiotraceur marqué avec du carbone 11 (11C) pour la détection in vivo des plaques amyloïdes. Ce traceur appartient à la classe des dérivés benzothiazolés, connus pour leur affinité naturelle avec les structures amyloïdes, notamment les dépôts de β-amyloïde. Ces dépôts constituent une caractéristique pathologique de la maladie d'Alzheimer.
La molécule de PIB est produite à partir de la modification de la thioflavine-T afin d’accroître sa spécificité pour les plaques amyloïdes et de lui permettre de traverser la barrière hémato-encéphalique. Cependant, la courte demi-vie de son isotope radioactif (11C), d’environ 20 minutes, constitue une limitation importante. En effet, cette contrainte exige une infrastructure spécialisée pour une utilisation immédiate afin d’optimiser la récupération d’informations lié à la radioactivité du Carbon 11.
Malgré cette limitation, les études ont démontré une sensibilité supérieure à 90 % pour la TEP au 11C-PIB, ce qui en fait une méthode extrêmement fiable pour confirmer la présence de la maladie d'Alzheimer en analysant en parallèle une TEP au 18F-FDG (Figure 20) [34], [35].
Si la TEP au 18F-FDG ne permet pas de distinguer clairement la maladie d'Alzheimer d'autres causes possibles, il est recommandé de procéder à une imagerie amyloïde au 11C-PIB. L’imagerie amyloïde est particulièrement utile pour exclure les syndromes qui peuvent imiter la démence, tels que la dépression ou les troubles thyroïdiens insuffisamment traités [35].
Figure 20 : Mise en comparaison du 11C-PIB et 18F-FDG [36]
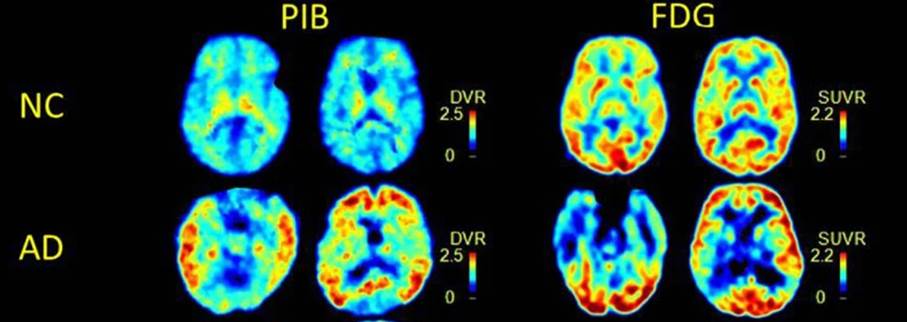
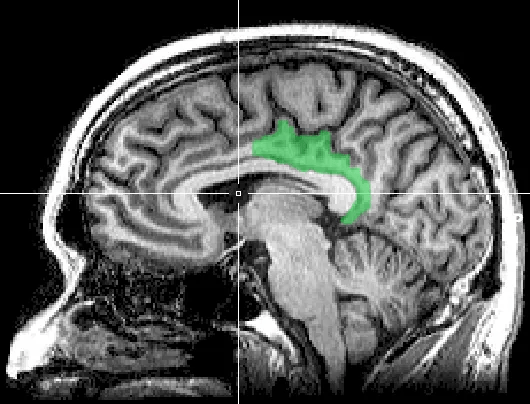
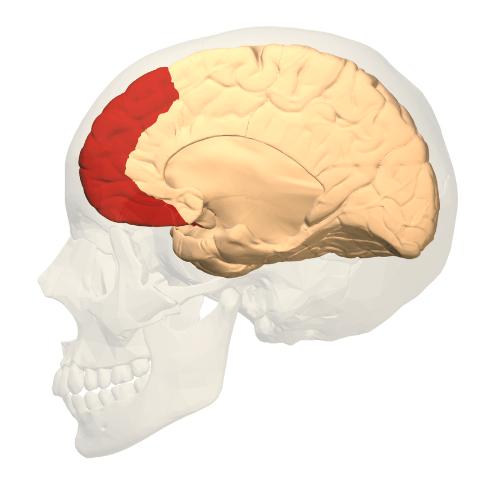
Les études réalisées à l'aide de la TEP-amyloïde (au PIB) montrent une concentration prédominante des dépôts amyloïdes dans certaines régions spécifiques du cerveau. Le cortex cingulaire postérieur (Figure 21) est particulièrement affecté, jouant un rôle dans la mémoire. Une accumulation notable est également observée dans le cortex frontal médian (Figure 22), une région impliquée dans la prise de décision et les fonctions exécutives. Enfin, les zones temporo-pariétales, montrent une implication importante dans les stades précoces et avancés de la maladie d'Alzheimer. Ces résultats sont cohérents avec les modèles neuropathologiques de la maladie, où les dépôts amyloïdes apparaissent bien avant les anomalies métaboliques ou structurelles détectées par la TEP au 18F-FDG ou l’IRM [37].
Figure 21 : cortex cingulaire postérieur
Figure 22 : cortex frontal médian [36]
4.5.3. Mise en évidence des protéines Tau par le composé 18F-flortaucipir
La National Institute on Aging and Alzheimer’s Association (NIA-AA) inclut l’utilisation du biomarqueur T (Tau), qui reflète la présence de lésions Tau spécifiques à la maladie d’Alzheimer. L'intégration de biomarqueurs complémentaires à celle de 18F-FDG et 11C-PIB , tels que le Tau détecté par la tomographie par émission de positons avec le traceur 18F-flortaucipir, s’avère intéressant pour améliorer le diagnostic différentiel. Cette approche permet de réduire le nombre de faux positifs, notamment chez les patients atteints d’autres troubles neurodégénératifs ou chez les personnes âgées normales, offrant ainsi une meilleure précision diagnostique.
Le développement du 18F-flortaucipir est un traceur possédant une forte affinité pour les agrégats de protéines Tau caractéristiques de la maladie d’Alzheimer. L’accumulation de l’amyloïde, qui est largement répandue avec l’âge dans les populations normales, l’augmentation des agrégats de Tau dans le néocortex est beaucoup moins fréquente. Cette spécificité accrue fait du 18F-flortaucipir un outil de précision pour différencier la MA d'autres troubles neurodégénératifs. Finalement, l’utilisation du traceur 18F-flortaucipir a démontré une sensibilité estimée à 89,9 % et une spécificité de 90,6 % pour le diagnostic de la maladie d’Alzheimer [38].
Figure 23 : dépôts de la protéine Tau dans le cerveau pour des patients sains et des patients atteints de la maladie d'Alzheimer [39]
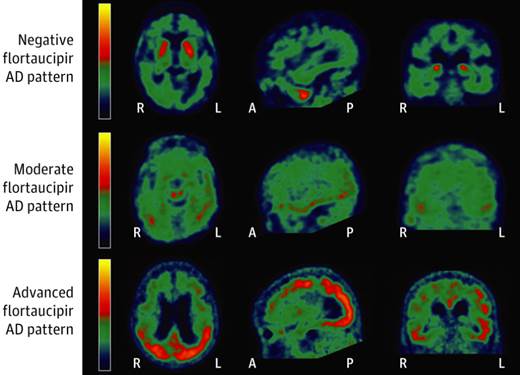
Les stades de Braak, décrivent la progression des dépôts de la protéine Tau dans le cerveau des patients atteints de la maladie d'Alzheimer. Ces stades montrent la propagation caractéristique des enchevêtrements neurofibrillaires de Tau, avec une progression bien documentée depuis les régions allocorticales jusqu'aux zones néocorticales. Les stades précoces touchent d'abord le cortex entorhinal, puis l'hippocampe, et les stades avancés affectent de plus en plus de régions du néocortex, incluant les lobes frontaux et pariétaux.
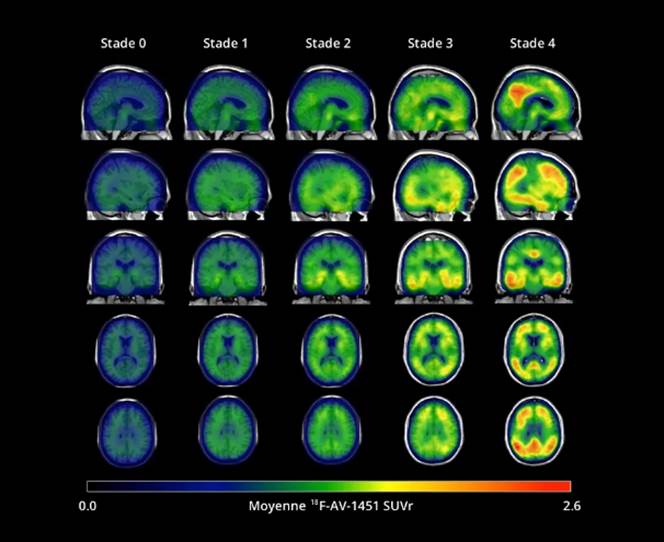
Dans les stades précoces de la maladie d'Alzheimer, la progression des dépôts de la protéine Tau suit un schéma bien défini, selon les stades de Braak (Figure 24). Au stade 0, les niveaux de Tau sont similaires à ceux des jeunes adultes sains, sans accumulation significative. Le stade 1 se caractérise par une augmentation notable de Tau dans les régions temporales médianes, notamment le cortex entorhinal et l'hippocampe, des zones essentielles pour la mémoire. Ce stade initial coïncide avec les premiers signes de troubles mnésiques. À l'étape 2, les dépôts s'étendent aux régions temporales extra-médianes, incluant le cortex temporal latéral. Cette progression entraîne des déficits plus marqués dans les fonctions spatiales et mnésiques. Le stade 3 voit l'extension des dépôts de Tau dans les régions dites Braak III/IV, avec une affectation plus large des lobes temporaux inférieurs et latéraux, accompagnée d'une altération significative des fonctions cognitives, notamment du langage et de la mémoire. Enfin, au stade 4, les dépôts sont largement présents dans le néocortex, touchant des zones telles que les lobes frontaux, pariétaux et occipitaux. Ce stade avancé est associé à un déclin cognitif sévère, incluant des troubles exécutifs et visuospatiaux, et conduit souvent à une perte d'autonomie importante (Figure 24)[40].
Figure 24 : Les stades de Braak [40]
5. Complémentarité des modalités d'imagerie
Les valeurs combinées de sensibilité et de spécificité pour diverses méthodes diagnostiques de la maladie d'Alzheimer par rapport aux témoins sont les suivantes :
- Imagerie par résonance magnétique (IRM) avec inspection visuelle (83%/89%)
- TEP au 18F-FDG (90-94%/73-89%)
- TEP au 11C-PIB (90-92%/84-100%).
- TEP au 18F-Flortaucipir (90%/91%)
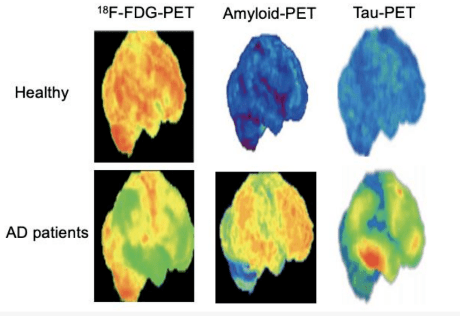
Ceci met en évidence la limitation d’un test unique dans le cadre du diagnostic de la maladie d’Alzheimer, soulignant ainsi l’importance d’une approche multimodale pour améliorer les méthodes de détection. L’usage combiné de différentes techniques d’imagerie et de divers traceurs radioactifs permet de cibler et d’évaluer plusieurs aspects pathologiques de la maladie, tels que l’accumulation de plaques amyloïdes, les enchevêtrements neurofibrillaires de protéine Tau et les altérations du métabolisme cérébral (Figure 25) [31].
Figure 25 : Traceur amyloïde et tau à la PET
Deux modalités prédominent actuellement en raison de leur complémentarité optimale : l’IRM structurelle et la TEP. Les autres modalités d’imagerie tel que le SPECT et le CT scan peuvent être utilisées pour soutenir le diagnostic selon les caractéristiques individuelles du patient.
5.1. Avantages et inconvénients de l'IRM structurelle
L’IRM est largement utilisée dans la recherche et le diagnostic de la maladie d’Alzheimer en raison de sa disponibilité et de sa capacité à fournir des images anatomiques détaillées. L'atrophie de l'hippocampe, observable sur des images hautes résolutions est un critère clé pour le diagnostic clinique de cette maladie.
Cependant, malgré sa valeur clinique pour évaluer la réduction de volume cérébral, l'IRM structurelle présente des limites en termes de spécificité moléculaire. Elle ne permet pas de déterminer précisément si la diminution de volume provient d’une perte neuronale directe, d’une réduction dendritique ou synaptique. De plus, des signes d’atrophie cérébrale peuvent également être observés dans le cadre du vieillissement normal ou sont caractéristiques d’autres maladies neurodégénératives autre qu’Alzheimer, ce qui complique l'interprétation des résultats.
Enfin, comme l'IRM structurelle ne mesure pas les modifications fonctionnelles, il est nécessaire de combiner cette technique avec d’autres méthodes d’imagerie afin d’améliorer la précision du diagnostic de la maladie d’Alzheimer [41].
5.2. Avantages et inconvénients de la TEP
La TEP peut être plus efficace que les simples mesures de volume par IRM structurelle pour détecter les signes précoces de neurodégénérescence dans la maladie d’Alzheimer. En effet, cette technique peut mettre en évidence des anomalies métaboliques avant que l'atrophie du cerveau ne devienne visible sur une IRM. Bien que la TEP 18F-FDG soit fiable pour identifier les premiers stades de la maladie, son usage reste limité à cause de son coût élevé et de la rareté des appareils. De plus, elle nécessite l’injection de marqueurs radioactifs, ce qui en fait une méthode plus invasive que l’IRM. C’est pourquoi cette modalité est plutôt utilisée en dernière intention malgré qu’elle soit plus indicative que l’IRM.
Cependant la TEP permet une analyse approfondie de l’activité métabolique et du dysfonctionnement synaptique dans le cerveau des patients, en quantifiant notamment les protéines toxiques comme cité plus haut, telles que l’amyloïde et la protéine Tau, qui contribuent au passage des neurones sains à un état pathologique. Par ailleurs, il est à noter que l’hypométabolisme (baisse d’activité métabolique) observé via la TEP 18-FDG reflète souvent une perte neuronale déjà avancée et pourrait ne pas être détectable dans les tout premiers stades de la maladie, avant que les dommages neuronaux ne soient présents [41].
Bien que la recherche concernant la MA s’articule principalement autour de l’immunothérapie, nous avons décidé, lors de ce projet, de nous concentrer sur les modalités d’imagerie, notamment celles utilisées à des fins de diagnostic et de suivi.
6. Innovations
Les innovations en santé progressent rapidement, ouvrant la voie à des marqueurs encore plus spécifiques pour détecter diverses protéines pathologiques, ou à des techniques combinées comme l’IRM/TEP devenant plus accessibles.
Cette approche se concentre sur des dispositifs médicaux et des solutions de diagnostic qui s'inscrivent dans le domaine de l'imagerie, en cohérence avec les objectifs du projet. Les outils d'analyse automatisée basés sur l'intelligence artificielle, conçus pour affiner les diagnostics, témoignent également du potentiel grandissant des technologies d'imagerie médicale.
6.1. L’électroencéphalogramme pour identifier les personnes à risque ?
Dans la maladie d’Alzheimer, les troubles du sommeil apparaissent souvent bien avant le diagnostic. Ainsi, est ce que ces altérations du sommeil sont causés par les premières étapes de la maladie ou constituent-ils un facteur de risque favorisant la neurodégénérescence ? Une équipe de chercheurs de l’Inserm de Caen, menée par Géraldine Rauchs, s’est penchée sur le lien entre le sommeil paradoxal et les dépôts de protéines amyloïdes, l’un des marqueurs clés de la maladie.
La maladie d’Alzheimer résulte notamment de l’accumulation de protéines amyloïdes dans le cerveau. Si les troubles de la mémoire sont le symptôme le plus connu, des troubles du sommeil figurent également parmi les symptômes et arrivent de façon précoce, bien avant le stade de démence.
La majorité des études portant sur ce sujet s’intéressaient d’avantage au sommeil lent car il est associé à une période de forte récupération mais aussi car ce serait lors du sommeil lent que les déchets toxiques produits par nos neurones seraient éliminés. C’est grâce à ces études que l’association entre l’accumulation de protéines amyloïdes et les troubles du sommeil lent a été prouvée.
Cependant, le sommeil paradoxal paraît très intéressant à étudier car il met en jeu des neurones de type cholinergiques, atteints très rapidement dans la maladie d’Alzheimer. De plus, des modifications du sommeil paradoxal sont observées dès les stades précoces de la maladie, et cela bien avant les modifications qui atteignent le sommeil lent [42].
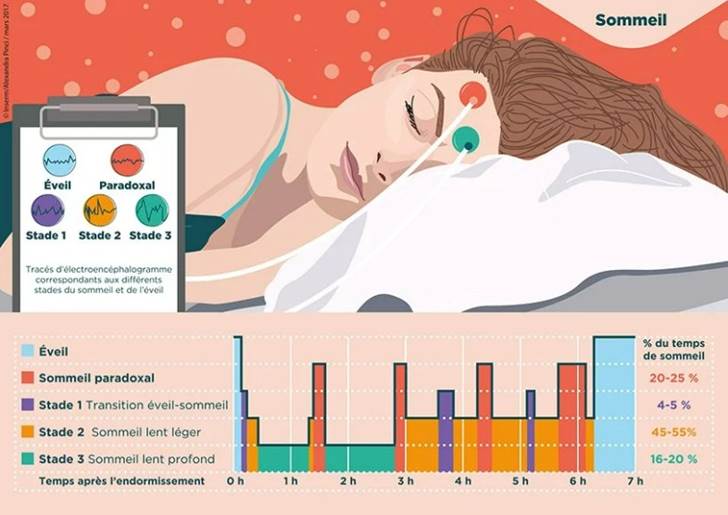
Figure 26 : Image expliquant les différents types de sommeil et leur importance relative par rapport aux cycles de sommeil
Les chercheurs ont analysé, grâce à un électroencéphalogramme (EEG), le sommeil de personnes âgées sans troubles cognitifs. Simultanément, des examens d’imagerie par IRM et PET scan ont été réalisés pour rechercher de possibles dépôts de plaques amyloïdes dans leur cerveau.
Ils ont réussi à montrer que la puissance des ondes cérébrales thêta, caractéristiques du sommeil paradoxal (Figure 27), est d’autant plus faible que le nombre de protéines amyloïdes importantes dans le cerveau. Cette association n’est pas retrouvée pour les ondes du sommeil lent, léger ou profond. Ces résultats suggèrent donc que les modifications précoces du sommeil paradoxal pourraient signaler un risque accru de progression vers la démence.
Autre découverte intrigante : la baisse de la puissance des ondes cérébrales thêta s’accompagnent d’une augmentation du débit sanguin dans certaines régions cérébrales d’avantage touchées par des dépôts amyloïdes.
Les chercheurs s’attendaient plutôt à un flux sanguin moindre car l’activité cérébrale dans ces régions est réduite par ces dépôts.
Cette hausse de la perfusion pourrait être un mécanisme compensatoire pour maintenir l’activité neuronale, mais elle pourrait, à terme, être néfaste car une hyperactivité neuronale est connue pour favoriser le dépôt de ces protéines amyloïdes [43].
Pour confirmer ces hypothèses, l’équipe prévoit d’étendre ses travaux à des groupes plus larges, incluant des personnes à différents stades de troubles cognitifs. En parallèle, elle continue de suivre les participants déjà étudiés afin de déterminer si leurs troubles du sommeil peuvent prédire une évolution vers la maladie d’Alzheimer. Ces recherches ouvrent des perspectives prometteuses pour mieux repérer les personnes à risque et leur proposer des stratégies préventives.
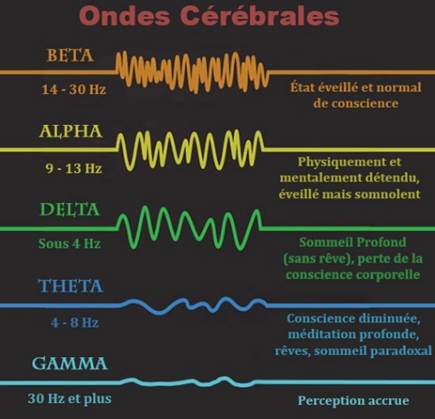
Les paramètres essentiels pour caractériser les ondes cérébrales à l’aide d’un EEG incluent l'amplitude, qui mesure l'intensité de l'activité électrique en microvolts (µV), la fréquence (Hz) qui permet de différencier les types d'ondes (alpha, bêta, delta, gamma et thêta). La morphologie de ces ondes (pointues, fuseaux, complexes, etc.) est également un critère important pour détecter des anomalies. De plus, la distribution spatiale, qui localise les ondes sur différentes régions du cortex, et la synchronisation, qui évalue la coordination temporelle entre les régions, sont des paramètres importants pour analyser l'activité cérébrale et identifier des états normaux d‘états pathologiques [44].
Figure 27 : Les cinq principaux types d’ondes cérébrales, observables en EEG
6.2. Utilisation de l’imagerie rétinienne pour diagnostiquer la MA
L’imagerie rétinienne, initialement développée comme une méthode non invasive en ophtalmologie, suscite aujourd’hui un intérêt croissant en neurologie notamment en tant qu’outil potentiel de diagnostic de la MA.
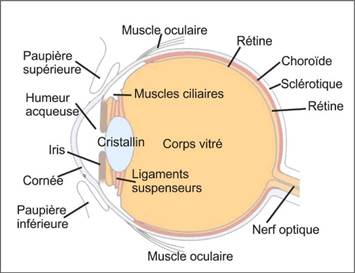
La rétine est une fine membrane composée située au fond de l’œil, essentielle à la vision (Figure 29). Elle constitue la couche photosensible de l'œil et joue un rôle central dans la transformation des signaux lumineux en influx nerveux, transmis ensuite au cerveau via le nerf optique. Cette fine membrane, d’origine diencéphalique, partage donc des similitudes avec le système nerveux central et est fortement vascularisée.
Des recherches ont montré que des dépôts de protéines amyloïdes et des altérations vasculaires, caractéristiques de la maladie d’Alzheimer, peuvent être détectés dans la rétine. Ces observations ouvrent la voie à une approche visuelle pour étudier les marqueurs de la maladie. L’examen est réalisé par un ophtalmologiste.
Figure 28 : Appareil de Tomographie par cohérence optique
Figure 29 : Schéma d’un œil humain

Diverses technologies sont utilisées pour visualiser la rétine comme l’imagerie hyperspectrale, qui repose sur la capture à différentes longueurs d’ondes du spectre lumineux (visible et IR) ou la tomographie par cohérence optique (OCT) [45], [46].
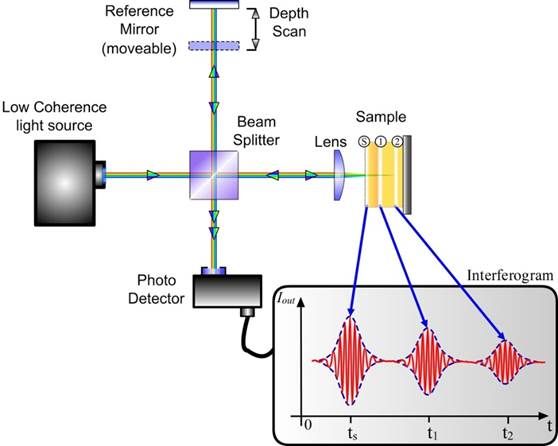
La tomographie par cohérence optique (OCT) est une méthode d’imagerie en temps réel et non invasive (Figure 28), permettant de visualiser et d’obtenir des images en coupe transversale à haute résolution (≤10µm) de tissus biologiques. Dans certains cas, des produits de contraste sont nécessaires pour bien visualiser les différentes structures.
Les images OCT fournissent des informations sur l’épaisseur, la texture et l’intégrité des différentes couches d’un tissu comme la rétine.
Principe physique :
La tomographie par cohérence optique (OCT) est fréquemment comparée à une version optique de l'imagerie ultrasonore. Elle repose sur le principe d’interférométrie à faible cohérence. L’interférence entre la lumière de référence et la lumière réfléchie par l’échantillon permet d’obtenir des informations sur les propriétés optiques et la structure du tissu.
Tout d’abord, l'OCT émet un faisceau de lumière dirigé vers l'œil. Ce faisceau est divisé en deux trajets : l’un est orienté vers le tissu à examiner et l’autre vers un miroir de référence. La lumière réfléchie par ces deux trajets est ensuite recueillie par un détecteur (Figure 30). Les écarts de temps nécessaires au retour de la lumière, depuis le tissu à analyser et le miroir de référence, sont analysées pour reconstruire une image détaillée en coupe transversale. On peut ensuite combiner les différentes images en coupe transversale pour obtenir des images tridimensionnelles.
Les données obtenues appartiennent au domaine fréquentiel, ainsi l’application d’une transformée de Fourier inverse est nécessaire pour convertir les données fréquentielles acquises en une image spatiale, en fonction de la profondeur ou des distances [45], [46].
Figure 30 : Schéma d’une configuration OCT [47]
L’OCT est utilisé dans différents domaines médicaux comme l’ophtalmologie, la dermatologie ou encore la cardiologie depuis plusieurs années. Les progrès réalisés dans le domaine de l’OCT ont notamment conduit au développement de l’angiographie OCT (OCT-A). Cette technique permet une visualisation non invasive du flux sanguin dans le système vasculaire rétinien, sans avoir besoin d’agents de contraste. L’OCT-A permet d’observer des indicateurs vasculaires qui peuvent être des signes précoces de la dysfonction cérébrale associée à la MA.
L’imagerie rétinienne constitue une piste révolutionnaire pour le diagnostic précoce et non invasif de la maladie d’Alzheimer. Bien que des recherches supplémentaires soient nécessaires pour standardiser et valider ces approches, elle représente un espoir pour améliorer le dépistage et l’intervention précoce dans cette maladie [45], [46].
Conclusion
En conclusion, l’imagerie médicale joue un rôle important dans le diagnostic de la maladie d’Alzheimer grâce aux méthodes précises pour détecter les signes et suivre l’évolution de la pathologie. L’IRM permet de visualiser les altérations structurelles du cerveau, tandis que la TEP révèle l’accumulation de biomarqueurs spécifiques (plaques amyloïdes et protéine tau) de la maladie, ainsi qu’une baisse d’activité cérébrale. La combinaison de ces techniques, grâce à la multimodalité, améliore la précision et la fiabilité du diagnostic.
De plus, les innovations en cours, telles que l’EEG et l’imagerie rétinienne, offrent des perspectives prometteuses pour une détection précoce et sont à moindre coût et facile d’utilisation. Ces avancées pourraient améliorer la prise en charge des patients, mais également promouvoir la recherche pour un traitement en identifiant les personnes à risque avant l’apparition des symptômes cliniques.
Par conséquent, l’imagerie médicale, actuelle et future, est une approche qui peut répondre aux défis liés au diagnostic de la maladie d’Alzheimer et contribuer à l’amélioration de la qualité de vie des patients.