IDS006 — Facilitation de l’accès aux marchés biomédicaux internationaux : le STED
DOI mémoire
https://doi.org/10.34746/xp5a-pf55Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs

ESSABIRI Sara 
GROELL Agathe
Contacts
- Sara ESSABIRI : saraessabiri4@gmail.com
- Agathe GROELL : agathe.groell@gmail.com
Citations
A rappeler pour tout usage : S. Essabiri et A. Groell, « Facilitation de l’accès aux marchés biomédicaux internationaux : le STED ».Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de projet, janvier 2019, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids006/ ; https://doi.org/10.34746/xp5a-pf55
Article publié
Suite à ces travaux, un article a été publié : ID interne : 2019_03_idsap
Résumé
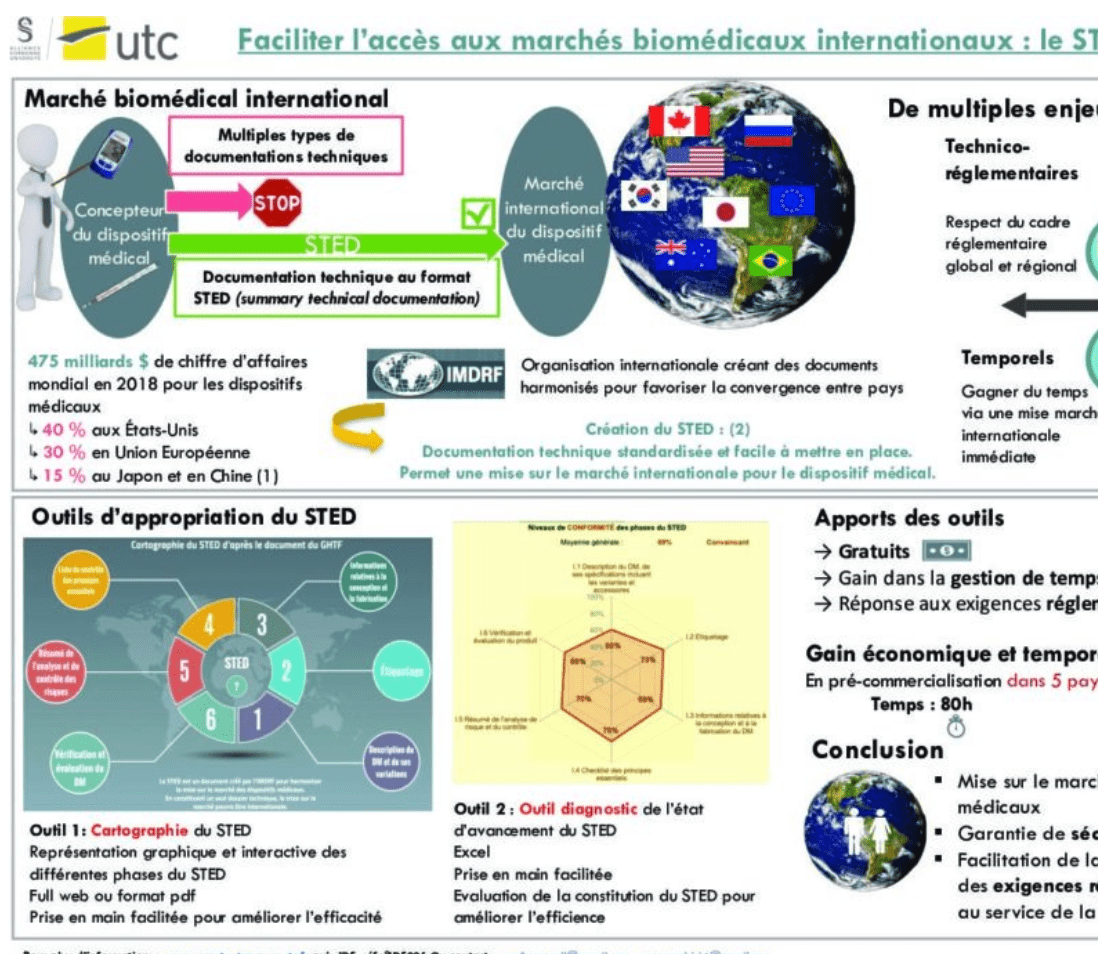
Le STED permet de prouver la conformité aux exigences essentielles de sécurité et de performance pour obtenir l’accès au marché pour un fabricant de dispositifs médicaux.
L’importance de ce tissu industriel international, son aspect innovant et sa croissance exponentielle en fait un enjeu majeur à prendre en considération lors de la commercialisation de ce type de produits de santé.
Des outils facilitant l’appropriation et la mise en œuvre efficace et efficiente du STED ont été développés. Une cartographie du STED en facilite la lecture et un outil de diagnostic permet d’évaluer l’état d’avancement dans la constitution de la documentation technique.
L’élaboration de la documentation technique en s’aidant des outils précédemment cités permet d’améliorer l’efficacité et l’efficience de fabricants de dispositifs médicaux au cours de la phase pré-commercialisation de produit et ce quel que soit le pays de mise sur le marché.
Abstract
The complexity of the international regulations in the medical device industrial sector, led the regulatory authorities of countries such as : Australia, Brazil, Canada, The United States, Japan, Russia and the European Union, to encourage the harmonization and simplification of the regulatory working habits creating the International Medical Device Regulators Forum (IMDRF), previously the Global Harmonization Task Force (GHTF) and the widespread of the STED « standard technical documentation ».
The use of the STED template allows to prove conformity to the local regulatory requirements to enable a medical device manufacturer to have access to the market.
The importance of this international industrial network its innovative aspect and its exponential growth cannot be ignored when commercializing this kind of medical product.
Tools have been developed allowing the use of the STED. An interactive map facilitates the understanding of the STED and a diagnostic tool helps estimate the level of conformity while establishing the technical documentation. The elaboration of the technical documentation with the use of the above listed tools is important for the efficiency of the medical device manufacturer during the product pre-commercialization phase regardless of the country.
Téléchargements

Mémoire d'Intelligence Méthodologique

