IDS062 - Mise en place d'un SMQ pour l'obtention de la certification ISO 9001:2015
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteure

Contact
Citation
A rappeler pour tout usage : Salma MHAMDI, “Mise en place d'un SMQ en place pour l'obtention de la certification ISO 9001 : 2015”, Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Dispositif Médical et Affaires Réglementaires (DMAR), Mémoire de stage, septembre 2020, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids062/
Résumé
Pour faire face à la concurrence, respecter les exigences réglementaires et satisfaire les clients, les organismes s’orientent vers une mise en place de la démarche qualité selon la norme ISO 9001. La norme ISO 9001 est un référentiel relatif aux exigences du système de management de la qualité et qui s’adresse à tout type d’organisation, quel que soit son domaine d’activité. Ce projet a été élaboré dans le centre de recherche clinique du Groupe Hospitalier Paris Saint Joseph qui souhaite obtenir la certification ISO 9001 : 2015 et ainsi être l'un des premiers centres de recherche clinique certifiés des établissements de santé privé d'intérêt collectif. Ce travail a pour objectif de présenter la méthodologie employée pour la mise en place d’un système de management de la qualité. Au cours de ce stage une cartographie de processus, une politique qualité, des fiches processus ainsi que d’autres documents ont été élaborés. Mots-clés : Recherche Clinique - ISO 9001 : 2015 – Système de management de qualité –– Processus – certification
Abstract
In order to face the competition, to respect the regulatory requirements and to satisfy the customers, the organizations is moving towards the implementation of the quality approach according to the ISO 9001 standard. The ISO 9001 standard is a reference relating to the system requirements of quality management and which is aimed at any type of organization, whatever its field of activity. This project was developed in the clinical research center Paris Saint Joseph which wishes to obtain ISO 9001 V 2015 certification be one of the first certified clinical research units of private health establishments of collective interest. The aim of this work is to present the methodology used for the implementation of a quality management system. During this internship, a process map, a quality policy, process sheets and other documents were drawn up. Key words : Clinical Research - ISO 9001 : 2015 - Quality management system –– Process – Certification
Téléchargement
MISE EN PLACE D’UN SMQ POUR L’OBTENTION DE LA CERTIFICATION ISO 9001 : 2015 AU SEIN DU CRC
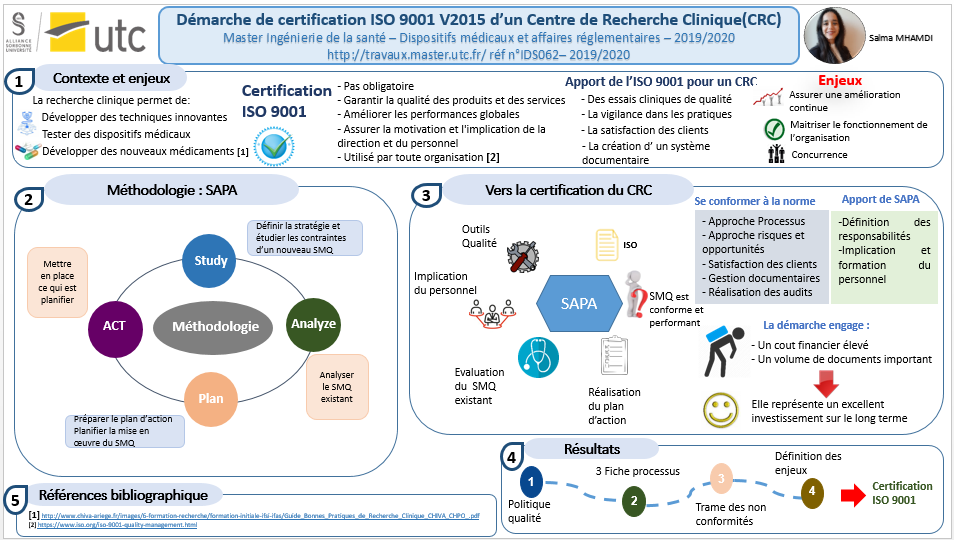
Mémoire complet : Mise en place d'un SMQ pour l'obtention de la certification ISO 9001 :2015 au sein du CRC
Dédicaces
Je dédie ce projet à :
Mes chers parents Ahmed et Touria :
Il n'y a pas de mot pour exprimer ma reconnaissance, mes remerciements, mes sentiments pour vos sacrifices, votre amour, votre soutien, votre confiance, vous avez toujours été là pour moi. Je suis très reconnaissante pour l'éducation que vous m'avez donnée et pour la personne que je suis maintenant. Que dieu vous accorde la santé et la joie.
Mes sœurs Oumaima et Sara et mon frère Simo :
Je vous remercie pour votre amour, votre soutien et vos encouragements. Je vous souhaite la réussite dans vos vies et tout le bonheur du monde.
Tous mes amis, tout particulièrement Ghita :
Merci pour votre amitié sincère et pour les beaux moments partagés
Remerciements
Ce stage a été pour moi une expérience très enrichissante et formatrice, aussi bien au niveau professionnel que personnel. La contribution avec de nombreux collaborateurs m’a notamment permis de m’épanouir dans mon investissement.
Je souhaite, en premier lieu, remercier Mme BEN NASR Nesrine ma tutrice pendant ce stage, pour m’avoir donné l’opportunité d’effectuer ce stage au sein du centre de recherche clinique, ainsi que pour ces encouragements, sa gentillesse et ses conseils qui m’ont permis de développer mes connaissances dans le domaine de la recherche clinique.
Merci à Mr FARGES Gilbert mon suiveur de stage pour sa disponibilité, ses conseils, ses explications pendant toute la période du stage.
Merci à Mme Isabelle CLAUDE et Mr Jean-Matthieu PROT nos responsables du master Ingénierie de la santé pour leur soutien et leurs conseils.
Je souhaite enfin remercier l’ensemble des collaborateurs du centre de recherche clinique et tout particulièrement Dr Hélène BEAUSSIER pharmacien responsable CRC, Michèle LOHORE, Lilia BRIK, Julien FOURNIER, Emmanuelle SACCO pour leur accueil et leur collaboration.
INTRODUCTION
Dans le cadre de ma formation en Master 2 Ingénierie de santé parcours Dispositif Médical et Affaires Réglementaires à l’université de Technologie de Compiègne (UTC), j’ai eu l’opportunité d’effectuer un stage de 6 mois au sein du centre de recherche clinique (CRC) du Groupe Hospitalier Paris Saint Joseph (GHPSJ). Ce projet de fin d’études m’a permis de tester mes connaissances et compétences acquises au cours de mes études.
La recherche clinique est un secteur en plein développement. Elle a un rôle primordial dans l’évolution des connaissances dans le domaine de la santé et par conséquent dans l’évolution des soins. Elle permet d’évaluer le rapport bénéfice/risque, des nouveaux médicaments, des produits de santé (dispositif médical), et d’autres traitements etc.
Afin de garantir la qualité des études cliniques, d’améliorer la conduite de la recherche clinique et d’harmoniser les pratiques, les structures d’aide à la recherche clinique peuvent implémenter un système de management de la qualité en se faisant certifiés par la norme ISO 9001.
Dans ce contexte, le centre de recherche clinique du GHPSJ a décidé d’implémenter un système de management de la qualité (SMQ) selon la norme ISO 9001 :2015. L’objectif est de réussir l’intégration complète du SMQ au sein du CRC et d’obtenir la certification en début d’année 2021.
Ce rapport de stage a pour but de décrire la méthodologie employée et les missions effectuées pour la réalisation de ce projet. La première partie sera consacrée à la présentation de l’organisme d’accueil et de la recherche clinique. La seconde partie concernera la méthodologie employée pour la certification ISO 9001 :2015. Et la dernière partie aura pour objectif la présentation des résultats obtenus.
CHAPITRE I : CONTEXTE ET ENJEUX DE LA RECHERCHE CLINIQUE
1- Présentation de l’organisme d’accueil
1-1 Groupe Hospitalier Paris Saint Joseph
Le GHPSJ est un groupe hospitalier issu de la fusion en 2006 de trois hôpitaux : l’hôpital Saint-Joseph, l’hôpital Notre-Dame de Bon Secours et l’hôpital Saint-Michel auxquels s’ajoute l’hôpital Marie Lannelongue dont la fusion a eu lieu le 01 janvier 2020. Il est administré par la Fondation hôpital Saint-Joseph. Le GHPSJ est un hôpital qui a le statut juridique d’ESPIC : Établissement de Santé Privé d’Intérêt Collectif. Le GHPSJ est le premier hôpital sur Paris qui a obtenu la certification par la haute autorité de santé (HAS) avec un niveau A [1].
Les missions principales du GHPSJ sont de :
- soigner tous les patients en apportant d’excellents soins médicaux
- accompagner les patients durant leurs parcours de soins
- innover en réalisant des recherches cliniques
- former les professionnels de santé
Les valeurs partagées par l’établissement sont l’accueil, l’éthique, le professionnalisme ainsi que l’esprit d’équipe [1].
Chiffres clé 2019 du GHPSJ : Effectif et Capacité d’accueil (tableau 1)
| Effectif 490 médecins 153 internes 185 externes 2 063 personnels non médicaux Séjours MCO 77 182 des séjours hospitaliers 56 360 des passages aux urgences 3 559 des naissances 263 829 des consultations externes | Capacité d’accueil : 19 salles d’opération 4 salles de cardiologie et d’imagerie interventionnelle 4 salles d’endoscopie 1 salle hybride 1 robot chirurgical Imagerie médicale : 3 scanners, 3 IRM, 1 EOS 1 laboratoire de biologie médicale et d’anatomopathologie 1 laboratoire de microbiologie spécialisé dans le dosage des antibiotiques 9 salles d’accouchements et 2 salles de césariennes |
Tableau 1 : Effectif et capacité d'accueil du GHPSJ {source auteur et d’après [2]}
1-2 Centre de recherche clinique (CRC) du GHPSJ
Le Centre de recherche clinique du GHPSJ, a été créé en 2012 par le Conseil d’Administration et la Direction Générale. Le Centre est un membre de l’association RESPIC qui fédère la recherche entre les ESPIC et vise à mutualiser les pratiques entre les centres. Il est chargé d’assurer l’organisation d’une recherche clinique de qualité, de soutenir la promotion, l’investigation, la publication et l’émergence de nouveaux projets afin d’améliorer la qualité et la sécurité de la prise en charge des patients. Le CRC travaille en étroite collaboration avec les services thérapeutiques et les plateaux techniques de l’hôpital (salles d’opération, salles d’endoscopie, scanners ...) impliqués dans la recherche. Il suit actuellement environ 200 études. Le CRC a promu et géré, depuis sa création, 400 études dont plus d’un tiers sont interventionnelles [3]. En 2019, le CRC a contribué à la mise en place et la réalisation de 184 études cliniques dont 121 études interventionnelles et 63 études non interventionnelles. Depuis 2013 Le GHPSJ a publié plus de 1 500 dans des revues médicales internationales dont 300 articles ont été publiés en 2019 [3].
La recherche réalisée dans les services de l’hôpital s’exerce dans plusieurs domaines :
- amélioration de la qualité et de la sécurité des prises en charge des patients,
- évaluation d’un nouveau médicament dans le cadre d’un essai thérapeutique,
- relation entre le résultat d’un examen complémentaire et l’évolution d’une maladie,
- intérêt d’un examen complémentaire dans le diagnostic ou le suivi,
- nouvelle indication pour un traitement déjà sur le marché,
- suivi très précis d’un groupe de malades pour mieux en connaître l’évolution, etc.
Le CRC est constitué d’une équipe mobilisée sur l’ensemble de l’hôpital dédiée à la recherche avec un effectif d’une vingtaine personnes (figure 1).
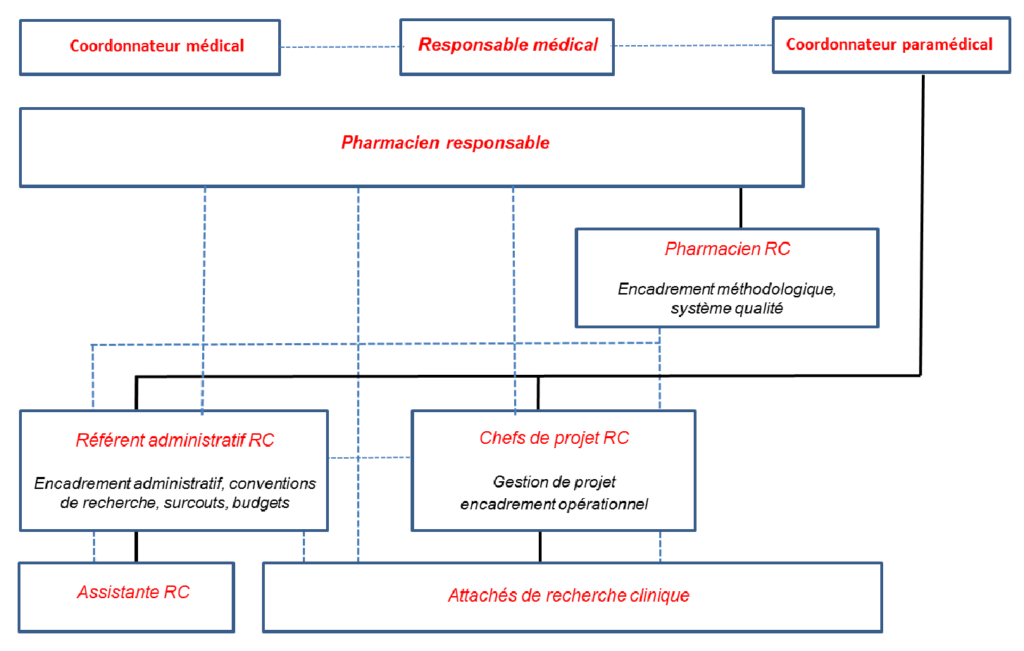
Le CRC est constitué de deux pôles :
Pôle Promotion : les missions de ce pôle sont assurées par l’équipe projet qui est composée d’une pharmacienne responsable, une pharmacienne recherche clinique (référente qualité), deux chefs de projets et d’une référente administrative. Cette équipe se charge des aspects scientifiques, réglementaires, administratifs et financiers des études dont le promoteur est le GHPSJ.
Pôle Investigation : Les missions d’investigation des études cliniques qui se déroulent au GHPSJ sont assurées par les Attachés de Recherche Clinique (ARC). Ils collaborent avec les investigateurs des études de l’initiation à la clôture de l’essai clinique, aident à la prise en charge des patients et travaillent sous la responsabilité des chefs de projets afin d’assurer le bon déroulement des études sur le site.
2- Recherche clinique
2-1 Définition
La recherche clinique correspond aux études scientifiques menées sur l’homme afin d’améliorer les connaissances médicales ou biologiques et développer de nouveaux traitements ou dispositifs médicaux [4]. Elle concerne les personnes malades mais peut concerner les personnes saines. La participation dans un essai clinique est volontaire, aucun essai ne peut être effectué sans information et accord préalable des patients.
2-2 Typologie de la recherche clinique
Il existe trois grandes catégories pour la Recherche Impliquant la Personne Humaine (RIPH ou loi Jardé):
- Catégorie 1 : c’est une recherche interventionnelle quicomporte une intervention sur les participants non justifiés par leurs prises en charge habituelles. Elle concerne les recherches portant sur des médicaments et les recherches ne portant pas sur les médicaments (produits de santé et hors produit de santé).
- Catégorie 2 : c’est une recherche interventionnelle qui ne comporte que des risques et des contraintes minimes.
- Catégorie 3 : c’estune recherche non interventionnelle qui ne modifie pas les actes pratiqués, les produits utilisés et la prise en charge des patients. Cette catégorie est désignée aussi par recherche observationnelle [5].
Il existe aussi la recherche n'impliquant pas la personne humaine (ou hors jardé) qui porte sur la réutilisation des données patients.
3- Principaux acteurs de la recherche clinique
La recherche clinique implique un nombre important de professionnels assurant les activités de promotion et d'investigation. Parmi les acteurs principaux, on peut distinguer : Le promoteur : c’est est une personne physique ou morale qui prend l’initiative de l’essai clinique et qui en est responsable. Il en assure la gestion et vérifie que son financement est prévu.Il s’engage et veille à ce que la recherche soit conduite conformément au protocole en vigueur, aux Bonnes Pratiques Cliniques, et aux dispositions législatives et réglementaires en vigueur [5].
L’investigateur : c’est une personne physique qui dirige et surveille la réalisation de la recherche sur un lieu. Il est responsable de la conduite de la recherche dans son centre, il inclut les patients dans l’étude et veille à la sécurité des personnes [6].
Le centre investigateur : c’est le lieu dans lequel une étude clinique se déroule et qui dispose des moyens nécessaires pour la réaliser.
L’Attaché de recherche clinique (ARC) : il assure le lien entre le promoteur et l’investigateur et garantit la mise en place, le suivi et la clôture des études sur le centre investigateur.
L’ARC moniteur : Il est mandaté par le promoteur. Il permet de contrôler la qualité des données recueillies, de les valider, d’auditer les centres de recherches et de vérifier les compétences des équipes investigatrices et l’application du protocole.
4- Réglementation en recherche clinique
a- Réglementation
La réglementation a une importance indispensable en recherche clinique. Elle définit les règles de conduite des études et les responsabilités des différents acteurs. Ceci dans le but d’assurer la sécurité, les droits des patients et de garantir la qualité de la recherche clinique. La réglementation de la recherche clinique n’a cessé d’évoluer depuis 1947 et devient de plus en plus exigeante. L’évolution des textes réglementaires en recherche cliniques est présentée sur la figure (2).
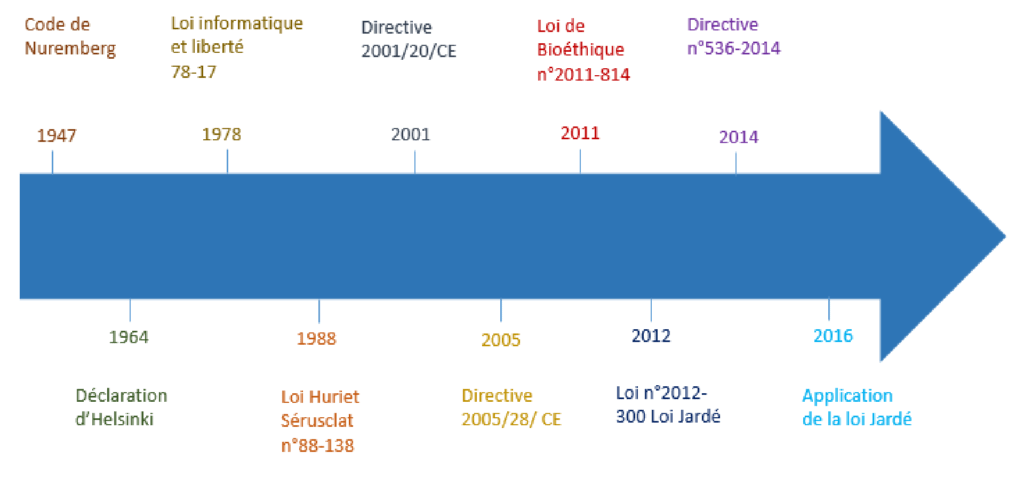
b- Les principaux textes de loi en recherche clinique
- La loi Huriet-Serusclat (20 décembre 1988) : Loi relative à la protection des personnes se prêtant à des recherches biomédicales. Elle établit une protection obligatoire des individus qui se prêtent à des études de recherche clinique avec un devoir d’information, et la nécessité de recueillir le consentement écrit.
- Les bonnes pratiques cliniques (BPC) sont reconnues au plan international. elles constituent un ensemble d’exigences de qualité de leurs données scientifiques d’une part, et le respect de l’éthique d’autre part. Elles doivent être respectées lors de la planification, la mise en œuvre, la conduite, le suivi, le contrôle de qualité, l’audit, le recueil des données, l’analyse et l’expression des résultats des recherches biomédicales. leurs objectifs est de protéger les droits des personnes se prêtant à ces recherches, la confidentialité des données à caractère personnel et les résultats de ces recherches. Les BPC sont destinées aux promoteurs, investigateurs et collaborateurs des recherches biomédicales.
- La loi informatique et liberté (loi de juillet 1994) concerne le traitement des données à caractère personnel ayant pour fin la recherche dans le domaine de la santé
c- Instances réglementaires
Les études cliniques ne peuvent commencer qu’après avoir obtenu des autorisations / avis favorables des instances nationales suivantes :
- Agence nationale de sécurité du médicament et des produits de santé (ANSM) : elle évalue la démarche des études cliniques portant sur les médicaments ainsi que les produits de santé et assure la sécurité des personnes participant dans l’étude en garantissant la qualité et la sécurité des produits utilisés lors de la recherche.
- Comité de protection des personnes (CPP) : c’est une instance chargée de s’assurer que les études cliniques menées sur l’homme respectent les droits et les différentes mesures éthiques, médicales et juridique visant à garantir la protection des participants.
- Commission nationale de l'informatique et des libertés (CNIL) : c’est une autorité indépendante qui assure la protection des données personnelles et veille à ce que l’usage des données informatisées soit conforme à la loi « informatique et libertés ».
La figure (3) présente les autorisations / avis des différentes catégories de la recherche clinique.
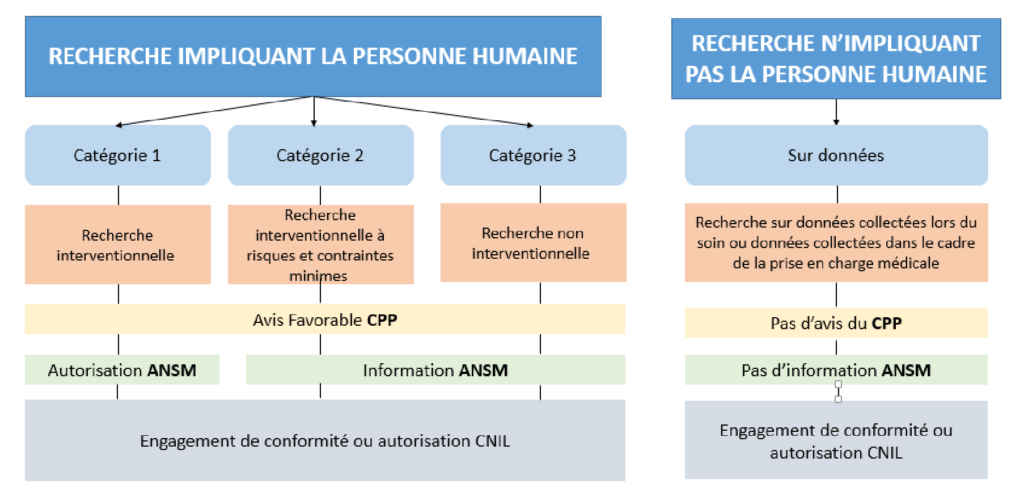
Figure 3 : Démarches réglementaires en fonction de la typologie de l'étude {source auteur et d’après [5]}
5- Dynamique et enjeu de la recherche clinique
La recherche clinique est un secteur dynamique qui offre plus de 18 000 d’emplois avec un taux de 95% d’employabilité pour les attachés à la recherche clinique [7]. La France est classée 4 ème au sein de l’Europe pour cette activité de recherche clinique [8].
En 2019, la France était le leader pour le nombre des études menées en Europe sur les dispositifs médicaux et les médicaments, 25,5% des études sur les dispositifs médicaux, et 29% des études sur les médicaments menées en Europe se passent en France [7]. Cette position forte des études sur les DM s’explique par le fait qu’un nombre important de fabricants de DM réalisent leurs études en France pour ce secteur. Ce qui n'est pas le cas dans la majorité des autres pays européens. Ainsi, La recherche clinique en France est un secteur porteur, dynamique et notoire, elle porte en elle l’image d’une médecine développée, moderne qui attire les investisseurs, les médecins et les patients. De ce fait, la recherche clinique a un rôle très important dans le classement et la renommée des établissements de soins concernés.
Aujourd’hui, les établissements sont confrontés à de fortes pressions financières. L’exemple des financements de MERRI (missions d’enseignement, de recherche, de référence et d’innovation) qui attribue une partie importante du financement sur la base des indicateurs suivant : le développement d’une recherche de qualité, la valorisation du projet, la diffusion de l’innovation etc [9].
Au vu de l’enjeu financier et de l’importance de la règlementation en recherche clinique, la démarche qualité a toute sa place en recherche clinique. Avec le CRC qui se développe à grande vitesse aussi bien sur le nombre des études de recherche en cours que sur la nature des missions remplies la direction a initié le projet de certification ISO 9001 : 2015. C’est dans cette démarche que j’ai été recrutée pour assister la Pharmacienne Référente Qualité (PRQ) sur l’instauration d’une démarche qualité au sein du CRC et préparer le travail de certification.
6- Présentation du projet
Pour faire face à la concurrence et afin d’améliorer le fonctionnement d’une organisation, l’implémentation d’un système de management de qualité est indispensable, parce qu’elle permet de maîtriser et d’améliorer le fonctionnement d’un processus en donnant une vision plus claire et précise des objectifs (règlementaires, financières...).
Le CRC s’est engagé dans une démarche de management de la qualité interne et souhaite poursuivre dans le cadre d’une démarche structurée ISO 9001 : 2015 afin de maîtriser ses pratiques, d’améliorer la qualité et la sécurité de ces activités. L’objectif du CRC est d’obtenir la certification ISO 9001 :2015, d’ici début 2021, pour gagner en lisibilité, fiabilité et crédibilité, valoriser la recherche clinique, attirer des promoteurs et des partenaires en France et à l’international et faire ainsi partie des premiers établissements de santé privée d'intérêt collectif certifiés.
CHAPITRE II : MÉTHODOLOGIE EMPLOYÉE POUR LA CERTIFICATION ISO 9001 : 2015
1- Définition du projet
Afin de mieux cerner la problématique du projet, la méthode QQOQCP a été utilisée (Tableau 2).
| Donnée d’entrée | Mise en œuvre d’une politique qualité basée sur la norme ISO 9001 : 2015 |
| QUI ? | Salma MHAMDI |
| QUOI ? | Participation à la mise en place du SMQ : certification ISO 9001 : 2015 |
| OU ? | Centre de recherche clinique du GHPSJ |
| QUAND ? | Du 17/02/2020 au 01/09/2020 |
| COMMENT ? | Elaboration d’un plan d’action en se basant sur le diagnostic réalisé par un consultant |
| POURQUOI ? | Améliorer la qualité des activités du CRC Satisfaire les parties intéressées Obtenir la certification ISO 9001 : 2015 |
| Donnée de sortie | Comment mettre en place un SMQ conforme à la norme ISO 9001 :2015 ? |
Tableau 2 : QQOQCP - cadrer la problématique {source auteur}
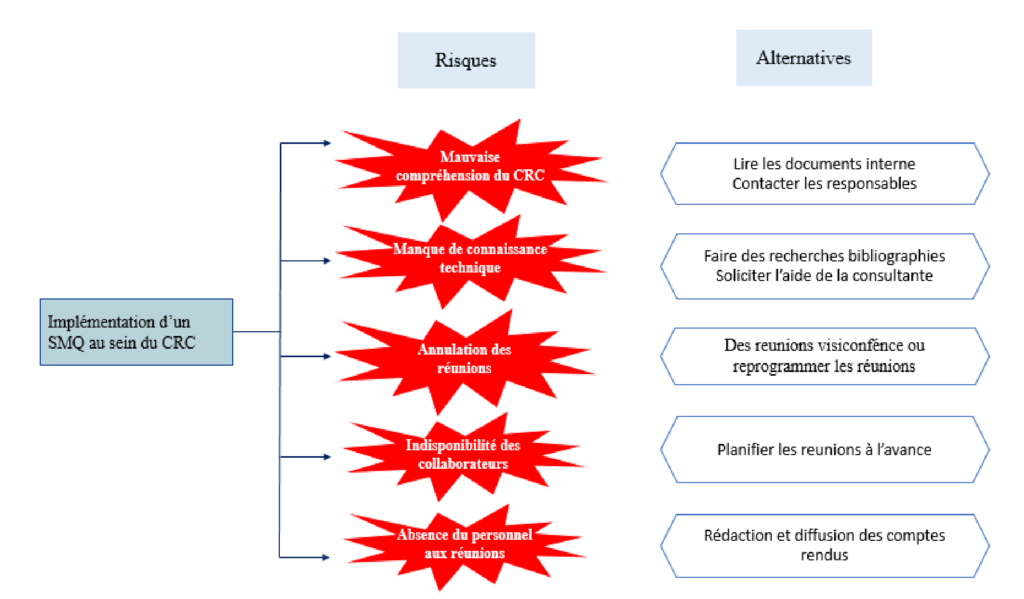
2- Risques et alternatives du projet
Il est important de prévoir et identifier les risques éventuels pouvant être rencontrés sur le projet et de planifier les alternatives possibles. La figure (4) présente les différents risques susceptibles de ralentir la progression et l’exécution du projet ainsi que les alternatives.
3- Méthode de résolution : SAPA
Afin de conformer à la norme ISO 9001 :2015, une nouvelle méthode a été élaborée appelée SAPA (figure 5). Elle comprend 4 étapes principales :
- Study : cette étape consiste à étudier la norme IS0 9001 : 2015 et à définir les contraintes d’un SMQ.
- Analyse : cette phase vise à réaliser un état des lieux et à analyser le SMQ existant.
- Plan : elle consiste à planifier les actions à mettre en œuvre.
- Act : cette étape vise à réaliser les actions planifiées afin de se conformer à la norme ISO 9001.

3-1 Study
Le Système de Management de la Qualité :
Le SMQ est un ensemble d’actions mises en place par une organisation qui souhaite avoir une démarche qualité. Il permet à l’organisme de déterminer la politique interne, les objectifs et les responsabilités conformément à sa stratégie. Il indique l’identification des processus, leur traçabilité, la conformité des produits et la satisfaction client.
Afin de se conformer à la norme ISO 9001 :2015 les organisations doivent mettre en œuvre sept principes [10]:
- L’orientation client : c’est la satisfaction des clients en mettant en place une analyse de leurs besoins, un processus de communication, un traitement de leurs réclamations.
- Le Leadership : la direction doit établir la finalité, les orientations stratégiques et créer des conditions dans lesquelles le personnel est impliqué pour atteindre les objectives qualités de l’organisme.
- L’implication du personnel : il est indispensable qu’un organisme soit doté d’un personnel compétent, impliqué dans toutes les activités pour assurer la progression et que les collaborateurs soient conscients de leurs importances et leurs rôles.
- L’approche processus : l’identification et la structuration des processus permet d’obtenir des résultats de manière efficiente et efficace, d’assurer la confiance des parties intéressées et d’analyser les performances.
- L’amélioration continue : consiste à augmenter la satisfaction des clients et la performance de l’organisme. Elle se repose sur l’implication du personnel et du leadership des dirigeants.
- Prise de décision fondée sur des preuves : Prendre des décisions sur l’analyse et l’évaluation de données par le biais des indicateurs de performance par exemple, permettra d’avoir plus de chance d’obtenir le résultat voulu. Les décisions doivent être analysées de manière objective afin d’éviter les mauvaises interprétations.
- Management des relations avec les parties intéressées : Les parties intéressées correspondent aux acteurs avec lesquels l’organisme est amené à collaborer au quotidien.
L’ISO 9001:2015
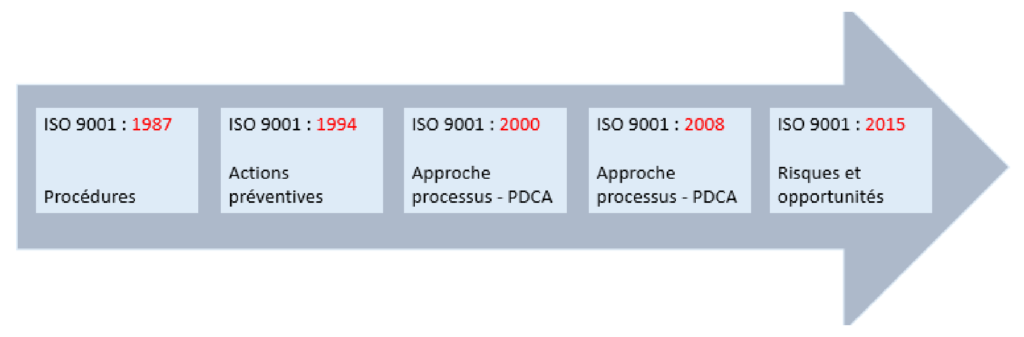
La norme ISO 9001 :2015 établit les exigences relatives à un SMQ, elle est internationale reconnue et appliquée partout dans le monde. C’est une norme qui donne des orientations pour le pilotage, l’organisation et les bonnes pratiques dans une entreprise, elle vise à assurer la satisfaction de client et l’amélioration continue. Aujourd’hui, plus d’un million d’entreprises et organisations dans le monde appliquent la norme ISO 9001:2015 [11]. Cette dernière a été revue plusieurs fois depuis sa publication en 1987 (figure 6).
La certification
La certification est une démarche par laquelle un organisme accrédité ou autorisé évalue et vérifie la qualité, la qualification, les caractéristiques, les procédures, les processus, les biens ou les services des organisations conformément aux normes ou exigences établies.
La certification ISO 9001 démontre qu’une organisation ou une entreprise est apte à fournir un produit ou un service conforme aux exigences du référentiel. Elle se déroule en 5 étapes :
- conception du SMQ
- mise en place de SMQ
- certification : pré audit et audit
- maintien de la certification : audit de suivi annuel
- renouvellement de la certification chaque 3 ans
La préparation à la certification ISO 9001 peut durer jusqu'à 18 mois, cette période dépend de la taille de l’entreprise, l’effectif, le nombre des sites etc.
La certification ISO 9001 s’adresse à tout type d’entreprise, d’organisme et d’association quel que soit le domaine d’activité. Le statut certifié ISO 9001 est utilisé par différentes organisations afin d’atteindre les objectifs définis, d’accéder à des nouveaux marchés, améliorer la productivité et renforcer la réputation de l’entreprise.
3-2 Analyse
a- État des lieux
Avant de s’engager dans une démarche qualité, il est important de réaliser un état des lieux de l’organisation pour connaître le niveau de conformité par rapport au référentiel.
Cette étape permet de :
- évaluer les forces et les faiblesses de l’organisation
- choisir la meilleure stratégie à adopter pour la réussite du projet
- définir les conditions de réussite de l’implémentation du SMQ
- élaborer le plan d’action
Afin de réaliser l’état des lieux, une consultante a été sollicitée pour aider le CRC dans cette démarche. En se basant sur son rapport de diagnostic, la comparaison de l'existant par rapport aux exigences de la norme ISO 9001 V2015 a donné les résultats suivants (Figure 7).
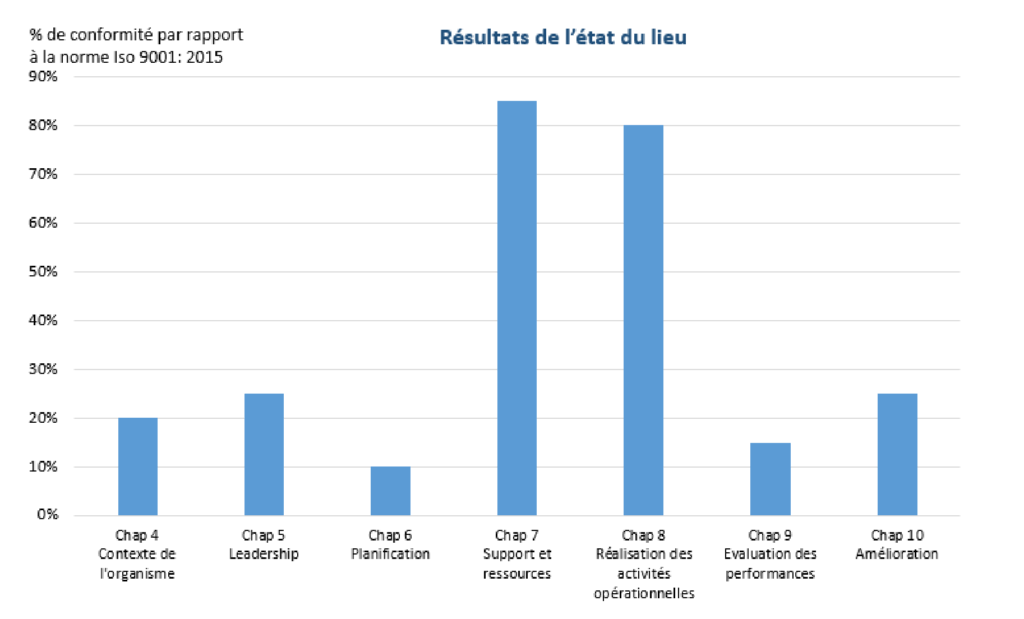
Cette étape d’analyse nous a permis de réaliser un état des lieux et d’identifier les exigences de la norme ISO 9001 : 2015 sur lesquelles le CRC répond ou ne répond pas. Les exigences du chapitre 7 « Support et ressources » (concernant les ressources humaines, infrastructures, environnement de travail, compétences…) et chapitre 8 « Réalisation des activités opérationnelles » (qui concerne la planification et maitrise opérationnelles, maitrise de la production et prestation de service…) sont respectées et maîtrisées. Le contexte de l’organisme, leadership, planification évaluation des performances et l'amélioration sont des dispositions moins maîtrisées vis à vis du référentiel et qui nécessitent une revue et une amélioration afin d'être conforme à la norme ISO 9001 :2015.
b- SWOT
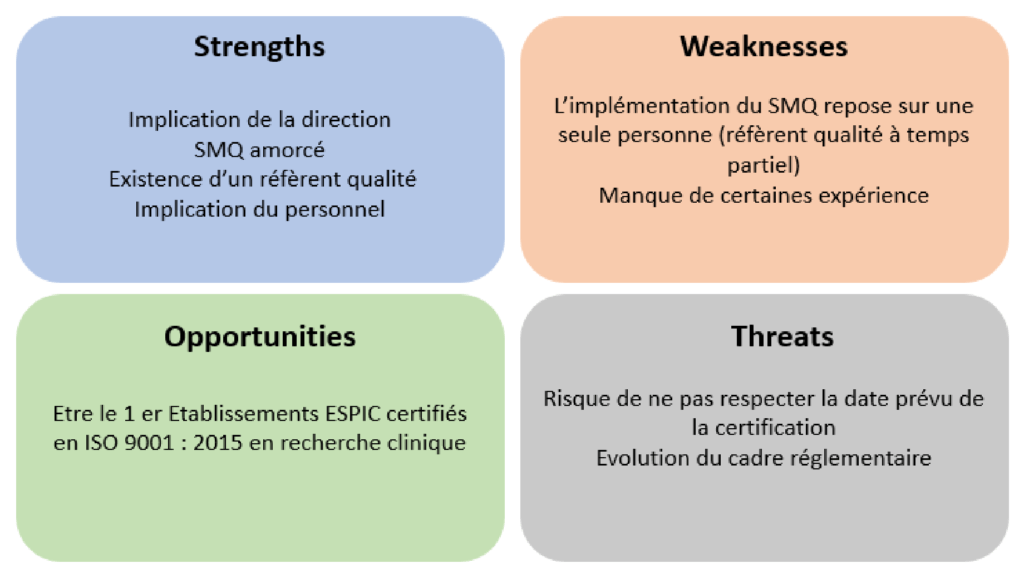
e diagnostic du système de management de la qualité du CRC a permis d'identifier des points forts, des points faibles, des menaces et des opportunités du système qui seront exploitables pour définir la stratégie et les objectifs à atteindre (Figure 8).
3-3 Plan
A la suite de l’analyse de l’existant par rapport aux exigences de la norme ISO 9001 :2015, un plan d’action a été élaboré pour traiter les écarts détectés et mettre en place des actions correctives.
Pour bien suivre les actions à mettre en place, la solution retenue était la création d’un tableau Excel (figure 9) qui mentionne les actions à mettre en œuvre par processus, l’ordre de priorité, l’état d’avancement, les échéances et le responsable de l’action. Ce plan concerne les trois processus définis et la gestion documentaire. Ce tableau regroupe toutes les actions à entreprendre face aux défaillances du système de management de qualité pour répondre aux exigences de la norme ISO 9001.
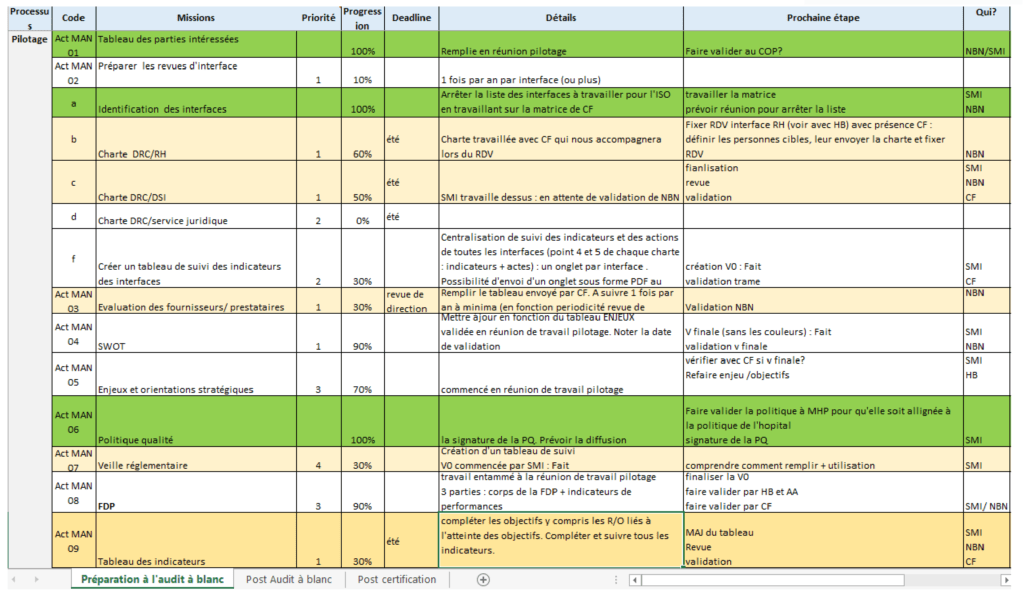
Ce plan d’action permet de :
- donner une vision exhaustive et globale sur la charge à venir
- définir les missions de chacun
- maîtriser le temps de mise en œuvre
- connaitre à tout moment l’état d’avancement du projet
3-4 Act
En se basant sur le plan d’action établi, différentes actions ont été réalisées. Les actions et les résultats obtenus sont détaillés au niveau du chapitre suivant.
Chapitre III : RESULTATS OBTENUS
Les actions menées ont été encadrées par le réfèrent qualité et en interaction avec l’équipe CRC ainsi que la direction.
1- Définition du contexte de l'organisme
Afin que le SMQ soit efficace et pertinent, il est important qu’il contribue complètement à la stratégie de l’organisation. Pour cela, il doit être en accord avec ses enjeux internes et externes et répondre aux besoins des parties intéressées.
a- Enjeux internes et externes
Pour déterminer les enjeux internes et externes du CRC (figure 10), deux outils ont été utilisés :
- L’analyse PESTEL (Politique, Economique, Sociologique, Technologique, Ecologique, Légal) qui permet d’évaluer l’influence de l’environnement économique que rencontre le CRC et son marché.
- La SWOT qui sert à analyser les forces, les faiblesses, les opportunités et les menaces du CRC.
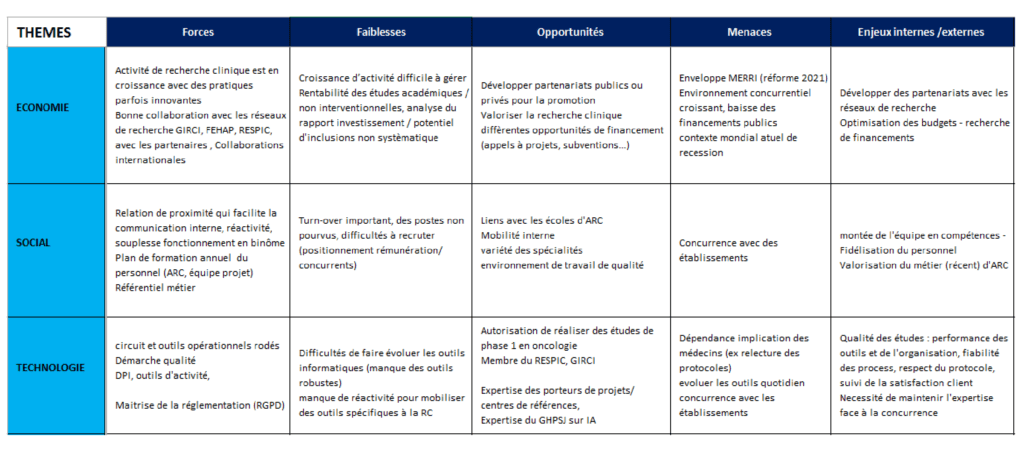
Figure 10 : Extrait du tableau des enjeux internes et externes {source auteur}
b- Parties intéressées et leurs besoins
Les parties intéressées sont des personnes ou des organisations qui peuvent avoir un impact ou être affectées par une activité ou décision de l’organisme.
Afin d’identifier les besoins et les attentes des différents acteurs liés à l’activité du CRC une analyse a été effectuée (Figure 11).

c- Définition des axes stratégiques
En se basant sur la SWOT et l’analyse des parties intéressées, les axes stratégiques suivants ont été identifiés :
- Développer et valoriser l’activité de la recherche clinique.
- Renforcer les partenariats
- Assurer la maîtrise des process, la qualité des études et conforter la satisfaction des promoteurs et des médecins investigateurs
- Valoriser le métier de la recherche clinique et développer les compétences des collaborateurs
2- Rédaction de la politique qualité du CRC
a- Pourquoi la politique qualité ?
La politique qualité est un document du SMQ d’une organisation qui permet de cadrer la démarche et de la communiquer en interne et/ou en externe. Elle comprend l’engagement de la direction pour développer et assurer la réussite de la démarche qualité. Elle contient souvent des orientations sur l’amélioration continue, sur le développement d’un processus et sur la satisfaction des clients. Ces orientations vont permettre de définir les objectifs essentiels du système de management de qualité. La politique qualité est signée par le directeur et revue lorsqu'il y’a des changements importants dans les objectifs ou les orientations stratégiques. La norme ISO 9001 :2015 exige à ce que la politique qualité soit établie, communiquée et réponde aux exigences suivantes :
- adaptée à l’organisation
- correspond à l’orientation stratégique
- fournit un cadre pour définir les objectifs qualité
- contient un engagement pour satisfaire les exigences applicables
- inclut un engagement pour l’amélioration continu du SMQ
b- La politique qualité du CRC
La politique qualité du CRC a été définie, puis validée par les responsables du CRC et la direction. Cette politique sera communiqué par la suite à tous les employés. La figure 12 présente la politique qualité définit pour le CRC.

3- Réalisation de la cartographie de processus
a- Qu’est-ce qu’une cartographie de processus ?
Une cartographie est composée de plusieurs processus qui sont liés entre eux et qui doivent fonctionner ensemble pour être performant. L’approche processus est une méthode qui sert à définir et décrire l’ensemble des activités de l’organisme. Cette approche est demandée par l’ISO 9001 V2015 et qui consiste à :
- définir les processus indispensables au SMQ
- définir les éléments d’entrée et de sortie de chaque processus
- définir les ressources nécessaires
- surveiller et améliorer le processus
La cartographie de processus doit être lisible, simple, objective, synthétique, facile à comprendre par les parties intéressées et contenir les données importantes pour son utilisation.
Afin de répondre à cette exigence de la norme, une cartographie de processus a été établie pour définir les activités du CRC et donner une vision globale sur son fonctionnement. Cette présentation graphique n’est pas seulement nécessaire pour modéliser le fonctionnement du CRC mais aussi pour mettre en place le SMQ et cibler le progrès.
La cartographie de processus a été divisée en trois grands processus :
- Processus de management ou de pilotage qui renforce l’idée de vision d’anticipation, la prise des décisions et qui intègre la responsabilité de la direction, les objectifs qualité, la mise en œuvre des processus, la partie communication ainsi que la planification du système avec l’approche risque/opportunités et l’amélioration [12].
- Processus de réalisation du service (opérationnel) qui est le cœur du métier et qui consiste à développer et concevoir le service, à gérer la relation avec le client, à produire ou réaliser la prestation du service et à maîtriser la sous traitance et les achats des partenaires.
- Processus support qui contribue au déroulement des autres processus et qui permet de gérer les ressources fonctionnelles tel que les infrastructures, le matériel informatique.
b- La cartographie de processus du CRC
La cartographie qui a été élaborée pour le CRC est composée des processus macro qui regroupent l’ensemble des activités réalisées par le CRC, à savoir : Processus de pilotage, Processus d’investigation et Processus de promotion (Figure 14).
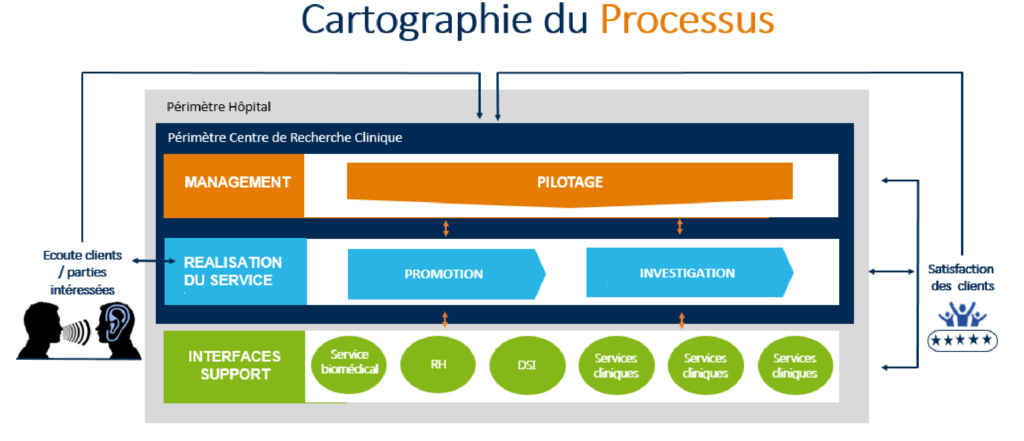
Une fois les processus ont été identifiés, une fiche processus a été établie afin de détailler chaque processus et de définir ses interactions avec les autres processus
4- Élaboration des fiches processus
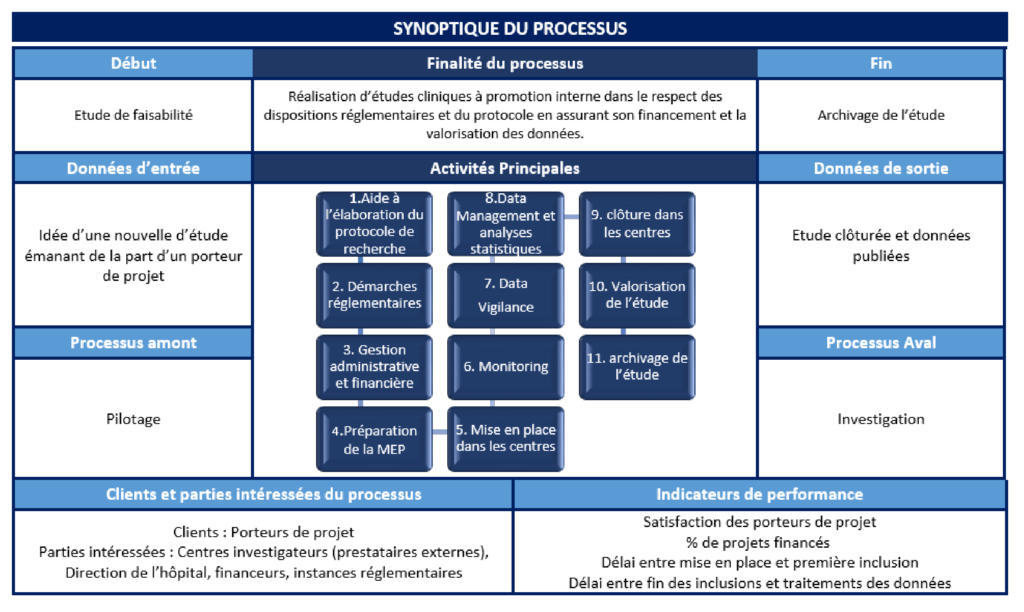
La fiche processus est un document qui regroupe les éléments nécessaires pour comprendre le périmètre du processus, sa finalité, ses activités principales, ses données d’entrée, ses données de sortie et son niveau de performance.
L’objectif de la fiche processus est de manager et piloter les activités du processus d’une manière efficace, de définir les opportunités pour traiter ou éviter les risques, de définir des indicateurs de performance et de proposer des actions d’amélioration.
Aucun format n’est officiellement obligatoire pour cette fiche, il peut être sous format Word ou Excel par exemple. Cependant, cette fiche doit contenir les éléments suivants :
- Le nom du pilote du processus : c’est la personne chargée de piloter le processus, d’animer de manière transversale les différents services contributeurs, de suivre les indicateurs de performance et de vérifier l'efficacité du processus
- Sa finalité : c’est la mission et la valeur ajoutée du processus
- Les données d'entrée et le processus amont : les éléments de départ du processus et qui vont être transformés
- Les données de sorties et les processus aval : les produits et les services qui sortent du processus
- Ses clients : les personnes qui profitent directement du processus
- Les attentes clients : le processus permet de répondre aux besoins de ses clients. Leurs attentes sont donc à clarifier.
- Les indicateurs de performance : ce sont les indicateurs qui permettront de mesurer si le processus assure sa finalité et répond à sa mission. Ils sont utilisés pour vérifier si le processus fonctionne correctement
- Les documents utilisés : ce sont les documents qui vont compléter le descriptif du processus et qui sont utilisés par les différents acteurs : Procédure, Mode opératoire, enregistrement…
La fiche processus doit être élaborée avec les acteurs du processus afin d’avoir une perception consensuelle du périmètre et des limites du processus.
Afin de détailler les activités du CRC, une fiche processus a été élaborée pour définir les activités de chaque processus, les responsables et les livrables de chaque activité. Pour chaque processus, une fiche processus a été élaborée (figure 14).
Pour créer ces fiches processus, les principales étapes ont été suivies :
- décrire
les activités du processus, les responsables et les livrables de chaque
activité
- définir les indicateurs de performances
- valider les fiches
Cette fiche processus est donc un élément important dans la construction du système, c’est pourquoi elle doit être réévaluée et formalisée de façon régulière.
5- Préparation de la revue processus
La revue de processus n’est pas obligatoire selon la norme ISO 9001 : 2015 mais elle est considérée comme un moyen de pilotage et de communication. Elle permet au pilote de processus de faire un point sur la performance, le fonctionnement et l’efficacité du processus.
La revue du processus commence généralement par la reprise du compte rendu de la réunion précédente et finit par la planification des actions ou des projets.
La revue de processus concerne tous les acteurs du processus et permet :
- au pilote de s’impliquer dans l'amélioration du processus,
- de réaliser un diagnostic sur les projets ou les activités
- de suivre les actions
- de préparer la réunion de revue de direction
C’est un outil de support pour prendre en compte le retour d'expérience du processus et d’assurer la progression de la maturité du processus.
La fréquence des revues des processus qui a été décidée par le CRC est de deux revues de processus par an pendant les deux ans qui suivent la certification. Une fois le SMQ est mis en place et maîtrisé les revues pourront être programmées une fois par an. La première revue des processus aura lieu en octobre. Une partie de la préparation de ces revues a été effectuée.
6- Gestion documentaire
La gestion des documents est un élément indispensable pour garantir un bon fonctionnement du SMQ, il est important de documenter les informations (procédures, modes opératoires, enregistrements..) et de les mettre à jour.
La mise en place de l’ISO 9001 : 2015 ne doit pas surcharger le système documentaire, mais elle doit permettre la création des documents nécessaires. C’est pour cela une revue de la documentation existante a été effectuée pour examiner les éléments à ajouter, les documents à créer, les documents à regrouper et les procédures à transférer en mode opératoire.
Le système documentaire du CRC comprend quatre types de documents :
- Procédure
- Enregistrement
- Mode opératoire
- Info
7- Animation des groupes de travail
La réussite de la mise en œuvre d’un système de management de qualité ne pourra se faire qu’avec la mise en place des réunions avec les parties concernées. Tout au long de mon stage, différentes réunions ont été programmées, notamment des réunions de préparation et des réunions de groupe de travail.
Les réunions des groupes de travail durent entre 2H30 à 3H30, l’objectif est de travailler sur des fiches processus, des indicateurs de performance et voir s'il y a des choses à améliorer ou à mettre en place dans le processus. Il a été décidé de faire 2 réunions de groupe de travail pour chaque processus. La réunion du groupe de travail a permis au personnel de se sentir impliqué dans le projet, vu qu’il contribue et donne leurs avis sur les différents sujets. Ces réunions de travail ont été une opportunité d’échange où la communication est essentielle pour avancer sur les fiches processus et pour arriver aux résultats attendus. C’est lors de ses réunions que la majorité des actions ont été résolues grâce à l’implication des acteurs qui ont une vision juste de leurs activités
8- Formation qualité du personnel du CRC
L’implication du personnel fait partie des 7 principes de management de la qualité. Le personnel est au cœur de l’organisation : il a une place prépondérante aussi bien pour la mise en œuvre des processus que pour l’amélioration continue. Par conséquent, il est impératif que ces personnes aient conscience de leur importance dans la mise en place du SMQ. Durant mon stage, deux réunions de formation ont été effectuées, les thèmes abordés lors de ces séances de sensibilisation et de formation étaient :
- Les audits
- Les apports du règlement européen 2017/745
9- Diagnostic final du SMQ du CRC
Pour voir l’avancement de la mise en place du SMQ au sein du CRC, un diagnostic a été réalisé en utilisant l’outil d’autodiagnostic élaboré par l’UTC afin de visualiser les résultats (figures 17 et 18).

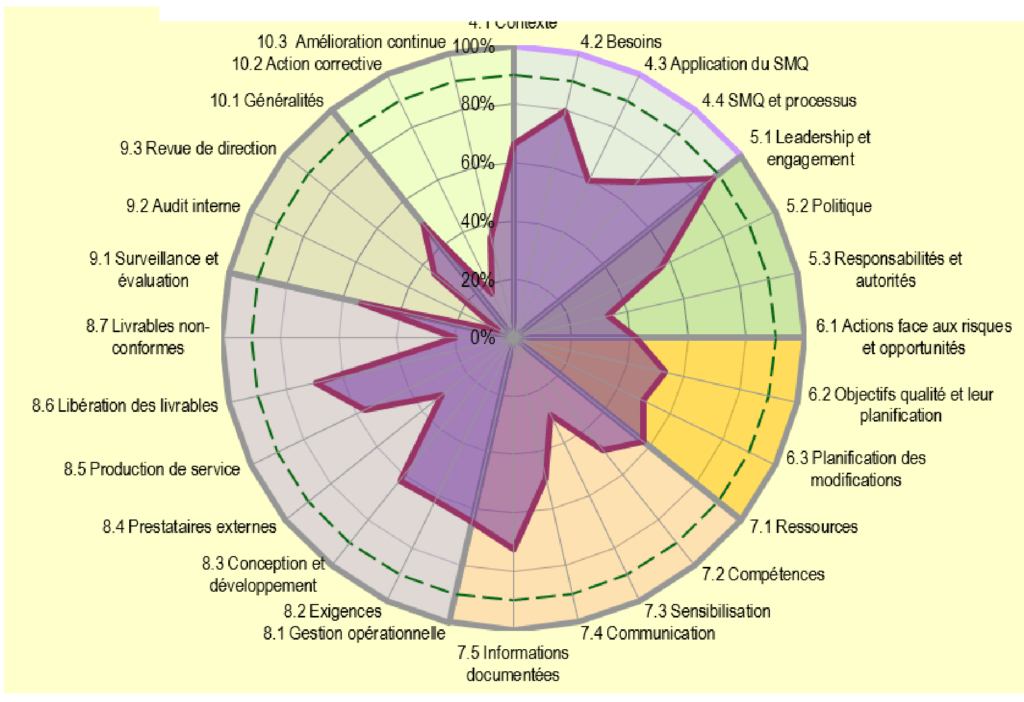
Les résultats de ce diagnostic montrent une évolution et un changement clair par rapport au démarrage de la démarche qualité. Mais il existe encore des points faibles au niveau de « planification, évaluation des performances, et amélioration » qui doivent être améliorés avant d’être certifié. En fait, il reste la moitié du travail à faire pour la mise en place du SMQ et l’obtention la certification ISO 9001 :2015.
Apport du stage
Durant mon stage j’ai pu appliquer des compétences acquises au cours de ma formation à l’UTC. L’UTC m’a permis d’être très vite autonome et de m’adapter assez rapidement. J’ai su retranscrire les capacités d’analyse qui sont demandées lors des UVs pour les différents problèmes à traiter au cours de mes missions. Mes études m’ont également permis d’être organisé pour effectuer plusieurs missions simultanément.
J’ai également rencontré des challenges au cours de mes 6 mois de stage. Le premier était le manque de connaissance sur mon environnement de travail. Mon champ d’action se focalisait principalement sur la recherche clinique. Je n’ai pas effectué d’enseignement liée à ce domaine (promotion, investigation, protocoles...). C’était une opportunité d’acquérir de nouvelles connaissances et d’assimiler les notions importantes pour réaliser ma mission. Un autre challenge rencontré était la surcharge de travail de l’équipe pendant la période du COVID qui a entrainé l’annulation de plusieurs réunions qui ont dû être reportées et reprogrammées, Ce qui a causé le report des revues de processus prévues en juillet.
Mon stage au sein du centre de recherche clinique GHPSJ a été enrichissant sur de nombreux aspects, Il m’a apporté beaucoup de connaissance des exigences et de la réglementation de la recherche clinique. Le secteur de la recherche clinique étant très exigeant, il était bénéfique de faire un stage dans ce milieu. J’ai travaillé au sein d’un centre de recherche performant et challengé en permanence. Ceci m’a permis de voir l’importance d’une organisation et d’un management de la Qualité vigoureux.
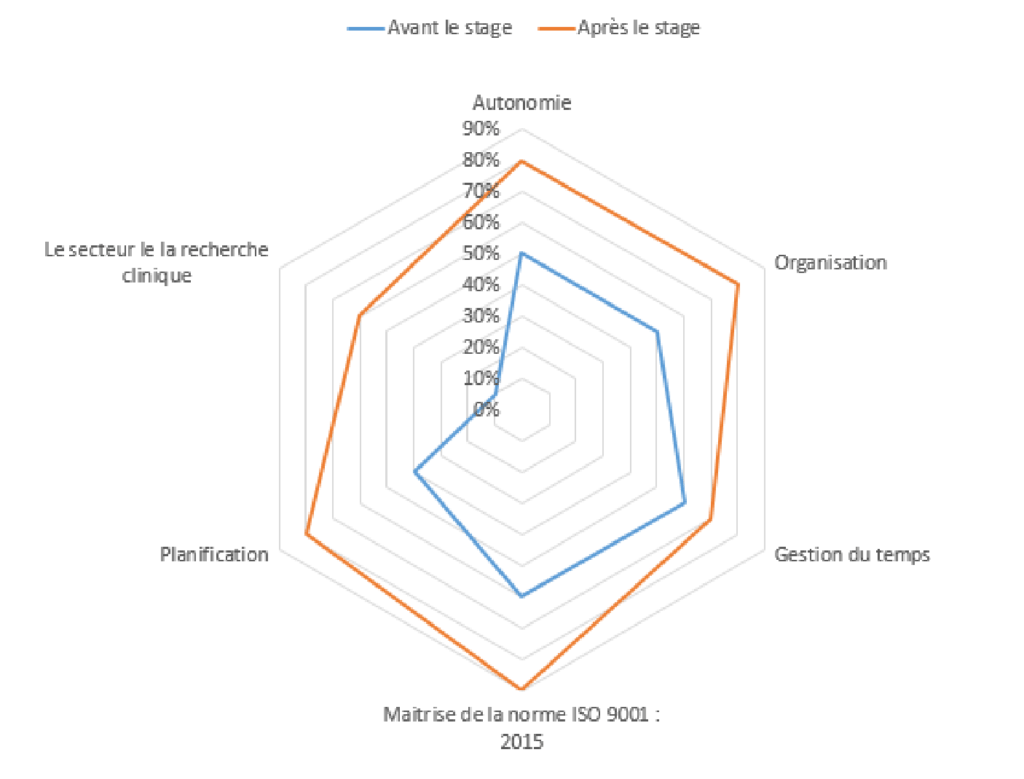
Ce stage m’a permis d’acquérir des compétences en termes d’autonomie, de gestion de projet et de communication relationnelle et d’adaptabilité. La figure (17) présente l’évolution de mes connaissances et compétences pendant ces 6 mois de stage
Conclusion
En intégrant le Centre de Recherche Clinique du GHPSJ, il m’a été confié pour mission de participer à la mise en place d’un système de management de qualité et de préparer à la certification ISO 9001 : 2015.
A partir d’une démarche établie SAPA détaillant les actions à entreprendre pour la réalisation de cette mission, en commençant par étudier la norme ISO 9001 : 2015 et définir la stratégie et les contraintes du SMQ, Puis en analysant le SMQ existant pour réaliser un état des lieux, et en terminant par planifier les actions et les mettre en place. Ceci nous a permis d’obtenir des résultats satisfaisants après six mois de travail. Certes la pandémie du Coronavirus a mis la majorité des missions en ralentissement pendant une période de deux mois, pour permettre à tout le monde de contribuer au maximum dans la lutte contre le virus, mais le prolongement de mon stage nous a permis d’avancer sur certaines missions.
Bien que le SMQ du CRC a évolué au cours de ces six mois, cependant il reste certains axes à réaliser :
- Analyse et traitement des non conformités
- Enquête de satisfaction des clients
- Suivi des indicateurs de performance
La construction d’un SMQ dans une structure implique un changement au sein de celle-ci, cela nécessite donc beaucoup de préparation, de communication et des réunions de groupes de travail surtout dans un service ayant une lourde charge de travail.
Bibliographie
[1] Hôpital Paris Saint-Joseph. « Qui Sommes-Nous ». [En ligne]. Disponible sur : https://www.hpsj.fr/ (consulté le 03/09/2020).
[2] Hôpital Paris Saint-Joseph. « Chiffres clés – Rapport Annuel » 2019 [En ligne]. Disponible sur : https://www.hpsj.fr/qui-sommes-nous/chiffres-cles-rapport-annuel/ (consulté le 03/09/2020).
[3] « Rapport annuel 2019 » [En ligne]. Disponible Sur : https://fr.calameo.com/read/0042444057c0199821eab (consulté le 17/05/2020).
[4] C.STERVINOU « Guide de Bonnes Pratiques en Recherche Clinique ». Publié en 2015. [En ligne]. Disponible sur http://www.chiva-ariege.fr/images/6-formation-recherche/formation-initiale-ifsi-ifas/Guide_Bonnes_Pratiques_de_Recherche_Clinique_CHIVA_CHPO_.pdf (consulté le 17/05/2020).
[5] Article L1121-1 du Code de la santé publique. 12 avr. 2018 Disponible sur : https://www.legifrance.gouv.fr/affichCode.do?idArticle=LEGIARTI000032722870&idSectionTA=LEGISCTA000032722874&cidTexte=LEGITEXT000006072665&dateTexte=20200702. (Consulté le 17/05/2020).
[6] Décision du 24 novembre 2006 fixant les règles de bonnes pratiques cliniques pour les recherches biomédicales portant sur des médicaments à usage humain. [En ligne]. Disponible sur : https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000819256& (Consulté le 17/05/2020).
[7] G. Cliquet, « Les chiffres clés de la recherche clinique en France ». Association Française des Entreprises de la Recherche Clinique. Communiqué de presse : 30 janvier 2020 [En ligne]. Disponible sur : https://www.afcros.com/images/Communiques_Presse/CP_20200130.pdf (Consulté le 17/05/2020).
[8]: Les entreprises des médicaments (LEEM). « La recherche clinique industrielle sur le médicament en quelques chiffres » Décembre 2018. [En ligne]. Disponible sur : https://www.leem.org/sites/default/files/2018-12/infographie.pdf (Consulté le 17/05/2020).
[9]: V, Dievolt et C, MISSE « comprendre la recherche clinique et l'innovation à l'hôpital » Disponible sur : https://www.dunod.com/sciences-humaines-et-sociales/comprendre-recherche-clinique-et-innovation-hopital-enjeux
[10] : ISO 9001, « Système de Management de la Qualité – Exigences ». 09 juillet 2015.
[11] : Organisation Internationale de Normalisation. « Pourquoi ISO 9001 ? » [En ligne]. Disponible sur : https://www.iso.org/iso-9001-quality-management.html (Consulté le 17/05/2020)
[12] : Y, Mougin « La cartographie des processus : Maîtriser les interfaces ». Juillet 2011.Disponible sur : https://books.google.fr/books?id=AkvhN7N_MvwC&printsec=frontcover&dq=editions:utxC1xvYbyIC&hl=fr&sa=X&ved=2ahUKEwiuiv_cxePqAhWQFxQKHcdLDT8Q6AEwAXoECAEQAg#v=onepage&q&f=false (Consulté le 17/05/2020).
[13] : Y. ZHENG, L. MARTINS FLORIS, et M. R. KHEDHIRI, « Outil d’autodiagnostic pour le projet de la norme ISO 9001:2015 », Université de Technologie de Compiègne. Publié en Janvier 2015. Disponible sur : https://www.utc.fr/master-qualite/public/publications/qualite_et_management/MQ_M2/2014 2015/MIM_projets/qpo12_2015_gp01_autodiag_ISO_9001_v2015/index.html.
[13] : Hôpital Paris Saint-Joseph « Composition de l’équipe du CRC » [En ligne]. Disponible sur : https://www.ghpsjresearch.com/fr/organisation/lequipe/ (Consulté le 03/059/2020).