IDS164 - Amélioration du Système de Management de la Qualité de Mauna Kea Technologies
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteure

Contact
- Pricilla VIMPI NAZOMBO : pricillavimpi@hotmail.fr
Citation
A rappeler pour tout usage : Pricilla VIMPI NAZOMBO , "Amélioration du Système de Management de la Qualité de Mauna Kea Technologies", Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Mémoire de Stage, https://travaux.master.utc.fr/, réf n° IDS164, Septembre 2022, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids164/
Résumé
Mettre en place et maintenir un Système de Management de la Qualité (SMQ) adapté, efficace et efficient dans le temps permet aux entreprises du secteur biomédical d’accroître leur performance et d’assurer la conformité de leur Dispositif médical (DM) tout en satisfaisant au mieux les besoins de leurs clients.
Pour les aider, ces entreprises ont à leurs dispositions plusieurs outils : le référentiel le plus utilisé est la Norme ISO 13485 : 2016 « Dispositifs médicaux – Système de management de la qualité – Exigences à des fins réglementaires ». Sa certification atteste de la capacité qu’a une entreprise à répondre aux exigences liées à la conception et à la fabrication des DM, en vue des autorisations réglementaires.
Le présent rapport présente, à travers les différents projets réalisés lors de ce stage de fin d’études, une partie des actions entreprises pour améliorer le système de management de la qualité d’une société qui conçoit, développe et commercialise un dispositif médical innovant.
Très enrichissant, ce stage a contribué au développement des compétences techniques et relationnelles essentielles que je dois avoir pour entamer dans le secteur de la qualité, de façon sereine, ma carrière professionnelle.
Mots-clés : Qualité, Système de Management de la Qualité, Amélioration Continue, ISO 13485 : 2016, Dispositif Médical, Gestion de Projet
Abstract
Establishing and sustaining a Quality Management System (QMS) that is customized, effective, and efficient over time enables organizations in the biomedical sector to increase their performance and ensure the conformity of their medical devices (MD) while satisfying the needs of their customers.
To help them, these companies have several tools at their disposal : the most widely used is the ISO 13485 : 2016 "Medical devices - Quality management systems - Requirements for regulatory purposes". Its certification to a company's ability to meet the requirements related to the design and manufacture of medical devices for regulatory approval.
This report presents, through the various projects carried out during this internship, the actions undertaken to enhance the quality management system of a company that designs, develops and commercializes an innovative medical device.
Very enriching, it contributed to the development of the essential technical and relational skills that I must have to start my professional career in the quality sector in a serene way.
Keywords : Quality, Quality Management System, continuous improvement, ISO 13485:2016, Medical Device, Project Management
Téléchargements

Mémoire de fin d'étude présentant une partie des missions réalisées au sein du département qualité de Mauna Kea Technologies pour améliorer leur Système de Management de la Qualité
Remerciements
Ci-dessous sont répertoriées toutes les personnes ayant contribué à la réussite de ce stage, mon épanouissement lors de celui-ci, et que je voudrais remercier :
Mme Griffoux, ma tutrice de stage, pour sa disponibilité, sa patience, son soutien, sa bienveillance, ses conseils, pour m’avoir partagé son savoir qui m’a permis d’avoir plus confiance en moi.
Mme Capron, directrice qualité, pour son accueil chaleureux, sa bonne humeur, pour toutes ses formations, ses explications et pour être devenue un modèle à atteindre.
Mr Halouani, ingénieur qualité, pour m’avoir aidé quand j’en avais besoin, pour sa disponibilité, son sourire et pour m’avoir partagé son optimisme.
L’équipe Support, pour vos explications sur le fonctionnement de SalesForce, pour votre accueil, votre disponibilité et pour avoir été l’une des raisons pour laquelle je me suis rapidement sentie intégrée.
Les équipes de Mauna Kea Technologies pourm’avoir fourni, à travers nos nombreux échanges, les connaissances et les compétences m’ayant été indispensables lors de la rédaction de ce rapport. Pour leurs accueils chaleureux, leurs disponibilités, leur bonne humeur et tous les bons moments passés ensemble.
Mes amis et ma famille pour leurs présences et le soutien qu’ils m’ont apporté tout le long de l’élaboration de ce rapport.
Mme Claude et Mr Prot, mes responsables de formation en Master Ingénierie de la Santé à l’Université Technologique de Compiègne, pour leurs aides, leurs conseils ainsi que les enseignements qu’ils m’ont conférés.
Mr Grosset, mon maître de stage, pour sa disponibilité et ses retours m’ayant permis de perfectionner ce rapport de fin d’études.
Liste des Abréviations
- AFNOR : Association française de normalisation
- ANSM : Agence nationale de sécurité du médicament et des produits de santé ;
- DM : Dispositifs Médicaux ;
- GED : Gestion électronique des documents ;
- ISO : Organisation Internationale de Normalisation ;
- MKT : Mauna Kea Technologies ;
- QO : Qualification Opérationnelle ;
- QP : Qualification de Performance ;
- SI : Système informatisé
- SMQ : Système de Management de la Qualité
Liste des Figures /Annexes
- Figure 1 : Bâtiment de Mauna Kea Technologies France
- Figure 2 : Organigramme général extrait du Manuel Qualité de MKT
- Figure 3 : Organigramme du pôle Qualité de MKT
- Figure 4 : Produit phare de MKT : Cellvizio®
- Figure 5 : Illustration du processus d'Endomicroscopie Laser Confocale
- Figure 6 : Étapes du processus de qualification de la Passerelle SalesForce-Qalitel Conform
- Figure 7 : Extrait du rapport de qualification de Qalitel Conform
- Figure 8 : Critère C1 - Gravité des conséquences d’une mesure erronée
- Figure 9 : Périodicités OPPERET : Modélisation de la Notation des Equipements
- Figure 10 : Périodicités OPPERET : Modélisation des Périodicités de MKT
- Figure 11 : Extrait du Tableau récapitulatif des mises à jour à réaliser dans la GED
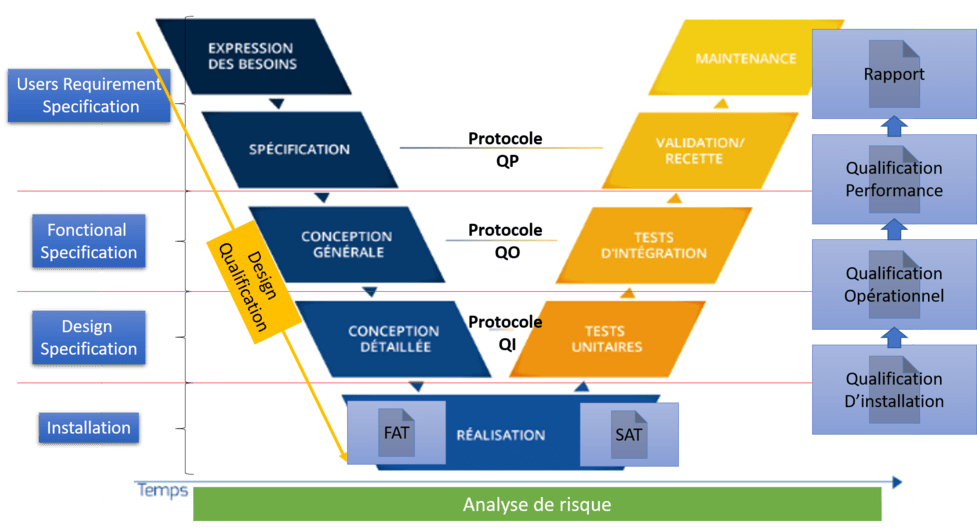
- Annexe 1 : Modélisation du Cycle de Validation d'un Système Informatisé
Glossaire
- Action corrective : « Action visant à éliminer la cause d’une non-conformité et à éviter qu’elle ne réapparaisse » [1]
- Action de correction : Action visant à remettre immédiatement en conformité
- Amélioration continue : Action visant à améliorer l’existant et son fonctionnement
- Client : « Personne ou organisme qui reçoit un produit ou un service » [1]
- Conformité : Réponse satisfaisante à une exigence
- Dispositif médical : Appareil destiné par le fabricant à être « utilisé seul ou en association chez l’être humain pour une ou plusieurs fins médicales spécifiques (…) et dont l’action principale voulue n’est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, dans le corps humain ou à la surface de celui-ci, mais dont la fonction peut être assistée par de tels moyens » [1]
- Enregistrement : « Document faisant état de résultats obtenus ou apportant la preuve de la réalisation d’une activité » [1]
- Événement indésirable : « Un événement indésirable associé aux soins réalisés lors d'investigations, de traitements (…) est un événement inattendu au regard de l'état de santé et de la pathologie de la personne et ayant des conséquences potentiellement préjudiciables » [2]
- Exigence : « Besoin ou attente formulée, généralement implicite ou obligatoire » [1]
- Non-conformité : « Non-satisfaction d’une exigence » [1]
- Politique : « Intentions et orientations d’un organisme, telles qu’elles sont officiellement formulées par sa direction » [3].
- Politique qualité : « Politique en matière de qualité » [3]
- Procédure : « Manière spécifiée de réaliser une activité ou un processus » [1]
- Processus : « Ensemble d’activités corrélées ou en interaction qui utilise des éléments d'entrée pour produire un résultat escompté » (éléments de sorties) [1]
- Qualité : « Aptitude d'un ensemble de caractéristiques intrinsèques d'un objet à satisfaire des exigences » [3]
- Qualification : « Les activités réalisées pour la vérification sont parfois appelées processus de qualification » [3]
- Réclamation : « Toute expression de mécontentement adressée à un organisme, concernant son produit, (ses services), ou le processus de traitement des réclamations lui-même, pour laquelle une réponse ou une solution est explicitement ou implicitement attendue » [1]
- Système d’information / informatisé : « Ensemble organisé de ressources : matériel, logiciel, personnel, données, procédures... permettant d’acquérir, de traiter, de stocker des informations (sous forme de données, textes, images ...) » [4]
- Système documentaire : « Ensemble des documents sur lesquels s'appuie un organisme pour formaliser son organisation et mettre en œuvre avec succès son système de management » [5]
- Système de management : « Ensemble d'éléments corrélés ou en interaction d'un organisme, utilisés pour établir des politiques, des objectifs et des processus de façon à atteindre lesdits objectifs » [3]
- Système de management de la qualité : « Partie d'un système de management relatif à la qualité » [3]
- Validation : « Confirmation par des preuves objectives que les exigences pour une utilisation spécifique ou une application prévue ont été satisfaites » [1]
- Vérification : « Confirmation par des preuves objectives que les exigences spécifiées ont été satisfaites » [1]
Mémoire complet
Amélioration du Système de Management de la Qualité
de Mauna Kea Technologies
Introduction
“Un mauvais système triomphera toujours d’une bonne personne” - W. Edwards Deming, statisticien et qualiticien américain fondateur du « Total Quality Management »
Pour qu’un Dispositif médical (DM) puisse être commercialisé sur le territoire Européen, il doit obligatoirement avoir obtenu au préalable le marquage CE.
Ce marquage CE permet aux fabricants de dispositifs médicaux d’attester que celui-ci satisfait aux exigences normatives et réglementaires essentielles applicables en termes de performance et d’utilisation sans danger, pour les praticiens et leurs patients [1].
Pour obtenir cette certification, la mise en place d’un Système de Management de la Qualité (SMQ) efficace est essentielle. Ensemble cohérent de processus, procédures et responsabilités, le SMQ a pour vocation d’améliorer la coordination des activités réalisées au sein d’une organisation pour d’obtenir un produit en conformité avec les exigences.
Il atteste, notamment, de la capacité qu’à l’entreprise à fournir une réponse adaptée et optimale aux besoins des clients de manière continue dans le temps, à travers la politique qualité et les objectifs qu’elle met en place pour perfectionner, ses produits, son image et les services qu’elle propose. Une fois en place, une gestion de ce SMQ doit être mise en place pour garantir son maintien et permettre son amélioration continue.
Parmi les outils qui existent pour aider les organisations à mettre en place un SMQ efficient, la Norme ISO 13485 « Dispositifs médicaux — Systèmes de management de la qualité — Exigences à des fins réglementaires » est dédiée aux fabricants de dispositifs médicaux.
Dans le cadre du Master 2 Ingénierie de la Santé, parcours « Dispositifs médicaux et Affaires réglementaires » de l'Université de Technologie de Compiègne, j’ai réalisé un stage de fin d'études au sein du service qualité de Mauna Kea Technologies.
Ce rapport présente les différentes missions que j’ai réalisées, en tant que stagiaire ingénieur qualité, ayant contribuées à améliorer le Système de Management Qualité de la société.
Découpé en plusieurs parties, ce rapport présentera dans un premier temps Mauna Kea Technologies, son environnement et les produits qu’elle développe.
Par la suite, seront développées les diverses missions réalisées dans le cadre de l’amélioration continue du système de management de la qualité de la société.
Pour terminer, un bilan final récapitulera les compétences et comportements développés lors de ce stage.
I. Présentation de l'entreprise
A) Généralités
Figure 1 : Bâtiment de Mauna Kea Technologies France (source : auteur)

Fondée en mai 2000 par Sacha Loiseau, Mauna Kea Technologies (MKT) est une entreprise française qui conçoit, développe et commercialise un dispositif médical innovant [6].
La mission de MKT est d’éliminer, grâce à leur technologie innovante, les incertitudes de diagnostic et de décisions pour le traitement des patients, afin d'améliorer les soins perçus par le patient et réduire les coûts de santé.
L'entreprise est née d'une collaboration entre un astrophysicien et des médecins, qui ont eu l’idée d’utiliser les avancées technologiques et un savoir-faire issu de l’astronomie (observation de corps célestes à des années-lumière de la Terre) pour venir observer in vivo, avec une bien meilleure qualité d’image, les tissus humains.
Le siège social de l’entreprise se situe à Paris dans le 10e arrondissement. Actuellement, elle emploie environ 70 employés répartis en Europe, en Asie et aux États-Unis.
Entrée à la bourse de Paris en 2011, l’entreprise a réalisé, en 2021, un chiffre d'affaires s’élevant à 7,7 millions d'euros [7].
Pour étendre sur le plan mondial, l’export de ses produits et augmenter ses ventes, la société s’est associée avec diverses structures telles que Johnson & Johnson (2020) et plus récemment Tasly Pharmaceuticals (2022).
B) Services
Au sein de Mauna Kea Technologies, de nombreux services travaillent régulièrement ensemble pour assurer le fonctionnement de la société. La direction de MKT est chargée d’établir les responsabilités au sein de l’entreprise. Ces responsabilités se formalisent sous plusieurs formes dont celle d’organigramme. L’organigramme ci-dessous (Fig.2) schématise de façon hiérarchique les différents services de MKT.
Figure 2 : Organigramme généralisé extrait du Manuel Qualité de MKT (Juin 2022) (source : MKT)
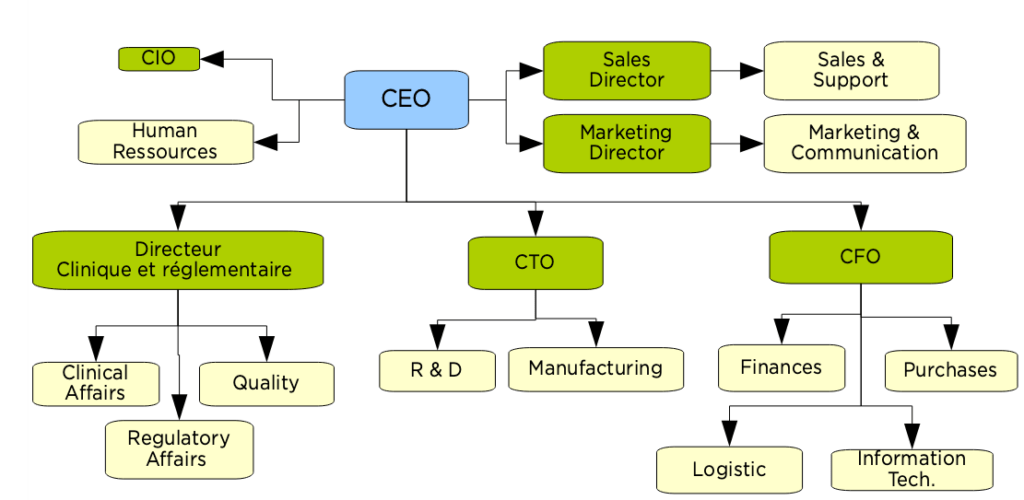
Parmi tous les services, celui de la qualité a pour responsabilité globale d'évaluer la conformité des produits et du système de management de la qualité (SMQ) de MKT. Ces principales missions sont de :
- Piloter et gérer le Système de Management de la Qualité ;
- Définir et mettre en place la politique qualité ;
- Gérer le système documentaire ;
- Évaluer la conformité des produits et/ou services de l’entreprise, aux exigences internes et externes, en réalisant des audits internes et en supervisant les audits externes ;
- Gérer l’obtention et/ou le renouvellement des certifications et/ou accréditations de l’organisation ;
- Identifier, analyser et résoudre les dysfonctionnements, donnant lieu à des Non-Conformités (NC)/ Réclamations clients, réelles (résolu par des actions de correction ou correctives) et probables (actions préventives, d’amélioration) ;
- Surveiller l’activité et les performances des collaborateurs via des indicateurs de performance ;
- Sensibiliser, informer et former les salariés pour assurer la bonne application des procédures.
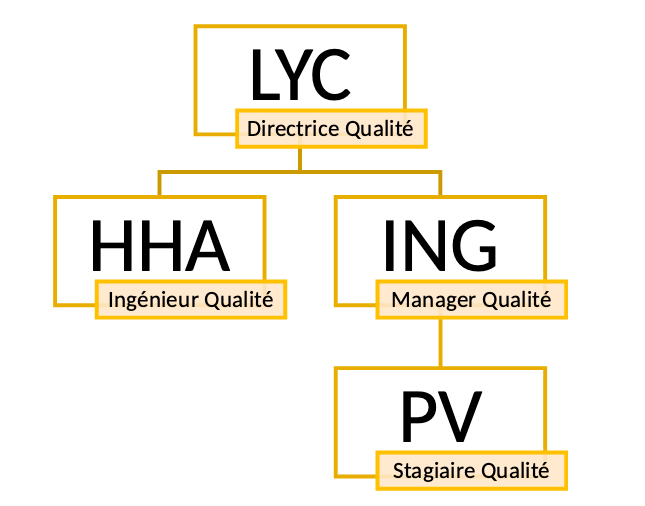
Figure 3 : Organigramme du pôle Qualité de MKT (Juillet 2022) (source : auteur)
C) Dispositif médical : Cellvizio ®
Figure 4 : Cellvizio® I.V.E : (a) Système d’endomicroscopie confocale (b) Minisonde ConfocaleTM (source : MKT)
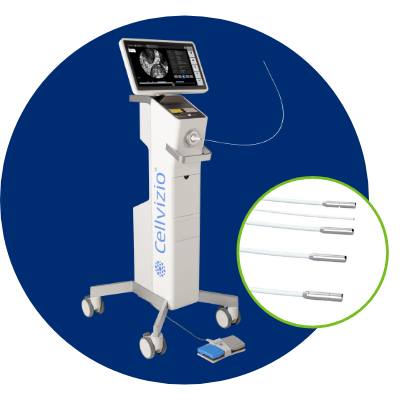
« Plus petit microscope au monde » [6], le Cellvizio® dispositif de classe IIa (règlement 2017/745), est la seule et unique plateforme d'imagerie cellulaire in vivo qui permet aux praticiens, en temps réel, de visualiser les tissus et de détecter des anomalies à l’échelle cellulaire.
Il est composé (Fig.4) de 3 principaux éléments :
- Un boitier contenant l’unité de balayage laser délivrant l’énergie permettant la création des images ;
- Un logiciel qui permet en temps réel de contrôler et de calibrer le système et d'acquérir et d'observer les images obtenues ;
- Une mini-sonde confocale, reliée au boitier dans sa partie proximal et au patient dans sa partie distale, permettant la transmission des informations brute.
La figure ci-dessous présente, sous la forme de schéma, l’image obtenue grâce à l’Endomiscroscopie Confocale Laser (CLE), la technologie responsable de cette acquisition en temps réel. Les informations perçues sont identiques à celle donnée par une coupe histologique après analyse d’un tissus prélevé (Biopsie).
Figure 5 : Illustration du processus d'Endomicroscopie Confocale Laser ( source : MKT)

« Les images Cellvizio proviennent d'un plan focal fin qui est projeté optiquement dans le tissu. Cela permet une observation profonde de la muqueuse et de ce qui se passe dans les cellules en temps réel »[8] (Fig.5).
Le Cellvizio est utilisé en recherche préclinique (domaines tels que les neurosciences, la recherche contre le cancer, sur les cellules souches, sur le développement des médicaments…) et en clinique (alternative à la biopsie, exploration médicale).
La large gamme de sondes disponible permet d’assurer une qualité d’image optimale « in vivo et un situ », quelle que soit l’application médicale voulue (gastroentérologie, pneumologie ou urologie) :
- CholangioFlex TM N : exploration des voies biliaires et pancréatiques ;
- AQ-Flex 19 TM N : exploration des kystes pancréatiques ;
- UroFlex et CystoFlex N : exploration des voies urinaires ;
- CelioFlex N : utilisé lors des procédures de laparoscopie, en collaboration avec un robot chirurgical ;
- GastroFlex TM N et ColoFlex TM N : exploration de l'appareil gastro-intestinal
- AlveoFlex TM N : exploration des alvéoles pulmonaires
- CranioFlex : exploration du système nerveux central lors de procédure crânienne à visée diagnostique et/ou thérapeutique (ex : biopsie, résection tumorale).
Exemple d'utilisation du Cellvizio :
- Surveillance et traitement de l’endo-brachyœsophage
- Caractérisation des lésions pulmonaires et gastriques
- Détection des kystes et cancers bilio-pancréatiques
- Détection et le traitement du cancer de la vessie
- Traitement et suivi des maladies inflammatoires chroniques de l’intestin
- Suivi des mucosectomies colorectales
Actuellement deux générations du dispositif Cellvizio sont commercialisées : le 100Serie (Cellvizio 2e génération) et l’I.V.E (3e génération). Nouvelle génération vouée à remplacer le 100Serie, l’architecture du système IVE a été améliorée, en réduisant notamment son format et en optimisant son intégration dans les salles d’intervention (écran tactile, connectivité DICOM…), pour faciliter son usage et sa manipulation.
II. Missions réalisées
A) Amélioration de la gestion interne des réclamations clients
1. Contexte
On définit par « réclamation » : toute « communication écrite, électronique ou verbale faisant état de déficiences relatives à l’identité, la qualité, la durabilité, la fiabilité, l’aptitude à l’utilisation, la sécurité ou les performances d’un dispositif médical qui n’est plus sous le contrôle de l’organisme ou relatives à un service qui affecte les performances d’un tel dispositif médical » [1].
Au sein du chapitre § 8.2.2 Traitements des réclamations de la norme ISO 13485 : 2016 « Dispositifs médicaux », il est indiqué que « l’organisme doit documenter des procédures pour le traitement des réclamations dans des délais appropriés, conformément aux exigences réglementaires applicables » et que « toute correction ou action corrective résultant du processus de gestion des réclamations doit être documentée » [1].
Ce qui permet à l’organisme de maintenir la conformité des dispositifs et du SMQ, d’améliorer leur gestion des risques, de garantir l’amélioration continue des procédés et d’augmenter leur satisfaction client.
Il est indispensable que les entreprises concernées soient réactives lorsqu’elles traitent leurs réclamations clients (diagnostic et mise en place d’actions de correction et/ou correctives), surtout si elles font face à un évènement potentiellement indésirable.
En effet si la survenue de l’évènement indésirable est attribuée à l’utilisation du dispositif, cet évènement indésirable doit être reporter au plus vite à l’organisme compétent (en France : ANSM).
La bonne gestion des réclamations clients permet à la société d’améliorer sa structure, son management, ses produits et de gagner la confiance de ses clients.
À MKT deux systèmes informatisés sont utilisés pour la gestion des réclamations clients : SalesForces et Qalitel Conform – Scoqi.
Définit par Larousse comme un « ensemble de moyens d'acquisition, de traitement, de stockage et de restitution de données, et de moyens de télécommunication mis en œuvre pour une application ou un ensemble d'applications spécifiés » [9], les SI peuvent être définis comme des systèmes qui réalisent, via une série complexe de processus et d’opérations, une ou plusieurs fonctionnalités.
Qalitel Conform par exemple, a été programmé pour dématérialiser la gestion des réclamations clients, des non-conformités et pour faire le suivi des actions correctives et préventives (CAPA).
Pour réaliser les fonctionnalités pour lesquels ils ont été développés, les SI : collectent, conservent, traitent et communiquent l’information.
Dans le cadre de la gestion des réclamations clients :
- Sales Forces : intervient dans le cadre de la gestion « externe » des réclamations clients. C’est dans ce SI que sera enregistrer dans un premier temps, par le service Support, la plainte émise par le client et les actions entreprises, en réponse, pour satisfaire ses besoins (ex : remplacement d’une sonde non fonctionnelle).
- Qalitel Conform – Scoqi : intervient dans le cadre de la gestion « interne » des réclamations clients. Il permet de faire le suivi des actions de correction, et/ou correctives, mis en place après qu’ait été diagnostiquée la cause de la non-conformité (ex d’action de correction : réparation d’une sonde ; ex d’action corrective : formation de rappel de l’équipe de production sur les méthodes d’assemblage du Cellvizio). C’est également le service support qui a la charge d’y enregistré les réclamations.
2. Enjeux et Objectifs
Le double enregistrement des données issues des réclamations clients, dans SalesForce puis Qalitel Conform, ayant pour conséquences :
- De faire perdre du temps au service support qui aurait pu le consacrer à d’autres tâches ;
- D’augmenter la probabilité d’erreurs de saisies, d’oublier d’apporter des informations complémentaires (après enregistrement de la réclamation) ;
- D’espacer la mise en place des actions internes visant à diagnostiquer et corriger la cause de la réclamation.
Il est apparu nécessaire de mettre en place une passerelle transférant automatiquement les données issues des réclamations, enregistrées sur Sales Forces, vers Qalitel Conform. Ainsi, les enregistrements des réclamations ainsi que leurs mises à jour, réalisés uniquement sur Sales Force sont automatiquement transférés dans Qalitel Conform, et sont accessibles et visibles dans les deux SI pour traitement.
L’ajout de la nouvelle fonctionnalité dans les SI nécessite de réaliser une qualification. Elle permettra d’attester de la conformité de l’utilisation par l’apport de preuves du fonctionnement tel qu’attendu.
Il est indiqué dans le chapitre § 7.5.6 Validation des processus de production et de prestation de service (ISO 13485 :2016) que les « applications logicielles doivent être validées (…) lorsqu’approprié, après (…) modification de ce logiciel » [1]. La qualification faisant partit des processus permettant de valider un système (voir Annexe 1), c’est une exigence réglementaire.
Composé de différentes phases, elle comprend les :
- Qualification de Conception (QC) : Permet en phase de création du SI, d’identifier et de définir les besoins utilisateurs et les spécificités et caractéristiques du SI. Elle se déroule de l’émission du besoin à l’arrivée de l’équipement sur site.
- Qualification d’Installation (QI) : Permet de vérifier la bonne installation du SI dans son environnement, conformément à ce qui avait été prévu dans la QC et selon les recommandations du fabricant.
Ainsi que les :
- Qualification Opérationnelle (QO) : Permet de vérifier que le SI fonctionne, tel qu’il a été installé (ou modifié), conformément aux spécifications demandées dans la QC. Sa démarche s’appuie sur une analyse détaillée des spécifications utilisateurs, fonctionnelles, techniques et réglementaires du SI (Ex : Transfert automatique bi journalier des données issues des réclamations).
- Qualification de Performance (QP) : Permet de vérifier que le SI répond aux performances souhaitées en s’appuyant sur les fonctionnalités attendues (Ex : Transfert bi-journalier effectué à 12h et 00H).
Ces deux qualifications consistent à documenter les tests de simulation réalisés.
Dans le cadre de ce projet, mon travail a consisté à valider et enregistrer les tests de qualifications, opérationnelles et de performance, créés sur la base de scénarii illustrant l’utilisation réelle des SI et de la Passerelle. Ont été pris en compte les droits et restrictions des utilisateurs, la réponse des SI en condition normale et anormal (face à une anomalie)…
3. Méthode et Résultats
Le processus de qualification de la Passerelle peut être divisé en 4 étapes (Fig.6) :
Figure 6 : Étapes du processus de qualification de la Passerelle SalesForce-Qalitel Conform (source : auteur)
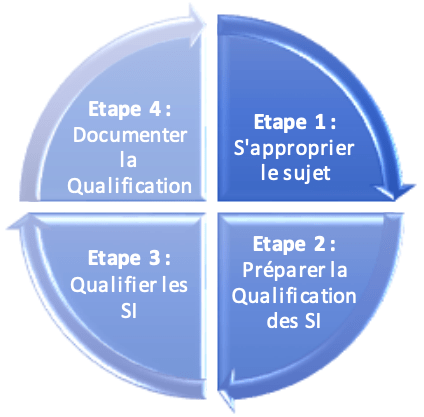
Etape 1 : S'approprier le Sujet
Utiliser Qalitel Conform a mis en évidence les problématiques apportées par ce double enregistrement des réclamations.
La lecture du cahier des charges fonctionnelles de la Passerelle a contribué à éclaircir les attentes des utilisateurs, à savoir :
- Le type de données (champs) à transférer (ex : nom du lieu faisant l’objet de la réclamation) ;
- La fréquence et les modalités du transfert : transfert automatique des données issues des réclamations deux fois par jour (12h et 00h) et transfert automatique déclenchable par les opérateurs responsables de la gestion des réclamations clients à MKT (en cliquant sur un « bouton » disponible sur l’interface de gestion de Qalitel Conform) .
Assister aux réunions de « démonstration » , animées par les responsables support et gestion des réclamations de MKT, m'a aidée à visualiser la création et la mise à jour des futures réclamations dans Qalitel Conform.
Cette étape s'est conclue par la définition de mes responsabilités :
- Création et validation des Tests de Qualification ;
- Rédaction et enregistrement de la documentation associée ;
- Formation des acteurs impactés par la mise en place de la Passerelle ;
Etape 2 : Préparer la Qualification des SI
Pour préparer au mieux la Qualification des SI et déterminer les tests à réaliser pour valider le fonctionnement de la Passerelle, conformément aux attentes et sans perturbation des performances attendues des systèmes, j’ai étudié dans un premier temps les anciennes révisions des rapports de qualification de Sales Force et Qalitel Conform.
Par la suite a eu lieu, avec la manager qualité et le responsable du service support, plusieurs réunions de brainstorming pour déterminer ensemble les tests à réaliser pour qualifier la Passerelle.
C’est lors de ces réunions de brainstorming que des anomalies sous-jacentes ont été découvertes et de nouveaux besoins, découlant de l’ajout de nouvelles fonctionnalités, demandées au fournisseur Scoqi. C’est également durant l’une d’elles que les pilotes les plus aptes à réaliser les tests de qualification ont été déterminés (ex : « administrateur scoqi », « utilisateur complaint »).
À l’issue de cette étape, il a été décidé de :
- Effectuer les anciens tests relatifs à la gestion des réclamations, présent dans les anciennes révisions des rapports de qualification (modifiés si impactés par l’ajout de la passerelle) ;
- Créés les nouveaux tests permettant de valider le fonctionnement de la passerelle :
- Transfert automatique des données déclenché par l’opérateur
- Transfert automatique des données programmé
- Réaliser les tests, non exclusifs à la gestion des réclamations, potentiellement impactés par l’ajout de la Passerelle.
- Supprimer les tests qui n'étaient plus applicables (ex : création par l’administrateur d’une fiche réclamation dans Qalitel Conform) ;
Ces tests ont été listés et regroupés dans un fichier Excel pour faciliter la gestion des résultats obtenus à l’issue de la phase de réalisation des tests de qualification.
Etape 3 : Qualifier les SI : Réalisation des Tests de Qualification
L’objectif de cette phase de réalisation des tests de qualification est de vérifier que le fonctionnement de la Passerelle est conforme aux attentes. La qualification s’est déroulée de la manière suivante :
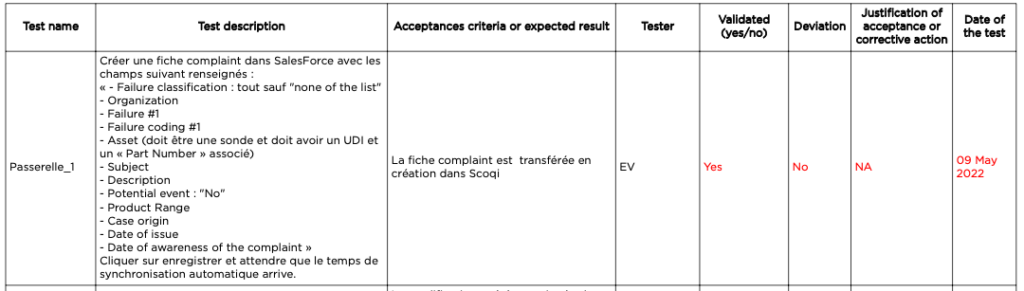
- Explication du déroulement de la séance : les testeurs ont eu accès au fichier Excel recensant les tests à réalisés et l’ordre de réalisation (Fig.7). Pour ne pas influencer les résultats, ils ont été laissés en autonomie pour les réaliser. Ma présence ayant deux buts : superviser le bon déroulement de la séance et répondre aux éventuelles questions.
- Réalisation des tests dans les conditions du contexte d’utilisation des SI : les membres de l’équipe support ont eu pour responsabilité d'enregistrer des réclamations, puis de modifier leurs contenus sur SalesForces comme s’ils devaient enregistrer une réclamation client.
- Observation des résultats sur Qalitel Conform : Le résultat des tests à réaliser étant observable sur Qalitel Conform, les testeurs devaient s'assurer, après avoir déclenché le transfert automatique des données, que pour chaque test réalisé, ces données étaient présentes (de la création à la clôture de la réclamation).
- Validation des tests : L’obtention d’un résultat équivalent au critère d’acceptabilité défini pour chaque test, sans qu’une déviation ne soit relevée, à permis de valider la qualification des systèmes.
Cette étape s’est conclue par l’édition des rapports de qualification des SI dans lesquels ont été insérés les tests réalisés et leurs résultats (Fig.7).
Figure 7 : Extrait du rapport de qualification de Qalitel Conform (source : MKT)
Etape 4 : Documenter la Qualification (Enregistrement de la documentation)
La dernière étape, de ce processus de qualification, a consisté à enregistrer dans le système documentaire toute la documentation associée (rapports de qualifications et procédure impactées mises à jour) est la dernière étape de ce processus de qualification.
Le projet et l’action d’amélioration relative ont été clôturés.
La mise en application de la Passerelle s’est conclue par la formation des équipes Qualité, Support, Clinique et Affaires réglementaires, sur l’utilisation de cette nouvelle fonctionnalité et les apports amenés.
B. Optimisation de la Périodicité des équipements du service de production
1. Contexte
Comme toute entreprise fabriquant des dispositifs médicaux, Mauna Kea Technologies possède un parc d’équipements. Ces équipements servent à valider la conformité du produit fabriqué par MKT.
La qualité du dispositif étant assurée par la qualité des mesures effectuées par les équipements en production, il est indispensable que leurs performances soient garanties.
Cette garantie passe par une étape de vérification périodique des équipements.
Cette exigence réglementaire est définie dans le chapitre § 7.6 « Maîtrise des équipements de surveillance et de mesure » de l’ISO 13485 : 2016 : « Pour assurer des résultats valables, les équipements de mesure doivent être : a) étalonnés et/ou vérifiés à intervalles spécifiés » [1]
Cela implique que leséquipements ayant atteint leur date d’échéance (date à laquelle ils doivent être à nouveau vérifiés/étalonnés) ne doivent pas être utilisés tant qu’il n’a pas été prouvé que les résultats qu’ils délivrent sont conformes (aux vues des spécifications définies).
Au début de l’étude (mai 2022), la périodicité des équipements de production de MKT était de façon générale définie plus ou moins aléatoirement, notamment basée sur les recommandations des fabricants, à 12 mois. Aucune méthode en place ne permettait de déterminer de façon efficace la périodicité des équipements de l’équipe production.
2. Enjeux et Objectifs
Pour déterminer si la périodicité attribuée à chaque équipement était probante, il a été décidé d’appliquer une méthode statistique permettant de déterminer la périodicité des équipements utilisés par le service production.
L’idée étant de justifier nos choix de périodicité et de faciliter la gestion des équipements, sans dégrader les performances attendues, en réduisant au possible les coûts de vérification associés.
La méthode choisie s’appelle OPPERET (OPtimisation des PERiodicités d’Étalonnage). Elle a été appliquée sur l’ensemble des équipements utilisés par le service de production, soit 64 équipements.
Pour l’appliquer, il a été nécessaire de créer un groupe de projet regroupant des acteurs des services de la Production (ex : responsable de la production), de la Qualité (ex : responsable du parc d’équipements), du Support (ex : expert de la méthode OPPERET) et de la Recherche et du Développement.
3. Méthode et Résultats
La méthode OPPERET peut être définie comme une méthode qualitative permettant de calculer la périodicité d’étalonnage/de vérification des équipements d’une société.
Contrairement à d’autre méthode, elle n’est pas uniquement basée sur l’observation des dérives d’un équipement. Elle prend en compte tout type de facteurs d’influence, pouvant améliorer ou dégrader la qualité de la mesure réalisée.
Relatif à l’usage réel de l’équipement et à son intégration dans le processus de mesure (ex : conditions d’utilisation, coût de l’étalonnage / de la vérification), elle intègre la notion de risque.
Son intérêt est qu’elle permet non seulement de définir des périodicités très réalistes, généralement plus longues que celles qui étaient en place avant son application, mais également de réduire les coûts liés à la gestion du parc d’équipements.
Le guide technique “Optimisation des périodicités d’étalonnage” publié par le Collège Français de Métrologie et l’AFNOR, explique les étapes à suivre pour calculer, en appliquant cette méthode, nos périodicités.
Etape 1 : Définition des critères, notations, pondérations
Lors de cette étape ont été réalisées diverses réunions de brainstorming (avec l’ensemble du groupe projet) pour :
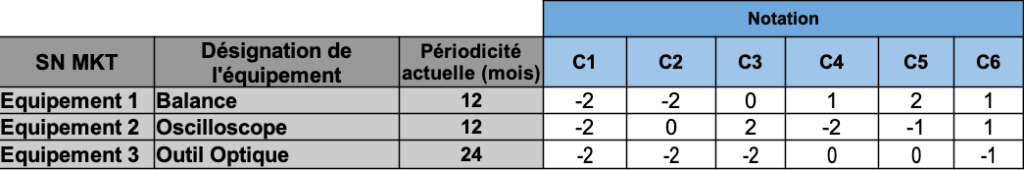
1. Déterminer les 6 critères (Cx), parmi ceux proposés dans le guide de l’AFNOR, reflétant l’activité du parc d’équipements de production de MKT. Ces critères étant :
- C1 : « Gravité des conséquences d’une mesure erronée »
- C2 : « Fréquence d’utilisation »
- C3 : « Dérive de l’équipement »
- C4 : « Contraintes de coûts »
- C5 : « Intervention sur l’équipement »
- C6 : « Facteurs permettant de déceler des anomalies »
Le choix de ces critères faisant suite à des discussions durant lesquelles ont été analysés les besoins des utilisateurs, la capacité des opérateurs à détecter des anomalies, le coût global des interventions (vérification/ré-étalonnage)…
2. Attribuer, en fonction de leur importance, une pondération à chaque critère (1 à 3).
3. Associée aux critères déterminés, une grille de notation objective, comprise entre -2 et 2 (voir l’exemple de C1 ci-dessous). Une notation élevée tendant à augmenter la fréquence de vérification finale et une notation faible à la diminuer (suite à l’association de toutes les notations de l’équipement).
Figure 8 : Critère C1 - Gravité des conséquences d’une mesure erronée
| Définition de C1 | Notation |
| Aucune influence sur la qualité de l'appareil | +2 |
| N/A | N/A |
| Arrêt de Production | 0 |
| N/A | N/A |
| Mise en jeu de la sécurité patient / utilisateur | -2 |
4. Noter individuellement chacun des équipements (64), sur chaque critère retenu, et déterminer les périodicités minimales et maximales acceptables dans le cadre de notre activité (12 et 60 mois).
Etape 2 : Obtention des résultats
La phase de calcul des périodicités optimales des équipements a consisté à appliquer, dans l’ordre indiqué, les formules décrites dans le guide d’optimisation des périodicités du collège de métrologie.
Un fichier Excel référençant l’ensemble des données obtenues a été mis en place pour faciliter l’application des formules, la compréhension des résultats obtenus et pour automatiser le suivi des périodicités obtenues.
Figure 9 : Périodicités OPPERET : Modélisation de la Notation des Équipements (source : MKT)
À la fin de cet exercice, nous avons obtenu un « CORRECTEUR OPPERET ». L’associer à la périodicité actuelle des équipements (avant application de la méthode) nous a permis d’obtenir leurs « Périodicité réelle ».
Figure 10 : Périodicités OPPERET : Modélisation des Périodicités de MKT (source : MKT)
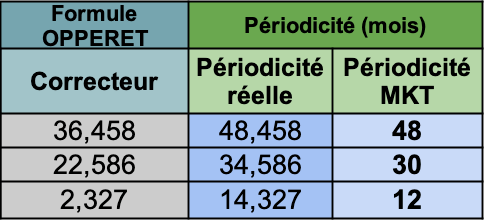
Pour déterminer la périodicité MKT des équipements de production, nous avons émis avec mon co-pilote de projet, des suggestions de périodicité basées sur les résultats des calculs. Ces suggestions ont été étudiées, par le groupe de projet, avant d’être admises. La pertinence des périodicités obtenues a été revue vis-à-vis du contexte dans lequel chaque équipement évolue (ex : intérêt d’admettre pour les équipements en plusieurs exemplaires une même périodicité ; risque d’admettre une périodicité élevée pour certains équipements).
Etape 3 : Mise en application des modifications
La validation finale des périodicités a entrainé un travail de mise à jour massif. Il a fallu :
- Mettre à jour les procédures impactées ;
- Mettre à jour, dans le système documentaire, la périodicité de chaque équipement ;
- Modifier toutes les étiquettes des équipements (changement de la date de la prochaine vérification) ;
- Clôturer le projet et sa documentation
Dans le cadre d’un suivi continu du projet, il a été décidé que chaque année, lors de la revue annuelle des périodicités des équipements, la notation de chaque équipement sera réétudiée pour prendre en compte les évènements s’étant déroulés (ex : utilisation plus fréquente de l’appareil, panne constater...) et ajuster en conséquence la périodicité des équipements.
Néanmoins, en cas de non-conformité, l’analyse de risque effectuée tiendra compte de la notation OPPERET pour que puisse être mise à jour, au besoin, la périodicité des équipements impactés.
C) Gestion documentaire
1. Contexte
MKT a mis en place en 2020, un système informatisé de gestion documentaire, Qalitel Doc communément appeler GED (Gestion Électronique des Documents). Ce SI permet la création, le stockage, le partage, l’archivage et la destruction dématérialisée des documents du SMQ de l’entreprise. Il est utilisé dans le cadre de la gestion des Formulaires (FOR), instruction de travail (INS), processus (PRS), procédures (SOP), enregistrements (REC). Soit tous les documents sur lesquels s'appuie l’organisme pour « formaliser son organisation et mettre en œuvre avec succès son système de management » et constituer son système documentaire [5].
Ce système documentaire doit être régulièrement mis à jour pour assurer la performance et l’efficacité du SMQ de la société en constituant un support d’informations fiables. Permettant ainsi d’assurer le fonctionnement de l’entreprise (capitalisation du savoir et savoir-faire) et la performance de ses collaborateurs (transmissions du savoir-faire). Comme indiqué dans le chapitre § 4.1 Exigences générales de l’ISO 13485 de 2016 : « L’organisme doit établir, mettre en œuvre et entretenir toute exigence, procédure, activité ou disposition devant être documentée conformément à la présente Norme internationale et aux exigences réglementaires applicables » [1].
2. Enjeux et Objectif
La dernière revue documentaire a été réalisée en 2021. Or, certains documents, présent dans la GED, n’ont pas évolués depuis 2017.
L’objectif de ce projet est de réévaluer la pertinence de la présence de ces documents en état dans le système documentaire de Mauna Kea Technologies.
Ainsi ce projet a consisté à :
- Vérifier que les documents concernés répondaient toujours à une exigence ;
- S’assurer que les documents étaient utilisés ;
- Archiver les documents qui n’étaient pas ou plus utilisés ;
- S’assurer que l’information documentée était toujours valable (mise à jour au besoin) ;
- Vérifier la nécessité de mettre à jour le modèle (métadonnées) des documents.
3. Méthode et Résultats
Etape 1 : Analyse documentaire préliminaire
La première étape de ce travail a consisté à extraire de la GED, sous format Excel, la liste des documents concernés.
Ces listes ont été classées par services, pour faciliter le travail à effectuer par la suite, à savoir : déterminer, si chaque document répondait ou non à une exigence et de ce fait quelles actions étaient à envisager en fonction de son utilisation (ex : archivage si le document ne répond à aucune exigence et n’est pas utilisé).
Ce travail a aiguillé, par la suite, les échanges réalisés avec les différents services, qui ont eu accès à ces travaux.
Etape 2 : Décider des actions à entreprendre avec les services concernés
Les réunions programmées avec les différents services concernés ont permis de :
- Leur présenter l’objectif du projet et les documents concernés par cette mise à jour documentaire ;
- Déterminer les documents qui ne seraient pas traités dans le cadre de ce projet : mis à jour dans le cadre d’un autre projet ;
- Définir les documents, dont le contenu, et/ou le modèle serait à mettre à jour : répondent à une exigence et/ou sont utilisés ;
- Définir les documents qui ne seraient pas mis à jour : document utilisé ne nécessitant aucune modification de contenu ;
- Déterminer les documents à archiver : ne répondent pas à une exigence et ne sont pas utilisés.
Pour faciliter le suivi des actions à réaliser, l’ensemble de la documentation concernée a été classé par service dans un tableau récapitulatif (Fig.11).
Figure 11 : Extrait du Tableau récapitulatif des mises à jour à réaliser dans la GED (source auteur)
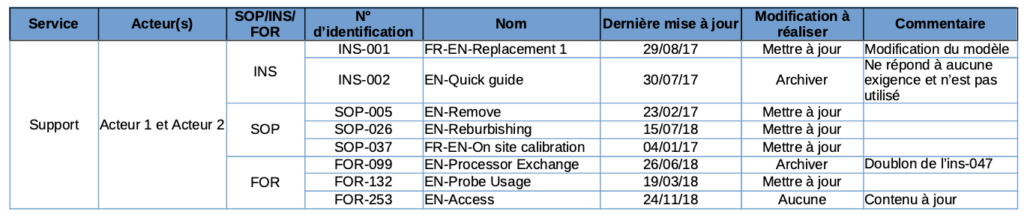
Etape 3 : Mise à jour du système documentaire (GED)
Cette étape a consisté à mettre en application les décisions prises lors de l’étape précédente.
La mise à jour de tous les documents à modifier a été réalisée dans la GED, à savoir :
- Les documents dont le contenu devait être modifié ;
- Les documents dont seul le modèle devrait être mis à jour ;
- Les documents impactés par l’archivage.
Les documents archivés nécessitant de s’assurer en amont qu’ils ne soient pas mentionnés dans d’autres documents annexes, il a fallu s’assurer dans un premier temps que ces documents aient été mis à jour (nouvelle révision disponible) avant d’entamer leurs archivages.
Une fois toutes les mises à jour effectuées, le projet a été clôturé.
III. Bilan Final
En tant que première expérience en entreprise, ce stage m’a permis d’accéder à des éléments très différents des précédents stages que j’ai réalisés, durant ma licence d’imagerie médicale, en milieu clinique et hospitalier.
A) Impacts des formations reçues
Lors de ce stage, j’ai pu mettre en pratique les connaissances et savoirs acquis durant mon master d’Ingénierie de la Santé à l’UTC. Notamment celles liées à la gestion de projet (capacité d’analyse, de rédaction…) et au management de la qualité (outils qualité, connaissance normative, principe du SMQ…). Les différentes interventions professionnelles m’ont également renseigné sur les aspects reliant le monde de la qualité à celui des dispositifs médicaux.
Associé à ce bagage « scolaire », j’ai reçu au sein de MKT diverses formations, visant à faciliter mon intégration au sein du département qualité. En lien direct avec les différentes activités que j’avais à réaliser (gestion du SMQ et ses projets d’amélioration), elles m’ont permis de développer mes connaissances et d’acquérir de nouvelles compétences.
Complémentaires, ces deux types de formations m’ont permis d’être rapidement opérationnelle et de m’adapter avec plus de facilité à la structure et ainsi qu’à ses besoins.
B) Compétences et comportements acquis
Lors de ce stage, j’ai développé :
- Mes connaissances : responsabilités du service qualité d’une entreprise de dispositif médical ; rôles et missions des différents services d’une entreprise commercialisant des DM (marketing, affaires réglementaires, production, support…) ; conception du Cellvizio® et ses sondes (dispositif médical développer et commercialiser par MKT) ; structure d’un Système de Management de la Qualité ; Normes ISO (9001, 13485, 15523).
- Mon savoir-faire : gestion interne des réclamations clients (Qalitel Conform) ; qualification d’un système informatisé ; gestion documentaire ; gestion de projet ; optimisation des périodicités d’un parc d’équipement (méthode OPPERET) ; animer des réunions ; comprendre, appliquer et modifier des procédures ; participer à des audits internes (et externes).
- Mon savoir-être : capacité d’adaptation et réactivité ; sens du travail d’équipe ; sens de l’organisation ; autonomie ; écoute ; rigueur ; leadership.
C) Difficultés rencontrées
J’ai été confronté durant ce stage à différentes problématiques qui ont nécessité que je prenne du recul et que je réfléchisse à comment je pouvais les surmonter.
L’une des premières difficultés rencontrées a été d’assimiler, sur le long terme, l’ensemble des informations relatives à la conception et à la fabrication du dispositif. Il m’a fallu à mon arrivée intégrer rapidement le fonctionnement de la structure et comment étaient développé le produit. Heureusement, grâce aux différentes formations reçues, aux nombreuses interactions avec mes collègues, en réalisant différents projets et en faisant preuve de persévérance, je me suis adapté en intégrant de nouvelles connaissances.
La seconde difficulté est devenue apparente lorsqu’il m’a fallu échanger des informations et communiquer de façon claire et concise avec différents collaborateurs. Avoir des capacités rédactionnelles et oratoires sont des prérequis essentiels pour pouvoir délivrer un discours, une idée, une formation et une présentation compréhensible par tous. Ce stage a mis en évidence, le travail à réaliser de mon côté pour améliorer cet aspect communicatif, n’ayant pas toujours réussi à délivrer clairement les messages que je voulais faire passer.
La troisième contrainte rencontrée était relative à la gestion de projet. Non seulement, il a fallu que je m’organise de mon côté pour pouvoir en autonomie gérer plusieurs projets en simultané (en organisant notamment mon emploi du temps et en priorisant certaines tâches), il a également fallu que je coordonne la disponibilité des tiers concernés, afin d’être certaine de respecter au mieux les délais impartis pour clôturer les projets (les jalons définis n’ont pas toujours été respectés). Par ailleurs, lors des réunions de brainstorming, il a fallu que je supervise les échanges etleurs déroulements pour que ces séances soient efficientes (résultat escompté obtenu) et que les avis de chacun soient pris en compte.
Conclusion
Cette expérience professionnelle très enrichissante m’a permis de découvrir à la fois le côté « industriel » du secteur des dispositifs médicaux, mais également d’être confrontée au côté opérationnel du monde de la qualité, fréquemment rattaché au pôle des affaires réglementaires, en participant au pilotage du Système de Management de la Qualité de Mauna Kea Technologies.
À travers les missions réalisées, pour améliorer celui-ci, j’ai été sensibilisé sur l’importance d’avoir un SMQ efficace et efficient.
Conçu pour aider les organismes à renforcer leurs processus et procédures internes, il est voué à être actif : son maintien et son amélioration continue dans le temps sont essentiels. Dans ce cadre, il est indispensable qu’il tienne compte des changements et évolutions affectant le marché des dispositifs médicaux et qu’il respecte les réglementations applicables en vigueur.
Son objectif étant de garantir la conformité des produits, la sécurité des utilisateurs et la promotion d’une satisfaction client, l’entreprise doit s’assurer qu’il répond aux indicateurs et objectifs qu’elle s’est fixée en regard de l’évolution de son activité.
Pour cela, elle peut compter sur l’ensemble des collaborateurs qui contribuent chaque jour, à travers leurs activités, à faire évoluer la société et son SMQ dans lequel chaque collaborateur est impliqué
Références Bibliographiques
[1] « NF EN ISO 13485 : 2016 : Dispositifs médicaux — Systèmes de management de la qualité — Exigences à des fins réglementaires ». International Organization for Standardization (ISO), Fevrier 2016. [En ligne]. Disponible sur : https://www.iso.org/obp/ui#iso:std:iso:13485:ed-3:v1:fr (consulté le 08 mars 2022)
[2] « Article R1413-66-1 – Code de la santé publique », Légifrance, Paris, 26 Juillet 2022. [En ligne]. Disponible sur : https://www.legifrance.gouv.fr/codes/section_lc/LEGITEXT000006072665/LEGISCTA000039459320/2022-07-26 (consulté le 21 août 2022)
[3] « NF EN ISO 9000 : 2015 : Système de Management de La Qualité - Principes Essentiels et Vocabulaire ». International Organization for Standardization (ISO), décembre 2015. [En ligne].Disponible sur : https://www.iso.org/obp/ui/#iso:std:iso:9000:ed-4:v2:fr:term:3.4.5 (Consulté le 29 juillet 2022)
[4] Kalika, M., Reix, R., Fallery, B., & Rowe, F. « Systèmes d'Information et Management des Organisations », 6ème édition, Vuibert, 2011, pp.1. ISBN 2711743810
[5] B. Froman, « Le système documentaire dans une démarche de management », 1er décembre 2001. [En ligne]. Disponible sur : https://bivi.afnor.org/notice-details/le-systeme-documentaire-dans-une-demarche-de-management/1294370 (Consulté le 20 mai 2022)
[6] « Notre Histoire - Mauna Kea Technologies », Mauna Kea Technologies. [En ligne]. Disponible sur : https://www.maunakeatech.com/fr/a-propos/17-notre-histoire (consulté le 30 avril 2022).
[7] « Mauna Kea Technologies publie ses résultats annuels 2021 », Mauna Kea Technologies, 21 avril 2022. [En ligne]. Disponible sur : https://www.maunakeatech.com/fr/actualites/227-mauna-kea-technologies-publie-ses-resultats-annuels-2021-et-annonce-son-chiffre-d-affaires-du-1er-trimestre-2022 (consulté le 18 mai 2022)
[8] « Système Cellvizio », Mauna Kea Technologies. [En ligne]. Disponible sur : https://www.maunakeatech.com/fr/physicians/11-systeme-cellvizio (consulté le 5 juillet 2022)
[9] « Définition : Système », Larousse. [En ligne]. Disponible sur : https://www.larousse.fr/dictionnaires/francais/système/76262#159194 (consulté le 21 août 2022)
Annexe
Annexe 1 : Modélisation du cycle de Validation d'un Système Informatisé (source : Nalys)