IDS072 - Le management du risque des dispositifs médicaux selon la norme NF S99-172 :2017
DOI mémoire
https://doi.org/10.34746/2sca-wy81Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteurs

Carolina MACEDO 
Anne-Charlotte MASSON 
Wei TAN 
Bin ZHANG
Contacts
- MACEDO Carolina : eng.carolinamcd@gmail.com
- MASSON Anne-Charlotte : annechat.nossam@gmail.com
- TAN Wei : wei.tan5726@gmail.com
- ZHANG Bin : zhangbin998428@gmail.com
Citation
A rappeler pour tout usage : C. MACEDO, A-C. MASSON, W. TAN et B. ZHANG, « Le management du risque des dispositifs médicaux selon la norme NF S99-172 :2017 », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Technologies Biomédicales et Territoires de Santé (TBTS) et Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de projet, janvier 2021, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids072/ ; https://doi.org/10.34746/2sca-wy81
Article publié
Suite à ces travaux, un article a été publié : ID interne : 2021_08_idsap
Résumé
Les services biomédicaux doivent garantir la sécurité de l’exploitation des dispositifs médicaux, grâce à la gestion des risques. Cette gestion comprend leurs activités et l’utilisation des dispositifs. Ils ont pour objectif, de garantir la disponibilité des dispositifs médicaux pour assurer la continuité des soins, ainsi que d’appliquer des exigences de sécurité et de qualité.
Afin de maîtriser les risques de manière systématique et normative en France, la norme NF S99-172 : 2017, « Exploitation et maintenance des dispositifs médicaux - Système de management du risque lié à l'exploitation des dispositifs médicaux » a été élaborée en février 2017. Il s'agit d'une norme relativement nouvelle, qui doit être pleinement comprise pour être appliquée.
Ce mémoire vise à aider les services biomédicaux, à comprendre et à appliquer les exigences pertinentes de la norme NF S99-172 pour mettre en place et consolider le système de management des risques. Un outil de compréhension et un outil d'autodiagnostic, de cette norme, sont proposés pour atteindre cet objectif.
Abstract
Biomedical services guarantee the safety of medical devices’ manipulation by managing the risks related to operation and use of them. This management aims to ensure that medical devices will be available for healthcare and safety and quality requirements will be applied.
In order to control risks by using a systematic and regulating method, the French standard NF S99-172 : 2017 « Operation and maintenance of medical devices - Risk management system related to the operation of medical devices » was drawn up in February 2017. This barely new standard has to be fully understood, as a means to be better applied.
This article aims to help biomedical services to understand and to apply the requirements of NF S99-172, so they can improve their risk management system. To achieve this goal, a NF S99-172 comprehension tool and a self-diagnostic toll will be presented in this article.
Téléchargements



Mémoire complet :
Le management du risque des dispositifs médicaux selon la norme NF S99-172 : 2017
Remerciements
Tout d'abord, l'équipe projet tient à remercier M. FARGES Gilbert, le responsable de l’enseignement « Ingénierie de projet ». Les connaissances pédagogiques et l'expérience qu'il nous a partagé sont très précieuses. Son évaluation patiente et ses suggestions efficaces pendant toute la durée du projet nous ont fortement aidé à avancer. C'était également une garantie essentielle pour la qualité de notre projet.
Nous remercions également Mme KONIG Béatrice, pour ces connaissances sur comment obtenir une bonne tenue bibliographique, une aide très utile pour le projet. Ses suggestions rendent les références bibliographiques de nos projets plus standardisées et plus pertinentes, afin de répondre aux exigences des publications scientifiques.
Enfin, nous remercions les auteurs cités dans cet article. Leurs œuvres jouent un rôle directeur important et constituent la base de la réalisation de ce projet.
Abréviations
ANSM - Agence française de sécurité sanitaire des produits de santé
CETIM - Centre Technique des Industries Mécaniques, www.cetim.
DM - Dispositif médical
DMCR - Dossier de Maîtrise Continue du Risque
GMED – Groupement pour l’évaluation des dispositifs médicaux, filiale du Laboratoire National de Métrologie et d’essais
PDCA - Plan, Do, Check and Act
R&D - Recherche et Développement
SMR - Système de management du risque
SNITEM - Syndicat National de l'Industrie des Technologies Médicales
Introduction
Dans la société moderne, la notion de « risque » est prépondérante. En France, tous les secteurs d’activités (agriculture, industriel ou tertiaire) doivent intégrer le principe de précaution sans pour autant atteindre le « risque zéro » qui reste utopique. Le but de cette politique est bien de prévenir les éléments : indésirables pour des dommages matériels, inacceptables concernant l’humain, et qui peuvent engendrer des coûts financiers démesurés.
Dans les établissements de santé, de nombreux risques sont présents comme le risque infectieux, avec les maladies nosocomiales [1], liées aux soins, à l’élaboration d’un diagnostic et au fait que les établissements sont des endroits où circulent de nombreux malades, atteints de pathologies diverses.
Une autre catégorie de risque n’est pas à négliger. Elle se base sur l’acte médical et correspond aux risques liés à l’exploitation des dispositifs médicaux.
Les dispositifs médicaux sont des équipements, des instruments, servant au diagnostic, à la prévention ou aux soins. Ils sont le plus souvent au contact des patients, voire parfois implantés. Il est à noter qu’ils sont également manipulés par le personnel médical. Étant donné leur nature, les dispositifs médicaux sont des éléments à « risques ». Une fausse manipulation, une déficience de l’appareil et ce sont des vies qui seront mises en danger.
Ces équipements sensibles sont gérés par les services biomédicaux, aussi appelé exploitants. Ceux-ci ont pour mission de fournir, de maintenir et de sensibiliser les utilisateurs à la bonne utilisation des dispositifs.
En l’état actuel des choses, seuls les fabricants de dispositifs médicaux sont soumis à des règlements et des exigences stricts pour la vente de leurs produits, et doivent assurer la sécurité dans l’utilisation de leurs dispositifs, en maîtrisant les risques associés. Néanmoins, ces exigences de maîtrise des risques tendent à se développer à l’exploitant, plus proche du patient et capable de déceler plus rapidement de potentiels risques. Le but est également de donner confiance en l’utilisation de ces dispositifs médicaux, étant contrôlés plus régulièrement et inclus dans un système de processus déterminés et régulés.
Pour pouvoir faire cela, un système de management du risque à implanter au sein du service biomédical est primordial. Celui-ci permettra d’assurer une maîtrise des risques des dispositifs médicaux présents dans l’établissement de santé et sous la vigilance du service biomédical. Les dispositifs ayant fait l’objet d’une étude approfondie sur ces potentiels risques. Les évènements dangereux pourront être évité et donc garantir la sécurité des patients.
Comment est-il possible d’assurer la bonne exploitation de ces dispositifs médicaux ? Quels sont les critères à respecter ? Comment obtenir un système de management du risque performant lié à l’exploitation des DM ?
Pour répondre à ces interrogations et promouvoir cette maîtrise des risques liée à l’exploitation des DM dans les services biomédicaux en France, une norme à vue le jour, en février 2017, la NF S99-172.
L’objectif de ce projet est de réaliser deux outils distincts, qui permettrait aux services biomédicaux la mise en œuvre de leur propre système de management des risques et de le consolider. Tout d’abord un outil d’aide à la compréhension de la norme NF S99-172 pour les néophytes mais également les utilisateurs quotidiens. Ensuite, un outil de positionnement par rapport à la maîtrise du risque lié à l’exploitation des DM pour les services biomédicaux l’ayant déjà mis en place.
Dans ce mémoire, le concept de management du risque en Qualité sera abordé en premier lieu. Les applications et les prérequis de la norme NF S99-172 seront ensuite déterminés afin de proposer des outils adaptés pour sa compréhension et pour se positionner par rapport à celle-ci. D’autres informations pertinentes pour les services biomédicaux sont disponibles pour qu’ils puissent répondre à leurs besoins, soit donner confiance aux soignants et aux patients, assurer la bonne exploitation des dispositifs médicaux et obtenir un système de management du risque performant.
Chapitre 1 : Les services biomédicaux et leur implication dans la qualité des soins
1.1. Le secteur du dispositif médical en France
L'industrie française des dispositifs médicaux a réalisé un chiffre d'affaires de 30 milliards d'euros en 2019, contre 28 milliards d'euros en 2016. Selon le Syndicat National de l'Industrie des Technologies Médicales (SNITEM), le nombre d'entreprises recensées a augmenté de plus de 200 pour atteindre le chiffre de 1502 entreprises en 2019 (Figure 1). Le secteur du dispositif médical en France affiche une belle dynamique [2].
Figure 1 : Les grands chiffres du secteur (Source : [3]).

La croissance du secteur est soutenue par la forte internationalisation des entreprises : les institutions du domaine génèrent un chiffre d’affaires de 9 milliards d’euros à l’export, en croissance de près de 10 %. A titre de comparaison, le taux de croissance de la filière n’est que de 3,7 % [3].
Le secteur est caractérisé par des produits dont le cycle de vie est court et d’innovations en perpétuel mouvement. De plus, le modèle de Recherche et Développement (R&D) du dispositif médical s’appuie sur la mise en place de partenariats publics/privés sur le long terme. La part de chiffre d’affaires consacrée à la R&D atteint 6 % en 2019. Près des deux tiers des entreprises ont une activité de R&D et près de 13 % des entreprises sont exclusivement actives en R&D (start-up) [3]. La partie relative aux ressources humaines est constitué de 90 000 collaborateurs engagés au service de la santé. Le domaine des dispositifs médicaux est un secteur important au regard du parc industriel français, par ailleurs, il s’inscrit comme l’un des acteurs majeurs du secteur des industries de santé [3].
1.2. Les exploitants de dispositifs médicaux
1.2.1. Définition, rôles, localisation
Les exploitants sont toutes les personnes physiques ou morales assurant la responsabilité juridique de l'activité requérant l'utilisation d’un dispositif, selon l’article R5211-5 du Code de la Santé Publique [4]. Dans le cadre de ce projet, les exploitants en question sont les services biomédicaux au sein des établissements de santé. Ils ont comme fonctions principales d’assurer l’investissement, la gestion, la maintenance et la sécurité des équipements biomédicaux.
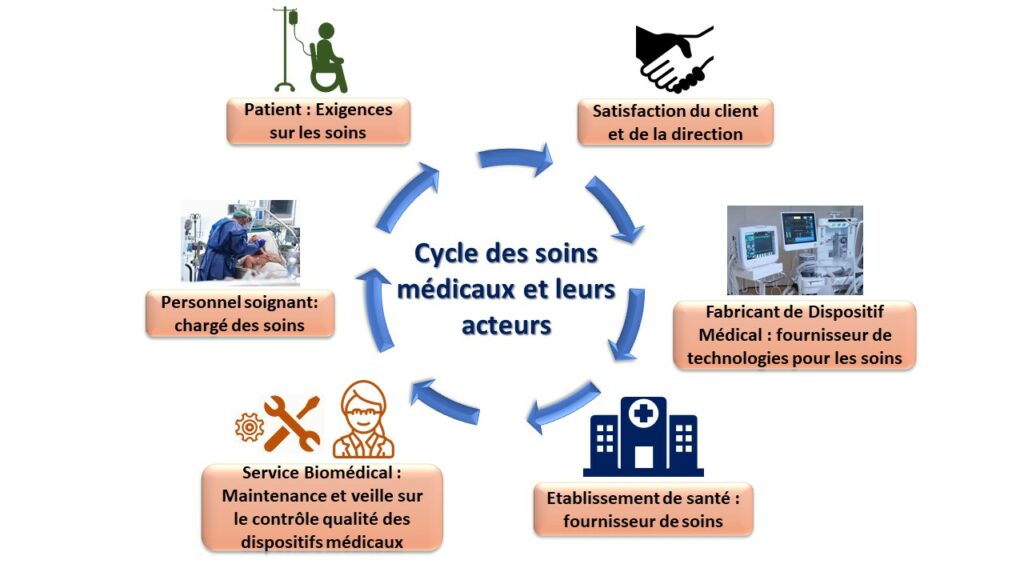
Ces services sont impliqués dans le cycle de soins du patient (Figure 2), étant donné qu’ils sont responsables de manager les services de contrôle qualité et de maintenance des dispositifs médicaux. D’autres tâches, comme le management du risque, sont aussi présentes dans ce service. Toutes ces prestations sont directement liées au patient et à sa santé, car un mauvais fonctionnement ou un risque non maîtrisé peuvent causer le décès d’un patient. De plus, ce sont les services biomédicaux qui forment le personnel soignant dans l’utilisation des dispositif médicaux. Conséquemment, une mauvaise utilisation de ces appareils peut porter une grave atteinte à la santé du patient. Ceci aura pour conséquence une prise en charge du patient de mauvaise qualité ou un soin médical non réalisé.
Figure 2 : Schéma du cycle des soins médicaux et leurs acteurs (Source : Auteurs).
Actuellement, la France possède environ 3000 établissements de santé dont 1300 sont publics. Une grande partie de ces établissements publics, approximativement 900, ont été regroupés sur 136 Groupements Hospitaliers de Territoires (GHT)[5]. Au sein de ces établissements de santé privés et publics, 450 services biomédicaux sont chargés des fonctions citées ci-dessus [6], [7].
Répondre aux exigences des services médicaux en assurant la qualité de leurs prestations, doit être une des préoccupations majeures des services biomédicaux. De cette façon, en 2019, 15 services biomédicaux en France étaient certifiés ISO 9001, et il est estimé que d’ici 2022, ce chiffre doublera et environ 30 services biomédicaux seront certifiés (figure 3) [8].
Figure 3 : Services biomédicaux en établissements de santé certifiés ISO 9001 en 2019 (Source : G. Farges - http://www.utc.fr/master-qualite/ puis « travaux » puis « certifications services biomédicaux »).
1.2.2. Les obligations réglementaires des services biomédicaux et autres normes applicables
Les services biomédicaux ont également des obligations règlementaires, en plus de leurs exigences propres, sous la forme de normes, dites facultatives. Selon le décret n°2001-1154 du 5 décembre 2001, ces services ont la responsabilité de la maintenance des dispositifs médicaux qu’ils exploitent ainsi que du contrôle qualité interne et externe des appareils sous leur vigilance [9], [10].
À la suite de ce décret, il était encore difficile de cibler toutes les familles de dispositifs concernés et d’établir les formes de contrôle qualité pour chaque groupe de DM. De cette façon, l’arrêté du 3 mars 2003 a été publié pour répondre à ces problématiques en listant les dispositifs médicaux concernés par l’obligation du décret n°2001-1154 [11], [12].
Le critère 8K, édité par la Haute Autorité de Santé (HAS), permet de cadrer cette maintenance des dispositifs. Ce critère doit être respecté par l’établissement de santé doit être certifier 8K-HAS et que le service biomédical fait partie des processus à contrôler pour obtenir cette certification [13].
Conséquemment, il existe également des normes pouvant être appliquées au sein des services biomédicaux et qui peuvent apporter des bénéficies aux activités réalisées. Ces normes, non obligatoires, ajoutent une plus-value aux prestations fournies lorsqu’elles sont appliquées. Quelques exemples sont décrits ci-dessous :
- La norme ISO 9001 :2015, qui consiste à mettre en place un système de management de la qualité. Une certification de cette norme induit que le service biomédical accorde de l’importance à la satisfaction des exigences de ses clients, soit le personnel soignant, la direction et/ou les fournisseurs. Elle exprime également le fait que le service, maîtrise ses processus opérationnels, documente et trace ces actions continuellement, ce qui assure la qualité de son service [14].
- La norme NF S99-170 [15] qui consiste à mettre en œuvre un système de management de la qualité de la maintenance et des risques associés. Elle met en avant la maintenance des dispositifs et le fait que le client bénéficiant du résultat du processus de maintenance, doit être écouté et ses exigences prises en compte [16].
- La norme NF S99-172 qui est le produit de nombreux éléments présents dans le management de la qualité et du risque. Cette norme et ses bénéfices seront mieux détaillés et présentés au cours du chapitre 2 de ce mémoire.
Finalement, un autre outil peut être employé par les services biomédicaux afin d’améliorer les prestations réalisées. Le Guide de Bonnes Pratiques Biomédicales en Etablissement de Santé est un recueil de bonnes pratiques de management, d’organisation et de réalisation. Il a pour objectif de réguler l’organisation du service biomédical et d’évaluer ses pratiques quotidiennes [17].
Au regard des obligations règlementaires et des normes possiblement applicables, il est important de comprendre les différents managements, qui une fois implanté, permettent de répondre aux besoins évoqués précédemment.
1.3. Généralités sur le management de la qualité
Le terme "qualité" est souvent caractérisé comme l'aptitude à satisfaire les clients malgré les impacts prévus et imprévus sur les parties intéressées pertinentes. Il inclut non seulement ses fonctions et performances, mais également sa valeur perçue et ses bénéfices pour les clients [18]. Néanmoins, l'impact de la qualité ne se limite pas seulement à la satisfaction du client, elle affecte plus directement la renommée de l'organisation.
Un système de management de la qualité est généralement considéré comme un ensemble d'activités qu'une organisation utilise pour déterminer ses objectifs, les ressources et les processus nécessaires pour atteindre ses résultats attendus. Il comprend : la définition des objectifs et de la politique qualité, la planification de ses activités, le contrôle qualité, l'assurance qualité et l'amélioration de la qualité [18].
Le système de management de la qualité permet non seulement aux directions d'optimiser l'utilisation des ressources, mais leur permet également de mieux gérer les différents processus et les interactions entre ceux-ci afin d'atteindre les résultats escomptés. D’un point de vue globale, l’adoption par l’organisation d’un système de gestion de la qualité signifie que l’organisation améliorera la satisfaction de ses clients en adoptant des stratégies qui amélioreront les performances globales et fourniront une base solide pour assurer sa propre durabilité [19].
Pour cela l’organisme doit adopter une approche basée sur la maîtrise de ces processus de leadership, de planification, de support, de ces activités opérationnelles et de l’évaluation de ces performances tout en adoptant une démarche d’amélioration continue.
La norme ISO 9001 appelé “Système de management de la qualité-Exigences” [19] permet de comprendre les critères à maîtriser pour arriver à un système performant, donnant confiance aux futures et actuelles parties prenantes.
Afin d'atteindre les résultats escomptés de manière efficace et efficiente, l'organisation comprend et gère les processus interdépendants en tant que système (Figure 4). Ce processus peut être géré efficacement par la méthode PDCA - Plan, Do, Check and Act. Cela aidera l'organisation à contrôler les résultats indésirables et à mettre à jour en permanence l'ensemble du système.
Figure 4 : PDCA des processus présents dans la norme ISO 9001 (Source : Auteurs, selon la Norme ISO 9001 [19]).
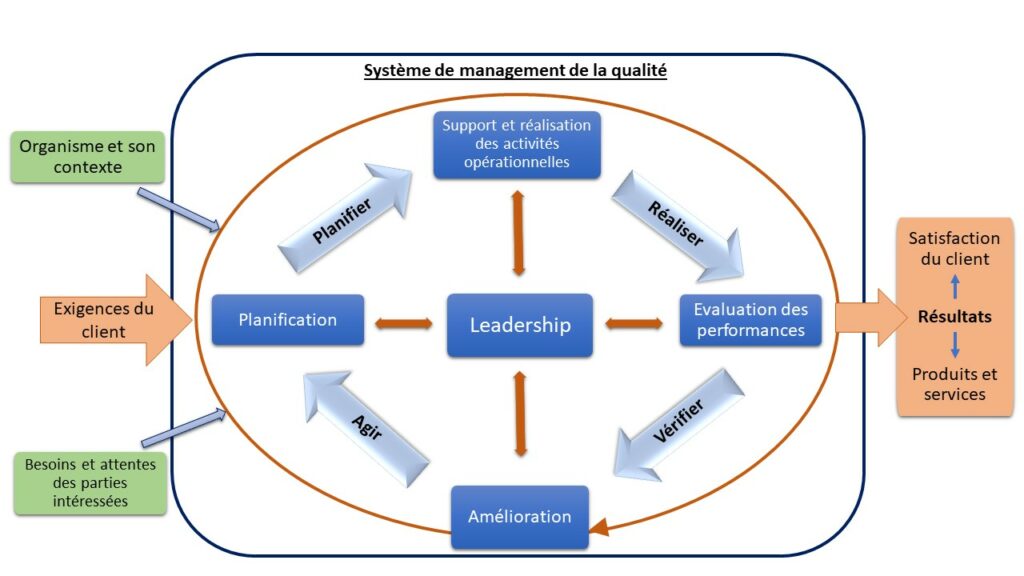
D’une façon plus explicite, les 4 phases de PDCA ont pour but de :
- Plan (analyser, préparer, planifier) : Confirmer les objectifs et les ressources du système, analyser la situation, les problèmes, les risques et les opportunités, rechercher et sélectionner des solutions.
- Do (faire -mettre en production - déployer) : Mettre en œuvre ce qui a été planifié.
- Check (vérifier - mesurer) : Selon les politiques, les objectifs, les exigences et les activités planifiées, le processus et les produits ou services obtenus sont mesurés et les résultats de la mesure sont affichés.
- Act (améliorer - corriger) : Développer un plan d'amélioration et le mettre en œuvre.
Dans le système de management de la qualité, la certification de conformité pour garantir les performances et la qualité du produit est obligatoire. La certification de conformité doit être établie par le fabricant lui-même ou par des organismes désignés par l'Agence française de sécurité sanitaire des produits de santé (ANSM) [20].
1.4. Généralités sur le management des risques
Le terme risque est souvent caractérisé comme une possibilité d’avoir des conséquences négatives par rapport à un ensemble d’activités ou à des événements potentiels. C’est-à-dire que le risque est en soi l’effet de l’incertitude d’un événement qui peut impliquer en non-achèvement des objectifs d’une activité, d’une fonction ou d’un organisme [18], [21].
D’après cela, les risques doivent être éliminés. Le cas échéant, des méthodes de maîtrise des risques sont mises en place pour les minimiser à une échelle d’acceptation où le rapport bénéfice-risque justifie la présence de celui-ci. Ainsi, prévoir, contrôler et manager les risques est devenu un besoin fondamental.
La norme NF ISO 31000 fournit les lignes directives pour le management du risque et elle définit celui-ci comme un ensemble d’activités coordonnées qui ont comme objectif de guider un organisme vis-à-vis du risque. Cette norme peut être employé et adaptée pour n’importe quel organisme ayant comme but développer une stratégie pour confronter les risques présents dans leurs activités [22].
Un management du risque performant est toujours en amélioration et il doit viser la création ou la préservation de la mission d’un organisme. C’est pourquoi l’intégration du management du risque dans les activités fondamentales et dans les différents niveaux de hiérarchie d’un organisme est essentiel.
Dans le contexte des dispositifs médicaux, le management des risques est très important, étant donné que si l’on n’est pas capable de prévoir les risques avant qu’ils arrivent les conséquences vont jusqu’au décès d’un patient ou d’un utilisateur. Alors, la surveillance des risques doit commencer avant que ces appareils soient en utilisation par les patients de forme à assurer la qualité et la performance de ceux-ci.
1.4.1. Management du risque chez les fabricants des dispositifs médicaux
De cette façon, les fabricants des dispositifs médicaux pour assurer la sécurité des équipements en phase de commercialisation, ils doivent en phase de production établir un système de gestion des risques qui respecte toutes les exigences de la norme NF EN ISO 14971. La différence entre la gestion des risques et le management de ceux-ci, est que le premier se centralise plutôt sur les risques au cours des tâches et le deuxième sur les risques qui peuvent affecter les résultats.
Ainsi, cette norme a été développée précisément pour les fabricants de dispositifs médicaux et elle s’appuie sur les principes de gestion de risques. Les exigences qui sont présentées aux fabricants peuvent s’appliquer au cours de tout le cycle de vie des dispositifs. Ainsi, la NF EN ISO 14971 exige qu’un processus documenté de gestion des risques soit établi, et souvent mis à jour, de manière à permettre l’analyse, l’évaluation et la maîtrise des risques [23], [24].
La gestion des risques, selon cette norme, impose que le fabricant doit aussi analyser la présence des risques résiduels et leurs impacts. Donc, il est nécessaire de vérifier si le bénéfice pour l’utilisation est supérieur au risque résiduel à but d’envisager possibles changements. Etant donné que la non-identification d’un risque ou d’une situation dangereuse peut avoir des conséquences majeures. Dans tous les cas, même si le risque résiduel global est acceptable, le fabricant est obligé dans la documentation d’accompagnement du dispositif d’informer aux utilisateurs de la présence de ces risques et des possibles situations dangereuses [24].
Le respect des toutes les exigences au cours des procédures de production, de post production et de commercialisation font qu’un dispositif médical de bonne qualité et bonne performance soit mis à disposition sur le marché de la santé. Suite aux procédures d’achat cet équipement arrive aux services de santé. Et aux établissements de santé, les soins de qualités se présentent au sein des services biomédicaux comme le besoin d’assurer une bonne maîtrise des risques liés à l’exploitation des dispositifs médicaux, dans l’intention de garantir la sécurité des patients, des utilisateurs et du personnel soignant [25].
1.4.2. Management du risque chez les exploitants des dispositifs médicaux
Au niveau des services biomédicaux, l’importance de mettre en place un système de management des risques est directement lié à la sécurité des usagers via la bonne exploitation des dispositifs médicaux. D’après cela, le management du risque permet aussi que le service respecte les exigences normatives et réglementaires en plus de planifier les actions nécessaires pour prévenir ou corriger des pannes [25]. C’est pourquoi chez les services biomédicaux en France, l’emploi et l’adéquation à la norme NF S99-172 se montre d’une grande importance.
Il existe différentes méthodes pour l’analyse de la criticité d’un risque. L’exploitant peut utiliser la méthode référencée dans l’Annexe B de la Norme NF S99-172. Cette méthode est proposée par la SNITEM et le CETIM. Celle-ci se base sur la méthode AMDEC, qui signifie analyse des modes de défaillance, de leurs effets et de leur criticité. Elle permet de relever tous les dangers pouvant intervenir sur un dispositif médical, d’en évaluer les risques et de les minimiser voire les éliminer, par des actions.
Cette méthode demande une revue et donc une amélioration continue car les risques peuvent survenir à plusieurs moments dans la vie du dispositif et ne sont pas toujours prévus. Chaque événement entrainant un danger et donc un risque, qui devra être pris en compte et tracé au sein d’un document avec les actions entreprises et à entreprendre pour le minimiser.
Chapitre 2 : La Norme NF S99-172, ou la mise en place d’un système de management du risque au sein des services biomédicaux
La norme NF S99-172 détaille les activités à réaliser, les éléments à contrôler et les plans d’actions à mettre en place, pour permettre aux exploitants de créer ou d’améliorer leur système de management du risque. Ceci ayant pour but d’identifier les possibles dangers associés à l’exploitation des dispositifs médicaux (ceux de diagnostic in vitro inclus) et de leurs accessoires, sous la responsabilité de l’exploitant. Le but est d'estimer et d'évaluer les risques, de maîtriser ces risques et de surveiller l'efficacité de cette maîtrise [26], [27].
2.1. Contenu de la norme
Tout d’abord, la NF S99-172 édité le 27 février 2017, regroupe deux normes distinctes, la norme NF ISO 9001 “Système de management de la Qualité - Exigences” version de 2015 [19] et la norme NF ISO 31000 “Management du risque - Principes et lignes directrices” version de 2010 [22]. Cette norme est dite de certification et elle emploie le terme « dispositif médicaux » pour l’ensemble de DM et dispositifs médicaux de diagnostic in vitro.
Le contenu de la NF S99-172 se partage en 3 articles informatifs et 7 articles contenant les exigences. De plus, trois annexes informatives sont aussi présentes dans cette norme (figure 5). Les trois premiers articles exposent : les objectifs généraux de la norme, les informations nécessaires à son application, les documents de référence nécessaires au bon emploi de la norme et les définitions et termes qui permettent aux exploitants de mettre en œuvre le système de management du risque.
Les sept articles suivants, dit articles normatifs, forment un cycle PDCA pour le système de management du risque (figure 6). Ce cycle peut être utilisé dès la mise à disposition du DM chez l’exploitant jusqu’à sa réforme.
Figure 5 : Contenu de la norme NF S99-172 (Source : Auteurs).
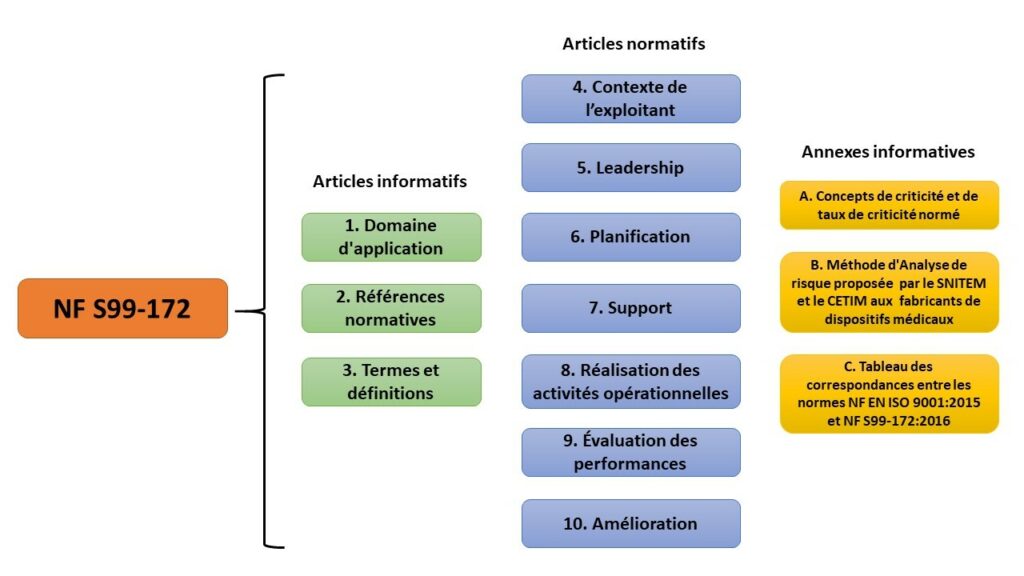
Figure 6 : Articles normatifs de la NF S99-172 composant un cycle PDCA (Source : Auteurs).
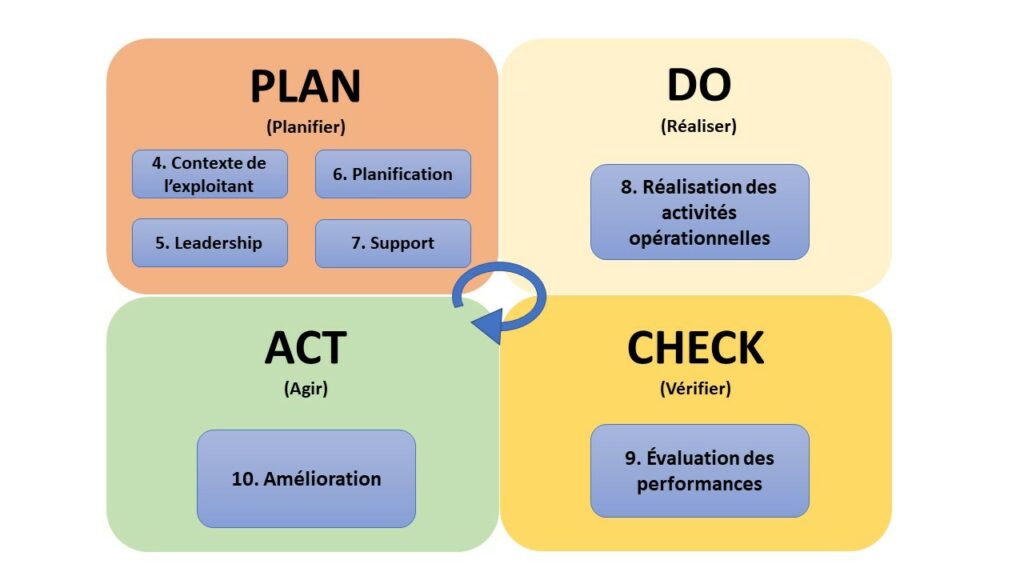
Les articles de 4 à 7 sont compris dans la partie PLAN du cycle. L’article 4 « Contexte de l’exploitant » présente les exigences pour : comprendre les enjeux internes et externes de l’exploitant et de son contexte, les besoins et les attentes des parties intéressées, le domaine d’application et la maitrise du SMR des dispositifs médicaux [26].
L’article 5 « Leadership » exige un engagement de la direction envers le système de management du risque et les besoins et exigences associées. De plus, cet article exige aussi qu’une politique de qualité soit créée, communiquée aux parties intéressées et révisée. Il est nécessaire que les responsabilités, les rôles et autorités soient attribuées aux personnes compétentes au sein de l’organisme [26].
Comprendre le contexte et avoir le leadership permet à l’exploitant de réaliser la planification des actions. Ainsi, l’article 6 « Planification » expose les exigences pour planifier les actions qui doivent être mises en place face aux risques et opportunités, avec les objectifs nécessaires à atteindre pour gérer le risque à travers des actions planifiées. Cet article finit avec des exigences par rapport à la planification des modifications du SMR, en prenant en compte les objectifs et les conséquences de ces modifications [26].
Pour finir la partie PLAN du cycle d’amélioration continue, l’article 7 « Support » expose ce que le système de management du risque nécessite pour être mis en place. L’exploitant doit alors identifier, déterminer et fournir les ressources nécessaires, avec les compétences indispensables et les personnes compétentes au management du risque. De même, il faut assurer la sensibilisation des personnes sous son contrôle et les besoins de communication interne et externe par rapport au SMR. Finalement, l’exploitant veille que le système de management du risque inclut toutes les informations documentées pertinentes : informations exigées par la norme, les spécifications d’utilisation et de la maintenance des dispositifs médicaux et d’autres jugées nécessaires [26].
Ensuite, le DO du cycle PDCA est composé de l’article 8 « Réalisation des activités opérationnelles ». Etant le plus long de la norme, cet article présente des activités opérationnelles qui sont liées à celles de la norme NF ISO 31000 v2010 et il vise principalement la maîtrise des risques. Voici quelques exigences, exposées dans l’article 8 :
- Les risques sur les DM doivent être communiqués périodiquement, de manière compréhensible et pertinente, à toutes les étapes du processus de management du risque et auprès de tous les acteurs concernés.
- Les risques seront préalablement choisis grâce à leur importance et criticité, afin de les éviter voire de les limiter le cas échéant.
- L’exploitant doit définir et documenter régulièrement comment il traite les risques choisis, possibles et leurs interdépendances.
- L'exploitant doit assurer et définir la maîtrise qu'il entend exercer sur les prestataires externes.
- L'exploitant doit prendre en compte l'impact potentiel des processus, produits et services fournis par des prestataires externes sur l'aptitude de l'exploitant à satisfaire en permanence aux exigences des clients et aux exigences légales et réglementaires applicables [26].
Puis l’article 9 « Evaluation des performances » comprend la partie CHECK du cycle. C’est à travers de la surveillance, la mesure, l’analyse et l’évaluation de l’atteinte des objectifs mesurables que l’exploitant pourra évaluer la performance de son SMR. Les audits internes doivent être réalisés à des intervalles planifiés pour assurer la conformité aux propres exigences et aux exigences de la norme. Ainsi que pour assurer la conformité à l’orientation stratégique, une revue de direction doit être réalisée au moins une fois par an [26].
Finalement, le dernier article normatif, le 10 « Amélioration », correspond à la partie ACT du cycle PDCA de la norme NF S99-172. L’amélioration au sein de ce document a pour l’objectif de satisfaire aux exigences, d’accroître la satisfaction du client et de mettre en place des actions correctives face aux non-conformités pour éviter les cas similaires. Alors, l'exploitant doit améliorer en continu la pertinence, l'adéquation, l'efficacité et la performance du SMR selon les résultats de l'analyse et de l'évaluation et les éléments de sortie de la revue de direction [26].
Comme un cycle en soi n’a pas de début ni de fin, l’exploitant peut utiliser cette norme comme une référence afin d’améliorer le système de management du risque pendant tout le cycle de vie des dispositifs médicaux.
2.2. Structure de la norme
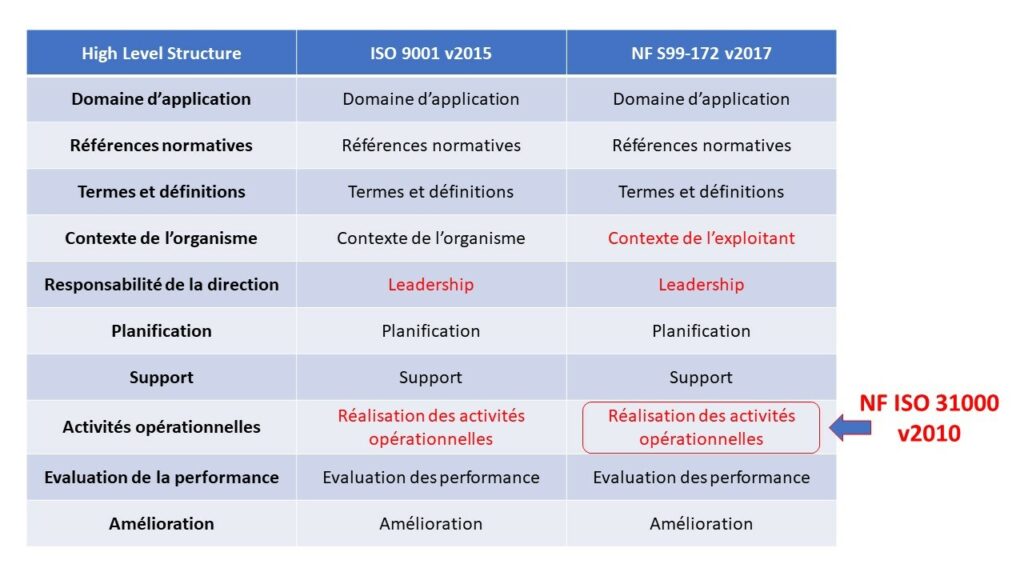
La structure de la norme en question (l'HLS, High Level Structure) est conforme au cadre commun utilisé dans les autres normes ISO de management. Ce modèle de processus composé de 10 articles permet une mise en application simple et efficace, assurant une dynamique managériale robuste et systématique de façon à pérenniser l’activité [27], [28].
La norme NF S99-172 possède des similarités aux normes ISO 9001 v2015 et NF ISO 31000 v2010, et présente deux concepts qui ne sont pas présents dans les précédentes. Ces éléments importants sont : l’Entité compétente chargée du management du risque et le Dossier de Maîtrise Continue du Risque (DMCR) [28].
Selon la NF S99-172, « L'exploitant doit mettre en place au moins une entité compétente, chargée du management du risque comprenant au moins un représentant de la direction ayant pouvoir de décision par délégation » [26]. Cet élément permet que le management du risque soit fait de façon pertinente, toujours en assurant une capacité d’action rapide [28].
Au cours des articles normatifs, des procédures documentées sont nécessaires. Elles seront réunies à travers d’un système de gestion dans le « Dossier de Maîtrise du Risque » que fait preuve des résultats de la performance du SMR [28].
De surcroît, la norme ISO 9001 v2015 utilise le même modèle processus de composition que la NF S99-172 v2017, donc il est possible d’identifier les similitudes entre leurs structures. Les sept premiers articles sont adaptés à chaque activité, mais présentent la même structure. Ainsi que le sous-article 8.4 et les articles 9 et 10. Toutefois la majorité de l’article 8 de la NF S99-172 dévoile des différences par rapport à l’ISO 9001. Cela est dû aux différents besoins de chaque activité de management, mais surtout que les activités opérationnelles de la NF S99-172 sont celles issues de la norme NF ISO 31000 v2010 (figure 7) [27].
Figure 7 : Comparaison entre les articles de la norme ISO 9001 v2015 et de la NF S99-172, selon la structure HLS (Source : Auteurs).
Pour une bonne compréhension et un bon déploiement de cette norme dans les services biomédicaux, ce projet propose la création d’un outil de compréhension pour les néophytes et un outil de positionnement pour ceux qui possèdent déjà un système de management du risque, au sein de leur service. La méthodologie employée pour le développement de ces outils est présentée ci-dessous.
2.3. Création d’un outil de compréhension de la norme
2.3.1. Analyse de la Norme
L’Analyse normative est une méthode pour simplifier des exigences complexes contenues dans les articles d’une norme. Le but de cette analyse étant de souligner et de faire ressortir les éléments clefs essentiels à partir de celles-ci. Elle permet donc au lecteur de mieux comprendre les exigences demandées et de mettre en place plus rapidement les actions exigées. Elle a été créée par Monsieur Gilbert Farges, docteur-ingénieur à l’Université Technologie de Compiègne. Un exemple de rendu final est disponible figure 8.
La première étape consiste à analyser le sommaire de la norme et de repérer les chapitres d’exigences. Dans le cas de la Norme NF S99-172, les chapitres 0, 1, 2 et 3 n’ont font pas partie, étant des chapitres informatifs. Les chapitres d’exigences sont généralement à partir du chapitre 4 jusqu’à la fin, soit jusqu’au chapitre 10, ici.
La seconde étape est de sélectionner un article ou sous article, d’un chapitre et d’identifier les éléments clefs par un code couleur.
Le code couleur, pour les mots clés, est le suivant :
- Rouge : identification d’une exigence avec le verbe “devoir” ou un document.
- Vert : action devant être réalisée. Généralement un verbe se plaçant après le verbe “doit” ou “doivent”.
- Bleu : élément principalement concerné par l’exigence. Cela peut être l’élément désigné par l’exigence, comme “le système de management de la qualité ” ou celui qui doit réaliser l’action comme “l’exploitant”. Tout élément pertinent est à surligner.
- Violet : élément conditionnel. Il peut parfois y avoir des éléments qui ne s’appliquent que dans certains cas. On peut retrouver par exemple : “lorsque approprié” “dans le cas où”, “lorsque les conditions s’y prêtent”.
Il est conseillé de faire le code couleur et de passer à la troisième étape, article par article, et non de réaliser le code couleur pour toute la norme d’un coup au risque de s’y perdre.
La troisième étape consiste à synthétiser tous les éléments importants, en une ou deux phrases. Ces « objectifs » permettent de saisir l’information essentielle de l’article de la norme.
Figure 8 : Exemple d'une Analyse Normative avec l'article 5.2 de la Norme NF S99-172 (Source : Auteurs).

Après avoir synthétisé l’ensemble des articles, les « objectifs » seront introduits dans l’outil de compréhension de la norme.
2.3.2. Forme globale de l’outil
Après avoir réalisé l'Analyse normative sur la norme NF S99-172, un outil de compréhension détaillé sous format « PDF » est mis à disposition des services biomédicaux pour aider à la compréhension de la norme NF S99-172. Cet outil de compréhension est interactif, et permettant à l'utilisateur d'en savoir plus sur chaque article et sous article de la norme de façon rapide et simple, en cliquant sur l'encadré correspondant à l'article ou au sous article d’intérêt (figure 9).
Figure 9 : Vue globale de l'outil de compréhension de la norme NF S99-172 (Source : Auteurs).
Dans cet outil, les informations générales et les points clés de la norme NF S99-172 repérés à travers l’analyse normative, ainsi que certains processus importants, sont expliqués en détail. Cet outil ne vise pas à remplacer la norme NF S99-172 mais à faciliter la compréhension et à exprimer l'essentiel. De façon à servir d’appui pour les services biomédicaux que souhaitent développer leur système de management du risque.
2.4. Création d’un outil d’autodiagnostic
2.4.1. Données d'entrées nécessaires
1. Plan Dynamique Stratégique
Un plan stratégique a pour objectif de visualiser l'avenir d’un projet de manière globale. Pour un service biomédical, il peut être utilisé pour planifier de façon systématique les ressources, les étapes, les objectifs et les travaux de mise en œuvre d’un projet. La planification dynamique stratégique est un outil efficace pour cela. Elle aide à répondre aux questions « pour qui ?» et « pourquoi ?» le projet est réalisé, ainsi que les activités à réaliser. Elle formalise le « sens » de l’organisation (figure 10).
Figure 10 : Exemple de Plan Dynamique Stratégique (Source : Auteurs)
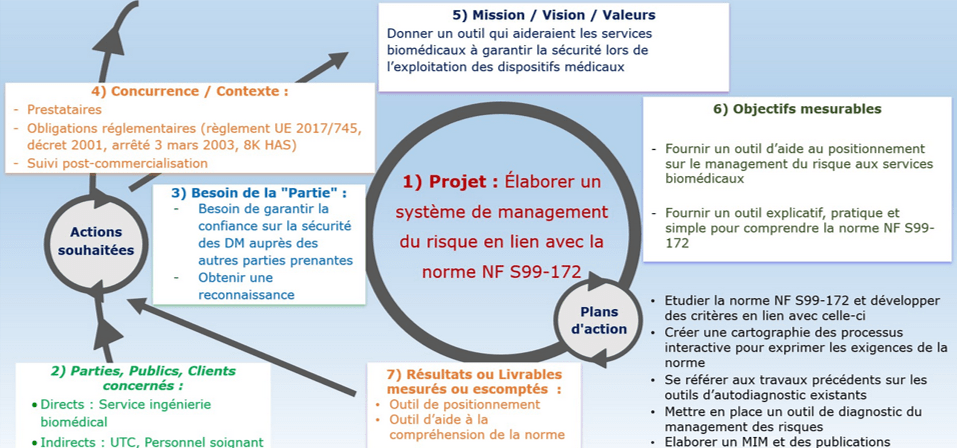
Cet outil apporte une stratégie et une vision claire d’un projet. Dans le cadre de ce projet, il a constitué également un bon guide pour la première étape de la construction d'un outil d'autodiagnostic. De manière qu’à la fin le rendu soit le mieux adapté aux besoins des services biomédicaux par rapport au management du risque. Ayant toujours le but d'aider les professionnels souhaitant améliorer leur système de management des risques existant. Ceci fait selon les exigences de la norme NF S99-172 afin de mieux remplir sa mission.
Pour compléter rapidement cette revue, les outils d'autodiagnostic sous forme d'Excel sont sans aucune doute les plus adaptés.
2. Cartographie des processus
La cartographie des processus est une représentation graphique de tous les processus liés entre eux par des liens logiques de besoins, d’actions, de sorties, de supports ou de ressources. Elle donne une vue d’ensemble des activités et permet d’appréhender clairement comment les activités doivent être réalisées et les relations entre elles.
Figure 11. Cartographie des processus (Source : Auteurs)
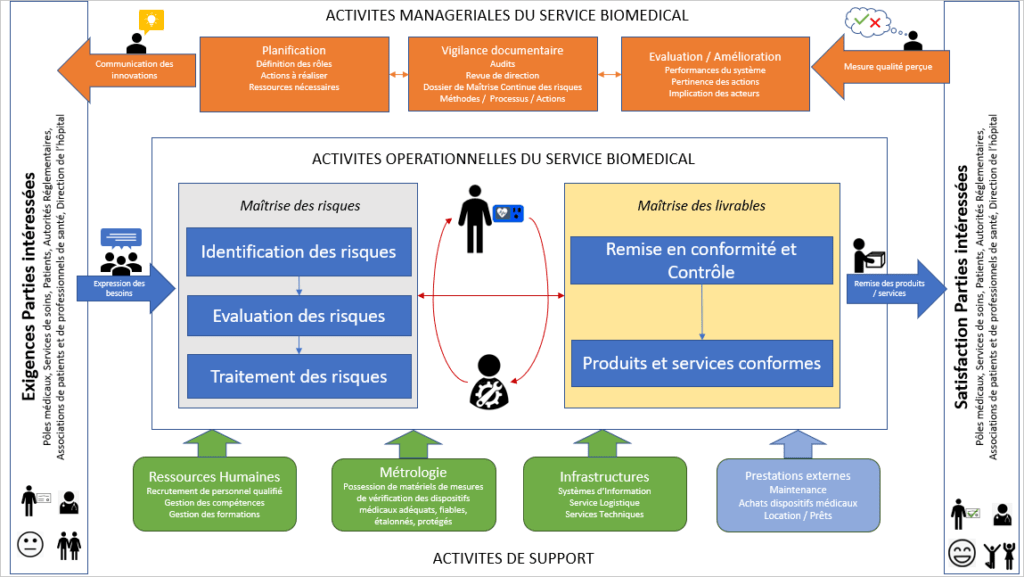
Pour aider les services biomédicaux et leurs systèmes de management du risque, la cartographie des processus, ci-dessus, a été réalisée pour l'intégralité du processus de la mise en œuvre des exigences. Au sein de cette cartographie, le service biomédical est l'entité principale. Les clients sont les pôles médicaux, les services de soins, les patients, les autorités les réglementaires, les associations de patients et de professionnels de santé et la direction de l’hôpital. (figure 11)
Le service biomédical peut utiliser la méthodologie et les comportements présentés sur cette cartographie pour maîtriser les risques et ses livrables. Ce service a éventuellement pour objectif assurer la disponibilité des équipements pour la continuité des soins et l’application des exigences de sécurité et de qualité [29]. En même temps, une représentation plus détaillée de la cartographie des processus sera nécessaire pour que les utilisateurs aient une compréhension plus intuitive de l'emplacement et de l'influence de tout élément critique.
Une fois que les professionnels auront obtenu les résultats de l'évaluation de la conformité et de la véracité de leur système de management du risque via l'outil d'autodiagnostic, ils pourront également utiliser la revue de cartographie des processus pour faire des suggestions raisonnables pour leurs processus.
2.4.2. La méthodologie de la création de l’outil d’autodiagnostic
L'outil d'autodiagnostic est un outil efficace qui évalue la performance d'un système de management. Il permet de cibler les actions d'amélioration pour parvenir à une optimisation continue du système. Il peut également faciliter la démarche de certification, contribuant ainsi à la preuve de la performance de l’organisation [30].
La démarche d'un outil d'autodiagnostic est un processus relativement complexe qui comprend non seulement la collecte de données et l'analyse des points critiques en amont, mais également des tests et des améliorations après la mise en place.
Un plan dynamique stratégique permet d'identifier et de déterminer la cible du processus d’autodiagnostic. Ensuite, la cartographie des processus affiche visuellement des informations telles que les données d’entrées et de sorties, les ressources nécessaires, les activités et les critères de succès. Après avoir compris le titre et les éléments du management des processus, les outils d'autodiagnostic existants permettent d'apporter des données d'évaluation accessibles et des modèle utilisable.
Les outils d'autodiagnostic prennent pour référence :
- L’outil d'autodiagnostic selon la norme ISO EN NF 22870 : 2017 [31]
- L’outil d'autodiagnostic selon la norme ISO 15189 : 2012 [32]
- L’outil d’autodiagnostic selon la norme NF S99-172 [28]
2.4.3. La structure générale d’un outil d’autodiagnostic
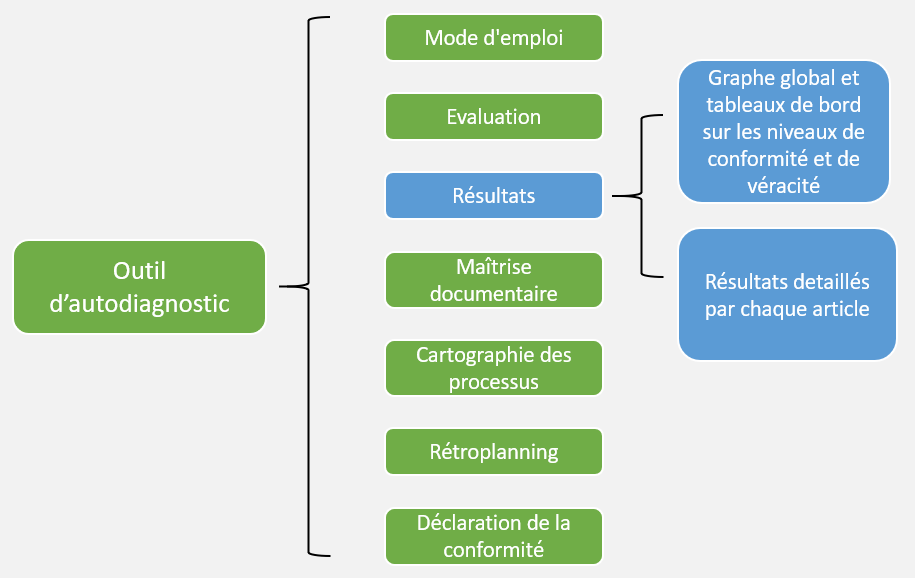
Les outils d'autodiagnostic existants fournissent des modèles utilisables. L'outil d'autodiagnostic contient généralement 10 feuilles. Cet outil en forme de tableur sera disponible en ligne aux service biomédicaux souhaitant réaliser un autodiagnostic de leurs systèmes de management du risque. (figure 12)
- Onglet 1° : « Mode d’emploi », qui permet de présenter l'outil et ses différentes parties aux utilisateurs. Dans le même temps, les utilisateurs peuvent comprendre le niveau d'évaluation et les paramètres correspondants via les échelles d’évaluation.
- Onglet 2° : « Evaluation », qui est constituée 96 critères d'exigence classés par article et sous article à évaluer, l'échelle de l’évaluation, le taux de véracité, le libellé de l’évaluation, la référence du document et le commentaire pour expliquer l’évaluation faite.
- Onglet 3° et 4° : « Résultats », qui est constituée d'une feuille pour une vue globale et d'une feuille pour chaque article. Elle donne une représentation graphique ou tabulaire permet de visualiser le niveau de conformité et de véracité selon la norme. L’utilisateur peut élaborer ses actions d'amélioration dans cette feuille selon l'évaluation.
- Onglet 5° : « Maîtrise documentaire », qui est composé d'une grille pour cibler les axes documentaires obligatoires et d'un espace de commentaires. Les utilisateurs peuvent vérifier visuellement la conformité et la véracité de différents types de dossiers documentaires grâce à cette grille.
- Onglet 6° : « Cartographie des processus ». Il s'agit d'une page qui sert à visualiser les différentes activités (Management, Support, Processus opérationnels) au sein d’un organisme.
- Onglet 7° : « Planning de suivi » permet aux utilisateurs de revoir et de se réévaluer en fonction des résultats de l'évaluation et des processus de mise en œuvre.
- Onglet 8° : « Déclaration de la conformité », qui est un document présentant les résultats de l’évaluation et si les exigences de la norme sont maîtrisées et peuvent conduire à une possible certification.
Figure 12 : La structure de l'outil d'autodiagnostic (Source : Auteurs).
Chapitre 3 : Les outils, une aide pour la mise en place de la norme NF S99-172 : 2017
3.1. L’outil de compréhension de la Norme NF S99-172 : 2017
L’outil de compréhension a été réalisé sous Powerpoint® et est disponible en format « PDF ». Celui-ci commence par un titre (figure 13) puis par une brève introduction expliquant comment naviguer dans l’outil (figure 14).
Figure 13 : Titre de l’outil de compréhension (Source : Auteurs)

Figure 14 : Page d'introduction - mode d'emploi de l'outil de compréhension (Source : Auteurs)

Après plusieurs clics, un écran d’accueil présente les 7 articles normatifs de la norme NF S99-172 (figure 9), il est possible de cliquer sur les différents encadrés afin d’arriver aux sous-articles de la norme (figure 16).
En cliquant sur les sous articles, les exigences clés de l’article/sous article sélectionné apparaitront (figure 15).
Figure 15 : Sous articles de la norme NF S99-172 : 2017 (Source : Auteurs)
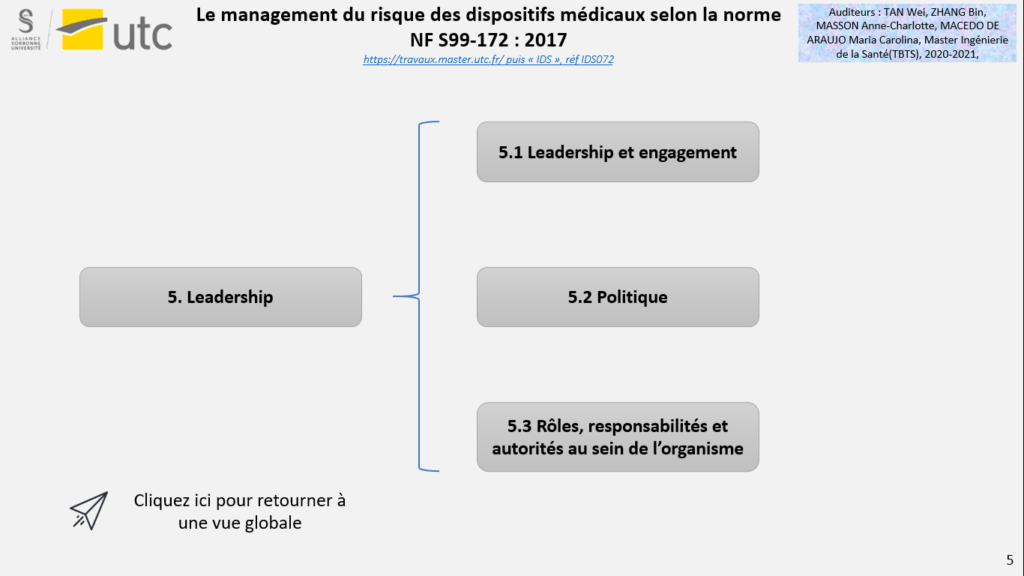
Figure 16 : Exigences d'un sous-article de la norme NF S99-172 : 2017 (Source : Auteurs)

Plusieurs logos seront présents dans l’outil de compréhension (figure 17) afin de vous guider tel que des avions de papier pour revenir à l’écran d’accueil, des souris d’ordinateur pour revenir aux sous articles quand vous êtes sur une page décrivant les exigences. Un logo en forme de document sera également présent sur certaines exigences. Celui-ci indique qu’une procédure documentée sera à constituer pour être conforme à la norme.
Figure 17 : Logos présents dans l'outil de compréhension

3.2. L’outil de positionnement ou d’autodiagnostic par rapport à la Norme NF S99-172
L’outil de positionnement ou d’autodiagnostic est sous la forme d’un Excel® et a pour but d’évaluer la conformité aux exigences de la norme NF S99-172 au sein d’un service biomédical.
L’outil est composé de 8 onglets (figure 18)
Figure 18 : Ensemble des feuilles de calculs de l’outil de suivi et de diagnostic (Source : Auteurs)

Tout d’abord, l’outil est constitué d’un mode d’emploi qui vient présenter les objectifs, les remarques, les différents onglets et les échelles d’évaluation utilisées pour fournir les résultats de l’évaluation. Une entête est disponible pour indiquer le nom de l’établissement où se déroule l’étude, le nom, le prénom, la fonction de la personne responsable de l’évaluation, son email et son téléphone, ainsi que les reconnaissances que le service biomédical possède déjà.
7 niveaux de véracité sont disponibles (Faux unanime, Faux, Plutôt Faux, Plutôt Vrai, Vrai, Vrai unanime et Non applicable) quant à la réalisation des critères qui aboutissent sur 5 niveaux de maitrise des processus :
- De 0 à 24%, la maitrise est dite insuffisante et l’organisation doit revoir le fonctionnement de ses activités pour les processus associés ;
- De 25 à 49%, la maitrise est informelle et l’organisation doit pérenniser et améliorer la maitrise de ses activités ;
- De 50 à 69%, la maitrise est dite probante mais des améliorations peuvent encore être apportées ;
- De 70 à 89%, les processus sont maîtrisés mais une meilleure traçabilité de ceux-ci ainsi que des preuves des résultats sont à fournir ;
- De 90 à 100%, la maitrise est conforme aux normes sur lesquelles la méthode s’appuie et l’organisation peut communiquer ses résultats dans le but de prouver cette conformité si elle le désire.
Sur la partie « Evaluation » (figure 19), les exigences de la norme sont répartis en 96 critères à évaluer selon les niveaux de véracité. Un encadré à droite permet de noter les références documentaires pour prouver la maîtrise de ce critère ou des commentaires. Lorsque les critères ont été établis avec leurs niveaux de véracité, un libellé du niveau de conformité apparait à la droite du critère, du nom de l’article ou sous-article, ainsi que de l’évaluation lorsque tout les critères sont avérés.
Figure 19 : Evaluation par rapport aux exigences de la norme NF S99-172 (Source : Auteurs)

Sur la partie « Résultats globaux », il y a le nombre total des véracités en fonction des critères, le nombre total des niveaux de conformité des 28 sous-articles, tout les deux sous forme de « bâtons », ainsi que des graphes radar des niveaux de conformités selon les 7 articles et les 28 sous-articles de la norme, exprimés en pourcentage (figure 20).
Figure 20 : Résultats globaux de la maîtrise des exigences de la norme NF S99-172 : 2017 au sein du service biomédical
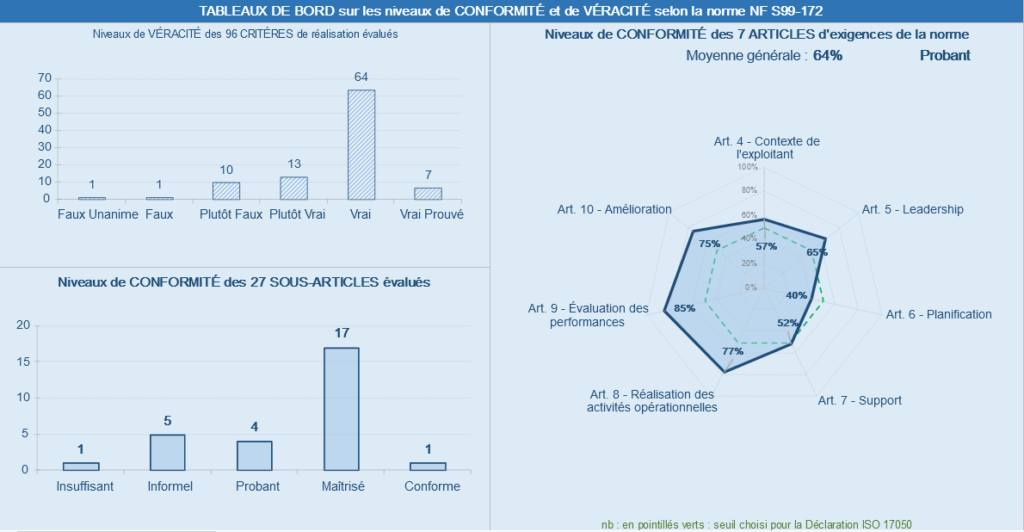
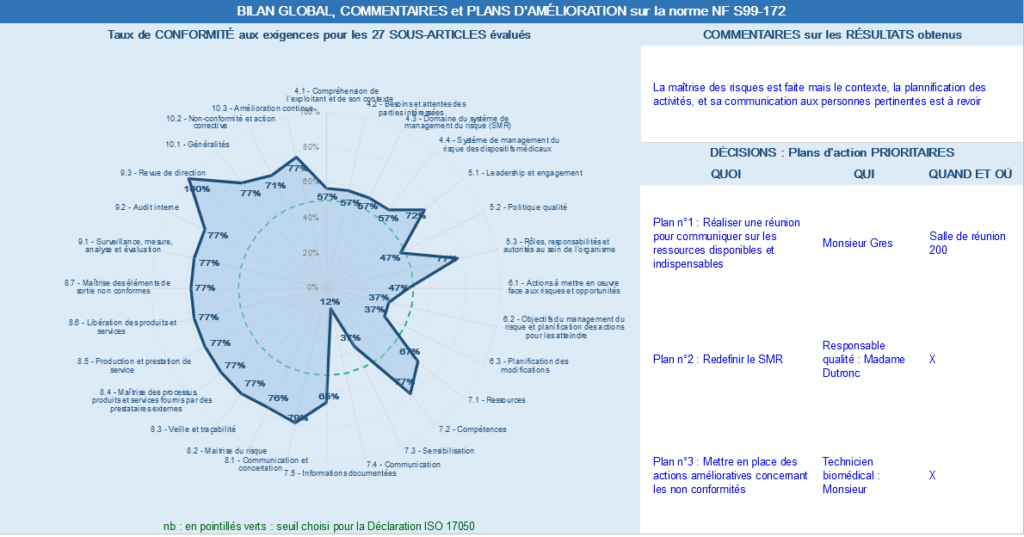
Une synthèse des résultats finaux est également présente (figure 21) pour plus de visibilité.
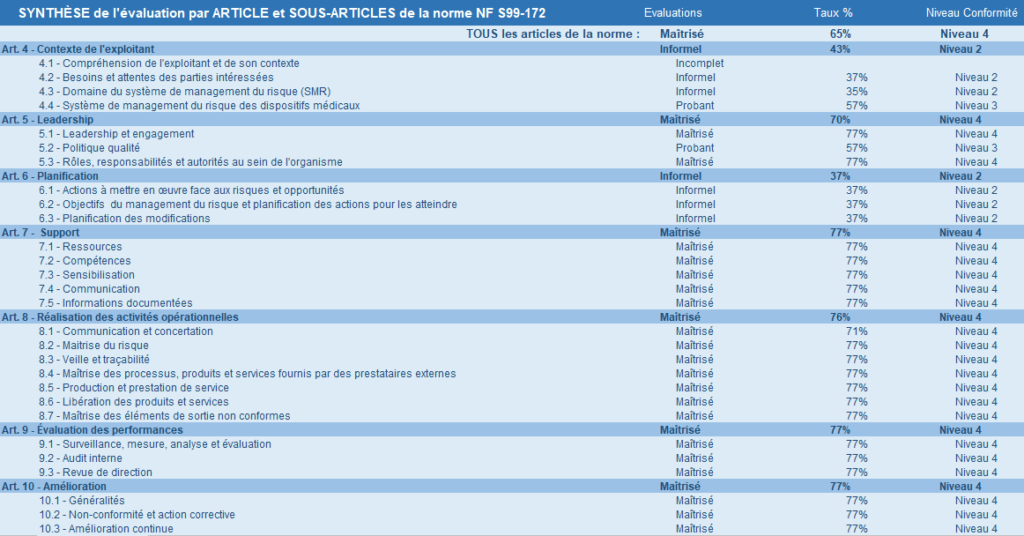
Figure 21 : Synthèse des résultats sur la maîtrise des exigences de la norme NF S99-172
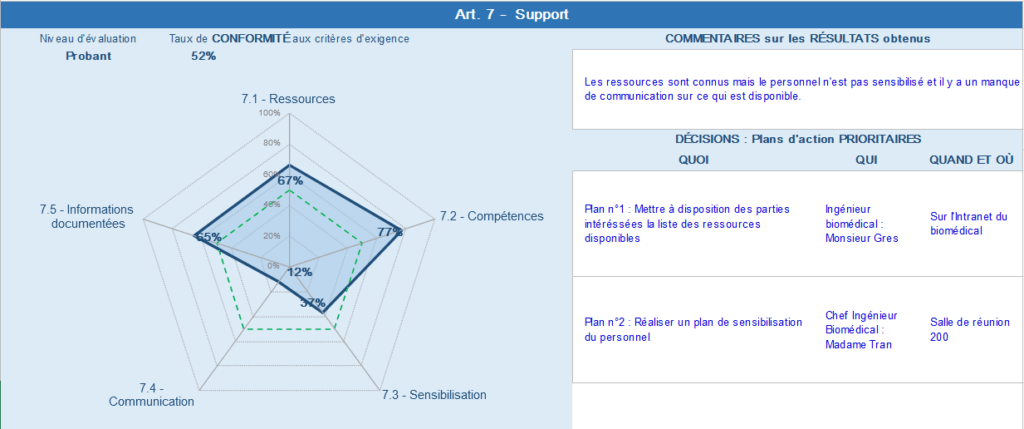
Dans la partie « Résultats par article » des graphes radar, avec le taux de conformité à un article en particulier, sont disponibles. Un espace commentaire et des cases pour éditer des plans d’actions afin d’améliorer la maîtrise des processus, propre à l’article sont également présents (figure 22).
Figure 22 : Résultat de conformité à un article de la norme NF S99-172 : 2017.
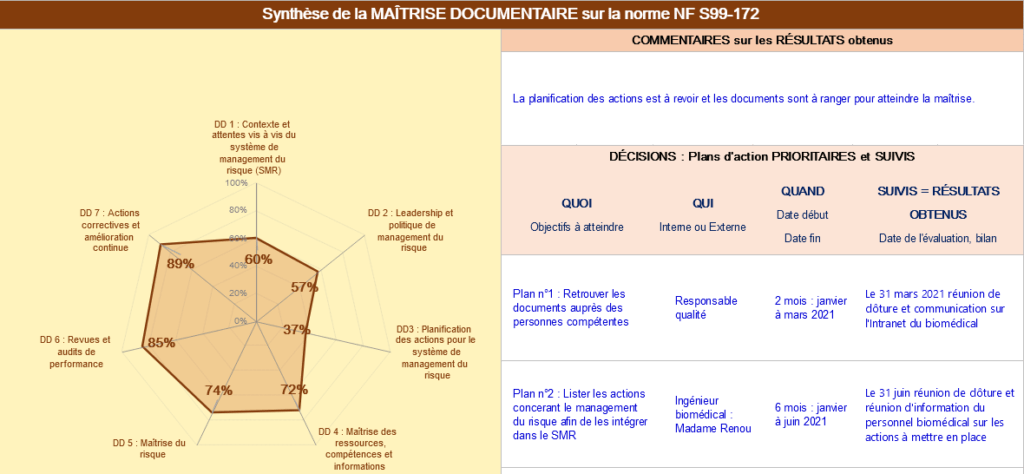
Dans la partie « Maîtrise documentaire » un graphe radar sur le taux de maîtrise des documents qu’il est nécéssaire de créer pour assurer la preuve de la maîtrise des processus est présent (figure 23). Le biomédical pourra indiquer le nom de ses procédures pour pouvoir assurer de cette maîtrise, mais également des plans d’actions à mettre en place pour améliorer cette maîtrise documentaire.
Figure 23 : Documents nécessaires pour la maîtrise des processus de la norme NF S99-172.
Dans la partie « Cartographie des processus », une cartographie générale des activités à mettre en place pour satisfaire aux exigences de la norme NF S99-172 est présente (figure 11), elle pourra aider le responsable à y voir plus clair. Il sera tout de même demandé au service biomédical de refaire une cartographie plus détaillé selon ses propres processus.
Pour cela, le « Planning de suivi » avec les processus, les acteurs et le niveau d’avancement des tâches peut être un atout. Certains éléments sont déjà définis mais le responsable aura la possibilité de modifier des éléments et d’en ajouter d’autres pour mieux correspondre à ses besoins.
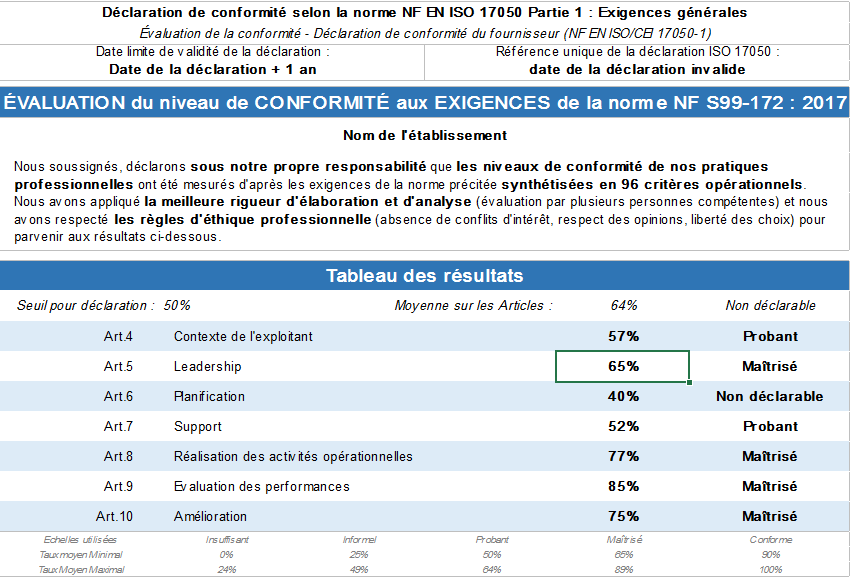
A la fin, une auto-certification sous le nom de l’onglet « Déclaration ISO 17050 » pourra être édité. Ce document pourra aider, dans le futur, à décrocher une certification officielle à propos de la norme NF S99-172 (figure 24).
Figure 24 : Déclaration de conformité à la norme NF S99-172 : 2017 selon la norme ISO 17050.
Conclusion
La norme NF S99-172, appelée « Exploitation et maintenance des dispositifs médicaux - Système de management du risque lié à l'exploitation des dispositifs médicaux », guide les services biomédicaux dans la mise en place de processus, permettant une bonne gestion des risques pouvant survenir sur les dispositifs médicaux.
Le but de ce projet est d’aider les services biomédicaux dans la compréhension de la norme, grâce à une cartographie interactive reprenant les exigences clés de celle-ci. Les personnes le souhaitant pourront également évaluer cette gestion des risques au sein du service, à l’aide d’un outil d’autodiagnostic, sous la forme d’un outil Excel. Ces outils permettent un gain de temps et une bonne prise en main pour les utilisateurs, ainsi qu’une meilleure application de cette norme et de ces exigences.
Cette maîtrise des risques, au travers d’un management performant, permet de limiter la survenue d’évènements indésirables et dangereux, lors de l’utilisation des équipements et ainsi assurer la sécurité des patients et utilisateurs des dispositifs.