IDS113 - Contribution à la mise en place du système de management de la qualité selon la norme ISO 13485 : 2016
Catégories
Les projets ou stages publiés auxquels vous accédez sont des rapports d'étudiants et doivent être pris comme tels. Il peuvent donc comporter des imperfections ou des imprécisions que tout lecteur doit admettre et donc supporter. Il ont été réalisés pendant les périodes de formation et constituent avant-tout des travaux de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux concepts, méthodes, outils et expériences sur les démarches qualité dans les organisations ou sur les technologies en santé.
Si, malgré nos précautions, vous avez des raisons de contester ce droit de diffusion libre, merci de nous en faire part (master@utc.fr), nous nous efforcerons d'y apporter une réponse rapide. L'objectif de la présentation des travaux sur le web est de permettre l'accès à l'information et d'augmenter ainsi la qualité des échanges professionnels.
Nous ne faisons aucun usage commercial des travaux de projet ou de stage publiés, par conséquent les citations des informations et l'emploi des outils mis à disposition sont totalement libres. Dans ce cas, nous vous demandons de respecter les règles d'éthique en citant explicitement et complètement vos sources bibliographiques.
Bonne lecture...
Auteure

Contact
Citations
A rappeler pour tout usage : Saryane Manuela WAOUSSI NGOKO , « Contribution à la mise en place du système de management de la qualité selon la norme ISO 13485 : 2016 », Université de Technologie de Compiègne (France), Master Ingénierie de la Santé, Parcours Dispositifs Médicaux et Affaires Réglementaires (DMAR), Mémoire de stage, réf n°IDS113, Juillet 2021, https://travaux.master.utc.fr/formations-master/ingenierie-de-la-sante/ids113/
Résumé
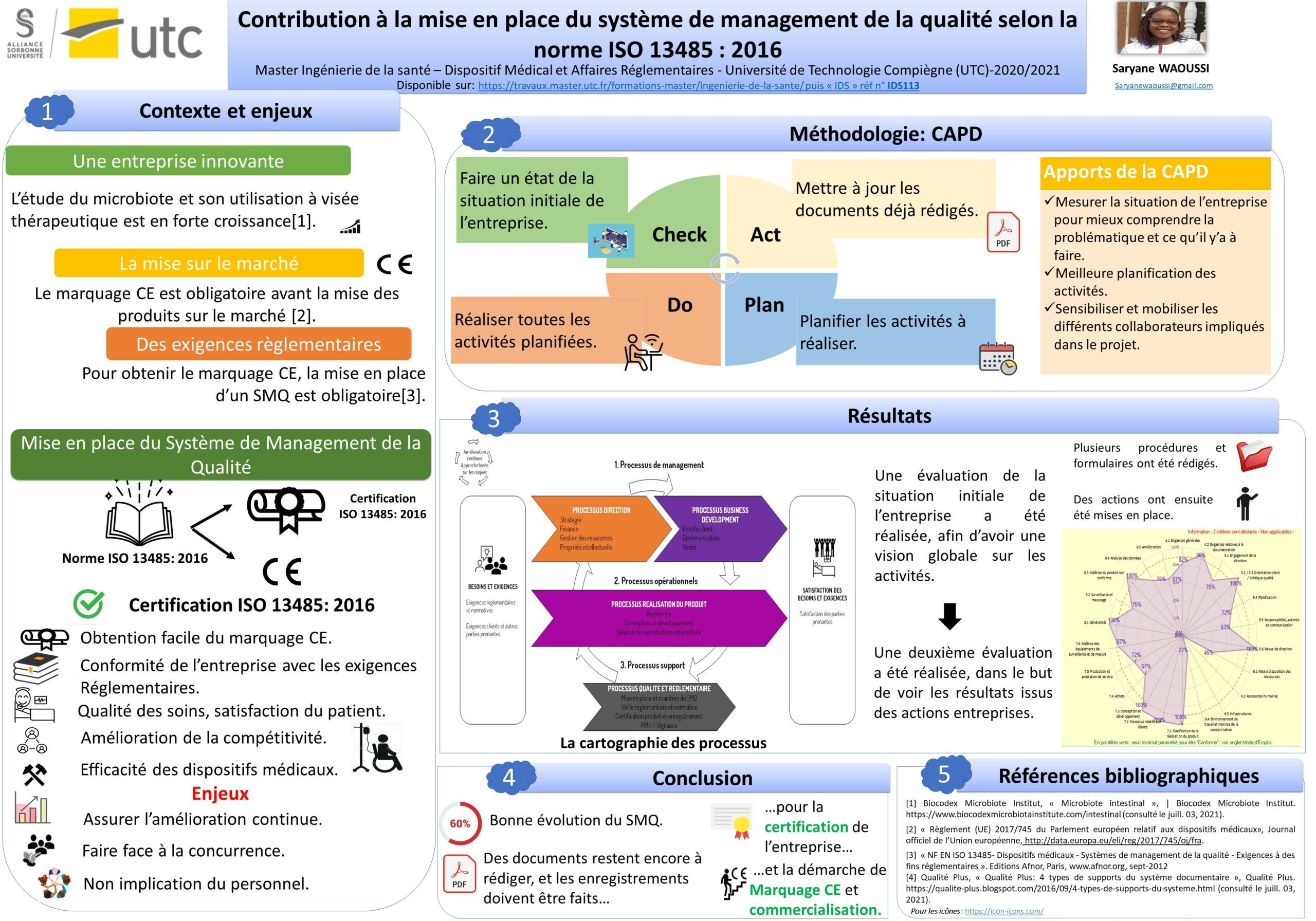
Le caractère strict du secteur des dispositifs médicaux impose à tous les fabricants de ces derniers à se conformer aux exigences de la réglementation 2017/745 applicable depuis Mai 2021. Cette conformité est, entres autres, démontrée par la mise en place d’un système de management de la qualité.
Le système de management de la qualité (SMQ) est un outil documentaire développé sur la base de la stratégie et des activités d’une entreprise. Il représente la référence même de l’entreprise, et s’inscrit dans une approche d’amélioration continue. L’effectivité de ce SMQ est assurée par la certification ISO 13485, qui représente la garantie de la conformité d’une entreprise à certaines des exigences réglementaires qui lui sont applicables, mais aussi facilite l’obtention du marquage CE des dispositifs médicaux de l’entreprise.
Ce document présente la méthodologie utilisée pour contribuer à la mise en place du système de management de la qualité d’une entreprise start-up qui conçoit des dispositifs médicaux.
Mots clés : Dispositif médical, système de management de la qualité, certification, ISO 13485, marquage CE.
Abstract
The strict nature of the medical device sector requires all manufacturers of medical devices to comply with the requirements of the 2017/745 regulation applicable since May 2021. This compliance is, among others, demonstrated by the implementation of a quality management system.
The quality management system (QMS) is a documentary tool developed on the basis of the strategy and activities of a company. It represents the reference of the company and is part of a continuous improvement approach. The effectiveness of this QMS is ensured by ISO 13485 certification, which represents the guarantee of a company's compliance with some of the regulatory requirements applicable to it, but also facilitates obtaining the CE marking of the company's medical devices.
This document presents the methodology used to help implement the quality management system of a start-up company that designs medical devices.
Keywords : Medical device, quality management system, certification, ISO 13485, CE marking.
Poster téléchargeable